Агар эндо кишечная палочка
На среде Эндо кишечная палочка образует круглые, выпуклые, гладкие колонии малиново-красного цвета с металлическим блеском. Среда Эндо — это дифференциально-диагностическая среда, которая кроме питательной основы, среда содержит 1% лактозу и насыщенный спиртовой раствор основного фуксина. Свежеприготовленная среда Эндо бесцветна или слегка розовая. При росте на этой среде кишечная палочка разлагает лактозу, образуются кислые продукты, они восстанавливают фуксин из бесцветного соединения в красный и поэтому вырастают колонии, окрашенные в малиново-красный цвет.
3. Изучить развёрнутую реакцию агглютинации с “живой” и “гретой” культурой при идентификации возбудителя колиэнтеритов.
Метод диагностики: бактериологический
Ингредиенты реакции: бактериальная суспензия (взвесь бактерий в физиологическом растворе), диагностические сыворотки, содержащие антитела к О55 и К11 антигенам, физиологический раствор.
Постановка: Диагностические сыворотки разводят в двух рядах, используя физиологический раствор. Для приготовления бактериальной суспензии добавить культуру с поверхности питательной среды в 3-5 мл физиологического раствора, разлить взвесь в 2 стерильные пробирки. Одну из них прогреть на водяной бане при 100°С в течение часа. В первый ряд добавляем несколько капель «живой» бактериальной суспензии, во второй ряд добавляем несколько капель бактериальной суспензии, «гретой» на водяной бане. Инкубируем в термостате 24 часа и учитываем результат.
Учет реакций агглютинации: Положительный результат — образование белого зонтика, отрицательный образование белой пуговки. Реакция считается положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а с живой не менее, чем 1:200 (диагностический титр реакции). Если реакция положительна, то выдают ответ в следующей формулировке “Выделена патогенная кишечная палочка серовара О55:К11.
Учесть биохимические свойства E. coli.
Ингредиенты: Среда Ресселя, которая содержит лактозу и глюкозу и пестрый ряд Гиса, состоящий из пяти углеводов. Кроме питательной основы и углевода к среде добавлен индикатор. Исходный цвет среды розовый, при образовании кислоты цвет среды становится синим. Газообразование улавливают с помощью поплавков-коротких стеклянных трубочек, запаянных с одного конца, помещенных в питательную среду, открытым концом вниз. Образование индола и сероводорода определено с помощью индикаторных бумажек. При образовании индола индикаторная бумажка, пропитанная насыщенным раствором щавелевой кислоты, розовеет. При образования сероводорода индикаторная бумажка, пропитанная уксуснокислым свинцом, чернеет.
Постановка: Пересев колоний со среды Ресселя на ряд Гиса и МПБ и инкубация 24 часа в термостате.
Биохимические изменения на пестром ряду с посевом кишечной палочки
| Лактоза | Глюкоза | Маннит | Мальтоза | Сахароза | МПБ | |
| Индол | Сероводород | |||||
| До кислоты и газа | До кислоты и газа | До кислоты и газа | До кислоты и газа | – | + | – |
Таким образом, для кишечной палочки характерна ферментация лактозы, глюкозы, мальтозы и маннита с образованием кислоты и газа, отсутствие ферментации сахарозы и образование индола.
Заполнить таблицу «Заболевания, вызываемые диареегенными E. сoli».
Решение ситуационных задач
III модуль «Кишечные инфекции»
Занятие № 2
ТЕМА: Микробиологическая диагностика дизентерии, брюшного тифа, паратифов А и В, сальмонеллезных гастроэнтеритов
ЦЕЛЬ ЗАНЯТИЯ: знать таксономию, основные свойства возбудителей, эпидемиологию, микробиологическую диагностику, принципы профилактики и лечения
уметь:учитывать характер роста на средах Эндо, Левина возбудителей дизентерии, ставить реакцию агглютинации на стекле, делать пересев на среду Ресселя, учитывать их биохимические свойства и реакцию агглютинации с парными сыворотками, реакцию Видаля
Задание на дом
1. Вопросы для самоподготовки:
1) Характеристика биологических свойств и особенности микробиологической диагностики дизентерии.
2) Характеристика биологических свойств и особенности микробиологической диагностики брюшного тифа, паратифов А и В.
3) Характеристика биологических свойств и особенности микробиологической диагностики сальмонеллёзных гастроэнтеритов.
Источник
Оглавление темы “Эшерихии. Эшерихиозы. Кишечная палочка. Шигеллы. Дизентерия.”:
1. Диагностика энтеробактерий. Выявление энтеробактерий. Диагностические подходы для энтеробактерий.
2. Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
3. Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
4. Патогенез поражений кишечной палочкой. Клинические проявления коли инфекции. Кишечные инфекции ( коли-инфекции ). Энтеротоксигенные кишечные палочки.
5. Энтероинвазивные кишечные палочки. Энтеропатогенные эшерихии. Энтерогеморрагические кишечные палочки.
6. Энтероадгезивные кишечные палочки. Уропатогенные эшерихии. Инфекции мочевыводящих путей вызванные кишечной палочкой. Бактериемия эшерихий.
7. Менингит вызванный кишечной палочкой. Респираторные инфекции вызванные эшерихиями ( кишечной палочкой ).
8. Микробиологическая диагностика кишечной палочки. Диагностика кишечной палочки. Выявление эшерихий.
9. Лечение эшерихиозов. Лечение кишечной инфекции. Профилактика эшерихиозов. Профилактика кишечной инфекции.
10. Шигеллы. Дизентерия. Бактериальная дизентерия. Шигеллез. История дизентерии. Серовары шигелл. Серовары возбудителей дизентерии.
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5×2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
– Также рекомендуем “Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.”
Источник
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
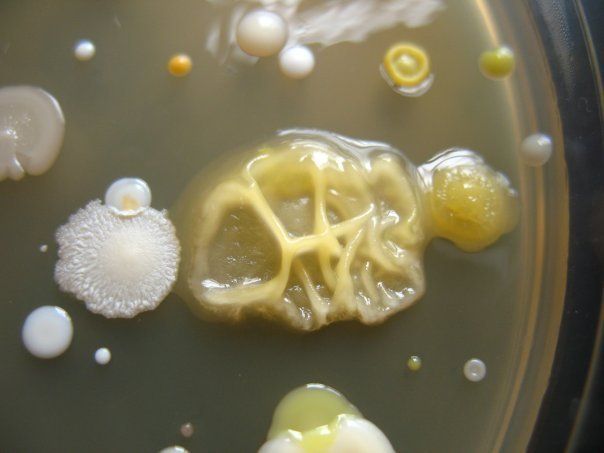
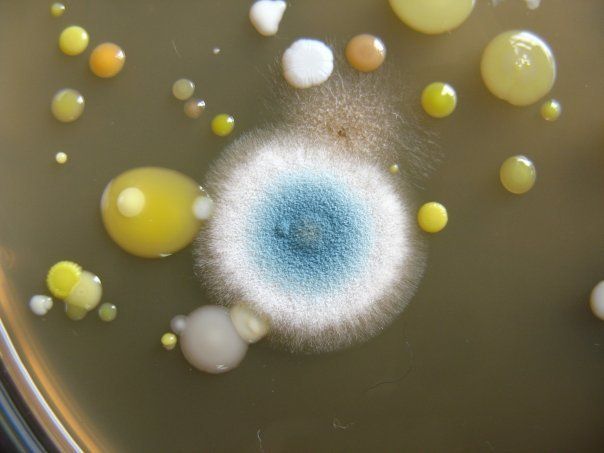
 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
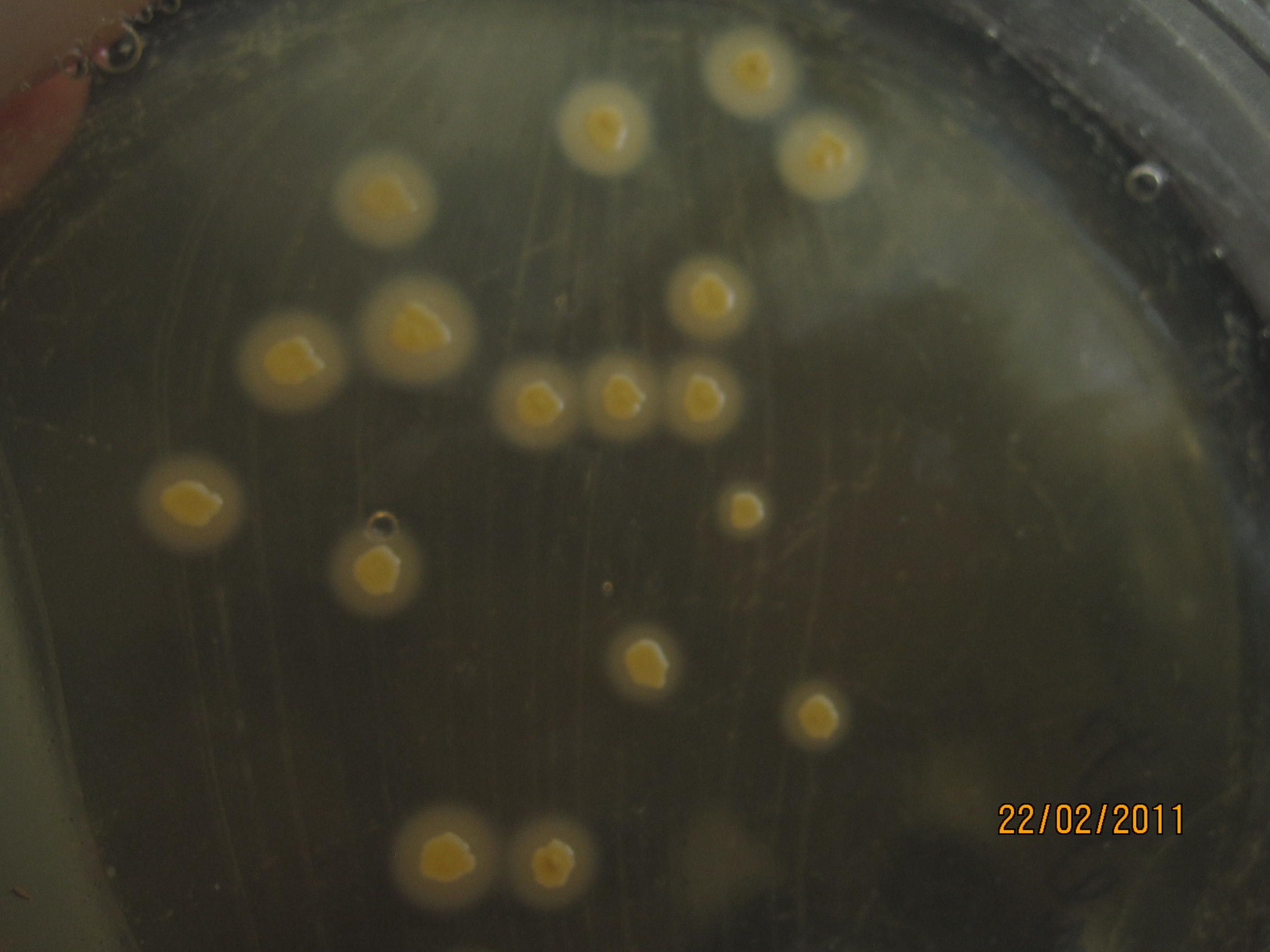
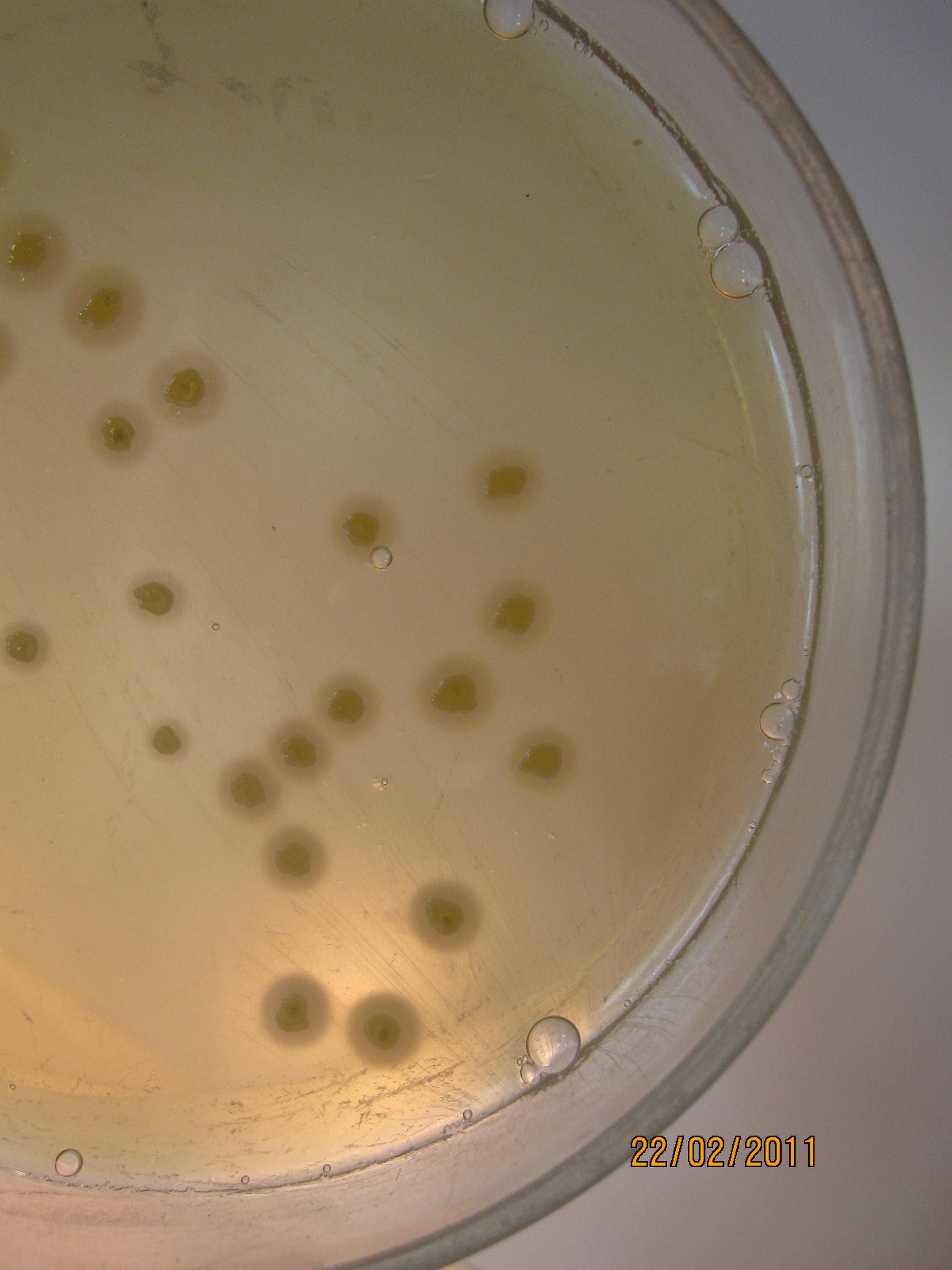 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
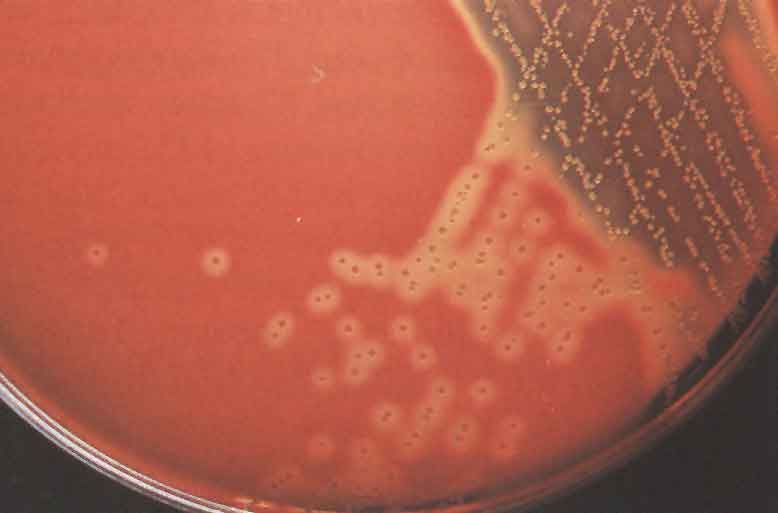
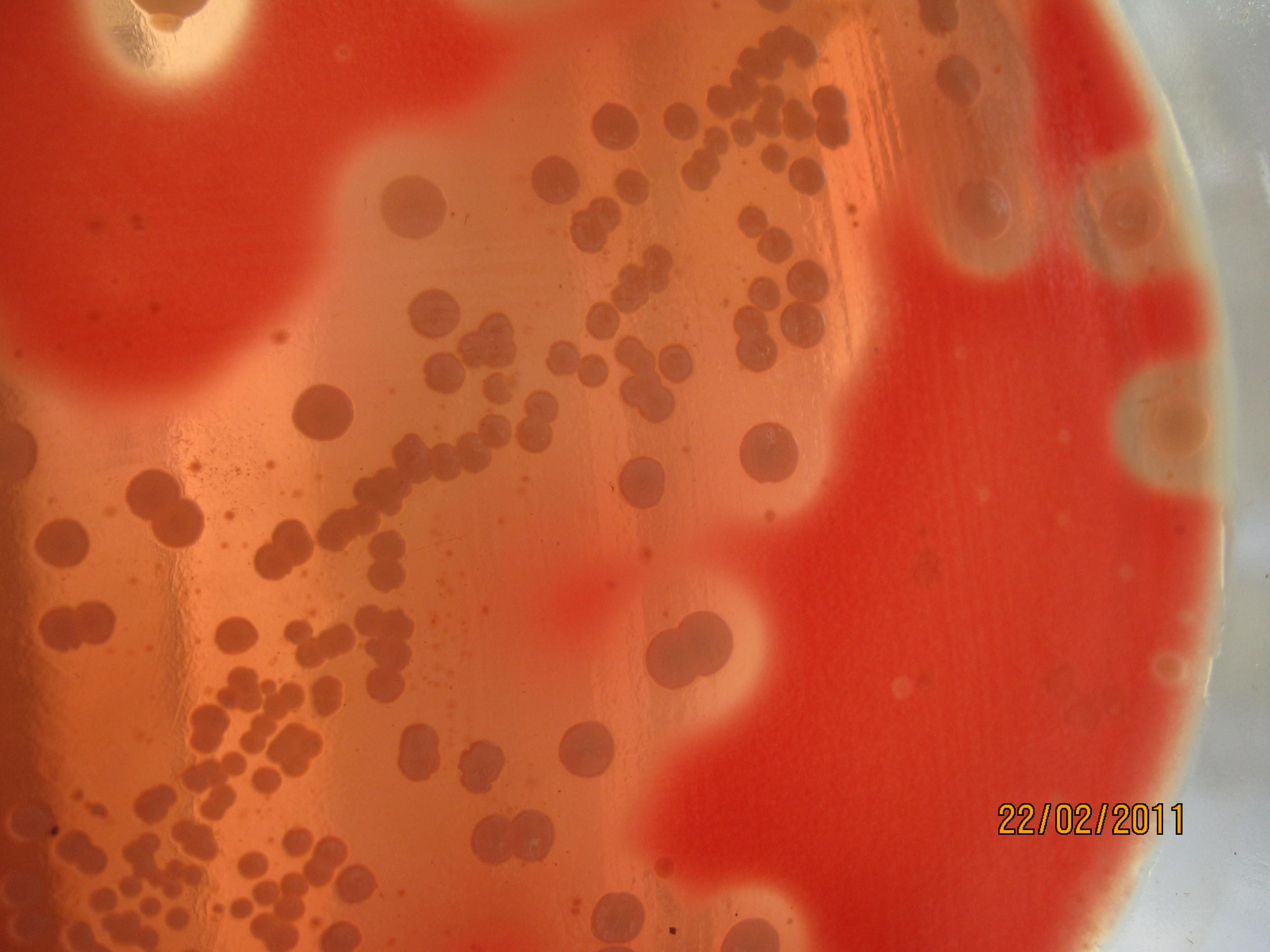 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
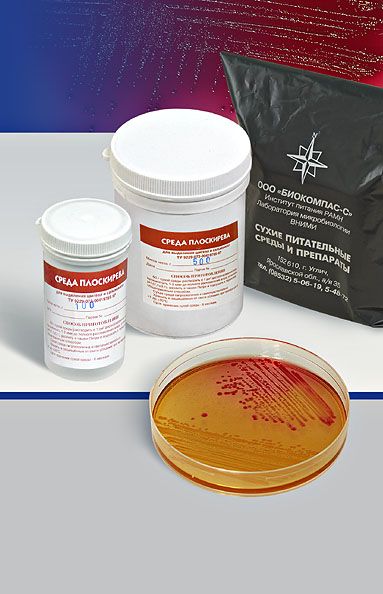
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
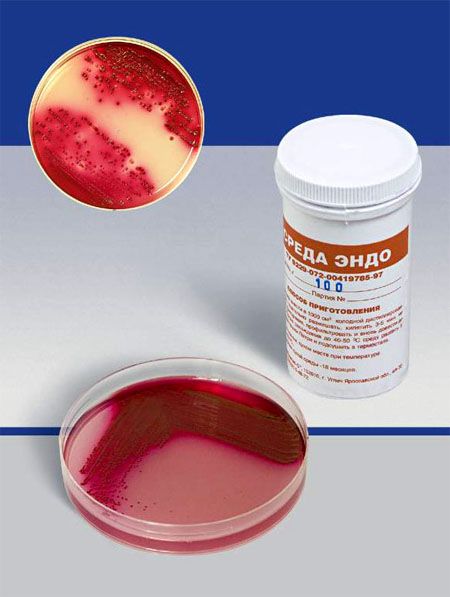
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
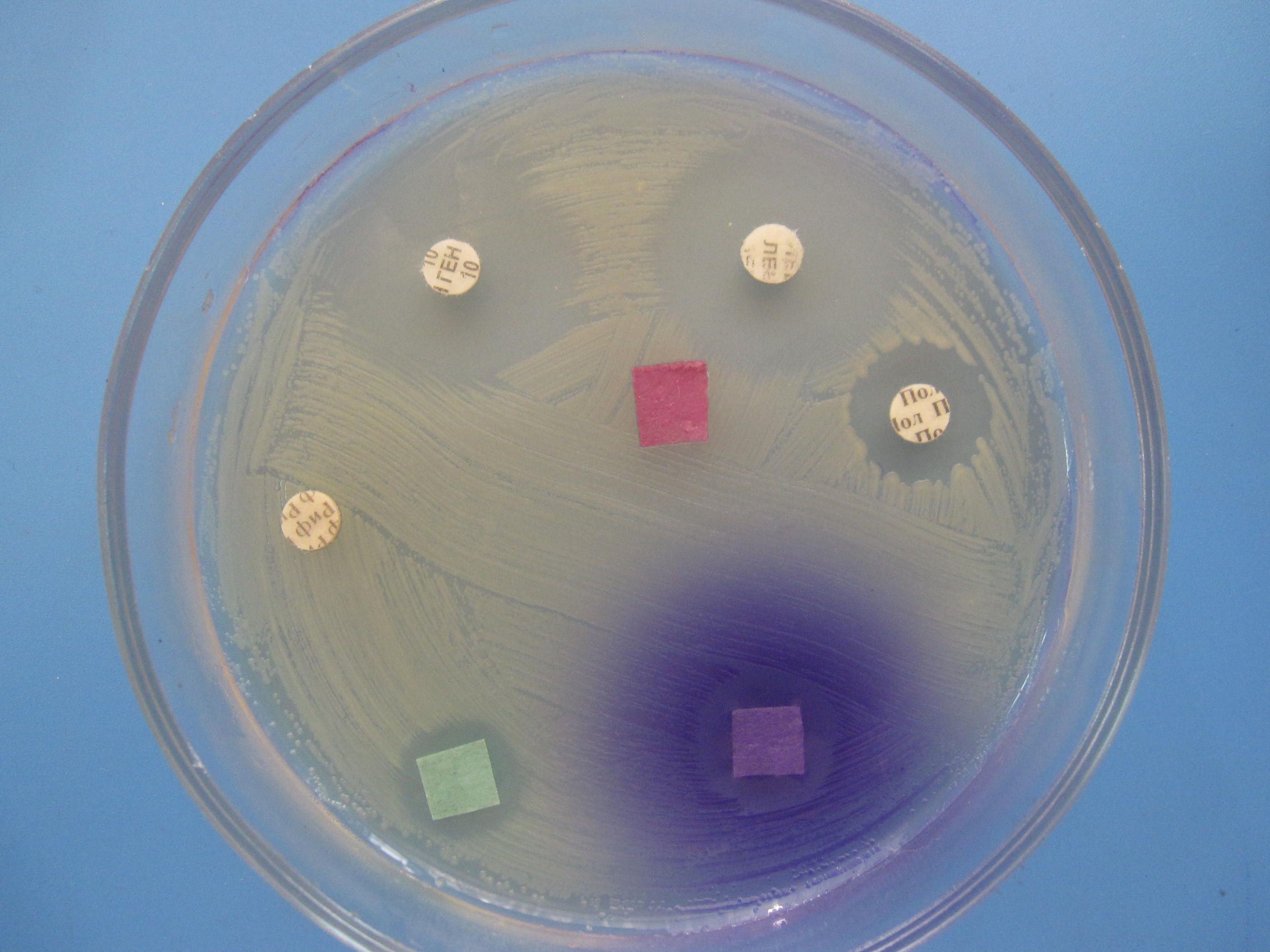 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
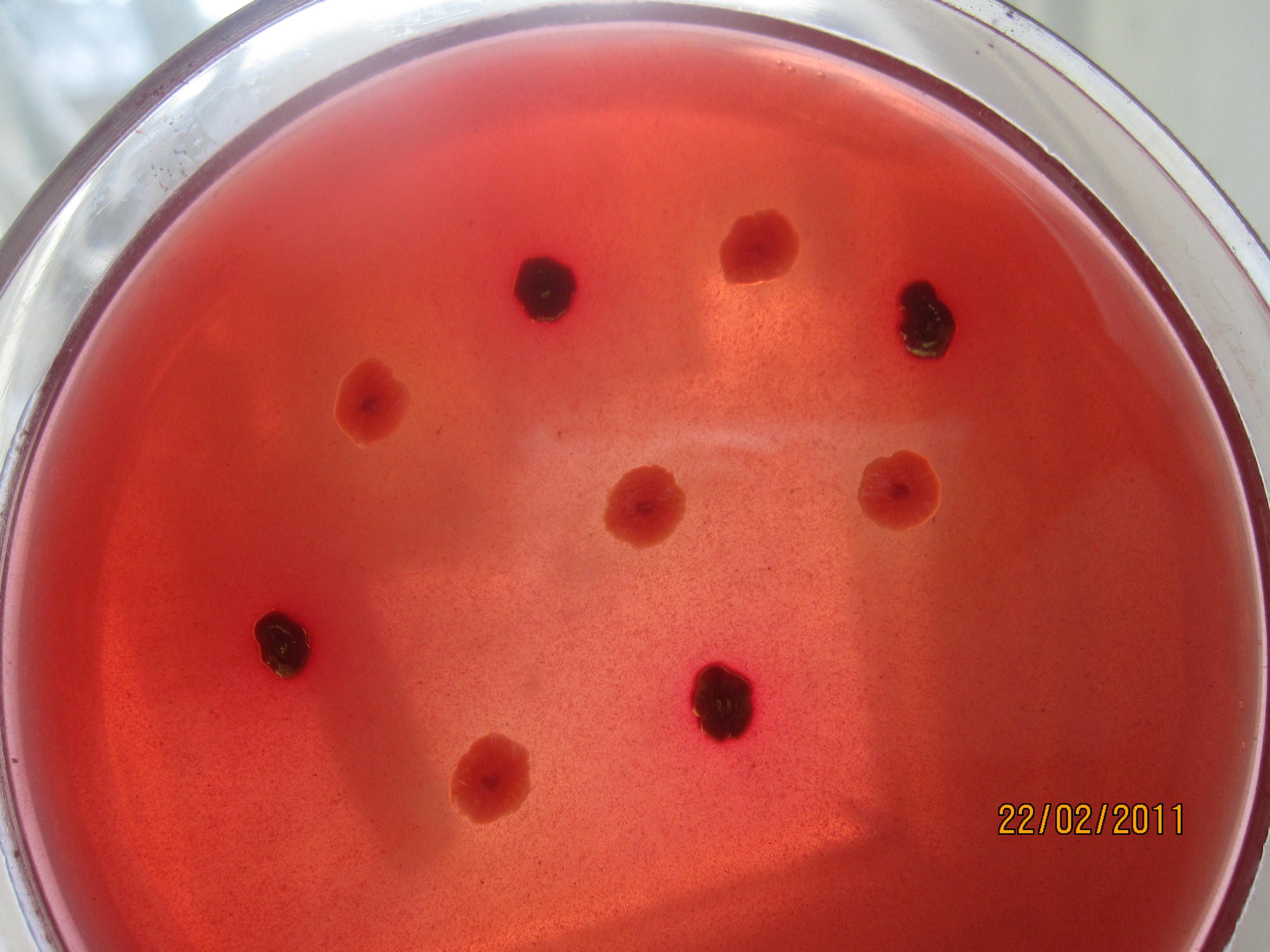
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
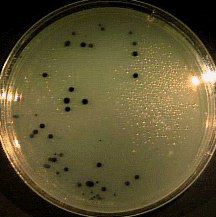
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
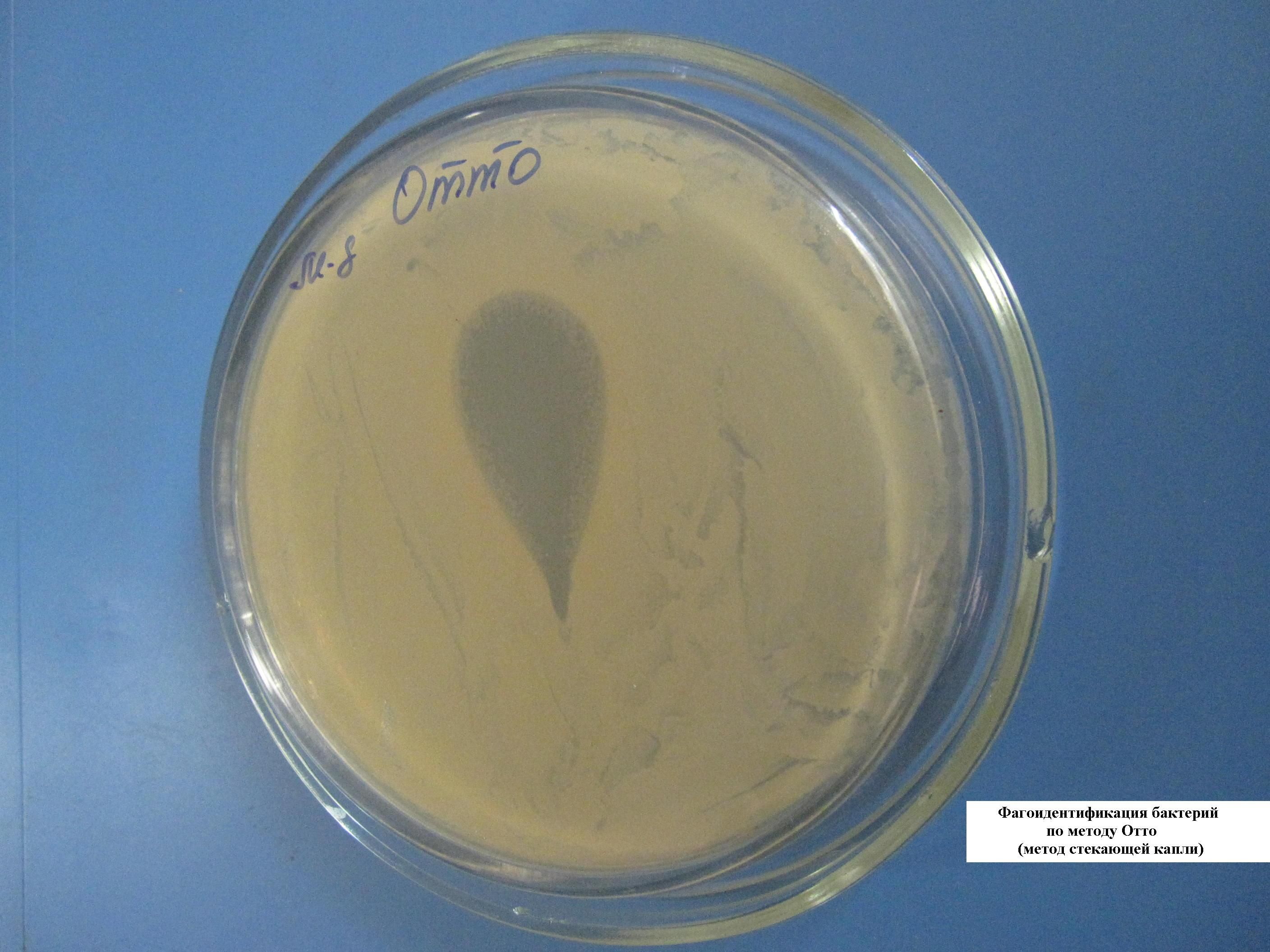
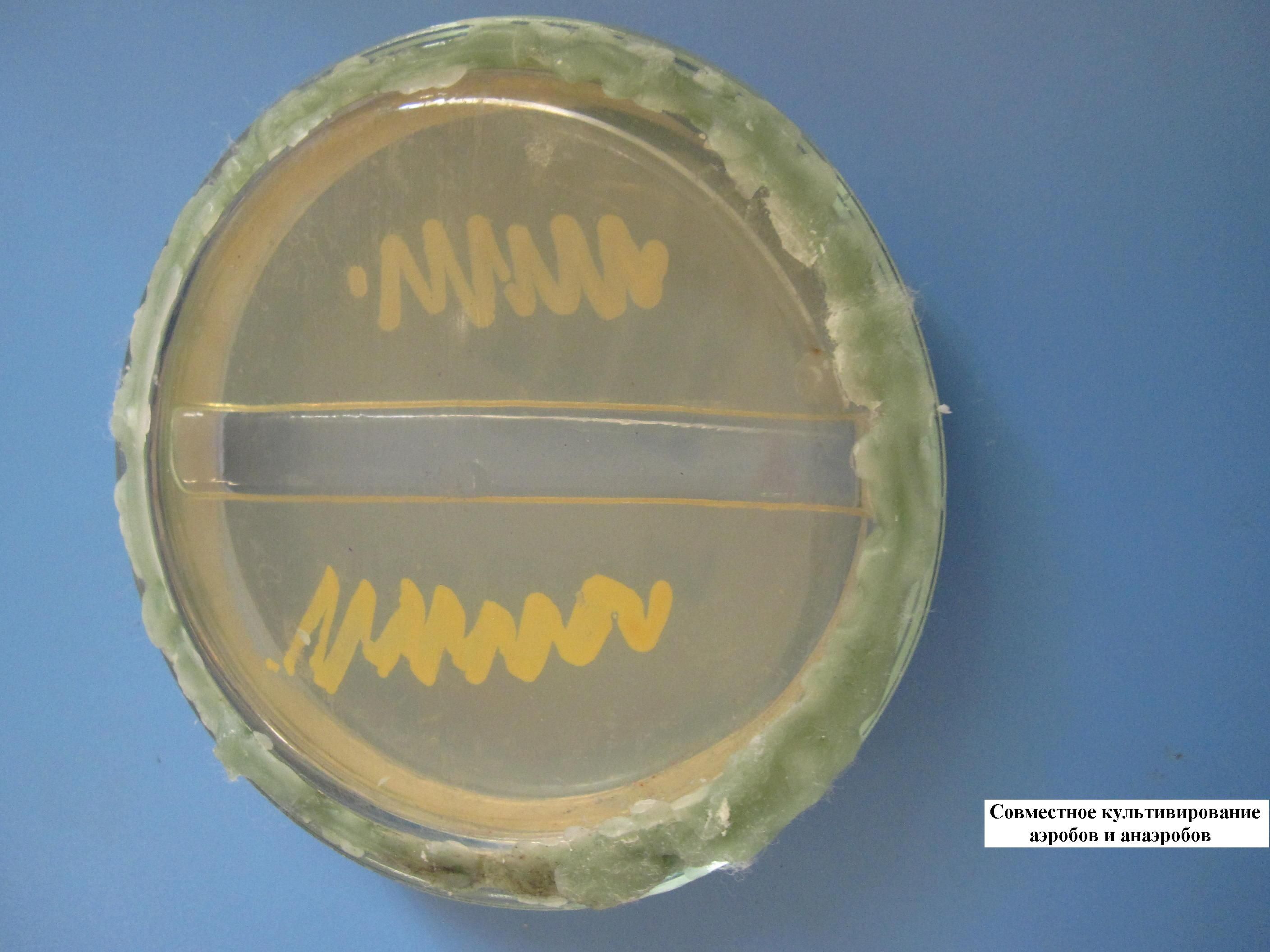 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
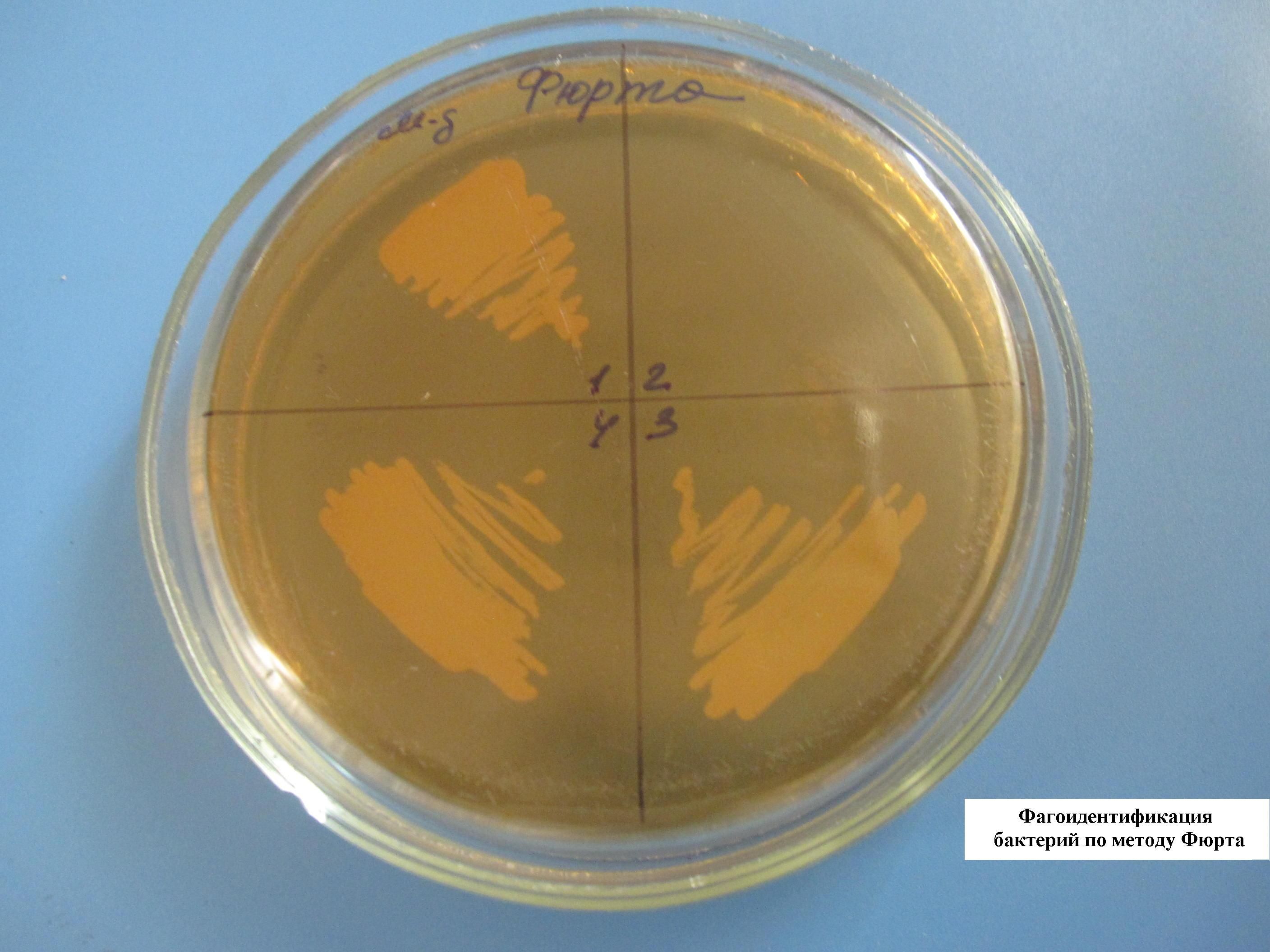 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
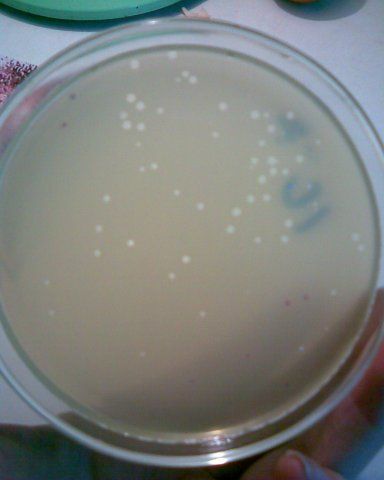 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
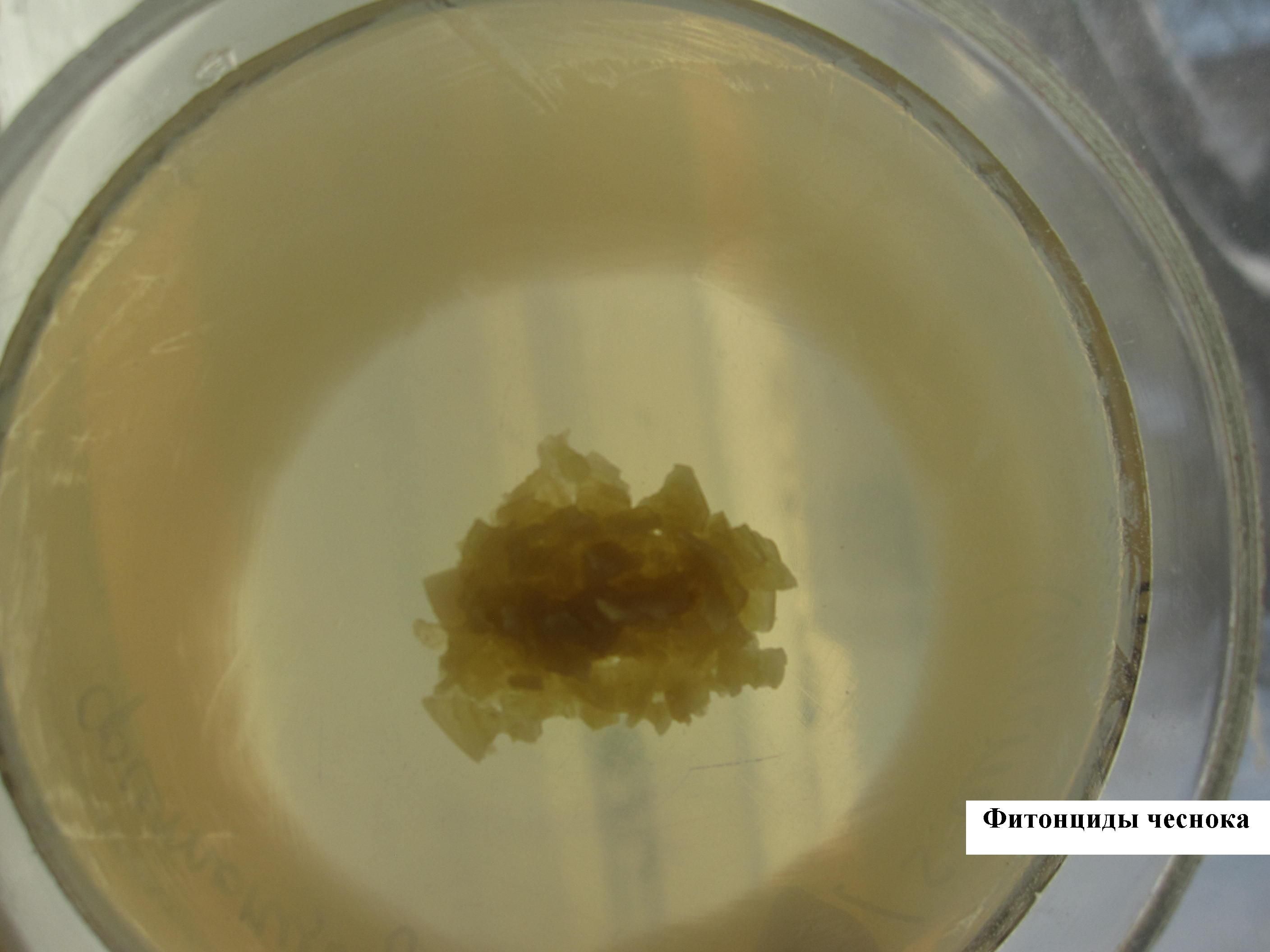 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник
Естественные среды представляют собой природные субстраты (молоко, кровь, желчь, сыворотка, картофель). Искусственные содержат смесь природных органических веществ и продуктов их кислотного или ферментативного распада. Синтетические среды состоят из буферной солевой основы и растворов аминокислот, углеводов, пуринов, пиримидинов, нуклеотидов, нуклеозидов, жирных кислот, витаминов в точно установленных дозировках. В качестве источников азота в них используются аминокислоты. Достоинство этих сред в том, что они имеют постоянный состав, по ним можно определить потребности микробов в тех или иных питательных веществах.
Плотные питательные среды готовят из жидких с добавлением уплотнителя. В качестве уплотнителя обычно применяют агар-агар. Агар-агар – продукт, получаемый из морских водорослей, представляет собой желтоватый порошок или пластинки, содержит высокомолекулярные полисахариды, не расщепляется большинством микроорганизмов, не разрушается при автоклавировании, питательную ценность сред не изменяет, не подавляет рост микробов. Для иммунологических и бактериологических полей используется вымороженный, осветленный агар, который при кипячении или автоклавировании смеси порошка с водой расплавляется при температуре 85–100°С, а при охлаждении до 45–48°С образует гель.
Для приготовления, плотных питательных сред агар-агар добавляют в концентрации от 1,5 до 3%.
Простые среды.
Мясо-пептонный бульон (МПБ) является белковой основой всех сред.
Существует несколько способов приготовления МПБ:
а) на мясной воде с добавлением готового пептона – это так называемый мясо-пептонный бульон;
б) на переварах продуктов гидролиза исходного сырья при помощи ферментов (трипсина – бульон Хоттингера, пепсина – бульон Мартена).
Мясо-пептонный агар (МПА) – получают путей добавления к МПБ arap-arapa (1,5–3%). Если МПА распределен по диагонали пробирки или флакона – это скошенный агар. Для его получения пробирки для застывания среды оставляют в наклонном положении. Если среда распределена в пробирке вертикально высотой 5–7 см, это агар столбиком. МПА, застывший в чашках Петри в виде пластинки – пластинчатый агар. Если среда имеет вертикальный слой высотой 2–3 см, и диагональный слой такой же величины, это полускошенный агар.
Специальные питательные среды – среды, на которых создаются условия для выращивания тех бактерий, которые не растут на простых средах.
Кровяной агар или кровяной бульон – получают путем добавления к питательной среде 5–10% подогретой стерильной дефибринированной крови барана, кролика лошади, человека. Среда используется для выделения стрептококков, пневмококков и других бактерий, а также для изучения гемолитической активности.
Сывороточный бульон или сывороточный агар получают путем добавления к простым средам 15–20% лошадиной или бычьей сыворотки. Среда применяется для выделения пневмококков, менингококков.
Желчный бульон или желчный агар получают путем добавления к питательной среде медицинской желчи без консерванта, или свежеполученной от крупного рогатого скота. Среда применяется для выделения брюшнотифозных, паратифозных и дизентерийных палочек.
Специальные среды для культивирования анаэробных бактерий: среда Китта-Тароцци состоит из питательного бульона, глюкозы и кусочков печени или мясного фарша для адсорбции кислорода.
Желатин – животный белок, продукт частичного гидролиза коллагена. Имеет вид бесцветных или светло-желтых пластинок без запаха и вкуса. В холодной воде набухает, сильно поглощая воду. При температуре 30°С растворяется, при охлаждении до 20–22°С превращается в гель (студень). Используется в микробиологии для изучения протеолитических ферментов.
Дифференциально-диагностические среды позволяют различить один вид микроба от другого. Принцип построения дифференциально-диагностических сред основан на разной биохимической активности бактерий. В состав дифференциально-диагностических сред входит основная питательная среда, обеспечивающая размножение бактерий, определенный химический субстрат, различное отношение к которому является диагностическим признаком, индикатор, изменение цвета которого свидетельствует о разложении субстрата и образовании кислых продуктов.
Агар Эндо – плотная среда, применяется для выделения и первичной идентификации энтеробактерий. В состав ее входят, кроме питательной основы, лактоза и основной фуксин, обесцвеченный сульфитом и фосфатом натрия. Правильно приготовленная среда бесцветна или имеет слегка розовый оттенок. Колонии бактерий (кишечная палочка), ферментирующие лактозу, окрашиваются на ней в красный цвет; бактерии, не ферментирующие лактозу (сальмонеллы), остаются бесцветными.
Среда Левина (лактозоэозинметиленовый агар) – среда для выделения энтеробактерий. Колонии лактозоферментирующих бактерий окрашены в темно-синий или черный цвет, колонии лактозоотрицательных бактерий вырастают под цвет среды (светло-фиолетового цвета).
Среды Гисса – набор определенных углеводов для изучения ферментативной активности бактерий и их дифференциации по этим признакам.
Элективные питательные среды содержат дополнительные вещества, задерживающие рост грамположительных бактерий. Селективные питательные среды стимулируют рост одних микробов и угнетают рост других. Селективные условия получают путем добавления в среду химических веществ. Так как в этих средах патогенные бактерии размножаются и накапливаются, их называют также средами обогащения.
Среда Плоскирева – плотная питательная среда, содержащая соли желчных кислот, бриллиантовый зеленый, лактозу и индикатор. Эта среда является не только селективной, так как подавляет рост многих микробов и способствует лучшему росту возбудителей брюшного тифа, паратифов, дизентерии, но и дифференциально-диагностической, так как лактозоотрицательные бактерии (шигеллы) образуют на ней бесцветные колонии, а лактозоположительные – кирпично-красные.
Селенитовая среда – является лучшей средой обогащения для сальмонелл и дизентерийных микробов Зонне. Селенит натрия, содержащийся в среде, стимулирует рост этих бактерий и подавляет рост сопутствующей флоры.
Среда Мюллера служит для накопления сальмонелл. К питательной среде добавляют мел, раствор Люголя и гипосульфит натрия. При взаимодействии этих веществ образуется тетратионат натрия, который угнетает рост кишечных палочек, но создает благоприятные условия для размножения сальмонелл.
Висмут-сульфит агар (среда Вильсона-Блера) – содержит соли висмута, бриллиантовую зелень. Сальмонеллы растут на этой среде в виде колоний чернота цвета. Другие виды бактерий на этой среде роста не дают.
Желточно-солевой агар (ЖСА) – среда для выделения стафилококков, содержит до 10% хлорида натрия, что подавляет большинство бактерий, содержащихся в материале. Кроме того, эта среда является и дифференциально-диагностической, так как присутствие яичного желтка позволяет выявить фермент лецитиназу (лецитовителлазу), который образуют патогенные стафилококки. Лецитиназа расщепляет лецитин на фосфорхолины и нерастворимые в воде жирные кислоты, поэтому среда вокруг лецитиназоположительных колоний мутнеет и появляется опалесцирующая зона в виде «радужного венчика».
Теллуритовые среды (сывороточно-теллуритовый агар, кровяно-теллуритовый агар) – селективные среды для выделения дифтерийных бактерий, содержат теллурит калия. Бесцветная соль теллура, содержащаяся в питательной среде, восстанавливается дифтерийными бактериями до металла, окрашивающего колонии в черный цвет.
Щелочной агар элективен для холерных вибрионов, щелочная реакция среды (рН 9,0) не препятствует росту холерных вибрионов, но тормозит рост других микроорганизмов.
Консервирующие среды – среды, содержат добавки, предупреждающие размножение и гибель микробов, что способствует сохранению их жизнеспособности. Консервирующие среды применяются, когда нет возможности быстрого посева на питательные среды.
Для бактерий наиболее употребительны консерванты:
а) глицериновая смесь, состоящая из 0,5 л химически чистого глицерина и 1,0 л физиологического раствора;
б) боратная смесь;
в) фосфатно-буферная смесь.
Для длительного сохранения свежевыделенных и производственных культур применяют полужидкий голодный агар, в этой среде при пониженной жизнедеятельности микробов продукты обмена накапливаются незначительно, что способствует хорошему сохранению культур.
Специальные среды.
В бактериологии широко применяются сухие питательные среды промышленного производства, которые представляют собой гигроскопические порошки, содержащие все компоненты среды, кроме воды. Для их приготовления используются триптические перевары дешевых непищевых продуктов (рыбные отходы, мясокостная мука, технический казеин).
Они удобны при транспортировке, могут длительно храниться, избавляют лаборатории от громадного процесса приготовления сред, приближают к разрешению вопроса о стандартизации сред. Медицинская промышленность производит сухие среды Эндо, Левина, Плоскирева, висмутсульфит агар, питательный агар, углеводы с индикатором ВР и другие.
Термостаты
Для культивирования микроорганизмов используют термостаты.
Термостат – это аппарат, в котором поддерживают постоянную температуру. Прибор состоит из нагревателя, камеры, двойных стенок, между которыми циркулирует воздух или вода. Температура регулируется терморегулятором. Оптимальная температура для размножения большинства микроорганизмов 37°С.
Методика приготовления пластинчатого агара
МПА расплавляют на водяной бане, затем остужают до 50-55°С. Горлышко флакона обжигают в пламени спиртовки, открывают чашки Петри так, чтобы вошло горлышко флаконы, не прикасаясь к краям чашки, выливают 10–15 мл МПА, закрыв крышку, покачивают чашку, чтобы среда равномерно распределилась, оставляют на горизонтальной поверхности до застывания. После подсушивания чашки с пластинчатым агаром хранят на холоде.
Посев петлей
Стерильной остуженной петлей берут каплю материала, левой рукой приоткрывают один край чашки, вносят петлю внутрь и у противоположного края делают петлей несколько штрихов на одном месте, затем петлю отрывают и засевают материал параллельными штрихами от одного края чашки к другому с интервалом 5–6 мм. В начале посева, когда микробов на петле будет много, они дадут сливной рост, но с каждым штрихом микробов на петле остается все меньше, и они будут оставаться одиночными и давать изолированные колонии.
Посев по методу Дригальского
Этот метод используется при посеве материала, обильно обсемененного микрофлорой (гной, испражнения, мокрота). Для посева по методу Дригальского берут шпатель и несколько чашек (3–4). Шпатель – это инструмент, изготовленный из металлической проволоки или стеклянного дрота, загнутого в виде треугольника или Г-образно. Материал петлей или пипеткой вносят в первую чашку и равномерно распределяют шпателем по поверхности среды, этим же шпателем, не прожигая его, втирают материал в питательную среду во второй чашке, а затем – в третьей. При таком посеве в первой чашке будет сливной рост, а в последующих чашках вырастают изолированные колонии.
Выделение чистой культуры по Щукевичу
Для посева берут свежеприготовленную питательную среду с конденсатом. Исследуемый материал забирают петлей и вносят его осторожно, соблюдая правила асептики, не касаясь среды и стенок, в конденсационную воду. Бактерии с высокой подвижностью «выползают» на влажную поверхность скошенного агара.
В результате самостоятельной работы студент должен знать:
1. Классификацию, морфологию грибов, их методы изучения.
2. Классификацию и морфологию актиномицетов.
3. Правила противоэпидемических режимов и техники безопасности.
Уметь:
1. Дифференцировать микроорганизмы при микроскопии.
2. Микроскопировать окрашенные препараты.
3. Обеззараживать материал, обрабатывать руки дезинфирующими препаратами.
4. Приготавливать препараты из чистых культур.
Источник