Анемия при кишечной инфекции
Специалистам / Практика / Практика (статья)
Статья |
17-09-2014, 22:10
|
 АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
Железодефицитная анемия – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности, опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни пациентов.
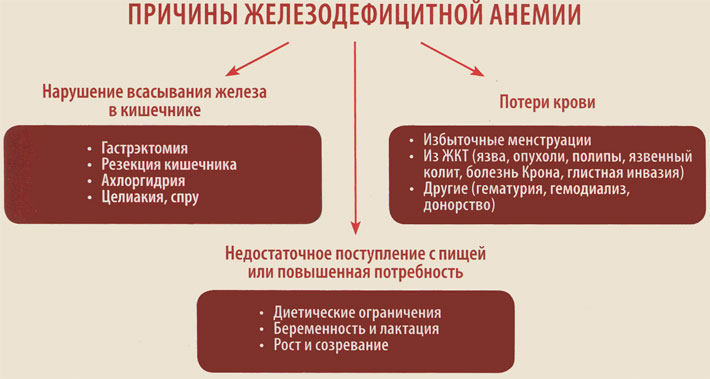
Выделяют три глобальные причины развития дефицита железа в организме:
- Недостаточное поступление с пищей или повышенная потребность.
- Нарушение всасывания железа в кишечнике.
- Хронические потери крови.
Заболевания желудочно-кишечного тракта являются одной из основных причин развития железодефицитной анемии, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний часто выступают болезни верхних отделов желудочно-кишечного тракта и толстой кишки.
Одной из важных причин развития железодефицитной анемии является нарушение процессов всасывания железа в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Различные заболевания тонкой кишки, сопровождающиеся синдромом мальабсорбции (энтерит, амилоидоз, целиакея, идеопатическая стеаторея), а также оперативные вмешательства на желудке и тонкой кишке (состояние после тотальной гастроэктомии, субтотальной резекции желудка, ваготомии с гастроэктомией, резекция тонкой кишки) приводят к развитию дефицита железа.
Накапливаются данные о потенциальной связи инфекции H. pylory с железодефицитной анемией, которая может быть следствием скрытых кровотечений при эрозивном гастрите и язвенной болезни, нарушение всасывания железа при хеликобактерном атрофическом пангастрите, а также снижения содержания аскорбиновой кислоты в желудке и конкурентного захвата и утилизации железа самой бактерией. Таким образом, эрадикация H. pylory может стать еще одним подходом к лечению железодефицитной анемии в отсутствии других явных ее причин.
Этиологическим фактором анемии может стать прием нестероидных противовоспалительных препаратов (НПВП). Врачам хорошо известна возможность как массивных, так и скрытых кровотечений из эрозий и язв желудка и двенадцатиперстной кишки при НПВП-гастропатии. Однако, железодефицитная анемия может быть следствием НПВП-энтеропатии, другими клиническими проявлениями которой могут служить гипоальбуминемия, мальабсорбция и наличие измененной крови в кале.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией железодефицитной анемии, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энетропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз).
Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит и болезнь Крона, часто сопровождаются развитием анемии. Ведущими механизмами при этом выступают кровопотеря у пациентов с язвенным колитом и болезнью Крона, а также мальабсорбция при вовлечении в процесс тощей и подвздошной кишки при болезни Крона.
Ведущей причиной анемии при патологии нижних отделов желудочно-кишечного тракта, особенно у пациентов старше 50 лет, служит колоректальный рак. Хроническая кровопотеря наблюдается при полипах толстой кишки, дивертикулезе, ишемическом колите, геморрое и анальных трещинах.
Анемический синдром часто делает необходимым тщательное обследование желудочно-кишечного тракта. Для уточнения вида анемии проводят исследования общего и биохимического анализа крови.
Среди причин железодефицитной анемии (почти 30-50% всех случаев) прежде всего рассматривают острые или хронические кровопотери из желудочно-кишечного тракта.

Причины железодефицитной анемии
Как показали результаты открытого мультицентрового исследования, проведенного в Украине в 2008 году и базировавшиеся на анализе 1299 историй болезней больных железодефицитной анемией, основной причиной развития были эрозивно-язвенные поражения пищевого канала (44,58%) и заболевания, сопровождающиеся синдромом мальабсорбции. Циррозы печени являлись причиной железодефицитной анемии в 10,39% случаев, воспалительные заболевания кишечника – 4,54% больных.
Диагностируется железодефицитная анемия у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т.д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей.
Диагностика анемии основывается, главным образом, на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина.
Верхние отделы желудочно-кишечного тракта | Нижние отделы желудочно-кишечного такта | Весь желудочно-кишечный тракт |
– Язва желудка | – Аденома толстой кишки | – Болезнь Крона |
Согласно рекомендациям ВОЗ, критерием анемии является снижение концентрации гемоглобина до уровня 120 г/л для женщин (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови 90-110 г/л), средней тяжести (гемоглобин – 70-89 г/л) и тяжелую (гемоглобин менее 70 г/л).
В лабораторной диагностике железодефицитной анемии основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС). ОЖСС – это общее количество железа, которое может связаться с трансферином. В норме сывороточная концентрация железа составляет 12-30 мкМоль/л (50-150мкг%), а ОЖСС – 30-85 мкМоль/л (300-360 мкг%).
Важное значение в лечении железодефицитной анемии имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины железодефицитной анемии невозможно, и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
В качестве заместительной терапии при железодефицитной анемии используют препараты железа.
Терапия железодефицитной анемии при заболеваниях желудочно-кишечного тракта проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки.
Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта. Лечение препаратами железа должно быть длительным.
Суточная доза для профилактики анемии и лечения легкой формы заболевания составляет 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+.
При выборе препаратов железа необходимо учитывать и их состав.
В настоящее время существуют препараты двухвалентного и трехвалентного железа. По мнению специалистов, наибольшей биодоступностью обладает двухвалентная форма железа, именно поэтому старт терапии начинают с препаратов этой группы. Согласно проведенным клиническим исследованиям, терапия препаратами двухвалентного железа позволяет за более короткий временной интервал нормализовать показатели красной крови.
Таким образом, анемический синдром достаточно часто является «маской» многих распространенных и тяжелых заболеваний желудочно-кишечного тракта. Ключевыми моментами диагностики являются определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита железа.
Источник
Анемии при инфекциях, опухолях – клиника, диагностика
Анемия при хронических инфекциях, воспалениях и новообразованиях – это группа гипохромных анемий походит на железодефицитные анемии общим наличием гипосидеремии, но отличается присутствием железа в костномозговых макрофагах.
В симптоматологии таких анемий преобладают признаки основного заболевания и лишь в редких случаях анемия составляет главный симптом. В принципе анемия умеренная и пропорциональна тяжести первичного заболевания. Так при хроническом полиартрите, не имеющем ни какой-либо иной причины, анемия составляет признак эволюции ревматического процесса.
Также показатель анемии больше у страдающего метастазом рака, чем при локализованной форме этого заболевания, даже без прорастания в костный мозг. Анемия развивается лишь после нескольких месяцев эволюции, затем удерживается на примерно стойком уровне.
С морфологической точки зрения анемия, развивающаяся в условиях хронической инфекции, воспаления или новообразования, в принципе носит нормоцитный и нормохромный и лишь в отдельных случаях умеренно гипохромный характер. При этом микроцитоз встречается редко, а пойкилоцитоз — отсутствует. Показатель численности ретикулоцитов нормальный, заниженный или слегка увеличенный.
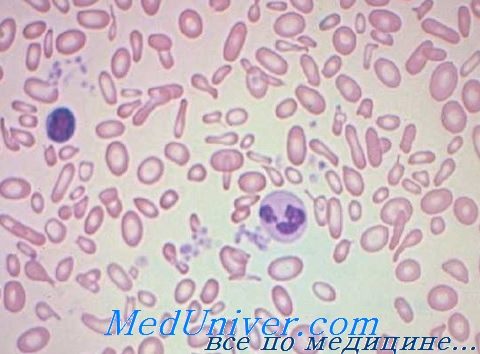
В нейтрофильных гранулоцитах выявляется токсическая зернистость. Исследование метаболизма железа указывает на низкую сидеремию уже с первых дней заболевания и на небольшое число сидеробластов, в то время как в костномозговых макрофагах отмечается наличие значительного количества гемосидерина. Показатель свободного протопорфирина в эритроцитах высокий.
Патогенез этого вида анемии комплексный. В первую очередь он зависит от подвоза небольшого количества железа к эритробластам в результате задержки железа макрофагами. Количество общего железа укладывается в норму, но его оборот и использование дефицитные. Отсутствует удовлетворительное объяснение задержки железа макрофагами.
Известно свойство железа способствовать развитию микробов; следует предполагать какую-то, тормозящую разрастание микробов роль гипосидеремии. Вместе с тем макрофаги используют железо для детоксикации бактериальных продуктов.
Меньшая продолжительность жизни эритроцита и неадекватная реакция костного мозга дополняют картину патогенеза. Органичение выработки эритроцитов видимо связанно с наличием небольшого количества эритропоэтина. При анемии в условиях раковой болезни дополнительными факторами являются хроническая потеря крови и возможность обсеменения костного мозга неопластическими клетками (миелофтизическая анемия).
В большинстве случаев постановка диагноза дело несложное в связи с наличием основного заболевания. Когда же дело осложняется исследование метаболизма железа представляет существенную ценность, поскольку выявляет низкие сидеремию и общую способность связывания железа, также наличие гемосидерина в костномозговых макрофагах.
Терапия нацелена на первичное заболевание. Обычно небольшая степень выраженности анемии не оправдывает проведение специальных терапевтических мероприятий, в том числе переливание крови. В случае хронического воспаления, возможно в сочетании с недостатком железа, целесообразно проводить железотерапию, однако лишь пероральным путем. Парентеральный способ введения железа способствует росту его количества в макрофагах, из которых, в дальнейшем, оно не поступает в процесс кроветворения.
– Также рекомендуем “Сидеробластические анемии – причины, классификация”
Оглавление темы “Гематология”:
- Анемии при инфекциях, опухолях – клиника, диагностика
- Сидеробластические анемии – причины, классификация
- Первичные сидеробластические анемии – причины, клиника, течение
- Лабораторная диагностика первичной сидеробластической анемии – анализы
- Лечение первичной сидеробластической анемии – принципы терапии
- Наследственная сидеробластическая анемия – анемия, реагирующая на пиридоксин
- Вторичная сидеробластическая анемия – анемии, вызываемые изониазидотерапией и отравлением свинцом
- Гемохроматозы – эпидемиология, классификация
- Клиника гемохроматоза – проявления
- Лабораторная диагностика гемохроматоза – анализы
- Лечение и профилактика гемохроматоза – принципы терапии
Источник
Анемия определяется как системная гипоксия, связанная со снижением содержания в организме кислородоносителя. Анемия устанавливается при концентрации гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин [4]. По данным ВОЗ, анемией страдают 2 млрд жителей Земли, 80–90% этих состояний связано с дефицитом железа (железодефицитные синдромы), а более половины является железодефицитной анемией (ЖДА) [2, 8]. ЖДА – это
абсолютный дефицит железа, приводящий к развитию сидеропенического синдрома и анемии (самая распространенная анемия в мире).
Регуляция обмена железа
Ежедневно организму для нормальной жизнедеятельности требуется 20–25 мг железа. С пищей человек получает 1–2 мг, остальное поступает из отслуживших свой 120-дневный срок циркулирующих эритроцитов. Именно поэтому ведущей причиной развития ЖДА является хроническая кровопотеря – недостаток эндогенного железа, содержащегося в собственном гемоглобине. В среднем запасы железа в организме составляют 3000 мг, из которых 2500 мг находятся в крови и до 500 мг – в печени, которая является основным его депо. В течение 1 года здоровый человек получает около 400–800 мг железа извне и столько же теряет.
Всасывание железа происходит в двенадцатиперстной кишке (ДПК) и верхних отделах тощей кишки, 70–80% железа усваивается в 2-валентной форме (гемовое железо из мяса, печени и рыбы). При поступлении в кишечник 3-валентного железа из растительной пищи с помощью медь-зависимой ферроредуктазы на апикальной мембране энтероцитов оно восстанавливается до 2–валентного. Двухвалентное железо через марганец-зависимые белки-транспортеры (ДМТ-белки – транспортеры 2-валентных металлов) поступает в энтероцит, а затем через белок ферропортин (универсальный транспортер железа из всех клеток организма в кровь) на базальной мембране выводится в систему циркуляции. Далее с помощью медь-зависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до 3-валентного состояния, чтобы связаться с транспортным белком – трансферрином (рис. 1). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [11].
Универсальным регулятором метаболизма железа является hepcidin (в отечественной литературе встречается 2 варианта перевода: гепцидин (такое название связано с тем, что этот белок вырабатывается в основном печенью и обладает бактерицидными свойствами) и гепсидин) [3, 26]. Он обладает свойством подавлять активность белка ферропортина, что ограничивает поступление железа из клеток организма в кровь. Увеличение количества железа в организме, так же как и любое воспалительное заболевание, инфекция или опухоль, ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи – к восстановлению захвата железа из пищи и кишечника [13]. Помимо железорегуляторной функции гепцидин обладает выраженным бактерицидным действием, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [3]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. Железо, которое остается внутри клеток, депонируется в виде ферритина (1 молекула ферритина содержит до нескольких тысяч молекул железа), количество которого в крови прямо пропорционально содержанию железа в депо. Следствием такого влияния гепцидина является снижение уровня сывороточного железа. Несмотря на гиперферритинемию, происходит развитие железодефицитного эритропоэза (гипохромной микроцитарной анемии). Такой вид анемии называется анемией хронической болезни (АХБ), относится так же, как и ЖДА, к железодефицитным синдромам и занимает 2-е место по частоте в мире.
Клиническая картина и диагностические критерии ЖДА
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [13].
В настоящее время выделяют несколько стадий дефицита железа [12]:
1. Предрасположенность – высокий риск развития дефицита железа (вегетарианство, подростковый возраст (в сочетании с нарушением менструального цикла у девочек), частые роды, наличие хронических болезней ЖКТ, заболевания женской репродуктивной системы, связанные с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако определяется повышение абсорбции 3-валентного железа в ЖКТ, которое может превышать 50% (в норме – 10–15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме по данным лабораторных исследований.
4. ЖДА.
Клинические проявления ЖДА связаны как с симптомами системной гипоксии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности), так и с развитием сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета.
Наиболее характерными лабораторными признаками ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8 (по старому исчислению), среднее содержание гемоглобина в эритроците менее 28 пг. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита – менее 80 фл [13].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных, их применение не всегда оправданно. Так, минимальные нормальные значения показателя ферритина сыворотки (ФС) как единственного маркера, отражающего запасы железа в организме и используемого для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [12], варьируют от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени.
В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [10]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [13]. Изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, т. к. они рассчитываются исходя из содержания трансферрина и сывороточного железа. Последний показатель не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [6].
Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20% [13]. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [6].
Наиболее частыми причинами развития ЖДА являются хроническая кровопотеря и повышение потребности в железе (подростковый возраст, беременность, лактация). Рассматривая хроническую кровопотерю как причину ЖДА, надо понимать, что речь идет о длительном процессе, когда в течение 1 года теряется более 2,5 л крови (более 1300 мг железа), что превышает запасы металла в депо и годовую возможность его абсорбции. Помимо этих причин патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в т. ч. обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [6].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [12].
Этиология и патогенез ЖДА при патологии ЖКТ
Дефицит железа сопровождает большое количество заболеваний гастроэнтерологического профиля [23].
Причинами развития кровотечения из верхних отделов кишечника наиболее часто являются язва желудка и ДПК, эрозивный гастрит, эрозивный эзофагит, реже – варикозное расширение вен пищевода, синдром Маллори – Вэйса, грыжа пищеводного отверстия диафрагмы, дивертикулез ДПК, опухоли желудка и тонкого кишечника, ангиодисплазия [1, 7, 9]. Нарушение всасывания часто обусловлено целиакией, отсутствием части кишечника после хирургического вмешательства.
Согласно литературным данным, на долю кровотечения из нижних отделов ЖКТ (дистальнее связки Трейтца) приходится не более 20% всех острых кровотечений, не менее 50% (что более важно для развития ЖДА) – хронических и большинство скрытых (наиболее сложных для топический диагностики) [8]. Среди основных причин данной патологии выделяют заболевания прямой кишки (геморрой, трещины), колиты (язвенный колит, болезнь Крона, инфекционные, ишемические), дивертикулярную болезнь толстой кишки, полипы, рак толстой кишки, эктазии сосудов толстой кишки [8, 14, 15].
ЖДА – хорошо известная проблема среди пациентов, страдающих воспалительными заболеваниями кишечника (ВЗК). ВЗК – общий термин, которым обозначают группу хронических болезней, характеризующихся деструктивным неспецифическим иммунным воспалением стенки кишки. К ВЗК относят язвенный колит и болезнь Крона. Выраженная общая слабость, типично сопровождающая ЖДА, является частым симптомом самих ВЗК и значительно снижает качество жизни таких больных наряду с рецидивирующими болями в животе или хронической диареей. Согласно литературным данным, анемия развивается в 75–80% ВЗК, при этом дефицит железа остается ее самой частой причиной у данной группы пациентов [21, 25]. Развитие дефицита железа при ВЗК вызвано рядом причин, среди которых фигурируют недостаточное всасывание железа и хроническая кровопотеря, которые ведут к дисбалансу поступления и потребления железа на нужды организма. При этом нельзя не отметить роль хронического воспаления и повышение концентрации провоспалительных цитокинов, особенно гепцидина, в развитии анемии при ВЗК [21, 23]. Такие состояния часто в литературе описываются как ЖДА + АХБ [12].
Принципы терапии ЖДА
Основные принципы терапии ЖДА:
- До начала лечения обязательно необходимо выявить и устранить причину развития ЖДА.
- Для лечения надо использовать только лекарственные железосодержащие препараты.
- Независимо от тяжести анемии лечение начинается с пероральных препаратов (с учетом противопоказаний: острых язв желудка и ДПК, эрозивного гастрита), невозможности использования или неэффективного приема пероральных препаратов в анамнезе).
- Лечебная доза пероральных препаратов железа составляет 100–200 мг элементарного железа в сутки (максимально 300 мг), разделенные на 2 приема.
- Использование парентеральных средств возможно лишь при доказанном абсолютном дефиците железа, лечение должно проводиться только в стационаре, используется только расчетная доза.
- В/м введение препаратов железа в настоящее время не используется.
- Сроки лечения при использовании пероральных препаратов железа зависят от тяжести анемии, составляют от 1 мес. при латентном дефиците железа до 3–4 мес. при использовании 2-валентного железа или 4–6 мес. при использовании 3-валентного железа.
- Эффективность лечения определяется по приросту гемоглобина через 1 мес. после начала лечения (не менее 10 г/л/мес.).
- Основанием для прекращения терапии является нормализация не уровня гемоглобина, а содержания железа в депо (ФС более 30–50 мкг/л).
Алгоритм лечения и оценка эффективности ЖДА представлены на рисунке 2.
Особенности лечения ЖДА при заболеваниях ЖКТ
Как уже говорилось, обязательные условия успешности терапии анемии, вызванной хронической кровопотерей (наиболее частая причина ЖДА у пациентов гастроэнтерологического профиля), – выявление источника кровопотери и его устранение.
Трудности и зачастую споры среди специалистов-гастроэнтерологов вызывает вопрос терапии железодефицитных состояний, сопровождающих ВЗК (болезнь Крона, язвенный колит).
Традиционно для лечения ЖДА используются пероральные препараты железа. Однако также известно, что при ВЗК всасывание таких препаратов может быть снижено, что влияет на эффективность терапии, и их использование может приводить к обострению ВЗК. Помимо этого, терапия пероральными препаратами железа у больных с ВЗК связана с частым развитием таких побочных эффектов, как тошнота, абдоминальная боль, диспепсия, что снижает приверженность пациентов к лечению [19, 21].
Согласно результатам опубликованного в 2014 г. исследования, посвященного сравнению эффективности терапии ЖДА у разных групп больных, при лечении питьевым раствором глюконата 2-валентного железа, меди и марганца пациентов с патологией ЖКТ и ЖДА, наблюдались хороший прирост уровня гемоглобина, но медленное и недостаточное восполнение запасов железа в депо. В этой группе побочные эффекты ферротерапии в виде диспепсических расстройств встречались чаще всего (в 20% случаев) [5].
Работы на животных моделях с применением пероральной ферротерапии продемонстрировали связь механизма обострения ВЗК с развитием оксидативного стресса, появлением свободных радикалов в клетках слизистой оболочки кишечника, что приводит к ее повреждению [17, 31]. Согласно результатам подобных исследований на больных, у пациентов с болезнью Крона и язвенным колитом демонстрируются снижение уровней плазменных антиоксидантов (таких как цистеин и глутатион) и повышение титров маркеров активности ВЗК при приеме пероральных препаратов железа [16, 18, 30].
Все это явилось причиной увеличения роли использования препаратов железа для в/в введения в терапии ЖДА у больных ВЗК [19, 23, 27]. Среди таких препаратов железа наиболее широкое применение в настоящее время нашли железа (III) гидроксид сахарозный комплекс (ЖСК, 100 мг железа в 5 мл), железа карбоксимальтозат (ЖКМ, 50 мг железа в 1 мл) и железа (III) гидроксид декстран (50 мг железа в 1 мл). Как правило, одномоментно вводят 100–200 мг, но, используя ЖКМ, однократную дозу можно увеличить до 1000 мг [13, 28].
Стоит отметить, что применение декстранов сопряжено с высоким риском анафилактических реакций. ЖСК и ЖКМ практически лишены такого риска [23, 29]. Тем не менее препараты железа для в/в введения должны применяться под контролем врача в условиях стационара, дозировки должны быть строго рассчитаны [13].
В 2012 г. проведен метаанализ публикаций, где сравнивали режимы с использованием в/в и пероральных форм железа в терапии взрослых больных ЖДА с ВЗК. Проанализировано 757 публикаций, при этом отмечено: более значительный прирост уровня гемоглобина отмечен в группе, получавшей внутривенные формы препаратов железа, индекс активности ВЗК и уровень качества жизни были сопоставимы в 2-х группах, а в группе пероральных препаратов железа отмечалось больше побочных эффектов [30].
В 2011 г. проведено рандомизированное контролируемое открытое мультицентровое исследование по применению препаратов железа для в/в введения в терапии ЖДА у больных ВЗК, где проводилось сравнение эффективности и безопасности применения ЖКМ в фиксированной дозе с индивидуально подобранными дозировками ЖСК. В исследование было включено 485 пациентов с ЖДА легкой и средней степени тяжести, проходивших лечение в 88 клиниках 14 стран мира. Больные получали либо ЖКМ (максимально 3 инъекции по 1000 или 500 мг железа), либо ЖСК в дозах, рассчитанных по формуле Ganzoni (максимально 11 инъекций по 200 мг железа). Согласно полученным результатам, большее число пациентов, получавших ЖКМ, достигло терапевтического эффекта, у этих больных была выше приверженность лечению, при этом оба режима хорошо переносились [28].
Однако зачастую анемия при ВЗК остается резистентной к терапии препаратами железа. Это может быть вызвано доминированием роли хронического воспаления, влиянием провоспалительных цитокинов на эритропоэз и гепцидина на перераспределение железа в организме больного [23]. Показано, что у пациентов с болезнью Крона и язвенным колитом, сопровождающихся анемией, уровень сывороточного эритропоэтина неадекватно низок степени анемии [22, 24], что является важнейшим признаком АХБ [11]. Это может быть обусловлено прямым ингибирующим действием провоспалительных цитокинов на выработку эритропоэтина почками [20].
Согласно C. Gasche et al., у большинства пациентов с анемией при ВЗК успешность терапии может быть достигнута путем использования комбинации ЖСК с препаратами эритропоэтина [23].
Заключение
ЖДА представляет собой важную, социально значимую проблему. Сочетание ЖДА с патологическими состояниями других систем организма, особенно часто – ЖКТ, вызывает определенные трудности при диагностике и лечении. Разработка современных рекомендаций с учетом этиологии и патогенеза дефицита железа у указанной группы больных позволит значительно повысить качество и эффективность оказания медицинской помощи при ЖДА.
Источник