Атф синтаза у кишечной палочки
У этого термина существуют и другие значения, см. АТФ.
Молекулярная модель АТФ-синтазы
Аденозинтрифосфатсинта́за (АТФ-синта́за, АТФ-фосфогидролаза, H+-transporting two-sector ATPase) — группа ферментов, относящихся к классу транслоказ, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов. Название по номенклатуре – АТФ-фосфогидролаза, однако, с августа 2018 года фермент перенесён из третьего (3.6.3.14) в седьмой класс (7.1.2.2[1]), так как катализируемая ферментом реакция протекает по обратному гидролизу пути, и не может быть описана с помощью других типов реакций остальных классов.
В классификации ферментов реакция описывается следующим уравнением:
ATP + H2O + 4 H+[side 1] = ADP + phosphate + 4 H+[side 2]
Энергию для синтеза АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например, из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
АДФ + Фн → АТФ + H2O
АТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ относится к так называемым макроэргическим соединениям, при гидролизе которых происходит освобождение значительного количества энергии.
Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы митохондрий.
Структура и номенклатура[править | править код]
Имеющаяся в митохондриях АТФ-синтаза F1FO очень хорошо исследована.
- компонент FO — трасмембранный домен,
- компонент F1 находится вне мембраны, в матриксе.
АТФ-синтазный комплекс FOF1 по форме напоминает плодовое тело гриба, у которого компонент F1 — это шляпка, ножка — это γ-субъединица компонента F1, а «корни» гриба — компонент FO, заякоренный в мембране.
В структурно-функциональном плане АТФ-синтетаза состоит из двух крупных фрагментов, обозначаемых символами F1 и FO. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтетазы, называемая фактором сопряжения FO, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода (ядер протия). Всего в состав комплекса FO входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону FO субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Номенклатура фермента имеет традиционное происхождение, поэтому довольно непоследовательна.
Обозначение компонента F1 является сокращением от «Fraction 1» (часть 1), а символом FO (в индексе записана буква O, а не ноль) обозначался участок связывания олигомицина.
Некоторые субъединицы фермента имеют также буквенные обозначения:
- Греческие: α, β, γ, δ, ε
- Латинские: a, b, c, d, e, f, g, h
Другие — более сложные обозначения:
- F6 (от «Fraction 6»)
- OSCP — белок, чувствительный к олигомицину (от англ. the oligomycin sensitivity conferral protein), ATP5O
- A6L (названный так по названию гена, кодирующего его в митохондриальном геноме)
- IF1 (фактор ингибирования 1), ATPIF1
Компонент F1 достаточно велик (диаметр его составляет 9 нм), чтобы быть видимым в трансмиссионный электронный микроскоп при негативном окрашивании[2].
Частичками F1 усеяна внутренняя митохондриальная мембрана. Изначально считалось, что они содержат весь дыхательный аппарат митохондрии. Однако после долгих экспериментов группа Эфраима Рекера (впервые выделившая компонент F1 в 1961) показала, что эти частички связаны с АТФазной активностью в том числе и в разделённых митохондриях, и в субмитохондриальных частицах, формирующихся при ультразвуковом воздействии на митохондрии. Множество дальнейших исследований в разных лабораториях подтвердили эту АТФазную активность.
Конформационные изменения АТФ-синтазы в ходе синтеза
Модель синтеза АТФ: механический катализ[править | править код]
В 60—70 годах XX века Пол Бойер предположил, что синтез АТФ связан с изменениями конфигурации АТФ-синтазы, вызываемыми вращением γ-субъединицы, так называемый механизм изменения участка связывания («перевёртыш», англ. flip-flop). Исследовательской группе под руководством Джона Э. Уокера, относившейся тогда к Лаборатории молекулярной биологии в Кембридже, удалось выделить АТФ-синтазный каталитический комплекс F1 в кристаллической форме. На тот момент это была самая крупная из известных науке асимметричная белковая структура. Её исследования показали, что модель вращающегося катализа, предложенная Бойером, соответствует действительности. За это открытие Бойер и Уокер получили половину Нобелевской премии по химии в 1997 году. Вторую половину получил Йенс Кристиан Скоу «за первое открытие фермента, осуществляющего транспорт ионов — Na+,K+-аденозинтрифосфатазы».
Механизм действия АТФ-синтазы. АТФ показан красным, АДФ и фосфат — розовым, вращающаяся субъединица γ — черным.
Кристалл F1 состоит из перемежающихся α- и β-субъединиц (по 3 каждого вида), расположенных как дольки апельсина вокруг асимметричной γ-субъединицы.
В соответствии с принятой моделью синтеза АТФ (также называемой моделью непостоянного катализа), градиент электрического поля, направленный поперёк внутренней митохондриальной мембраны и обусловленный электронной транспортной цепочкой, заставляет протоны проходить сквозь мембрану через АТФ-синтазный компонент FO.
Часть компонента FO (кольцо из c-субъединиц) вращается, когда протоны проходят через мембрану. Это c-кольцо жёстко связано с асимметричной центральной ножкой (состоящей в основном из γ-субъединицы), которая в свою очередь вращается внутри α3β3-участка компонента F1. Это приводит к тому, что три участка катализа, связывающиеся с нуклеотидами, претерпевают изменения в конфигурации, приводящие к синтезу АТФ.
Основные субъединицы (α3β3) компонента F1 соединены дополнительной боковой ножкой с неподвижным участком FO, что предотвращает их вращение вместе с γ-субъединицей.
Структура неповрёжденной АТФ-синтазы с низкой точностью выявлена при помощи электронной криомикроскопии (ЭКМ). Показано, что боковая ножка — это гибкая перемычка, похожая на канат, наматывающаяся на комплекс во время его работы.
При каждом обороте γ-субъединицы на 3600 синтезируются три молекулы АТФ, При этом, видимо, у разных организмов из межмембранного пространства в матрикс проходит от 10 до 14 протонов — по числу с-субъединиц[3].
В определённых условиях каталитическая реакция может протекать в обратном направлении, при этом гидролиз АТФ вызывает прокачку протонов через мембрану.
В механизме изменения участка связывания задействован активный участок β-субъединицы, последовательно проходящий через три состояния[4].
В «открытом» состоянии АДФ и фосфат подходят к активному участку. Затем белок охватывает эти молекулы и свободно связывается с ними («свободное» состояние). Следующее изменение формы белка прижимает молекулы друг к другу («тесное» состояние), что приводит к формированию АТФ. Наконец, активный участок снова переходит в «открытое» состояние, освобождает АТФ и связывает следующую молекулу АДФ и фосфата, после чего цикл производства АТФ повторяется.
Физиологическое значение[править | править код]
Как и у многих других ферментов, действие АТФ-синтазы F1FO обратимо. Большие концентрации АТФ заставляют её расщеплять АТФ и создавать трансмембранный протонный градиент. Такое использование АТФ-синтазы отмечено у анаэробных бактерий, не имеющих электронной транспортной цепочки. Эти бактерии применяют гидролиз АТФ для создания протонного градиента, который задействован в движении жгутиков и клеточном питании.
У аэробных бактерий в нормальных условиях АТФ-синтаза, как правило, работает в обратном направлении, производя АТФ за счёт энергии электрохимического потенциала, создаваемого электронной транспортной цепочкой.
В целом данный процесс называется окислительным фосфорилированием.
Он протекает и в митохондриях эукариот, на внутренней мембране которых расположены молекулы АТФ-синтазы, причём компонент F1 находится в матриксе, где и протекает процесс синтеза АТФ из АДФ и фосфата.
КПД АТФ-синтазы близок к 100%[5].
АТФ-синтаза у разных организмов[править | править код]
АТФ-синтаза растений[править | править код]
У растений АТФ-синтаза CF1FO присутствует в хлоропластах. Она встроена в мембрану тилакоида, причём компонент CF1 выступает в строму, где протекают темновые реакции фотосинтеза (также называемые светонезависимыми реакциями цикла Кальвина). Структура и механизм катализа АТФ-синтазы хлоропластов почти такая же, как и в митохондриях. Однако электрохимический потенциал у хлоропластов формируется не дыхательной электрон-транспортной цепочкой, а другими комплексами — фотосистемой II и цитохромным комплексом b6/f.
АТФ-синтаза E. coli[править | править код]
АТФ-синтаза кишечной палочки — самая простая из всех известных АТФ-синтаз. Она состоит всего из 8 видов субъединиц.
АТФ-синтаза дрожжей[править | править код]
Напротив, АТФ-синтаза дрожжей — самая сложная из известных. Она состоит из 20 различных видов субъединиц.
Эволюция АТФ-синтазы[править | править код]
Эволюция АТФ-синтазы считается примером модульной эволюции, при которой две субъединицы, каждая обладающая своими функциями, соединились и получили новые функции.
Гексамер α3β3, входящий в состав компонента F1 проявляет существенное сходство с гексамерной ДНК-геликазой. Оба типа ферментов образуют кольцо с вращательной симметрией 3 порядка, обладающее центральной пóрой. Действие каждого из них также зависит от относительного вращения макромолекулы внутри поры: геликазы используют спиральную форму ДНК для движения вдоль неё и для обнаружения суперскручивания, тогда как α3β3-гексамер использует изменения своей конфигурации из-за вращения γ-субъединицы для осуществления каталитической реакции.
Протонный мотор компонента FO проявляет большое функциональное сходство с протонными моторами жгутиков. И там, и там присутствует кольцо из множества небольших богатых α-спиралями белков, вращающихся относительно соседних неподвижных белков за счёт энергии протонного градиента. Это, конечно, очень зыбкое сходство, так как структура жгутиковых моторов гораздо сложнее, чем FO, а вращающееся белковое кольцо гораздо крупнее и состоит из 30 субъединиц против 10, 11 или 14, входящих в состав компонента FO.
Теория молекулярной эволюции предполагает, что две субъединицы с независимыми функциями — ДНК-геликаза с дополнительным АТФ-азным действием и протонный мотор — смогли соединяться, причём вращение мотора вызывало проявление АТФ-азной активности геликазы. Или же, наоборот, в первичной связке ДНК-геликазы и протонного мотора гидролиз АТФ на геликазе заставлял работать протонный мотор. Это соединение затем постепенно оптимизировалось, получило возможность катализировать обратную реакцию и через какое-то время превратилось в сложную АТФ-синтазу, существующую в настоящее время. Однако, до сих пор неясен механизм происхождения протонного мотора, который без геликазы или других комплексов не представляет никакой пользы.
См. также[править | править код]
- Окислительное фосфорилирование
- Митохондрия
- Хлоропласт
- Дыхательная электронтранспортная цепь
- Протонный насос
- Аденозинтрифосфатазы
Примечания[править | править код]
- ↑ Международный союз биохимии и молекулярной биологии. EC 7.1.2.2. IUBMB Enzyme Nomenclature (август 2018).
- ↑ Fernandez-Moran et al., Journal of Molecular Biology, Vol 22, p 63, 1962
- ↑ Протонный градиент АТФ-синтетазы (англ.)
- ↑ Gresser M.J., Myers J.A., Boyer P.D. Catalytic site cooperativity of beef heart mitochondrial F1 adenosine triphosphatase. Correlations of initial velocity, bound intermediate, and oxygen exchange measurements with an alternating three-site model (англ.) // J. Biol. Chem. : journal. — 1982. — Vol. 257, no. 20. — P. 12030—12038. — PMID 6214554.
- ↑ K. Kinosita, Jr. R. Yasuda, H. Noji, K. Adachi. А rotary molecular motor that can work at near 100% efficiency. Philos Trans R Soc Lond B Biol Sci. 2000 April 29; 355(1396): 473—489.
Литература[править | править код]
- Ю. М. Романовский, А. Н. Тихонов. Молекулярные преобразователи энергии живой клетки. Протонная АТФ-синтаза — вращающийся молекулярный мотор (рус.) // УФН. — 2010. — Т. 180. — С. 931—956.
Ссылки[править | править код]
- «АТФ-синтаза — чудесная молекулярная машина» (англ.)
- Хорошо проиллюстрированная лекция об АТФ-синтазе, прочитанная Энтони Крофтсом в Университете Иллинойса в Урбана-Шампен (англ.)
- Протонные и натриевые насосы-АТФазы типа F, V и A в базе данных OPM (англ.)
- Нобелевская премия по химии за 1997 год, присуждённая Полу Д. Бойеру и Джону Э. Уокеру за открытие ферментного механизма синтеза АТФ, и Йенсу К. Скоу за открытие ионно-транспортного фермента Na+, K±АТФазы (англ.)
- Harvard Multimedia Production Site — видеоролик, показывающий синтез АТФ
Источник
Строение и функционирование F1F0-АТФ-синтазы
Основная масса энергии в клетках эукариот и почти всех прокариот запасается в процессе окислительного фосфорилирования в форме АТФ. Этот многоступенчатый процесс происходит в мембранах.
В организме человека весом около 70 кг за 75 лет при сидячем образе жизни нарабатывается 2 млн кг АТФ. В клетках эукариот синтез АТФ, который является одним из наиболее распространенных ферментативных биологических процессов, происходит в специальных органеллах, называемых митохондриями.
Образование АТФ в клетке катализируется ферментом F1F0-АГФ-синтазой, который представляет собой необычный молекулярный мотор, использующий энергию электрохимического градиента протонов (трансмембранный протонный градиент) для синтеза АТФ. Электрохимический градиент протонов создается комплексами, переносящими электроны в ходе окислительного фосфорилирования.
Он определяется двумя показателями: мембранным потенциалом и разностью концентраций протонов по сторонам мембраны митохондрий.
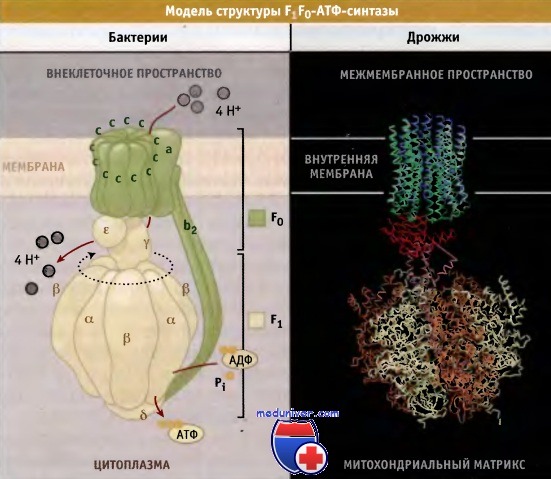
Общая структура F1F0-АТФ-синтазы во всех клетках одинакова, хотя состав субъединиц может различаться. Простейшая форма F1F0-АТФ синтазы цитоплазматической мембраны бактериальной клетки состоит из восьми типов субъединиц и обладает молекулярной массой 530 кДа.
Состав ее может быть выражен стехиометрической формулой а3 b3 γ δ ε a b2 с10-14. В митохондриях фермент содержит 7-9 дополнительных регуляторных субъединиц, которые немного увеличивают его молекулярную массу. АТФ-синтаза состоит из двух доменов:
• связанный с мембраной домен F0 (ab2c10-14 у бактерий), который участвует в транслокации протонов в направлении электрохимического градиента, и
• глобулярный домен F1(а3 β3 γ δ ε у бактерий), содержащий каталитические сайты, ответственные за синтез АТФ. (Изолированный F1 домен обладает способностью к гидролизу АТФ.)
Субъединицы с домена F0 образуют кольцо, которое взаимодействует с субъединицей а. Субъединица у формирует центральный выступ ротора, который связан с основанием кольца с и входит в каталитический домен F1. Этот домен состоит из трех а и трех b субъединиц, которые расположены попеременно и образуют структуру гексагонального цилиндра вокруг субъединицы у.
Выступающая ножка статора состоит из субъединиц b2δ, причем субъединица δ связана с доменом F1, а b2 с доменом F0 митохондриальной мембраны и с субъединицей а.
Каким образом F1F0-АТФ-синтаза использует энергию трансмембранного протонового градиента для синтеза АТФ? Предложенная модель постулирует существование следующих основных этапов:
• субъединицы а и с контролируют транспорт протонов таким образом, что с-кольцо вращается по отношению к субъединице а. Иными словами, энергия электрохимического градиента протонов расходуется на механическое вращение субъединиц с;
• у-субъединица центрального выступа вращается вместе с с-кольцом, при этом трансмембранная движущая сила протонов передается на расстояние 100 А домен F1; и
• механическая энергия вращения используется для высвобождения АТФ, синтез которого катализируется b-субъединицами домена F1.
Поэтому вращение с-кольца и центральной у-субъединицы относительно субдомена а3 b3 играет существенную роль в сопряжении трансмембранной движущей силы протонов с образованием и выходом АТФ. Поскольку каждая с-субъединица несет один протон, то при полном обороте с-кольца (в зависимости от типа АТФазы) транспортируются 10-14 протонов, и на одну молекулу образующегося АТФ транспортируются около четырех протонов.
F1F0-АТФ-синтаза превращает электрохимическую энергию в механическую и снова в химическую, почти со 100%-ной эффективностью. Синтез АТФ может проходить с максимальной скоростью порядка 100 с-1, и уровень АТФ в клетке может достигать миллимолярных концентраций.
У некоторых бактерий F1F0-АТФ-синтаза работает в обратном направлении, и энергия, высвобождающаяся за счет гидролиза АТФ, расходуется на выход протонов из клетки и на создание их градиента по сторонам цитоплазматической мембраны. Затем энергия протонного градиента используется для транспорта в клетку метаболитов, например лактозы.

Схематическое изображение комплекса F1F0-АТФ-синтазы Е. coli и часть кристаллической структуры дрожжевого фермента.
Изображение кристаллической структуры дрожжевого фермента построено на основании Protein Data Bank file 1Q01.
Показано предполагаемое положение мембраны.
– Также рекомендуем “Строение и функционирование протонных насосов (H+-АТФазы, V-АТФазы)”
Оглавление темы “Биология клетки”:
- Строение и функционирование натрий-калиевой АТФазы
- Строение и функционирование F1F0-АТФ-синтазы
- Строение и функционирование протонных насосов (H+-АТФазы, V-АТФазы)
- Современные возможности изучения ионных каналов
- Вывод и применение уравнения Нернста
- Механизмы входящего выпрямления калиевых каналов мембраны клетки
- Развитие муковисцидоза (кистозного фиброза) при мутации гена анионного канала CFTR
- Секрекция и адресование белков в клетке
- Адресование (таргетинг) белков в эндоплазматическом ретикулуме клетки
- Сигнальные последовательности связывания белков с эндоплазматическим ретикулумом (ЭПР)
Источник