Атопический дерматит кишечная палочка
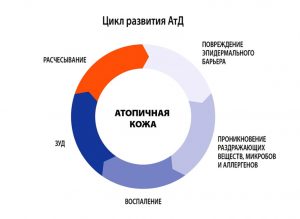
Атопический дерматит (АД) – хроническое рецидивирующее заболевание кожи, проявляющееся интенсивным зудом, высыпаниями в сочетании другими многочисленными признаками атопии (необычностью) – атопический ринит, бронхиальная астма, мигрень, гастродуоденит и др.
Атопический дерматит — симптомы
АД в мире страдают 5-15 % детей и 2-10 % взрослых, впервые выявленный в детстве АД продолжается у 45- 60 % взрослых пациентов. АД отличается хроническим рецидивирующим течением с возрастной динамикой клинических проявлений. По проявлениям заболевание возможно разделить на три периода.
- В младенческом возрасте (до 1.5-2 лет) заболевание носит острый характер, преобладают явления покраснения, отечности, мокнутия и коркообра
 зования.
зования. - В период от 2 лет до полового созревания болезнь носит характер хронического воспаления, на коже на первый план выступают явления гиперемии (эритемы) и шелушения, признаки вегетососудистой дистонии. Кожа в очагах поражения гиперпигментирована, из-за сильного зуда появляются множественные расчесы.
- У детей старшего возраста и взрослых преобладают явления инфильтрации (уплотнения) на фоне гиперемии застойного характера. На коже могут появляться зудящие высыпания, имеющие цвет нормальной кожи, которые сливаются в очаги сплошной папулезной инфильтрации. Обычно к 50 годам заболевание самостоятельно регрессирует.
Атопический дерматит – многофакторное заболевание, характеризующееся аномальным иммунным ответом на аллергены природного происхождения, наследственной предрасположенностью к заболеванию, хроническим рецидивирующим течением. Большое внимание уделяется различным факторам, запускающим процесс в коже и длительно поддерживающим хроническое течение заболевания. К таким факторам относятся бактериальные, вирусные, грибковые, паразитарные и кишечные инфекции, продукты питания и химические вещества (добавки к пище, лекарства), клещи из домашней пыли.
Атопический дерматит и хеликобактер пилори
В последние годы доказана связь атопического дерматита с болезнями органов пищеварения. Установлено, что большинство больных, страдающих АД, имеют хронический гастрит, гастродуоденит, синдром раздраженного кишечника с запорами, заболевания печени и желчного пузыря, нарушение микрофлоры кишечника и др. Нередко существование этих сопутствующих болезней является пусковым фактором атопического дерматита, как у детей, так и у взрослых.
 Так, в последние десятилетия в возникновении заболеваний желудка доказана роль специфического микроорганизма – Helicobacter pylori (НР), повреждающего слизистую оболочку желудка. Его наличие способствует активному поступлению токсинов и аллергенов в организм, развитию хронического воспаления слизистой желудка. У больных атопическим дерматитом в 90% случаев при проведении эндоскопического обследования желудка выявляется хронический гастрит и в 82.5% ассоциированный с НР. Отмечена связь между степенью обсеменения бактериями слизистой желудка, активностью хронического гастрита и степенью тяжести АД, что явилось обоснованием к включению в план обследования больных АД на хеликобактериоз и лечебных мероприятий антихеликобактерной терапии. Клинически гастриты у большей части больных АД протекают бессимптомно.
Так, в последние десятилетия в возникновении заболеваний желудка доказана роль специфического микроорганизма – Helicobacter pylori (НР), повреждающего слизистую оболочку желудка. Его наличие способствует активному поступлению токсинов и аллергенов в организм, развитию хронического воспаления слизистой желудка. У больных атопическим дерматитом в 90% случаев при проведении эндоскопического обследования желудка выявляется хронический гастрит и в 82.5% ассоциированный с НР. Отмечена связь между степенью обсеменения бактериями слизистой желудка, активностью хронического гастрита и степенью тяжести АД, что явилось обоснованием к включению в план обследования больных АД на хеликобактериоз и лечебных мероприятий антихеликобактерной терапии. Клинически гастриты у большей части больных АД протекают бессимптомно.
Эрадикация хеликобактера приводит к разрешению заболевания почти у трети больных АД, к улучшению течения АД у остальных пациентов, и самое главное, удлинению периода ремиссии заболевания АД и перехода непрерывного течения заболевания к рецидивирующему.
Обязательным условием профилактики АД у больных хроническим гастритом, ассоциированным с НР, учитывая оральный путь инфицирования, является обследование на хеликобактериоз контактных лиц в семье и вне ее!
Защитная роль кишечника
Здоровье невозможно без нормального функционирования кишечника, которому принадлежит большая роль в детоксикации и иммунологических процессах, которые протекают в организме человека. Слизистая кишечника представляет собой место контакта организма с окружающей средой. Для сравнения: поверхность кожи составляет около 2 квадратных метров, площадь же слизистой оболочки желудочно-кишечного тракта – около 400 квадратных метров. Поэтому слизистую кишечника считают самой большой частью защитной системы организма.
Для надежной защиты от внешнего вмешательства в пищеварительном тракте важнейшим оказался микробиологический барьер.
- Защитная микрофлора кишечника наиболее многочисленная (95%) и представлена в основном бифидобактериями, лактобактериями и кишечной палочкой. Эти микроорганизмы выделяют молочную и уксусную кислоты и другие вещества, которые обладают антимикробным действием и препятствуют проникновению и закреплению на слизистой кишечника вредных микроорганизмов, которые не свойственны человеку. Они стимулируют иммунную систему организма человека, являются сорбентами, которые способны накапливать значительное количество тяжелых металлов и других токсических веществ.
- Сапрофитная микрофлора кишечника представлена стафилококками, энтерококками и другими микроорганизмами, основная роль которых — утилизация конечных продуктов обмена организма человека.
- Оппортунистическая микрофлора представлена различными микроорганизмами (стрептококки, золотистый стафилококк, грамотрицательные энтерококки, грибы рода кандид и др.), которые при определенных условиях вызывают патологический процесс.
Для человеческого организма исключительно важно поддержание требуемого состава и количества кишечных бактерий. Оптимальные условия могут быть нарушены вследствие неправильного питания, возбудителями диареи (бактерии и паразиты), дополнительными отрицательными факторами могут быть токсические вещества, поступающие из окружающей среды, например, тяжелые вещества – кадмий, свинец, ртуть, а также путешествия в другие страны с иными микроорганизмами. Отрицательным действием на флору обладают многие лекарственные средства и методы лечения, непереносимость продуктов питания, вредно одностороннее и несбалансированное питание, недостаточность пищеварительных ферментов.
Атопический дерматит и дисбактериоз
Многие кожные болезни, и в том числе Атопический дерматит, сопровождаются дисбактериозом, и при этом считается, что отягощающим фактором при АД является недостаточное количество лактобактерий. Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют образование иммуноглобулинов класса А, которые, особенно в раннем возрасте, являются основными антителами против пищевых аллергенов.
В настоящее время считают, что возникновение кожных заболеваний в определенной мере связано с нарушением микроэкологического баланса кишечника. У 80-95% больных атопическим дерматитом отмечается дисбактериоз кишечника, при этом наряду с дефицитом лактобактерий и бифидобактерий наблюдается избыточный рост золотистого стафилококка, кишечной палочки с измененными свойствами, грибов роста кандид, выделяющих токсины.
Эти нарушения требуют санации кишечника от вредных бактерий, проведения детоксикационной терапии (энтеросорбции) и создания условий для развития собственной микрофлоры пациента, регуляции работы кишечника (борьба с запорами). Энтеросорбция – неинвазивный метод детоксикации и направлена она на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, условно-патогенных микроорганизмов и продуктов их жизнедеятельности. Одним из самых эффективных сорбентов являются природные органические на основе пищевых волокон, таких как лигнин, который не усваивается в пищеварительной системе и обладает высокой сорбционной активностью.
Новое направление лечения АД представляет собой применение пребиотиков (лактулоза), полученных из естественных источников и выступающих в качестве питательной среды для развития своей собственной нормальной флоры кишечника. Сочетание сорбента и пребиотика представлено в препарате Лактофильтрум, который производится из компонентов природного происхождения в таблетированной форме, прост в употреблении — по 2 таблетки 3 раза в день в течение 3-4 недель.
В клинической практике выявлена корреляция между степенью выраженности дисбактериоза и проявлений АД. Кроме прямого влияния дисбактериоза на сенсибилизацию организма при АД, в настоящее время доказано опосредованное влияние на состав аутомикрофлоры кожи у больного АД.
Образование токсических веществ в кишечнике в дальнейшем действует не только на иммунную систему, но и нарушает детоксикационную функцию печени, образование и выделение желчи из печени, желчевыводящих путей и желчного пузыря.
Атопический дерматит и желчный пузырь
При обследовании больных, страдающих атопическим дерматитом, в 60% случаев определяется дискинезия желчевыводящих путей, у взрослых по гипотоническому типу, т.е. желчный пузырь плохо сокращается, и не выводятся токсические вещества из организма.
У 31% пациентов в желчном пузыре определяется густая желчь, с хлопьями или мягкими конкрементами (сладж желчи), что свидетельствует о нарушении качественного состава желчи, продуцируемой печенью. Таким образом, нарушается еще одна функция органов пищеварения, осуществляющая детоксикационную функцию организма.
При этом в комплекс лечения больных АД добавляются желчегонные препараты (желчегонные сборы трав, Хофитол, Гепабене, настой шиповника или Холосас, Холит и др.), а также назначаются препараты, улучшающие функцию печени и качество желчи, продуцируемой печенью (Урсофальк, Урсосан, Уролесан), препараты расторопши, гептрал, гепатосан и др., проводятся гуманные тюбажи желчного пузыря (с растительными маслами, медом, минеральной водой).
Клинический опыт показывает, что улучшение состояния микрофлоры кишечника, регуляция работы кишечника без запоров и улучшение работы печени и желчевыводящей системы и желчного пузыря способствует более эффективному лечению больных с атопическим дерматитом.
Питание при атопическом дерматите
Несколько слов о питании у больных АД. Питание для больных АД во многих случаях не играет настолько большой роли, как часто полагают. Существует огромное количество продуктов питания, для которых выявлена взаимосвязь с АД, но в конечном счете реальным фактором является только индивидуальная чувствительность. Существует целый спектр потенциально опасных продуктов, и каждый пациент должен составить индивидуальный рацион питания. Пациентам с АД необходимо соблюдать полноценное питание, избегать строгих диет, особенно в детском возрасте.
Продукты питания, которые могут оказывать негативное воздействие на Атопический дерматит:
- Острые, копченые продукты,
- пряности,
- алкоголь,
- овощи (перец, редис, квашеная капуста, сельдерей, помидоры),
- орехи,
- сладости (мед, сахар, сушеные фрукты, шоколад),
- крепкие мясные бульоны,
- маринады,
- кофе, какао,
- яйца, молоко,
- рыба,
- пищевые добавки, консерванты, пищевые красители.
Пациент и сам должен активно участвовать в процессе оздоровления своего организма. Особенно следует обратить внимание на такие важные мероприятия как:
- полноценное питание,
- отказ от сахара,
- употребление в пищу пищевых волокон (отруби, пектины, сложные углеводы),
- употребление кисломолочных продуктов, заквашенных лактобактериями, или препараты с лактобактериями,
- отказ от свинины.
Атопический дерматит — фитотерапия
Важное место в лечении и профилактике обострений играет фитодиетология. Она включает использование соков из клюквы, черной смородины, красной и черноплодной рябины, свекольный, сливовый, яблочный, черничный, тыквенный, капустный соки.
Лечение Атопического дерматита травяными сборами
Несколько прописей травяных сборов, применяемых при АД.
- Сбор 1. Трава череды 10.0, листья подорожника 10.0, листья крапивы 10.0, трава полыни 5.0, трава тысячелистника 5.0, трава зверобоя 15.0, трава хвоща 10.0, листья толокнянки 20.0. Смешать, приготовить настой из 1 чайной/столовой ложки (в зависимости от возраста). Принимать по 1/3 стакана 3 раза в день до еды, прием 1-2 месяца.
- Сбор 2. Трава трехцветной фиалки 20.0, корень девясила 10.0, трава зверобоя 15.0, трава хвоща 10.0, шишки хмеля 10.0, трава душицы 10.0, цветки ромашки 15.0, трава мяты перечной 5.0. Смешать. Доза и способ приготовления настоя. Принимать по 1/3 стакана 3 раза в день после еды в течение 1-2 месяцев.
- Атопический дерматит с сопутствующими запорами. К 1и 2 настою добавить слабительный сбор, настой плодов фенхеля (5.0:200.0), настой листьев подорожника (10.0:200.0), настой плодов тмина (5.09:200.0) или препараты лактулозы (Дюфалак, Нормаза, лактусан)
- Атопический дерматит при длительном течении процесса, особенно в зимне-весеннем периоде. Используются растительные лекарственные препараты с витаминными свойствами. Это настой листьев крапивы (15.0:200.), плодов шиповника (10.0:200.0), листьев черной смородины и ее плодов.
- Атопический дерматит с выраженными мокнутиями, отечностью и инфильтраций кожных покровов. Полезны настои плодов можжевельника (5.0:200.0), листьев почечного чая (3.5:200.0), травы хвоща полевого (10.0:200.0), мочегонного сбора.
- В целях улучшения показателей неспецифического иммунитета применяют настой цветков черной бузины (5.0:200.0), настой корня солодки (10.0:200.0), экстракт элеутерококка или настойку аралии по 2-3 капли (в зависимости от возраста ребенка) утром и вечером в течение 2 недель.
- Сбор для нормализации углеводного обмена. Настой листьев крапивы (10.0:200.0), отвар корня одуванчика (10.0:200.), настой листьев черники (10.0:200.0), отвар корня лопуха (5.0:200.0). Эти настои обладают противовоспалительным, противозудным свойством, оказывают нормализующее действие на желчевыводящие пути и поджелудочную железу.
Местное лечение Атопического дерматита
Для регенерации кожи используется и наружная терапия, принципом которой является: «влажное наносится на влажное». Рекомендуется использовать проницаемые воздухом влажные повязки. Компрессы накладываются трижды в день, каждая процедура продолжается 1 час. В качестве используемых средств используется черный и зеленый чай, ромашковый чай.
Примеры повязок на мокнущие поверхности:
- Повязка с настоем коры дуба: 2 столовые ложки дубовой коры разводятся в 500 мл воды и кипятятся в течение 15 минут, после чего настой процеживают, остужают, в него опускают ткань для компресса и неплотно накладывают на больное место. Достаточно применять такие компрессы 3-4 дня, но ежедневно нужно готовить свежий отвар.
- С этой же целью можно использовать отвар лапчатки (15г:200.0), настой травы зверобоя или тысячелистника (15г:200.0).
- Компресс из трехцветных фиалок: 2 чайные ложки сухих фиалок настаивают в чашке кипятка, получившийся настой сливают, остужают и используют для компрессов на пораженные места.
- Очень широко используются растворы соли, например ванны с солями Мертвого моря. При правильном комплексном лечении мучительный зуд исчезает быстро, но если он сохраняется, то втирание разведенного яблочного уксуса может в значительной степени облегчить зуд.
- После прекращения мокнутий применяются мази, кремы. Пример мази следующего состава: сок подорожника 15 мл, настойка ландыша 5 мл, настойка валерианы 5 мл, настойка календулы 5 мл, димедрол 1 г, паста цинковая 79 г. Смешать. Наносить на пораженные участки 2-3 раза в день тонким слоем после удаления ранее нанесенной мази растительным маслом.
Для очистки кожи не использовать мыло! Можно использовать масляно-молочную ванну: 1 столовая ложка оливкового масла и 200 мл молока добавляются в ванну.
Следует придерживаться правила: каждые 3-4 дня препараты наружной терапии следует менять между собой для предупреждения развития побочных эффектов.
Здоровья вам, дорогие читатели! Если остались или возникли вопросы, задавайте.
Источник
Статья посвящена анализу нарушений и методам коррекции в составе комплексной терапии кишечной микробиоты при атопическом дерматите у детей
Значение кишечной микрофлоры в патогенезе атопического дерматита
Атопический дерматит (АД) — широко распространенный хронический воспалительный дерматоз, наблюдающийся у 15–30% детей и 2–10% взрослых. Это заболевание характеризуется разнообразием фенотипов с широкой вариабельностью клинических признаков [1–3].
На сегодняшний день дисфункция кожного барьера и измененные иммунные реакции представляются основными факторами в патогенезе АД [2–5]. В основе АД, по современным представлениям, лежит нарушение кожного барьера, обусловленное мутацией в гене FLG, кодирующем белок филаггрин. Филаггрин играет важную роль в поддержании эпидермального гомеостаза, удерживая воду и поддерживая барьерную функцию кожи. Мутация в гене FLG приводит к увеличению трансдермальной потери воды, а также повышению проницаемости кожи, что облегчает проникновение в нее из окружающей среды антигенов и различных микроорганизмов [6, 7].
В острой стадии заболевания антигены из внешней среды проникают через нарушенный кожный барьер и вызывают высвобождение кератиноцитами провоспалительных цитокинов, таких как интерлейкин 33 и интерлейкин 25. Последние, в свою очередь, активируют Т-лимфоциты 2 типа, что приводит к нарастанию воспалительной реакции в коже, которая еще более усиливается при вовлечении в процесс клеток Лангерганса. Ремоделирование тканей, наблюдаемое при хронической стадии АД, может быть вторичным по отношению к интерлейкин-17-опосредованному высвобождению цитокинов с профибротической активностью, таких как интерлейкин 11 и фактор роста опухоли бета (TGF-β) [8].
Кишечная микрофлора играет ключевую роль в формировании и функционировании иммунной системы, влияя на течение иммунопатологических процессов во всех органах и тканях.
Известно, что многочисленные бактерии, населяющие кишечник, в частности Bacteroides fragilis, Faecalibacterium prausnitzii и бактерии, принадлежащие к кластерам Clostridium IV и XI, через различные механизмы оказывают модулирующее влияние на иммунокомпетентные клетки, продуцирующие про- и противовоспалительные цитокины, в различных органах и тканях, включая кожу [9].
Продуцируемые кишечными бактериями короткоцепочечные жирные кислоты (КЖК), особенно бутират, подавляют иммунные реакции, снижая пролиферацию клеток, синтезирующих провоспалительные цитокины, их миграцию и адгезию. За счет торможения гистондеацетилазы и инактивации передачи сигналов NF-κB КЖК регулируют как активацию, так и апоптоз иммунных клеток. С другой стороны, ингибирование гистондеацетилазы способствует пролиферации регуляторных клеток, участвующих в различных физиологических процессах в коже, включая регуляцию роста волосяного фолликула, дифференцировку клеток и заживление ран [10–12]. Также показано, что кишечный микробиоценоз может определять физиологические и патологические процессы в коже, регулируя иммунный ответ через транслокацию кишечных бактерий и их метаболитов непосредственно в кожу [12, 13]. В случае повышения проницаемости кишечных барьеров находящиеся там бактерии, а также их метаболиты попадают в кровоток, достигают кожи и могут влиять на ее гомеостаз. В частности, ДНК кишечных бактерий были выделены из крови больных псориазом [13].
Кишечный микробиом, по-видимому, существенно влияет на микробиом кожи. КЖК, синтезируемые кишечной микрофлорой, в частности пропионат, ацетат и бутират, играют ключевую роль в определении микробиомного профиля кожи, влияя на механизмы иммунной защиты. Микроорганизмы рода Propionibacterium, например, способны в значительных количествах продуцировать КЖК, преимущественно ацетат и пропионат, которые, в свою очередь, проявляют выраженный антимикробный эффект в коже в отношении наиболее распространенных штаммов метициллин-резистентного Staphylococcus aureus. В то же время Staphylococcus epidermidis и Propionibacterium acnes, хорошо изученные кожные комменсальные микроорганизмы, в меньшей степени подвержены влиянию КЖК по сравнению с другими представителями кожной микрофлоры [14, 15].
В ряде исследований была продемонстрирована связь между нарушением состава кишечной микрофлоры (кишечным дисбиозом) и АД [16]. В частности, применение метагеномного анализа образцов стула у пациентов с АД продемонстрировало значительное снижение численности F. prausnitzii у этих больных по сравнению с контрольной группой. Параллельно наблюдалось снижение продукции КЖК кишечной микрофлорой у пациентов с АД. Авторы подчеркивают наличие связи между уменьшением численности F. prausnitzii, с одной стороны, и нарушением эпителиального барьера и вторично возникающим воспалением — с другой [17, 18]. Вместе с тем нарушение кишечного барьера на фоне дисбиоза способствует проникновению антигенов, микробов и их токсинов в кровоток и взаимодействию их с тканями-мишенями, включая кожу, где они запускают или усиливают иммунные реакции, приводящие к дальнейшему повреждению тканей [16, 18–20].
Влияние пробиотиков на течение атопического процесса
Положительное влияние кишечных бактерий на состояние кожи показано в ряде исследований с использованием экспериментальных моделей.
В исследовании T. Levkovich et al. (2013) у мышей, получавших c питанием добавку Lactobacillus reuteri, наблюдалось увеличение толщины кожи, усиленный фолликулогенез и увеличенная продукция себоцитов, что проявлялось более густой, блестящей шерстью [21]. В другом исследовании на грызунах Y. Horii et al. (2014) показали, что добавки Lactobacillus brevis SBC8803 уменьшали у крыс кожный кровоток, возможно, через усиленное высвобождение серотонина из кишечных энтерохромаффинных клеток и последующую активацию парасимпатических влияний. Также было показано значительное снижение трансэпидермальной потери воды при введении в пищу лактобацилл [22]. Этот эффект был воспроизведен далее в клинических исследованиях на людях. После приема пероральной добавки L. brevis SBC8803 в течение 12 нед. значительно снизилась трансэпидермальная потеря воды и значительно увеличилась гидратация кожи [23].
В других исследованиях также было показано, что бактериальные пищевые добавки оказывают положительное влияние на барьерную функцию кожи человека. У добровольцев, которые принимали Lactobacillus paracasei NCC2461 в составе пищевой добавки в течение 2 мес., наблюдалось снижение трансэпидермальной потери воды, ассоциированное с увеличением циркуляции в крови TGF-β, цитокина, оказывающего благоприятное влияние на состояние барьерных функций [13, 24]. H. Baba et al. (2006) обнаружили, что добавление Lactobacillus helveticus к эпидермальным культурам кератиноцитов человека повышает экспрессию кератина 10 и инволюкрина, маркеров ранней и поздней дифференцировки клеток, что позволяет предположить способность L. helveticus стимулировать дифференцировку эпидермальных клеток. Кроме того, было показано дозозависимое увеличение синтеза профилаггрина — белка, участвующего в процессах окончательной дифференцировки кератиноцитов [25].
Показано, что кишечный микробиом поддерживает восстановление гомеостаза кожи после ультрафиолетового (УФ) облучения. Так, 10 дней перорального приема Lactobacillus johnsonii у безволосых мышей защищал их от вызванного ультрафиолетом эффекта контактной гиперчувствительности, связываемой с уменьшением числа эпидермальных клеток Лангерганса и увеличением уровня интерлейкина 10 [26]. В плацебо-контролируемом исследовании пищевая добавка L. johnsonii La1 защищала иммунный гомеостаз кожи у 54 здоровых добровольцев после воздействия УФ-излучения. Этот эффект был опосредован через нормализацию эпидермальной экспрессии CD1a-трансмембранного гликопротеина [27, 28].
Кишечная микрофлора способствует аллостазу кожи, оказывая влияние на дифференцировку Т-клеток в ответ на различные иммунные стимулы. Так, пероральное введение Lactobacillus casei снижает дифференцировку CD8C T-клеток в эффекторные клетки кожной гиперчувствительности и уменьшает их численность в коже при воздействии 2,4-динитрофторбензола. Эта бактерия также увеличивает число FoxP3 регуляторных T-клеток в коже, в результате чего снижается апоптоз-опосредованное воспаление и восстанавливается гомеостаз через иммуномодуляторные механизмы [29, 30].
Клетки Th17 широко представлены как в коже, так и в кишечнике, т. к. оба органа контактируют с внешней средой [31]. Эти клетки и их провоспалительные цитокины непосредственно участвуют в патогенезе ряда хронических воспалительных дерматозов, включая псориаз и болезнь Бехчета. Баланс между Th17 эффекторными клетками и регуляторными Т-клетками находится в значительной степени под влиянием кишечного микробиома [32].
Таким образом, имеющиеся данные указывают на тесную функциональную связь кишечной микрофлоры как с физиологическими, так и с патологическими процессами, протекающими в коже, что позволяет говорить о существовании функциональной оси «кишечник — кожа». Вклад в развитие АД может вносить как дисбаланс кишечного микробиоценоза, так и нарушение кожного барьера.
К настоящему времени проведено достаточно много исследований, которые в экспериментальных и клинических условиях показывают возможность применения пробиотиков в составе комплексной терапии АД.
В экспериментальном исследовании на мышах течение АД улучшалось при пероральном введении L. casei var. rhamnosus (LCR35), что сопровождалось увеличением кишечной популяции B. fragilis, лактобацилл, бифидобактерий и энтерококков при снижении Clostridium coccoides и восстановлении баланса Th1 и Th2 клеток [33].
Метаанализ, который включал 8 клинических исследований (741 новорожденный), продемонстрировал положительное влияние пробиотиков, содержащих лактобациллы, на снижение тяжести АД [34].
По данным другого метаанализа (568 детей в возрасте от 1 до 18 лет: 296 — получали пробиотики, 272 — контрольная группа), отмечено улучшение показателей SCORAD (Scoring of atopic dermatitis — шкала атопического дерматита) у детей от 1 года до 18 лет с АД, получавших пробиотики. При этом эффект в большей степени наблюдался при применении Lactobacillus fermentum, Lactobacillus salivarius и смеси различных штаммов (Bifidobacterium bifidum, Lactobacillus acidophilus, L. casei и L. salivarius) [35]. Эти данные подтверждают результаты ранее опубликованных исследований [36].
Метаанализ рандомизированных контролируемых исследований, проведенный Y.S. Chang et al., выявил высокую эффективность в снижении тяжести АД и его профилактике при применении синбиотиков — комбинации пребиотиков и пробиотиков со смесью различных микробных штаммов у детей старше 1 года [37].
Рандомизированное двойное слепое плацебо-контролируемое исследование, в которое вошли 50 детей в возрасте от 4 до 17 лет, показало, что смесь пробиотиков (Bifidobacterium lactis CECT 8145, Bifidobacterium longum CECT 7347 и L. casei CECT 9104) была эффективной в снижении индекса SCORAD [38]. В нескольких рандомизированных клинических испытаниях, касающихся применения пробиотиков у взрослых больных с АД, сообщалось об их положительном эффекте.
A. Roessler et al. в двойном слепом плацебо-контролируемом рандомизированном исследовании с использованием комбинации пробиотиков (L. paracasei Lpc-37, L. acidophilus 74–2 и Bifidobacterium animalis subsp. lactis DGCC 420), продолжавшемся 8 нед., отметили, что значение SCORAD имело тенденцию к снижению, а после приема добавок в стуле пациентов с АД увеличилось количество L. paracasei и B. lactis [39].
Исследование, проведенное Y. Yoshida et al., в котором в течение 8 нед. у пациентов с АД использовалась Bifidobacterium breve, показало, что тяжесть атопического дерматита значительно уменьшилась, а доля B. breve в микрофлоре кишечника увеличилась в группе пациентов, получавших пробиотики [40].
L. Drago et al., используя пробиотик L. salivarius в течение 16 нед. у 38 пациентов с АД средней и тяжелой степени, обнаружили улучшение показателя SCORAD и значительное уменьшение уровня цитокинов Th1 (интерлейкин 12, интерферон-γ), а также значительное уменьшение количества стафилококков в стуле у пациентов, получавших пробиотик [41].
Пероральный прием пробиотика B. animalis subsp. lactis (LKM512) уменьшал выраженность зуда у взрослых пациентов с АД в проспективном плацебо-контролируемом исследовании. При этом было установлено, что противозудный эффект связан с увеличением продукции микрофлорой кишечника кинуреновой кислоты [42].
Кишечная микрофлора и кишечная моторика при атопическом дерматите
В проведенное нами исследование был включен 41 ребенок с тяжелым АД в возрасте 5–16 лет (средний возраст 10,95±0,51 года), 20 мальчиков и 21 девочка [42]. У всех детей оценивалась метаболическая активность кишечной микрофлоры c определением КЖК в стуле методом высокоэффективной газожидкостной хроматографии, а также исследовалась электрическая активность кишечника методом периферической электрогастроэнтерографии.
Выявленные в исследовании нарушения метаболической активности кишечной микрофлоры характеризовались повышением продукции микроорганизмами кишечника уксусной, пропионовой, масляной, валериановой кислот при достоверном повышении доли изокислот.
Полученные данные указывают на увеличение активности сахаролитической флоры, сопровождающееся нарастанием активности нехарактерных для нормального микробиоценоза кишечника протеолитических микроорганизмов при увеличении доли анаэробов.
Также была выявлена связь проявлений АД с изменениями метаболической активности кишечной микрофлоры, скорее всего опосредованной изменениями моторики ЖКТ. Так, показана достоверная положительная корреляционная связь средних значений индекса SCORAD с парциальным содержанием уксусной кислоты, положительная корреляционная связь продукции изокапроновой кислоты с площадью кожного процесса и выраженностью экскориаций, а также парциальным содержанием уксусной кислоты и выраженностью мокнутия.
Функциональные нарушения моторики толстой кишки могут быть причиной изменения состава кишечного микробиоценоза. Выявлена тесная отрицательная связь моторики толстой кишки с суммарной продукцией кишечной микрофлорой КЖК, в частности уксусной и масляной кислот. Другими словами, замедление моторной активности толстой кишки приводит к увеличению синтеза указанных КЖК. При этом снижение электрической активности толстой кишки коррелировало с усилением зуда, потерей сна и эритемой.
Таким образом, основной патологический процесс при АД, предположительно, через изменение состояния вегетативной нервной системы меняет моторику кишечника, что приводит к изменению кишечного микробиоценоза, а изменение внутрикишечного метаболизма и всасывание метаболитов на фоне повышенной проницаемости кишечного барьера поддерживают активность АД.
Новые возможности повышения эффективности лечения
С целью коррекции нарушений моторики органов пищеварения больные получали тримебутина малеат. Тримебутина малеат, действуя на энкефалинергическую систему кишечника, регулирует моторику на всем протяжении желудочно-кишечного тракта, усиливает моторику в случае ее снижения и ослабляет при повышении. Одна таблетка содержит100 мг или 200 мг тримебутина малеата. Препарат разрешен в РФ для применения у детей с 3 лет перорально. Взрослым и детям с 12 лет он назначается по 100–200 мг 3 р./сут, детям 3–5 лет — по 25 мг 3 р./сут, детям 5–12 лет — по 50 мг 3 р./сут.
На фоне проводимого в нашем исследовании комплексного лечения положительная динамика индекса SCORAD указывала на улучшение состояния кожи, более выраженное в основной группе с применением тримебутина малеата (16 детей) по сравнению с контрольной (24 ребенка). На фоне проводимого лечения в контрольной группе достоверной динамики показателей КЖК не было, в основной же группе отмечались положительные изменения, выразившиеся в достоверном снижении суммарной продукции кислот и отношения парциальной доли уксусной кислоты к сумме всех КЖК. Кроме того, по сравнению с контрольной группой достоверно ниже были показатели общего содержания КЖК в стуле, а также содержания уксусной и масляной кислот. Однако нормализация наблюдалась не в полной мере, а содержание изокислот оставалось повышенными даже в конце исследования, что указывает на необходимость продолжения терапии, возможно, с включением пре- или пробиотиков. Результаты исследования указывают на эффективность применения тримебутина для коррекции моторики, но для коррекции состояния микробиоценоза требуются дополнительные терапевтические средства [42].
В качестве такого пробиотического средства может выступить Максилак® Бэби, выпускаемый в форме лиофилизата в гранулах, специально для детей с первых дней жизни. Он содержит 9 специально подобранных штаммов полезных бактерий, включая Lactobacillus rhamnosus GG и B. longum BG-7 в концентрации 1 млрд КОЕ, а также пребиотический компонент — фруктоолигосахариды. Гранулы Максилак® Бэби защищены специальной запатентованной технологией — двумя оболочками: белковой и из коллоидных полисахаридов. Белковая оболочка позволяет без потери качественного и количественного состава пройти три естественных барьера: кислую среду желудка, соли желчных кислот, пищеварительные ферменты. Оболочка из коллоидных полисахаридов защищает содержимое от воздействия влаги и высоких температур. Максилак® Бэби не содержит лактозы и казеина, что особенно важно для детей с АД, имеющих сенсибилизацию к белкам коровьего молока.
В работе Т.Г. Маланичевой и соавт. под наблюдением находились 65 детей с АД в возрасте от 4 мес. до 2 лет, 35 из которых получали в составе комплексной терапии синбиотик Максилак® Бэби по 1 пакетику-саше в сутки в течение 20 дней (в группе сравнения 30 детей получали только базисную терапию основного заболевания). На фоне проводимого лечения у детей основной группы общий терапевтический эффект составил 91,4±5,1%, в то время как в группе сравнения — 80,0±4,3% (р<0,05), с сокращением длительности периода обострения в 1,5 раза (с 13,8±1,4 до 9,1±2,3 дня, р<0,05). Высокий индивидуальный терапевтический эффект в основной группе наблюдался в 2 раза чаще, а низкий — в 2,3 раза реже, чем в группе сравнения. При этом в основной группе индекс SCORAD на фоне лечения снизился в 5 раз — с 29,0±4,8 до 5,6±1,8 балла, а в группе сравнения — в 3 раза, с 29,3±4,7 до 9,8±1,9 балла (р<0,05). Эффект также характеризовался значительным увеличением продолжительности ремиссии. Авторы сделали вывод, что полученные результаты открывают новые возможности применения пробиотических средств, в частности синбиотика Максилак® Бэби, у детей с АД [43].
Заключение
Таким образом, при АД наблюдаются существенные изменения состава и метаболической активности кишечной микрофлоры, которые коррелируют с характером основного заболевания и в значительной степени связаны с особенностями моторики кишечника. Применение в составе комплексной терапии прокинетиков и пробиотиков повышает эффективность лечения АД. Тем не менее многие вопросы взаимосвязи кишечного микробиоценоза с физиологическими и патологическими процессами в коже, включая таковые при АД, остаются не в полной мере изученными и требуют дальнейших исследований, которые в конечном итоге откроют новые пути повышения эффективности терапии.
Источник