Биологические свойства острых кишечных инфекций


Главная
Случайная страница
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать неотразимый комплимент
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?
Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника
Острые кишечные инфекции (ОКИ), по терминологии ВОЗ – диарейные болезни, объединяют более 30 заболеваний бактериальной, вирусной или протозойной этиологии, основным симптомом которых является острая диарея. На рис. 1 представлены основные возбудители первичных ОКИ.
ОКИ являются одними из самых актуальных инфекционных заболеваний в связи с повсеместным распространением и развитием у части больных тяжелого состояния, которое может представлять непосредственную угрозу для жизни (ежегодно в мире от ОКИ умирает 5-10 млн человек). По данным ВОЗ, ежегодно регистрируется до 1-1,2 млрд диарейных заболеваний. В России, в частности, как и в прежние годы, ОКИ занимают 3-4-е место среди всех инфекционных болезней.
На практике все зарегистрированные ОКИ принято разделять на следующие основные группы (Секачева М.И., 2000):
• заболевания, при которых возбудитель остается неустановленным (в 40% случаев);
• ОКИ с установленным возбудителем (в 30-40% случаев заболевание обусловлено вирусами, в 20% – патогенными бактериями). Отдельно выделяют диарею, возбудителями которой являются шигеллы.
По другим данным, примерно 70% случаев ОКИ приходится на заболевания с неустановленной этиологией (Вовк Е.И. и соавт., 2002). Это можно считать следствием общепринятого для ОКИ «синдромального» принципа установления диагноза, который полностью оправдывает себя при заболеваниях, не имеющих эпидемического характера.
Действительно, при спорадических ОКИ (а они доминируют) сходство клинической картины и течения заболеваний различной этиологии позволяет не тратить время на точное определение возбудителя, поскольку это существенно не влияет на выбор стратегии и тактики лечения.
В случае же вспышек ОКИ как можно более раннее выделение и идентификация возбудителя болезни становятся важнейшей задачей, требующей значительных затрат времени и наличия хорошо оснащенной лаборатории.
Важно отметить, что в более обширную группу ОКИ неустановленной этиологии входят и большинство так называемых пищевых токсикоинфекций (ПТИ). Эту группу составляют приблизительно 20 этиологически различных, но патогенетически и клинически сходных заболеваний, не представляющих эпидемической опасности (Вовк Е.И. и соавт., 2002).
ПТИ наиболее часто возникают после употребления продуктов, в которых размножились с выделением экзотоксинов S. aureus, C. perfringens типа А или B. cereus. Заболевания характеризуются коротким инкубационным периодом (чаще 1-4 ч), отсутствием лихорадки, поражением желудка. К пищевым интоксикациям относится также заболевание, вызываемое ботулотоксином, однако оно имеет свою, весьма отличную от других пищевых интоксикаций клиническую картину.
ОКИ – заболевания различной этиологии и семиотики – объединяет общий для всех преимущественно фекально-оральный механизм передачи возбудителя и развитие вследствие этого характерного симптомокомплекса острой диареи. Независимо от этиологии, инфицирование возбудителями ОКИ происходит преимущественно пищевым или водным путем.
Достаточно сказать, что с пищей и водой человек ежесуточно поглощает до 1 млрд микробных тел (Малов В.А., Горобченко А.Н., 2005).
Согласно результатам современных эпидемиологических исследований, в различных странах этиологическая структура кишечных инфекций может существенно отличаться. Так, если в экономически развитых странах на вирусную этиологию острых инфекционных диарей приходится 75-80%, на бактериальную – 15-20% всех верифицированных случаев, то в развивающихся государствах доминируют заболевания бактериальной этиологии. Кроме того, у некоторых контингентов существует повышенный риск заболевания ОКИ.
К опорно-диагностическим критериям, позволяющим заподозрить инфекционную природу диареи, можно отнести:
• острое начало заболевания;
• острую профузную диарею (основной симптом);
• тошноту, рвоту;
• боли в животе;
• примеси слизи и/или крови в испражнениях;
• в тяжелых случаях – наличие симптомов интоксикации и нейротоксикоза, а также обезвоживания;
• лихорадку;
• снижение или отсутствие аппетита;
• нарушения гемодинамики (нарушения микроциркуляции, уменьшение количества отделяемой мочи);
• развитие метаболического ацидоза;
• нередко увеличение печени и селезенки.
Патогенетические механизмы ОКИ связаны с особенностями возбудителей, которые посредством нескольких механизмов преодолевают противомикробную защиту организма хозяина. Такими механизмами являются:
• адгезия (адгезины – лектиноподобные молекулы – обеспечивают адгезию бактерий к микроворсинкам слизистой оболочки кишечника; агглютинины различной природы и др.);
• инвазия (инвазины – белки бактериального происхождения, обеспечивающие инвазию путем изменения функций цитоскелета эпителиальных клеток; жгутики, энтеробактины (различные сидероформные системы, связывающие ионы Fe2+); интегрины и т. д.);
• продукция энтеротоксинов (действующих на механизмы ионного обмена в энтероцитах);
• продукция цитотоксинов (вызывающих гибель клеток хозяина).
Необходимо также учитывать важную роль в патогенезе:
• факторов выживания бактерий в цитоплазме фагоцитов и сыворотке крови;
• гемагглютининов;
• ферментов.
С помощью адгезии микроорганизмы колонизируют кишечник и способны находиться и размножаться в нем, несмотря на наличие перистальтики и механизмов антимикробной резистентности. При адгезии микроорганизмов происходит продукция энтеротоксина, который достигает своей цели – клеток кишечника. У некоторых возбудителей (энтеротоксигенная E. coli) механизм адгезии реализуется с помощью поверхностных структурных белков, у других (энтеропатогенная E. coli) – с помощью фактора адгезии.
Продукция энтеротоксинов характерна для V. cholerae. Она облегчает прикрепление возбудителя к клеткам слизистой оболочки кишечника. Энтеротоксин стимулирует внутриклеточную систему аденилатциклазы, что приводит к активной секреции электролитов и интерстициальной жидкости в просвет кишечника. Стенка кишечника остается морфологически интактной, однако в связи со значительным объемом секретируемой жидкости в течение нескольких часов может развиваться выраженное, угрожающее жизни обезвоживание.
В ходе реализации механизма инвазии вначале происходит адгезия, а затем – инвазия возбудителей ОКИ в слизистую оболочку кишечника, развивается воспалительная реакция, результатом которой может быть гибель клеток эпителия, а клиническим проявлением – лихорадка, спастические сокращения кишечника, боли в животе, наличие слизи и/или крови в кале. Механизм инвазии характерен для шигелл, сальмонелл, кампилобактерий.
Некоторые бактерии способны продуцировать цитотоксины. Шигеллы (S. dysenteriae) обладают способностью выделять классический тип цитотоксина (токсин Шига). Энтерогеморрагические E. coli серотипа О157, энтеропатогенные E. coli и Vibrio parahaemoliticus также способны продуцировать подобный токсин.
Таким образом, ОКИ существенно различаются структурой возбудителей, их способностью к инвазии, механизмами патогенеза.
При ОКИ происходит активация иммунной системы, которая подвергается постоянному и интенсивному воздействию разнообразных продуктов микробной жизнедеятельности, в т. ч. относящихся к факторам патогенности. Изучение эффекторных свойств цитокинов привело к открытию их роли в механизмах рецепторопосредованной регуляции противоинфекционной защиты организма. В фазе острого воспаления цитокины определяют развитие защитных реакций как на локальном уровне, в зоне инвазии патогена, так и на системном. Важная роль в инициации синтеза цитокинов на начальном этапе инфекционного процесса принадлежит компонентам бактериальной клеточной стенки – липополисахаридам (ЛПС), токсинам, пептидогликанам и др., которые инициируют продукцию интерлейкинов (ИЛ-1, ИЛ-6, ИЛ-8) и фактора некроза опухоли (ФНО-α). В свою очередь эти цитокины способствуют синтезу и секреции группы белков, называемых реактантами острой фазы воспаления, а также других цитокинов, что определяет каскадный механизм продукции цитокинов и многообразие их биологических эффектов (Luderitz G. et al., 1986; Кетлинский С.А. и соавт., 1992; Пальцев М.А. и соавт., 2003; Гюлазян Н.М. и соавт., 2008).
Основной особенностью острой фазы воспаления является присутствие в организме компонентов бактерий, в частности эндотоксинов.
Эндотоксины являются сложными ЛПС, высвобождаются при гибели бактерий и состоят из 3 фрагментов. Патоморфологическое действие всех эндотоксинов одинаково и не зависит от их происхождения. В клинических условиях при воздействии эндотоксина отмечаются следующие наиболее выраженные изменения: лихорадка, артериальная гипотензия, диссеминированное внутрисосудистое свертывание, нарушение кровоснабжения органов, ацидоз, лейкопения, активация системы комплемента, в частности С3.
При ОКИ, вызванных облигатно-патогенными возбудителями, увеличение концентрации провоспалительных цитокинов и белков острой фазы воспаления происходит при относительно незначительной активации специфических иммунных механизмов. Это повышает роль воспалительных белков и цитокинов в антимикробной защите, не исключая возможности их непосредственного связывания с компонентами патогена для инактивации и выведения из организма (Бутюгов А.А., 1998).
Несмотря на то что сведения о действии цитокинов несколько противоречивы, сегодня многие исследователи сходятся во мнении, что выработка ФНО-α занимает центральное место в механизме реализации биологических эффектов ЛПС. Будучи первичным эндогенным медиатором, он способен активировать «каскад цитокинов», которые, обладая синергизмом действия, усиливают эффекты ФНО-α (Малов В.А., Пак С.Г., 1997).
При ОКИ, вызванных безусловно-патогенными шигеллами и сальмонеллами, исходные уровни цитокинов выше, чем при ОКИ, вызванных условно-патогенными энтеробактериями (Валишин Д.А. и соавт., 2006).
Ошибочно расценивать бактериальные ЛПС только как медиатор повреждения. Целесообразно рассматривать биологическую роль ЛПС через призму феномена гормезиса (Малов В.А., Пак С.Г., 1992, 1994), когда малые дозы этого биополимера, являющегося маркером бактериальной инвазии, вызывают локальное повышение коагуляции, активацию каскадных реакций, регулирующих выраженность воспалительной реакции и активность фагоцитоза, локализуют очаг воспаления с последующим удалением из него как самих бактерий, так и поврежденных тканей. Дозы ЛПС, превышающие функциональные возможности природных защитных (антиэндотоксиновых) систем организма, вызывают активацию мононуклеарных клеток не только в первичном очаге воспаления, но и в других органах, что представляет собой избыточный и неадекватный ответ организма, приводящий к развитию неконтролируемой системной воспалительной реакции с повреждением различных органов, развитием шока и летальным исходом (Малов В.А., Пак С.Г., 1997).
Для идентификации патогена на поверхности макрофагов имеются паттернраспознающие рецепторы, взаимодействие которых с возбудителем приводит к фагоцитозу и индуцирует провоспалительные процессы. Захваченный макрофагами инфекционный патоген, деградируя внутри фагосомы, реагирует с находящимися в мембране фагосомы TLRs (Toll-like receptors), при этом запускается каскад внутриклеточных реакций, следствием которых является синтез широкого диапазона медиаторов воспаления (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-12, ФНО-α и др.; Hajishengallis G. et al., 2004). В этом случае спектр синтезируемых цитокинов определяется видом TLR. Установлено, что TLR-4 запускает синтез ИЛ-1, ИЛ-6, ИЛ-8, а TLR-2 стимулирует выработку ИЛ-12 и ФНО-α. Существует кооперация между различными TLRs. В ряде работ сообщается о совместной экспрессии TLR-4 и TLR-2 (Calvana J.E., 2003).
При шигеллезах местная воспалительная реакция обусловлена увеличением продукции регуляторных цитокинов и количества цитокинпродуцирующих клеток. Резко возрастает количество клеток, экспреccирующих ИЛ-1β, ФНО-α, ИЛ-4, ИЛ-6, ИЛ-10 (Дьяченко А.Г. и соавт., 2001). Сальмонеллезная инфекция включает продукцию цитокинов, характерных для Thl-клеток (Eckmann L., Kagnoff M.F., 2001), холерный токсин индуцирует продукцию воспалительных цитокинов – ФНО-α, ИЛ-6, ИЛ-16 (Cauwels A. et al., 1997), затяжное течение иерсиниозной инфекции сопровождается пониженной продукцией ИЛ-2, интерферона-γ (ИФН-γ) и повышением уровня ИЛ-4 (Попова О.В. и соавт., 2004).
Н.М. Гюлазян и соавт. (2008) у больных с ОКИ в подавляющем большинстве случаев выявляли высокие уровни провоспалительных и противовоспалительных цитокинов. Причем их высокие уровни установлены при микст-инфекции, сальмонеллезе и ОКИ неустановленной этиологии, более низкие – при шигеллезе и наиболее низкие – при иерсиниозной инфекции. Определены наиболее высокие концентрации для ИЛ-10 и ИЛ-1β на протяжении всего заболевания, независимо от его этиологии, необычно часто обнаруживался противовоспалительный ИЛ-4.
Говоря о взаимодействии возбудителей кишечных инфекций и иммунной системы хозяина, важно отметить, что многие из них приобрели целый ряд свойств, позволяющих противодействовать механизмам иммунитета, создавать «дружественное» микроокружение и выживать в организме хозяина. Так, многие кишечные бактерии секретируют продукты, включая токсины, способствующие презентации антигена молекулами МНС II класса (Portnoy D., 2005). Иерсинии и сальмонеллы обладают специализированным механизмом секреции III типа, который обеспечивает не только образование токсичных молекул, но и их проникновение через мембрану клетки-мишени. Токсины, продуцируемые с помощью такого механизма, оказывают множественные ингибирующие эффекты на ряд макрофагальных функций (Bratsky M., 1999; Portnoy D., 2005).
Внутриклеточные патогены используют успешную стратегию для уклонения от наиболее эффективного клеточно-опосредованного иммунитета, ингибируя синтез ИЛ-12, необходимого для генерации Th1, и/или стимулируя продукцию иммуносупрессивных цитокинов ИЛ-10 и трансформирующего фактора роста β (TGF-β) антигенпредставляющими клетками. Эту стратегию «выбирает» Y. enterocolitica.
Date: 2015-07-23; view: 1575; Нарушение авторских прав
Источник
Острые кишечные инфекции (ОКИ), по
терминологии ВОЗ – диарейные болезни,
объединяют более 30 заболеваний
бактериальной, вирусной или протозойной
этиологии, основным симптомом которых
является острая диарея. На рис.
1представлены основные
возбудители первичных ОКИ.
ОКИ являются
одними из самых актуальных инфекционных
заболеваний в связи с повсеместным
распространением и развитием у части
больных тяжелого состояния, которое
может представлять непосредственную
угрозу для жизни (ежегодно в мире от ОКИ
умирает 5-10 млн человек).
На практике все зарегистрированные ОКИ
принято разделять на следующие основные
группы:
• заболевания, при которых
возбудитель остается неустановленным
(в 40% случаев);
• ОКИ с установленным
возбудителем (в 30-40% случаев заболевание
обусловлено вирусами, в 20% – патогенными
бактериями). Отдельно выделяют диарею,
возбудителями которой являются
шигеллы.
По другим данным, примерно
70% случаев ОКИ приходится на заболевания
с неустановленной этиологией .
В случае же вспышек ОКИ как можно
более раннее выделение и идентификация
возбудителя болезни становятся важнейшей
задачей, требующей значительных затрат
времени и наличия хорошо оснащенной
лаборатории.
Важно отметить, что в
более обширную группу ОКИ неустановленной
этиологии входят и большинство так
называемых пищевых токсикоинфекций
(ПТИ). Эту группу составляют приблизительно
20 этиологически различных, но
патогенетически и клинически сходных
заболеваний, не представляющих
эпидемической опасности
К опорно-диагностическим
критериям,позволяющим заподозрить
инфекционную природу диареи, можно
отнести:
• острое начало заболевания;
•
острую профузную диарею (основной
симптом);
• тошноту, рвоту;
• боли в
животе;
• примеси слизи и/или крови в
испражнениях;
• в тяжелых случаях –
наличие симптомов интоксикации и
нейротоксикоза, а также обезвоживания;
•
лихорадку;
• снижение или отсутствие
аппетита;
• нарушения гемодинамики
(нарушения микроциркуляции, уменьшение
количества отделяемой мочи);
• развитие
метаболического ацидоза;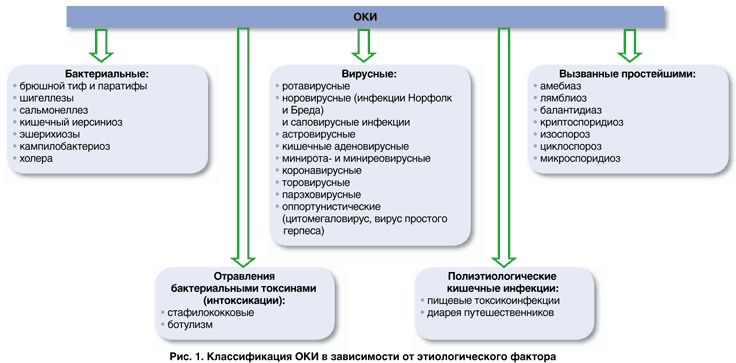
При ОКИ доминируют два клинических
синдрома – интоксикация и обезвоживание
(эксикоз). Для интоксикационного синдрома
характерны общая слабость, головная
боль, озноб, повышение температуры тела,
тошнота, рвота, боли в животе, нарушение
аппетита, бледность кожных покровов.
Обезвоживание, вплоть до развития
гиповолемического шока, развивается
при многих ОКИ, в первую очередь, при
холере и сальмонеллезе. Это обусловлено
потерей жидкости и гемоконцентрацией.
Дебют бактериальной
диареисопровождается выраженной
интоксикацией, значительным ухудшением
общего состояния, дегидратацией, головной
болью, лихорадкой до 38-39 °С, тошнотой и
рвотой. При генерализации инфекции
возможно появление симптомов раздражения
мозговых оболочек, мышечных и
костно-суставных болей.
Бактериальная
диарея сопровождается тенезмами и
интенсивными схваткообразными болями
в животе, а при дизентерии приводит к
появлению крови в испражнениях. В острой
фазе болезни проявляются также
специфические симптомы того или иного
возбудителя бактериальной диареи. При
клинически очерченном течении заболевания
во всех случаях требуются госпитализация
и эпидемиологическая оценка.
При вирусных диареяхвозбудители
вызывают лизис эпителиоцитов, абсорбирующих
жидкость из просвета кишечника и
синтезирующих дисахаридазы. Сохраняются
только незрелые эпителиальные клетки
крипт, секретирующие жидкость и
электролиты. Следствием этого является
накопление в просвете кишечника
нерасщепленных дисахаридов, повышение
осмотического давления, что привлекает
жидкость в просвет кишки и приводит к
диарее. При острых кишечных диарейных
инфекциях вирусной этиологии возбудителями
заболевания чаще всего являются
ротавирусы или вирусы Норфолк.
Инкубационный период, как правило, более
короткий, чем при эпидемической
бактериальной диарее. Острый вирусный
гастроэнтерит, хотя и сопровождается
лихорадкой и нарушением общего состояния
больного, редко приводит к тяжелой
интоксикации, развитию выраженной
воспалительной реакции и дегидратации
организма.
Среди ОКИ паразитарного происхождениянаибольшее клиническое значение имеют
амебиаз и лямблиоз. Известно, что
клиническая картина амебиаза развивается
приблизительно у 10% инфицированных.
Амебный колит характеризуется болями
в животе, лихорадкой, кровавой диареей,
сопровождается риском возникновения
перфорации толстой кишки.
Основные недостатки бактериологического
исследования испражнений при диарее
• отсроченность получения результатов
(через 3-5 дней);
• высеянные из фекалий бактерии не
всегда являются истинной причиной
диарейного синдрома;
• не все микробы-возбудители диареи
дают рост на бактериальных средах.
Реакция агглютинациис
аутокультурой является необходимым
элементом диагностики при расшифровке
острых диарей, вызванных условно-патогенными
бактериями, и нозокомиальных
инфекций.Реакция коагглютинации является
одним из методов экспресс-диагностики
шигеллезов, сальмонеллезов, иерсиниозов,
клебсиеллезов, эшерихиозов и ряда других
кишечных инфекций.
При серологических
исследованияхнарастание титра
антител в сыворотке крови больного
зависит не только от вида возбудителя,
но и от реактивности организма, которая
зачастую выражена недостаточно
методы химического определения
микробов– возбудителей диареи
в кале с помощью газовой хроматографии
и масс-спектрометрии, основанные на
анализе состава мономерных химических
компонентов микробной клетки и ее
метаболитов (маркерных веществ) –
детектировании микробного состава
фекалий
При
отсутствии лабораторного подтверждения
диагноз ОКИ устанавливается по топической
локализации патологического процесса
(гастрит, энтерит, гастроэнтерит, колит
и др.), на основании клинико-эпидемиологических
данных как «кишечная инфекция
неустановленной этиологии» с обязательным
указанием (как и при лабораторном
подтверждении) локализации поражения
(гастроэнтерит, колит и др.) и ведущего
клинического синдрома, определяющего
тяжесть заболевания (токсикоз с эксикозом,
нейротоксикоз, ИТШ и др.).
172.
Правила забора и транспортировки
клинического материала при ОКИ в
лабораторию. Примеры, основные принципы
МБ диагностики ОКИ
Источник