Болезнь бехтерева кишечные инфекции
Фактор, угнетающий миграцию макрофагов, может влиять на воспаление, формирование костной ткани при Анкилозирующем Спондилоартрите
Какие факторы приводят к воспалению и прогрессии анкилозирующего спондилоартрита (АС)? Ответы на эти вопросы долгое время ускользали от ревматологов. Хотя 90% пациентов с АС имеют положительные результаты теста на ген HLA-B27, у нас недостаточное понимание этого хронического воспалительного заболевания, которое приводит к боли, срастанию позвонков, и вовлечению кишечника у более половины пациентов. Прошлые исследования определили клетки, которые вызывают воспаление и формирование новой костной ткани при спондилоартрите (СА) у мышей, но не у людей, говорит доктор Nigil Haroon из Исследовательского Института Krembil Университета Торонто в Онтарио (Канада).
«Трудность оценки тканей является главным фактором, определяющим возможности исследования патогенеза АС. Боль в спине – распространенный среди людей симптом, но только у малой доли пациентов причиной этой боли является АС» — говорит он.
«Существует задержка в среднем в 8 лет от начала АС до постановки диагноза, поэтому мы ограничены в возможностях исследования преклинических и ранних стадий заболевания. Животные модели доступные для СА не являются идеальным представлением человеческого заболевания.»
В новой статье издания «Артрит и Ревматология» доктор Haroon с коллегами указали на вероятного виновника: фактор, угнетающий миграцию макрофагов (MIF). Согласно исследованию, «фактор, угнетающий миграцию макрофагов, стимулирует воспаление и предсказывает позвоночную прогрессию при Анкилозирующем Спондилоартрите», этот потенциальный цитокин управляет двумя главными процессами при АС и может быть и новой целью при разработке лекарств и потенциальным биомаркером, для выявления пациентов с более агрессивным АС, говорит доктор Haroon.
«Если преклинические исследования подтвердят, MIF будет идеальной терапевтической целью для клинических исследований АС» — говорит он. «По всей видимости MIF является независимым предиктором срастания позвоночника и на живом организме и «в пробирке», и может напрямую приводить к активации остеобластов (клеток, синтезирующих основное вещество костной ткани при восстановлении/регенерации кости) и минерализации».
Связь Кишечник-Позвоночник
Данное исследование нацелено на изучение прогрессии АС и связи кишечника и суставов, которую давно подозревали, говорит доктор Haroon. «У нас есть несколько намеков на присутствие данной связи. Некоторые из них: у 10% пациентов с АС имеет место клиническое воспалительное заболевание кишечника, но у 60-70% микроскопический колит. Клетки MAIT (инвариантные Т-клетки, связанные со слизистыми оболочками) и другие клетки из кишечника, были сопричастны артриту» — говорит он, добавляя, что MIF также играет ключевую роль в развитии хронического колита у мышей.
MIF, который помогает регулировать врожденный иммунитет, может также играть роль в других воспалительных аутоиммунных заболеваниях, как и в сепсисе.
В исследовании мышей с геном HLA-B27 исследователи увидели обычные клинические признаки АС, но если мыши «были помещены в условия без микробов, никаких клинических проявлений не было. Поэтому в развитии спондилоартрита вероятен триггер из внешней среды, действующий вместе с кишечником, как основным источником» — говорит доктор Haroon.
В прошлых исследованиях было показано, что кишечные микробы, такие как Heliobacter pylori, были триггерами высвобождения MIF, поэтому ученые подозревали, что «кишечник может быть местом, где начинается процесс СА». – поясняет доктор Haroon. «Фактор, связанный с кишечником, может быть ключом к запуску, тяжести протекания и определенным клиническим проявлениям заболевания. Уровни фекального и сывороточного кальпротектина использовались для предсказания наличия и активности синдрома раздраженного кишечника, но похожий маркер для АС еще предстоит доказать».
Исследование
Исследователи набрали 147 пациентов с АС, которые подходили по модифицированным Нью Йоркским диагностическим критериям и 61 здорового волонтера, в качестве контрольной группы. Они собрали исходные образцы сыворотки, ежегодно регистрировали клинические показатели и проводили рентгенограммы каждые два года. Пациенты с АС были классифицированы как прогрессирующие или непрогрессирующие на основании годовой скорости повышения модифицированного mSASSS, 56 были прогрессирующими и 91 — непрогрессирующими. Пациенты с АС оставались на своих регулярных дневных дозах стандартной терапии: нестероидных противовоспалительных препаратах (НПВП) и/или ингибиторах ФНО.
Исследователи также проанализировали ткани тонкой кишки, чтобы идентифицировать в кишечнике клетки, вырабатывающие MIF.
Используя проточную цитометрию, они выявили MIF-продуцирующие подмножества, образцы экспрессии рецептора MIF CD74 и индуцированное фактором MIF производство ФНО в образцах периферической крови пациентов. Они проанализировали минерализацию клеток остеобластов, индуцированную MIF, и измерили уровень β-катенина.
Результаты исследования показали, что MIF играет важные роли в прогрессии АС. У пациентов с АС исходный уровень MIF в сыворотке был выше в сравнении со здоровыми участниками контрольной группы. Этот фактор независимо предсказывал рентгенографическую прогрессию у таких пациентов, говорит доктор Haroon.
Уровень MIF был выше в их синовиальной жидкости, а также экспрессия MIF была повышена в их периферических суставах и тканях тонкого кишечника. Макрофаги, вырабатывающие MIF и клетки Панета, были обогащены в кишечнике. MIF также вызвал выработку ФНО моноцитами пациентов с АС. MIF активировал бета-катенин в их остеобластах и провоцировал минерализацию остеобластов, что дает предположение о его вероятной стимуляции патогенного роста костей, наблюдаемого при АС.
У пациентов в исследовании также отмечались более низкие уровни белка CD74 в моноцитах, что может быть признаком прогрессии заболевания и должно быть ещё изучено, говорит доктор Haroon. CD74 является высокоаффинным (с высокой степень связывания) рецептором для MIF. Когда MIF связывается с поверхностью CD74, его внутриклеточный домен (ICD) расщепляется или распадается. «Внутриклеточный домен может опосредовать провоспалительные эффекты MIF» — говорит доктор Haroon. «Антитело не может распознать расщепленный внутриклеточный CD74. Так уменьшение внутриклеточного CD74 указывает на активную связь оси MIF-CD74 в моноцитах пациентов с АС». Хотя пациенты с АС в группе «прогрессирующих» как правило были курильщиками, курение не выступало в качестве фактора в данном анализе. Применение НПВП также по всей видимости не влияло на прогрессию заболевания.
Нам нужно лучшее лечение
У ревматологов есть несколько вариантов управления симптомами АС и прогрессией заболевания, говорит доктор Haroon. Первичная терапия – применение НПВП для контроля воспаления и боли, и в случае отсутствия реакции со стороны пациента, за ними следуют ингибиторы ФНО. «Для лечения АС мы использовали препараты применяемые при ревматоидном артрите (РА). НПВП помогают только малой доле пациентов с АС. Модифицирующие болезнь антиревматические препараты, которые помогают при РА, не имеют результативности при аксиальном заболевании (с вовлечением позвоночника и / или крестцово-подвздошных суставов» — говорит он. «ФНО ингибиторы и ингибиторы IL-17 контролируют симптомы заболевания только у 50-60% пациентов. Не существует хороших прогностических алгоритмов для предсказания ответа на терапию при АС».
MIF мог бы стать многообещающей целью для развития новой более эффективной терапии для таких пациентов и способом лучшей идентификации пациентов с риском быстрой прогрессии заболевания, поясняет он.
«MIF является первым врожденным иммунным цитокином…который, как показано, управляет двумя процессами при заболевании напрямую» — говорит Haroon. «По всей видимости, MIF предшествует и ФНО и цитокинам Th17. MIF может быть не только хорошей целью для лечения, но также — надежным биомаркером для выявления пациентов с АС с особенно агрессивным течением заболевания. Такие пациенты могли бы быть отобраны для последующего отслеживания и агрессивного лечения, и включены в целевые терапевтические испытания».
MIF Cytokine May Impact Inflammation, Bone Formation in Ankylosing Spondylitis
Источник
Дата публикации 9 ноября 2019Обновлено 9 ноября 2019
Определение болезни. Причины заболевания
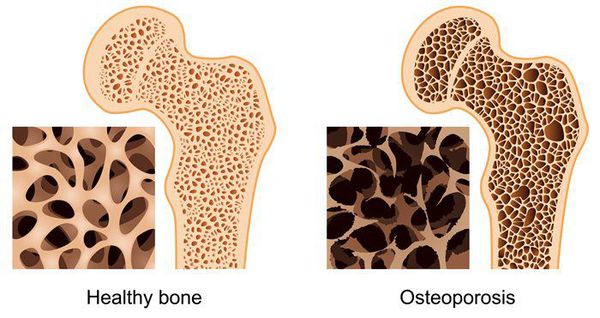
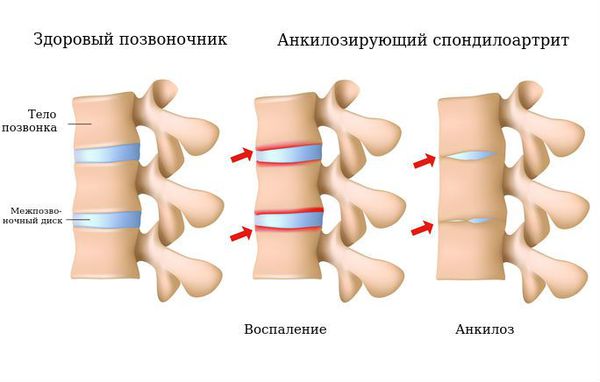
Болезнь Бехтерева (болезнь Штрюмпелля — Бехтерева — Мари, анкилозирующий спондилоартрит, АС) — это воспаление межпозвонковых суставов с последующим их анкилозом. Анкилоз — неподвижность сустава, наступающая в результате образования костного, хрящевого или фиброзного сращения суставных концов сочленяющихся костей. В результате патологического процесса позвоночный столб оказывается в жёстком футляре, значительно ограничивающем движения в нём. Объём движений в суставах постепенно уменьшается, позвоночник становится неподвижным.
Это заболевание известно человечеству с античных времён. Его первое историческое упоминание в литературе относится к 1559 году, когда итальянский хирург Реалдо Коломбо описал два скелета с характерными для анкилозирующего спондилоартрита (АС) изменениями в своей книге “Анатомия”. Через 100 лет, в 1693 году, ирландский врач Бернард Коннор описал скелет человека с признаками сколиоза, в котором крестец, тазовая кость, поясничные позвонки и 10 грудных позвонков с рёбрами были сращены в единую кость. Существует несколько клинических описаний этой болезни, сделанные в середине 19-го века. Но только записи русского врача Владимира Бехтерева в 1893 году, немецкого врача Адольфа Штрюмпеля в 1897 году и французского врача Пьера Мари в 1898 году, а также Бернарда Коннора в 17 веке считаются первыми описаниями АС.
Число больных в разных странах мира колеблется от 0,5 % до 2 % от общей популяции. Мужчины болеют в 3-6 раз чаще женщин, в возрасте 15-30 лет. Течение болезни у лиц мужского пола более агрессивное [1][6]. АС у женщин имеет некоторые особенности: артралгии (боли в суставах) мало выражены, артриты с длительной ремиссией, отсутствуют клинические признаки сакроилеита (воспаления крестцово-подвздошного сустава), функция позвоночника долгое время остается сохранной, заболевание прогрессирует медленно [1][6].
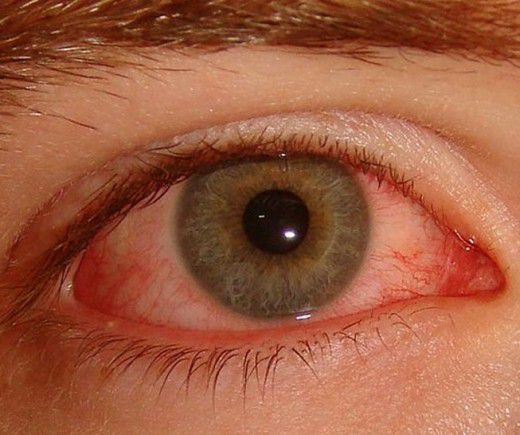
Болезнь Бехтерева обычно поражает позвоночник, крестцово-подвздошное сочленение и крупные суставы нижних конечностей. При первичной внесуставной локализации процесса заболевание может дебютировать поражением глаз. Поражение глаз при АС встречается в 10-50 % случаев и протекает в виде ирита (воспаления радужной оболочки глазного яблока), иридоциклита (воспаления радужной оболочки и цилиарного тела глазного яблока) или эписклерита (воспаления соединительного слоя между склерой и конъюнктивой), могут наблюдаться кератит (воспаление роговицы глаза) и конъюнктивит (воспаление слизистой оболочки глаза). У 5-10 % лиц первым признаком заболевания является ирит или иридоциклит.
Реже заболевание начинается аортитом (воспалением стенки аорты) или кардитом (поражением структур сердца) в сочетании с высокими показателями активности воспалительного процесса.
Этиология АС в настоящее время остаётся до конца неясной. В происхождении болезни большое значение придаётся генетической предрасположенности людей, т. е. наличию определённых генов, а именно антигена HLA-В27. Он встречается у 90-95 % больных, примерно у 20-30 % их родственников первой степени родства и лишь 7-8 % в общей популяции. В популяции частота HLA-В27 нарастает от экватора (0 %) к приарктическим регионам (20-40 %) Земли.
При данном процессе происходит агрессия иммунитета в отношении костно-мышечной системы (неадекватный иммунный ответ). Иммунитет ошибочно и агрессивно воспринимает некоторые ткани организма как чужеродные, поэтому анкилозирующий спондилоартрит относится к разделу аутоиммунных заболеваний.
Главную роль в развитии АС отдают ФНО-α (фактору некроза опухоли альфа). ФНО-α — цитокин (небольшая пептидная сигнальная молекула), играющий при любом виде воспалительного процесса центральную роль. ФНО-α имеет важное значение в прогрессировании тугоподвижности всего позвоночного столба. Его максимальная концентрация находится в крестцово-подвздошном сочленении [1][3][6].
Помимо прочего, в качестве пускового момента, способствующего развитию заболевания, может выступать изменение в иммунном статусе, вызванное переохлаждением, острым либо же хроническим инфекционным заболеванием. Дополнительно факторами для развития АС могут служить травмы таза или позвоночника. В качестве предположений выделяют гормональные нарушения, воспаления хронического характера в области мочеполовых органов и кишечника, а также инфекционно-аллергические заболевания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением – это опасно для вашего здоровья!
Симптомы болезни Бехтерева
К основным симптомам болезни Бехтерева относят скованность и боли в поясничной области с распространением в ягодицы, ноги. Боль, как правило, усиливается, во второй половине ночи. Среди симптомов также выделяют болезненность в пяточных костях, скованность в грудном отделе позвоночника. При появлении одного или нескольких симптомов необходима консультация ревматолога.
Болезнь подкрадывается незаметно. Но есть несколько признаков-предвестников, появление которых должно насторожить человека.
Предвестники анкилозирующего спондилоартрита:
- тугоподвижность позвоночного столба с утра, которая вскоре проходит (особенно после горячего душа);
- слабость, сонливость и быстрая утомляемость;
- длительное поражение глаз в виде их воспаления;
- летучие (не локализующиеся в одном месте), невыраженные боли в области поясницы;
- боль в области крестца может появляться в состоянии покоя или утром;
- при кашле, активном дыхании или чихании боль становится сильнее (если задействованы рёберно-позвоночные сочленения);
- иногда человек отмечает дискомфорт, когда сидит на жёсткой поверхности.
- уменьшается амплитуда движения головой;
- может меняться походка, появляется стойкая боль в области пяток;
- появляется ощущение сдавливания грудной клетки;
- нарастает боль в области тазобедренного сустава.
АС может начаться под маской ревматоидного артрита с болью в мелких суставах кистей и стоп, поражения сердца, а также нередки случаи, когда клинические проявления АС начинаются с глаз.
Одной из сторон данного патологического процесса является бессимптомность течения. В этом случае диагноз АС ставится на основании рентгенологического исследования, проводимого по поводу другого заболевания [1][2].
Полная характеристика симптомов АС:
- Боль в области спины и бёдер, особенно в покое. Со временем нарушение подвижности в поясничном отделе позвоночника.
- Симптом скованности суставов уменьшается после умеренных физических нагрузок или принятия тёплой ванны.
- Симптомы усиливаются после продолжительного отдыха.
- Со временем позвоночный столб утрачивает гибкость, и пациент не может наклониться вперёд.
- Возможно затруднение дыхания.
- Более чем в 20 % случаев АС поражает органы зрения (воспаления радужной оболочки). Жалобы на покраснение и болевые ощущения в области глаз, зрение не ухудшается.
- Воспаление может затрагивать верхние отделы позвоночника и поражать грудной отдел (болевые ощущения в области груди).
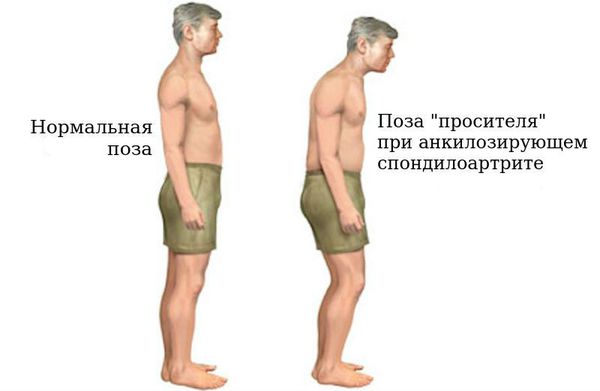
Прогрессирование АС отмечается ограничением подвижности туловища во всех направлениях. Болевую реакцию в позвоночнике вызывают кашель и чихание. Вместе с тем ограничение физической нагрузки приводит к нарастанию болевого синдрома, в то время как умеренная физическая нагрузка уменьшает боль. Без адекватного лечения возможно полное обездвиживание позвоночника, при котором тело человека приобретает характерную позу — позу “просителя” (руки согнуты в локтях, спина сутулая, голова наклонена, ноги немного согнуты в коленях), с полной инвалидизацией пациента.
Патогенез болезни Бехтерева
Патогенез болезни Бехтерева характеризуется наличием антигена HLA B27, что говорит о генетической предрасположенности к АС. Данный антиген делает похожими ткани сустава с инфекционным агентом. И в случае, когда инфекция попадает в организм носителя антигена, происходит реакция. На данный момент установлено, что антиген HLA B27 имеется практически у всех заболевших АС. В то же время не все носители этого гена обязательно болеют АС [3].
Согласно гипотезе, в эндоплазматическом ретикулуме клеток возникает аномалия синтеза белка антигена HLA B27. В результате этой аномалии происходит накопление и деградация изменённых молекул белка, что приводит к нарушению обмена веществ внутри поражённых клеток с избыточным синтезом медиаторов воспаления.
Рассматривается также другая гипотеза: занесение антигенного материала, особенно липополисахаридов клеточной стенки бактерий, через стенку кишечника. Это происходит из-за повышенной проницаемости кишечника, которая наблюдается у больных АС. Поражение суставов таза, позвоночника и внутренних органов, согласно данной гипотезе, объясняется особенностями кровоснабжения данных органов и систем, а также нарушением кровообращения в органах-мишенях данного заболевания.
Классификация и стадии развития болезни Бехтерева
Клинические варианты (формы) болезни Бехтерева:
- Центральная форма — вовлечён только позвоночник.
- кифозная — изменения шейной и грудной зоны позвоночника приводят к тому, что тело всё больше наклоняется вперед, формируется поза “просителя”;
- ригидная — сглаживание всех изгибов позвоночника, спина становится плоской, голова слегка откидывается назад, появляется поза “гордеца”.
- Ризомелическая форма — вовлечение позвоночника и корневых суставов (плечевых и тазобедренных).
- Периферическая форма — вовлечение позвоночника и периферических суставов (коленных, голеностопных и др.).
- Скандинавская форма — вовлечение мелких суставов кистей и позвоночника.
- Висцеральная форма — одна из перечисленных выше форм и вовлечение висцеральных органов (сердца, аорты, почек).
Диагностические признаки анкилозирующего спондилоартрита по рекомендации института ревматологии РАМН, 1997 год.
- Боль в пояснице, которая не проходит в покое, уменьшается при движении и длится более трёх месяцев.
- Ограничение подвижности в поясничном отделе позвоночника в сагиттальной и фронтальной плоскостях.
- Ограничение дыхательной экскурсии грудной клетки (разности между окружностью грудной клетки при полном вдохе и максимальном выдохе) относительно нормальных величин в соответствии с возрастом и полом.
- Двусторонний сакроилеит (воспаление крестцово-подвздошного сустава) II-IV стадии.
Диагноз считается достоверным, если у больного имеется четвёртый признак в сочетании с любым другим из первых трёх [7].
Осложнения болезни Бехтерева
Осложнения болезни Бехтерева опасны и серьёзны. Самые распространённые:
- амилоидоз почек — нарушение белково-углеводного обмена, в результате которого откладывается особый нерастворимый белок — амилоид. Этот белок нарушает функцию почек и в дальнейшем приводит к развитию почечной недостаточности;
- воспаление лёгких из-за уменьшения подвижности грудной клетки;
- воспаление радужки глаза, приводящее к потере зрения;
- поражение сосудов, повышающее риск развития инфаркта и инсульта;
- остеопороз — снижение прочности и нарушение строения костей;

- “синдром конского хвоста” — сдавливание пучка нервных корешков нижних отделов спинного мозга, в результате которого происходит недержание мочи и кала, паралич ног;
- сглаживание изгибов позвоночника (поза “гордеца”);
- неподвижность.
Для того чтобы предотвратить появление подобных осложнений, необходимо выявлять, диагностировать и лечить заболевание в наиболее ранние сроки [6][7][10].
Диагностика болезни Бехтерева
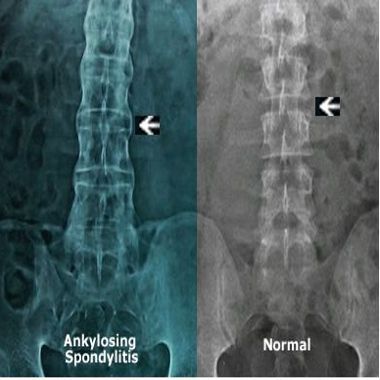
Поздняя диагностика болезни Бехтерева связана отчасти с общими симптомами заболеваний ревматологического профиля. Обязательным является рентгенологическое исследование, которое относят к наиболее точным методам диагностики. Главный критерий — это изменения в крестцово-подвздошной области.
Нечёткость контуров сочленения с расширением суставной щели характерно для первой стадии процесса. Наличие эрозий в суставных поверхностях характерно для второй стадии. Частичный анкилоз характерен для третьей стадии. При четвёртой стадии выявляется полный анкилоз.
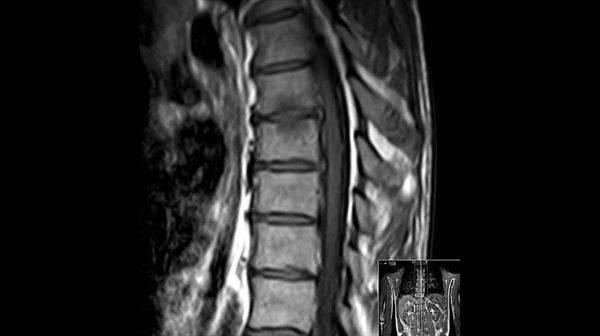
Более чувствительным методом диагностики анкилозирующего спондилоартрита является магнитно-резонансная томография.
Обязательным является генная диагностика на наличие HLAB27 антигена. Но необходимо отметить, что примерно у 10 % пациентов с АС данный антиген не выявляется.
В общеклиническом анализе крови отмечается увеличение скорости оседания эритроцитов (СОЭ) до 50 мм/ч, но нужно учитывать, что увеличение СОЭ характерно для любого воспалительного процесса.
Диагноз АС ставится на основании комплексного обследования, включающего осмотр пациента, анализ жалоб, клинико-лабораторно-инструментальную диагностику, данные рентгенологического обследования и МРТ [4][8][11].
Лечение болезни Бехтерева
Лечение болезни Бехтерева проводят на протяжении всей жизни пациента, основу его составляет сочетание нефармакологических и фармакологических методов терапии. Лечение должно быть комплексным, продолжительным и этапным (стационар — санаторий — поликлиника).
Лечение основано на трёх принципах. Иммуносупрессоры (препараты, подавляющие иммунитет) стоят на первом месте. Необходимость подавления иммунной системы исходит из патогенетического механизма. Вторым компонентом является применение гормональных препаратов для снятия воспаления в суставе. Третий компонент — это физиотерапия в сочетании с ЛФК.
До пациента с АС необходимо донести информацию, что главная задача лечения — затормозить прогрессирование заболевания. Лекарства приходится принимать на протяжении всей жизни: с началом развития недуга — с целью снять обострение, а затем для того, чтобы продлить период ремиссии. К сожалению, на данном этапе развития медицины добиться полного излечения невозможно. Работа пациента в содружестве с врачом позволит держать АС под контролем, уменьшить число обострений и долго сохранять подвижность, а соответственно, и качество жизни на достойном уровне.
Настоящий прорыв в лечении АС наметился в начале 21 века, когда в руках у ревматологов появились генно-инженерные препараты. Современная стратегия лечения АС строится по принципу “Лечение до достижения цели” (Treat to target). Генная инженерия добилась колоссальных успехов благодаря развитию высоких технологий, и первой линией таких препаратов стали ингибиторы ФНО (блокаторы ФНО-α). Биологические модификаторы иммунного ответа включают в себя ингибиторы ФНО-α (инфликсимаб, адалимумаб), ингибитор активации В-клеток (ритуксимаб). Препараты на молекулярном уровне блокируют синтез медиаторов воспаления, не подавляя при этом иммунную систему. Современная таргетная (молекулярно-прицельная) терапия нейтрализует негативно действующие медиаторы и останавливает каскад воспалительной реакции при АС. В результате удаётся эффективно препятствовать дальнейшему развитию воспаления и прогрессированию заболевания и тем самым сохранить подвижность позвоночника и суставов [9][12].
В большинстве случаев приходится использовать симптоматические (глюкокортикостероиды, нестероидные противовоспалительные препараты) и базисные препараты (“Делагил”, “Плаквенил”, “Сульфосалазин”). Базисные противоревматические средства (болезнь-модифицирующие антиревматические препараты) — это большая и неоднородная группа лекарств, объединённых общей способностью не только снимать симптомы и неспецифически уменьшать воспаление суставов, но и модифицировать, смягчать или тормозить прогрессирование самого заболевания, деструкцию кости и другие специфические поражения. Дозировки препаратов подбирает только врач [4][5][12].
Кроме лекарственной терапии пациенту с болезнью Бехтерева следует обеспечить оптимальный режим: полноценный сон в правильном положении, эмоциональный комфорт, постоянные занятия физкультурой, ликвидацию очагов хронический инфекции. Каждый год больным рекомендуется проходить санаторно-курортное лечение. Крайне осторожно может применяться мануальная терапия и лечебный массаж (места прикрепления сухожилий лучше не массировать). От физиотерапевтических процедур во время обострения стоит воздержаться [6][7][10].
Важное значение в лечении АС имеет лечебная гимнастика. Комплекс состоит из упражнений на расслабление мышц, методике глубокого дыхания для расширения экскурсии грудной клетки. Минимальное время упражнений около 30 минут. Если позволяет физическое состояние пациента, то необходимо заниматься скандинавской ходьбой и плаванием. Спать нужно на жёстком матраце и без подушки [4][5][6].
Особая роль в лечении отводится физиотерапевтическому лечению (ФТЛ). Основное применение ФТЛ осуществляется на санаторно-курортном этапе для продления периодов ремиссии. Для пациентов с АС показаны: криотерапия, теплолечение и магнитотерапия.
Магнитотерапия (англ. magnettherapy) — группа методов альтернативной медицины, подразумевающих применение статического магнитного поля или переменного магнитного поля. Процедура помогает снять болевой синдром и улучшить подвижность позвоночного столба [3][5][7].
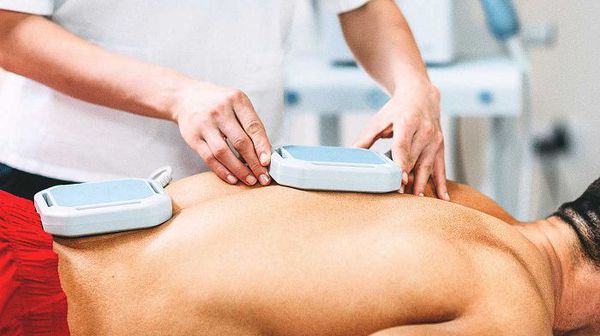
Криотерапия — лечение холодом. Физиотерапевтическая процедура, действие которой основано на ответных реакциях организма на переохлаждение наружного (рецепторного) слоя кожи. После недельного курса обычно наступает облегчение и положительный эффект с последующей длительной ремиссией [3][5][7].
Хлоридно-натриевые ванны. Их действие направлено на противовоспалительный и болеутоляющий эффект.
Массаж низкой интенсивности и мануальная терапия возможны в стадии ремиссии АС [3][5][7].
Следует уяснить: АС останется с больным навсегда, а вот качество жизни и фаза заболевания (ремиссия или обострение) зависит от хорошей приверженности пациента к лечению.
Прогноз. Профилактика
Прогноз при болезни Бехтерева серьёзный, но своевременная диагностика, адекватное наблюдение и традиционные методы лечения способны затормозить заболевание на ранних стадиях. Течение болезни — волнообразная смена воспалительных фаз и фаз ремиссии. Во время ремиссии наступает значительное облегчение состояния.
На сегодняшний день официальная медицинская статистика не знает случаев полного выздоровления. Однако несмотря на хроническое течение и возможные побочные действия лекарственных препаратов, пациенты с АС могут много лет поддерживать активный образ жизни. При нетяжёлом течении продолжительность жизни не отличается от общей популяции. Современная традиционная медицина способна с помощью различных медицинских препаратов если не вылечить, то хотя бы задержать развитие АС [2][6].
Источник