Частота желудочно кишечных кровотечений в россии

Желудочно-кишечные кровотечения

Частота кровотечений из верхнего отдела ЖКТ Варикозные вены 4 -6% Язва желудка и ДПК 40 -50% Рак желудка 5 -6% Стресс язвы 10 -14% Синдром Мэллори Вейса 9 -13% Эрозивные заболевания желудка и ДПК 6 -10% Другое 10 -12%
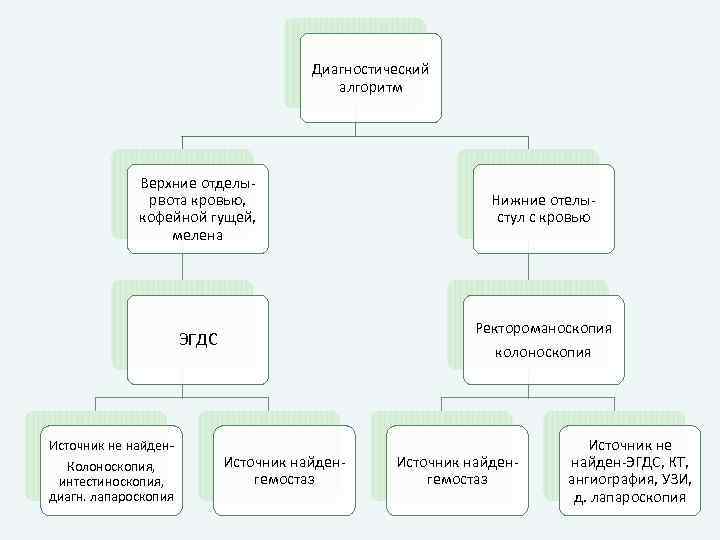
Диагностический алгоритм Верхние отделырвота кровью, кофейной гущей, мелена Ректороманоскопия ЭГДС Источник не найден. Колоноскопия, интестиноскопия, диагн. лапароскопия Нижние отелыстул с кровью колоноскопия Источник найденгемостаз Источник не найден-ЭГДС, КТ, ангиография, УЗИ, д. лапароскопия

Эндоскопическая классификация кровотечений по Forrest • IА струйное кровотечение. Рецидив 85% • IB капельное кровотечение. Рецидив 5% • IIA тромбированные сосуды в дне язвы. Рецидив 50% • IIB сгусток крови, прикрывающий язву. Рецидив 50% • IIC язва без признаков кровотечения с гематином на дне. Рецидив 5% • III источника кровотечения не обнаруженоязва без следов кровотечения
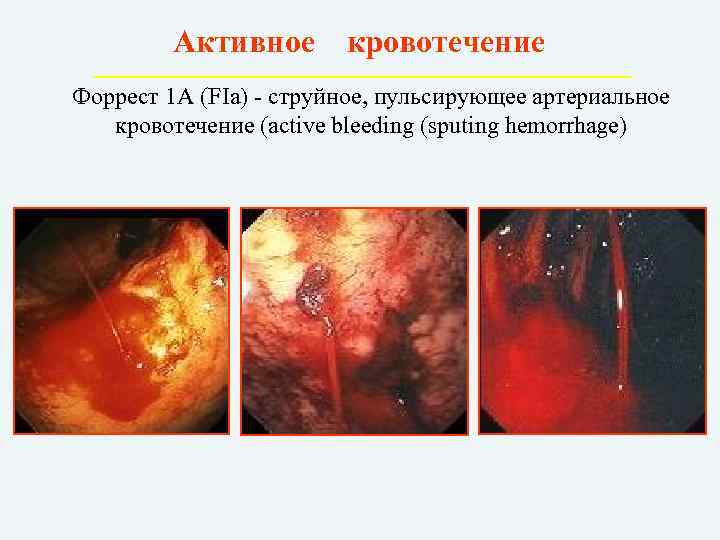
Активное кровотечение Форрест 1 А (FIa) – струйное, пульсирующее артериальное кровотечение (active bleeding (sputing hemorrhage)
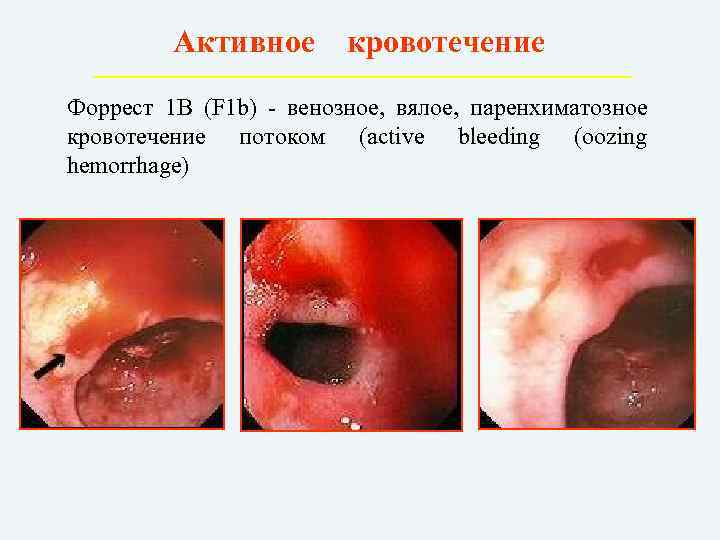
Активное кровотечение Форрест 1 В (F 1 b) – венозное, вялое, паренхиматозное кровотечение потоком (active bleeding (oozing hemorrhage)
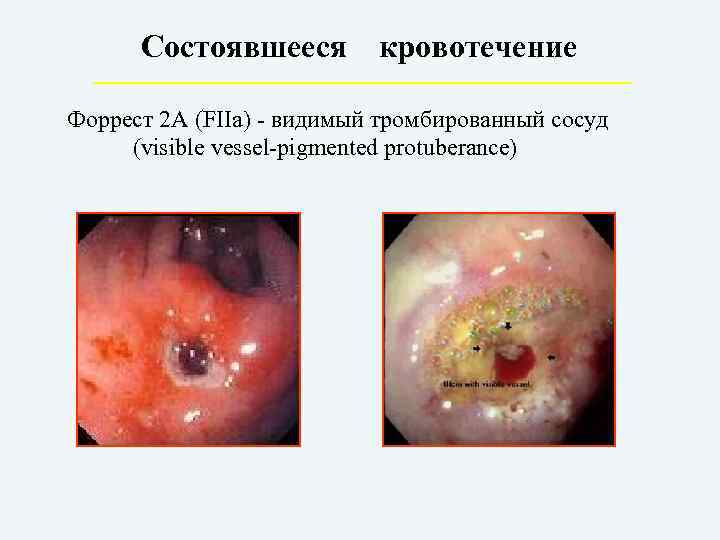
Состоявшееся кровотечение Форрест 2 А (FIIa) – видимый тромбированный сосуд (visible vessel-pigmented protuberance)
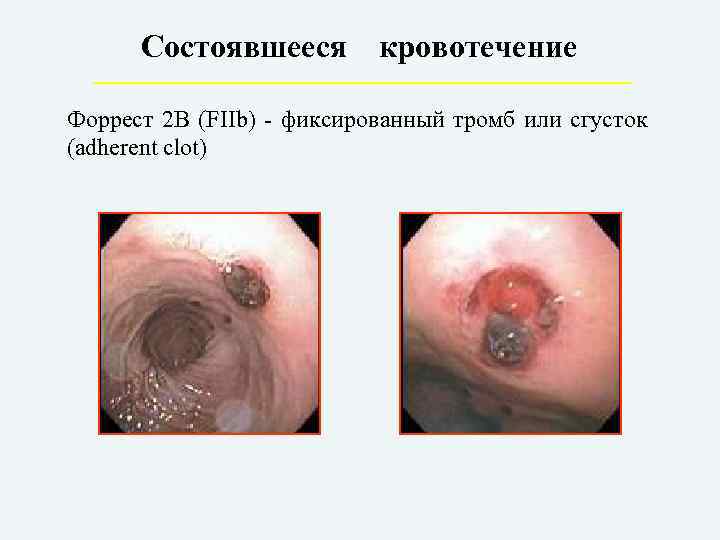
Состоявшееся кровотечение Форрест 2 В (FIIb) – фиксированный тромб или сгусток (adherent clot)
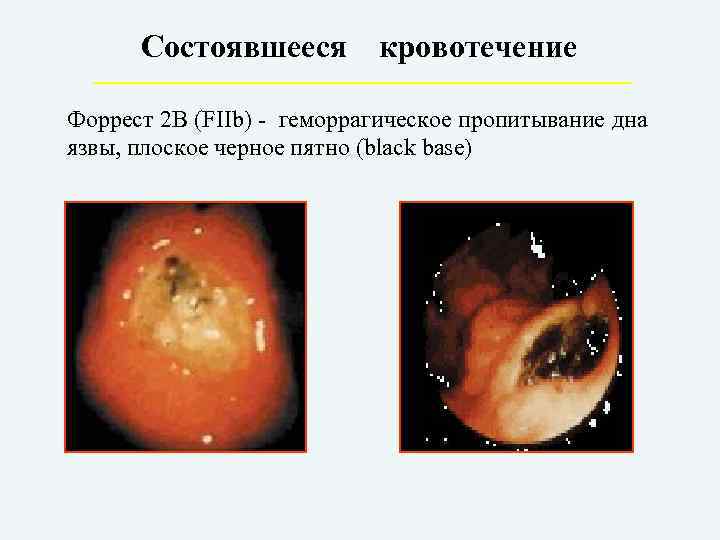
Состоявшееся кровотечение Форрест 2 В (FIIb) – геморрагическое пропитывание дна язвы, плоское черное пятно (black base)
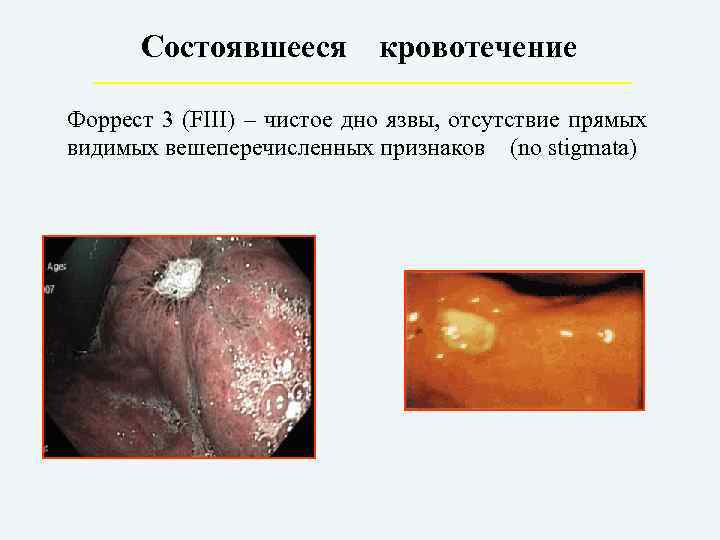
Состоявшееся кровотечение Форрест 3 (FIII) – чистое дно язвы, отсутствие прямых видимых вешеперечисленных признаков (no stigmata)

Лечение 1. Эндоскопический гемостаз 2. Оперативное вмешательство 3. Консервативное лечение

Показания для проведения эндоскопического гемостаза 1. Продолжающееся в момент исследования кровотечение ( Форрест FI a, FI b) 2. Остановившееся на момент эндоскопии кровотечение с сохраняющимся высоким риском рецидива кровотечения (Форрест FII a, FII b)

Противопоказания для проведения эндоскопического гемостаза 1. Отсутствие стигм кровотечения в дне и краях источника (Форрест III) 2. Невозможность адекватного доступа к источнику кровотечения (например, грубая деформация, стенозирование просвета) 3. Опасность возникновения перфорации органа (глубокие язвы или глубокие разрывы слизистой) 4. Отсутствие условий для адекватного выполнения гемостаза.

ЭГДС Эндоскопический гемостаз инъекционный Солевые инъекции, эпинефринадреналин 1: 10000 спирт-новокаиновые инъекции, полидоканол и т. д. термический Моно/биполярная электрокоагуляция, термокоагуляция, лазерная фотокоагуляция, микроволновая коагуляция аппаратом «Сургитрон» , аргоно-плазменная коагуляция механический Клипирование Компресссия комбинированный
Лечение Оперативное вмешательство Экстренная операция при невозможности эндоскопического гемостаза Срочные операции 12 -24 ч при высоком риске рецидива Плановое лечение не ранее 3 -4 нед.
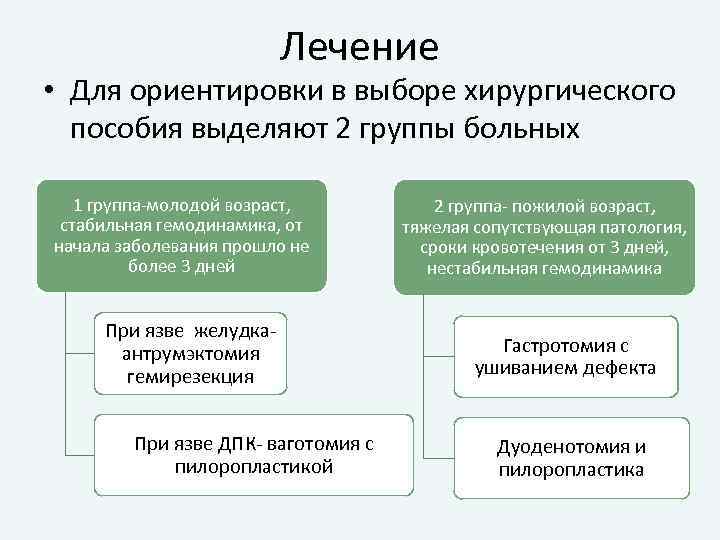
Лечение • Для ориентировки в выборе хирургического пособия выделяют 2 группы больных 1 группа-молодой возраст, стабильная гемодинамика, от начала заболевания прошло не более 3 дней При язве желудкаантрумэктомия гемирезекция При язве ДПК- ваготомия с пилоропластикой 2 группа- пожилой возраст, тяжелая сопутствующая патология, сроки кровотечения от 3 дней, нестабильная гемодинамика Гастротомия с ушиванием дефекта Дуоденотомия и пилоропластика

Консервативное лечение Постельный режим Диета Мейленграхта Ингибиторы протонной помпы по простой (40 мг) или максимальной схеме (80 мг)

Консервативное лечение Инфузионная терапия Кровопотеря средней степени: катетеризация ЦВ, контроль ЦВД, струйное введение коллоидов до АД 100 мм Hg, эритромасса Кровопотеря тяжелой степени: Кровопотеря легкой степени: объем, катетеризация ЦВ, превышающий мочевого пузыря, дефицит ОЦК в 1, 5 оксигенотерапия, раза струйное Коллоиды/кристалло переливание иды 1: 1 коллоидов и Объем инфузии=2, 5 кровезаменителей дефицита ОЦК

Консервативное лечение Коррекция анемиии Гемостатики: викасол, этамзилат, дицинон, кальция хлорид Очистительные клизмы для удаления крови из кишечника
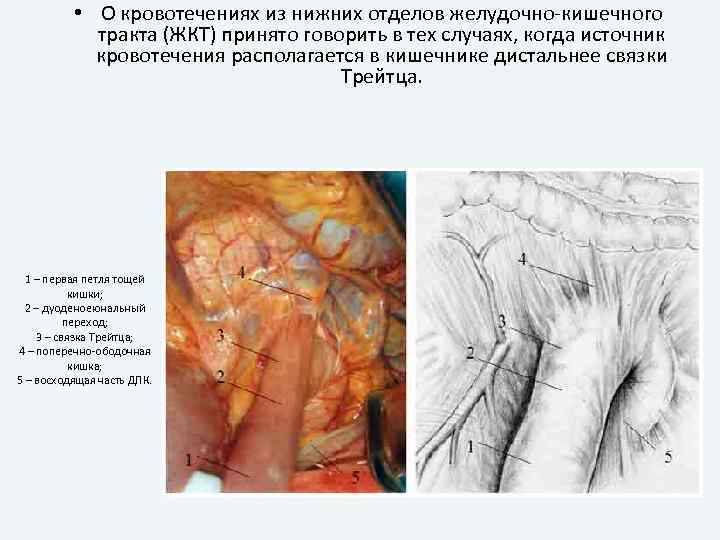
• О кровотечениях из нижних отделов желудочно-кишечного тракта (ЖКТ) принято говорить в тех случаях, когда источник кровотечения располагается в кишечнике дистальнее связки Трейтца. 1 – первая петля тощей кишки; 2 – дуоденоеюнальный переход; 3 – связка Трейтца; 4 – поперечно-ободочная кишка; 5 – восходящая часть ДПК.

Классификация кровотечений по выраженности симптомов. Кровотечения из нижних отделов ЖКТ могут быть: • явными (умеренно выраженными или массивными) • скрытыми

Этиология. Основные причины кровотечений из нижних отделов ЖКТ (их сравнительная частота может варьировать в зависимости от возраста) представлены следующим образом: • ангиодисплазии тонкой и толстой кишки; • дивертикулез кишечника (в том числе дивертикул Меккеля); • опухоли и полипы толстой кишки; • опухоли тонкой кишки; • хронические воспалительные заболевания кишечника; • инфекционные колиты; • ишемические поражения кишечника; • радиационный колит; • туберкулез кишечника; • геморрой и анальные трещины; • инородные тела и травмы кишечника; • аортокишечные свищи; • гельминтозы.

Этиология. Ангиодисплазии тонкой и толстой кишки. Кавернозные гемангиомы и ангиодисплазии слизистой оболочки тонкой и толстой кишок (артериовенозные мальформации) оказываются причиной массивных кишечных кровотечений в 30% случаев. Выделяют три типа ангиодиспластических поражений кишечника. • Ангиодисплазии I типа выявляются “главным образом” у пожилых людей и локализуются в толстой кишке. Размеры пораженных сосудов обычно не превышают 5 мм, что затрудняет их диагностику даже при лапаратомии. Нередким бывает сочетание указанных сосудистых изменений со стенозом устья аорты или пролапсом митрального клапана. • Ангиодисплазии II типа носят, как правило, врожденный характер, выявляются у лиц моложе 50 лет, локализуются в тонкой кишке, имеют больший размер по сравнению с ангиодисплазиями I типа и обычно хорошо видны на операции. • К ангиодисплазиям III типа, обозначаемым обычно как синдром Вебера – Ослера – Рандю, относятся телеангиоэктазии, которые могут располагаться в любом отделе ЖКТ и сочетаться с телеангиоэктазией слизистой оболочки полости рта, носоглотки, а также кожных покровов. Этот синдром наследуется по аутосомно-доминантному типу, и его признаки у родственников больного часто удается выявить при сборе семейного анамнеза.
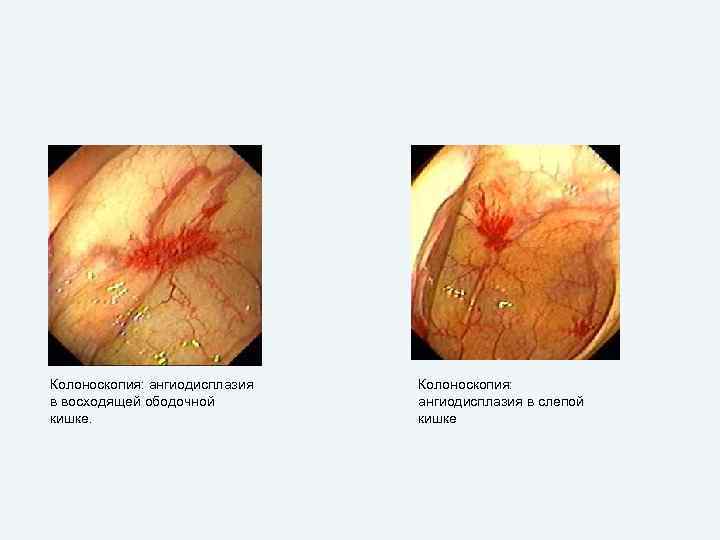
Колоноскопия: ангиодисплазия в восходящей ободочной кишке. Колоноскопия: ангиодисплазия в слепой кишке

Этиология. Дивертикулез кишечника как причина массивных кишечных кровотечений обнаруживается в 17% случаев. При этом, несмотря на более частую локализацию дивертикулов в левой половине толстой кишки, источником кровотечения служат преимущественно дивертикулы правой половины. Кровотечения чаще возникают при наличии дивертикулита, но могут наблюдаться и при отсутствии воспаления, развиваясь вследствие травматизации кровеносных сосудов. • Массивные кровотечения у детей и лиц молодого возраста в редких случаях могут быть вызваны изъязвлениями слизистой оболочки дивертикула подвздошной кишки (дивертикула Меккеля).
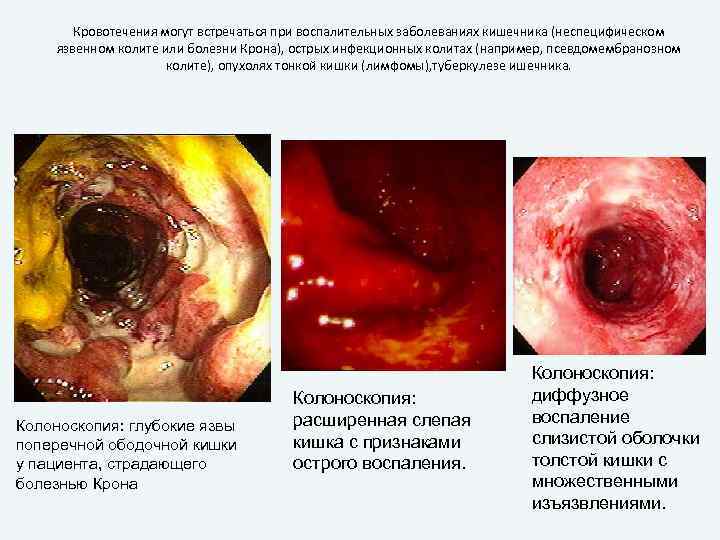
Кровотечения могут встречаться при воспалительных заболеваниях кишечника (неспецифическом язвенном колите или болезни Крона), острых инфекционных колитах (например, псевдомембранозном колите), опухолях тонкой кишки (лимфомы), туберкулезе ишечника. Колоноскопия: глубокие язвы поперечной ободочной кишки у пациента, страдающего болезнью Крона Колоноскопия: расширенная слепая кишка с признаками острого воспаления. Колоноскопия: диффузное воспаление слизистой оболочки толстой кишки с множественными изъязвлениями.

Клиническая картина. • Во многих случаях явные кровотечения бывают умеренно выраженными и часто не сопровождаются общими симптомами (например, падением артериального давления). • Реже наблюдаются массивные кишечные кровотечения. Под ними понимают такие случаи кровотечений, при которых наблюдаются гиповолемия, артериальная гипотония, тахикардия и для стабилизации уровня гематокрита (на 30%) требуется переливание не менее 2 доз крови.

Определенное диагностическое значение имеет цвет выделяющейся крови.
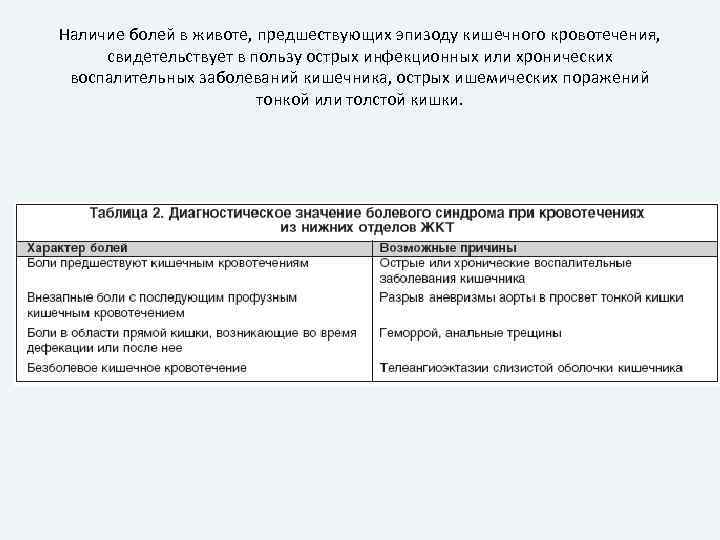
Наличие болей в животе, предшествующих эпизоду кишечного кровотечения, свидетельствует в пользу острых инфекционных или хронических воспалительных заболеваний кишечника, острых ишемических поражений тонкой или толстой кишки.

Клиническая картина. • Важное диагностическое значение имеют другие клинические симптомы, сопутствующие кишечным кровотечениям: остро возникшая лихорадка, боли в животе, тенезмы и диарея свойственны инфекционным заболеваниям толстой кишки • Длительная лихорадка, потливость, похудание, диарея часто присутствуют в клинической картине туберкулеза кишечника • Наличие лихорадки, артрита, афтозного стоматита, узловатой эритемы, первичного склерозирующего холангита, поражений глаз (ирита, иридоциклита) характерно для хронических воспалительных заболеваний кишечника
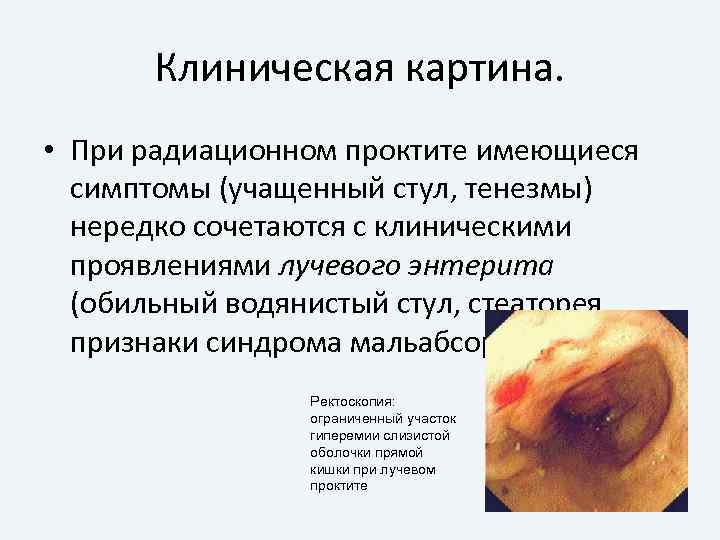
Клиническая картина. • При радиационном проктите имеющиеся симптомы (учащенный стул, тенезмы) нередко сочетаются с клиническими проявлениями лучевого энтерита (обильный водянистый стул, стеаторея, признаки синдрома мальабсорбции). Ректоскопия: ограниченный участок гиперемии слизистой оболочки прямой кишки при лучевом проктите

Диагностика. К диагностическим методам, применяемым для установления источника кровотечений из нижних отделов ЖКТ, относятся: • пальцевое ректальное исследование; • исследование кала на скрытую кровь; • аноскопия; • ректороманоскопия; • колоноскопия; • ангиография; • сцинтиграфия; • компьютерная томография и ЯМР.
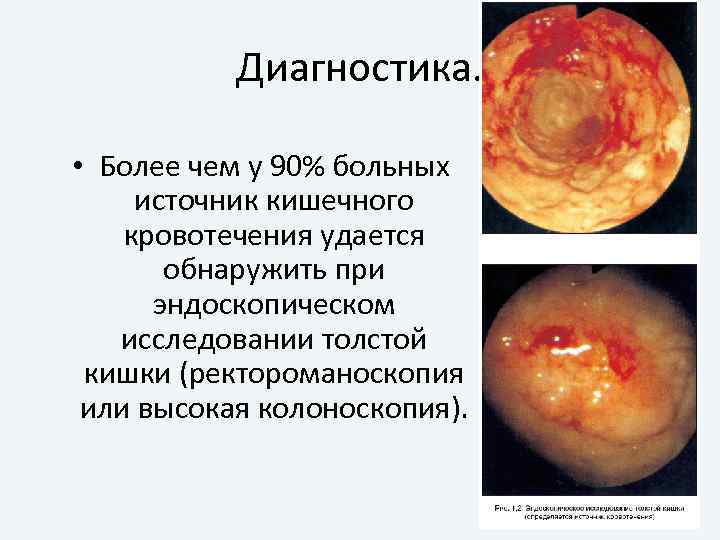
Диагностика. • Более чем у 90% больных источник кишечного кровотечения удается обнаружить при эндоскопическом исследовании толстой кишки (ректороманоскопия или высокая колоноскопия).
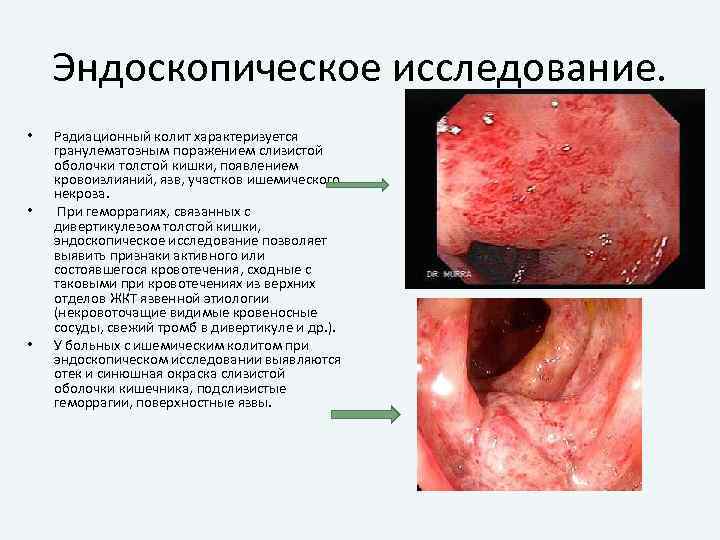
Эндоскопическое исследование. • • • Радиационный колит характеризуется гранулематозным поражением слизистой оболочки толстой кишки, появлением кровоизлияний, язв, участков ишемического некроза. При геморрагиях, связанных с дивертикулезом толстой кишки, эндоскопическое исследование позволяет выявить признаки активного или состоявшегося кровотечения, сходные с таковыми при кровотечениях из верхних отделов ЖКТ язвенной этиологии (некровоточащие видимые кровеносные сосуды, свежий тромб в дивертикуле и др. ). У больных с ишемическим колитом при эндоскопическом исследовании выявляются отек и синюшная окраска слизистой оболочки кишечника, подслизистые геморрагии, поверхностные язвы.
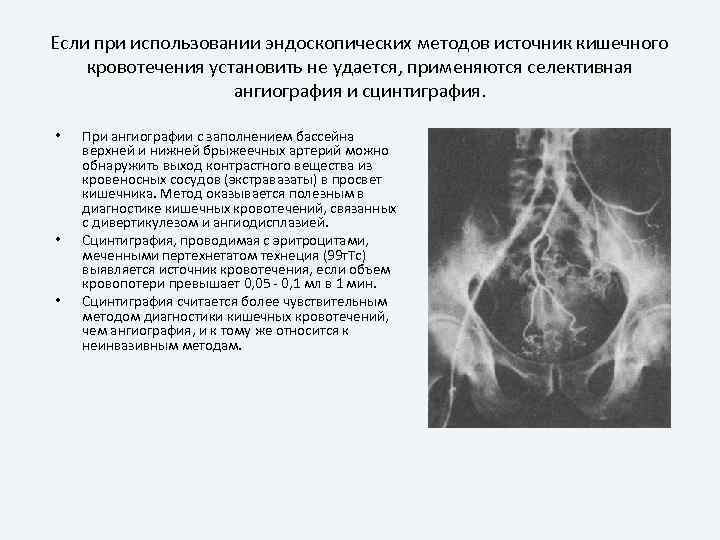
Если при использовании эндоскопических методов источник кишечного кровотечения установить не удается, применяются селективная ангиография и сцинтиграфия. • • • При ангиографии с заполнением бассейна верхней и нижней брыжеечных артерий можно обнаружить выход контрастного вещества из кровеносных сосудов (экстравазаты) в просвет кишечника. Метод оказывается полезным в диагностике кишечных кровотечений, связанных с дивертикулезом и ангиодисплазией. Сцинтиграфия, проводимая с эритроцитами, меченными пертехнетатом технеция (99 т. Тс) выявляется источник кровотечения, если объем кровопотери превышает 0, 05 – 0, 1 мл в 1 мин. Сцинтиграфия считается более чувствительным методом диагностики кишечных кровотечений, чем ангиография, и к тому же относится к неинвазивным методам.

Диагностика. По показаниям могут использоваться и другие методы исследования: • • ультрасонография (включая эндоскопическую), определение раково-эмбрионального антигена, исследование кала на патогенную микрофлору, специальные серологические исследования. В диагностике аортокишечных фистул может оказаться полезным применение компьютерной томографии или магнитной резонансной томографии.
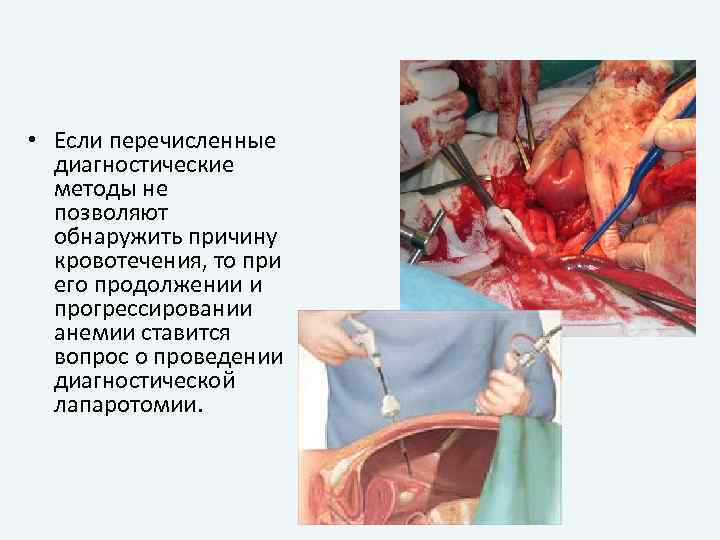
• Если перечисленные диагностические методы не позволяют обнаружить причину кровотечения, то при его продолжении и прогрессировании анемии ставится вопрос о проведении диагностической лапаротомии.

Оккультные кишечные кровотечения распознаются только при обнаружении положительной реакции кала на скрытую кровь.
Источник
Н.Е.Чернеховская
Доктор медицинских наук, профессор, РМАПО, Москва
Частота кровотечений из верхних отделов пищеварительного тракта составляет 30 случаев на 100 000 населения. Уровень смертности от кровотечений из верхних отделов пищеварительного тракта колеблется в пределах от 5 до 10% и в развитых странах имеет некоторую тенденцию к снижению [1]. От кровотечения умирают в основном люди преклонного возраста и лица с тяжелыми сопутствующими заболеваниями [5]. В нашей стране в последние годы, наоборот, наметилась тенденция к некоторому увеличению летальности при кровотечениях из верхних отделов пищеварительного тракта. Средняя летальность по Москве в 1998 г. составила 10,6%. Летальность при рецидиве кровотечения остается высокой и не имеет тенденции к снижению: ее уровень в среднем составляет 30-40% [4].
Основную роль в успешном лечении больных с кровотечением из желудочно-кишечного тракта играет ранняя и точная диагностика причины кровотечения. Диагностика желудочно-кишечного кровотечения складывается из трех основных компонентов.
Факт желудочно-кишечного кровотечения устанавливается хирург приемного отделения стационара на основании клинической картины заболевания. Наиболее постоянными симптомами кровотечения из верхних отделов пищеварительного тракта являются кровавая рвота или рвота жидкостью типа “кофейной гущи”, наблюдаемая у 60-70% больных, дегтеобразный стул (мелена) и симптомокомплекс острой кровопотери. Для последнего характерны ощущение слабости, шум в ушах, мелькание “мушек” перед глазами, сердцебиение, холодный пот. У 12-16% больных отмечается потеря сознания. Кровопотеря в 60 мл может привести к появлению черного, но оформленного кала. Истинная мелена возникает при кровопотере объемом примерно 500 мл. Пальцевое исследование прямой кишки, являющееся обязательным при подозрении на желудочно-кишечное кровотечение, помогает выявить черный стул.
Оценка степени тяжести кровопотери базируется на совокупности клинических и лабораторных данных. Выделяют три степени кровопотери:
1-я степень – легкая кровопотеря: общее состояние удовлетворительное, умеренная тахикардия – до 100 ударов в минуту, АД – в норме, ЦВД – 5-15 см вод. ст., диурез не снижен, гемоглобин – не ниже 100 г/л, дефицит ОЦК – до 20% от должного, метаболического ацидоза нет;
2-я степень – средняя кровопотеря: общее состояние средней тяжести, пульс – до 120 ударов в минуту систолическое АД – не ниже 80 мм рт. ст., ЦВД – не меньше 5 см вод. ст., умеренная олигурия, гемоглобин – от 100 до 80 г/л, дефицит ОЦК – от 20 до 29%, компенсированный метаболический ацидоз;
3-я степень – тяжелая кровопотеря: состояние тяжелое, пульс – больше 120 ударов в минуту, АД – ниже 80 мм рт. ст., ЦВД – 0, олигурия, гемоглобин – меньше 80 г/л, дефицит ОЦК – 30% и более, метаболический и дыхательный ацидоз.
К неблагоприятным прогностическим факторам при желудочно-кишечном кровотечении относятся:
возраст больного старше 60 лет;
наличие двух и более сопутствующих заболеваний;
массивная кровопотеря (больше 2 л);
шок при поступлении;
рецидив кровотечения в течение 72 ч.
После коррекции выявленных изменений или одновременно с ними
верифицируется локальная причина кровотечения. Основным методом диагностики локальной причины кровотечения из верхних отделов пищеварительного тракта является эзофагогастродуоденоскопия [3].
Первое упоминание об эндоскопическом исследовании при кровотечении из пищеварительного тракта принадлежит Killian (1900). Уже в середине 20-х годов XX века некоторые авторы (Jackson, Korbsch и др.) применяли эзофагогастроскопию у больных с желудочно-кишечными кровотечениями. Однако эти наблюдения были немногочисленны из-за несовершенства аппаратуры и отсутствия гибких эндоскопов. Потребовались годы, чтобы метод эндоскопии получил широкое распространение. Наибольшая заслуга в этом принадлежит Palmer, который занимался вопросами эндоскопической диагностики причин желудочно-кишечных кровотечений с 1945 г. Он пропагандировал раннее эндоскопическое исследование, которое называл “энергичным диагностическим методом”. Применение экстренной эзофагогастроскопии позволило автору поставить правильный диагноз в 87,1% случаев против 34,9%, когда больные обследовались “классическим” методом.
Широкое внедрение в клиническую практику эндоскопических методов исследования позволило решить вопросы экстренной диагностики локальной причины кровотечений из верхних отделов пищеварительного тракта. Диагностическая ценность ЭГДС при остром кровотечении составляет 75-98% [1]. При установленном диагнозе желудочно-кишечного кровотечения или подозрении на него ЭГДС рекомендуется выполнять в экстренном порядке. Противопоказанием к проведению ЭГДС является агональное состояние больного, когда результаты исследования не могут повлиять на дальнейшую тактику ведения пациента. Исследование выполняют в отделении реанимации или в эндоскопическом кабинете под местной анестезией гастрофиброскопом или видеогастроскопом.
Если не удается визуализировать источник кровотечения из-за большого количества крови, то делают промывание желудка “ледяной” водой (4о) с помощью толстого желудочного зонда и выполняют повторное эндоскопическое исследование. В зависимости от источника кровотечения, его интенсивности и оснащенности эндоскопического кабинета выбирают тот или иной способ местного гемостаза.
Наиболее частой причиной кровотечения из верхних отделов пищеварительного тракта является пептическая язва, на долю которой приходится около 50% всех кровотечений. Язвы, образующиеся при язвенной болезни, осложняются кровотечением у 15% больных. Соотношение кровоточащих желудочных и дуоденальных язв – 1:2–4, что отражает обычную частоту локализации язв при язвенной болезни (рис. 1, 2). По данным Панцырева Ю. М. и соавт. (1998), кровотечения из язвы двенадцатиперстной кишки составляют 68,9%, желудка – 24%, сочетанных язв – 2,8%.
Достаточно частыме причины кровотечений – синдром Маллори – Вейса, варикозно расширенные вены пищевода и злокачественные новообразования в пищеводе и желудке, эрозии желудка. К редким причинам кровотечений из верхних отделов пищеварительного тракта относятся мальформация сосудов, Меккелев дивертикул, опухоли тонкой кишки, болезнь Крона.
Первые попытки остановки желудочного кровотечения через эндоскоп путем термического воздействия были предприняты C. R.Youmans и соавт. в 1970 г. Начиная с 1971 г. в литературе стали появляться отдельные сообщения о проведении диатермокоагуляции через фиброэндоскоп при кровотечениях из верхних отделов пищеварительного тракта. Первые отечественные работы по лечебной эндоскопии путем диатермокоагуляции относятся к 1975 г. (Кукош В. И., Корнилов Ю. М., Панченков Р. Т. и др.) (цит. по Панцыреву Ю. М. и соавт., 1984).
Лечение больных с желудочно-кишечными кровотечениями на почве язвенной болезни желудка и двенадцатиперстной кишки до настоящего времени остается актуальной проблемой хирургии из-за тяжелых послеоперационных осложнений и высокой летальности, достигающей 8-10 % (Graham M.F. и соавт., 1995; Skok P., 1997).
В 1974 г. Forrest и соавт. описали эндоскопические признаки кровотечения из пептической язвы. В настоящее время эта классификация получила признание во всем мире.
Тип I – активное кровотечение:
Ia – пульсирующей струей;
Ib – потоком.
Тип II – признаки недавнего кровотечения:
IIa – видимый (некровоточащий) сосуд;
IIb – фиксированный тромб – сгусток;
IIc – плоское черное пятно (черное дно язвы).
Тип III – язва с чистым (белым) дном.
Показаниями к применению эндоскопических методов гемостаза служат активное артериальное или венозное кровотечение, а также высокий риск рецидива кровотечения.
Риск рецидива кровотечения считается высоким, если имеется видимый некровоточащий сосуд (F IIa) или фиксированный тромб-сгусток (F IIb). Риск рецидива кровотечения повышается при наличии в желудке большого количества крови, сгустков или жидкости типа “кофейной гущи”, при глубоких язвах малой кривизны желудка и задней стенки луковицы двенадцатиперстной кишки, обширных распадающихся опухолях и острых эрозивно-язвенных изменениях слизистой оболочки желудка и двенадцатиперстной кишки. При прогнозировании возможного рецидива кровотечения следует опираться не только на эндоскопические критерии, но и на клинико-лабораторные показатели, главными из которых являются геморрагический шок, заболевания печени, возраст больного, дефицит ОЦК и скорость снижения гемоглобина.
Использование эндоскопических методов гемостаза при диффузных поражениях слизистой оболочки желудка (болезнь Рандю – Вебера – Ослера, геморрагическая гастропатия и др.) малоэффективно. В этих случаях целесообразно назначить консервативную терапию, направленную на коррекцию патологического состояния, которое явилось причиной кровотечения, а при отсутствии эффекта от консервативной терапии – определить показания к оперативному лечению.
Среди различных способов эндоскопического гемостаза инъекционный метод наиболее распространен из-за высокой эффективности и простоты. Остановка кровотечения происходит за счет механического сдавления кровоточащего сосуда, сосудосуживающего эффекта и усиления местного тромбообразования. Для инъекций используют смесь раствора адреналина и гипертонического раствора в соотношении 1:5 в количестве от 5 до 15 мл. Через биопсийный канал эндоскопа проводят инъектор, к дистальному концу которого присоединяют шприц с раствором. Иглой прокалывают слизистую оболочку и вводят раствор по периметру язвы из нескольких точек до полной остановки кровотечения. Образовавшийся после инъекции отек слизистой оболочки сохраняется в течение 2-3 суток. С помощью инъекционного метода удается добиться гемостаза у 96,2% пациентов.
Для остановки кровотечения с помощью тока высокой частоты могут быть использованы зонды для моноактивного и биактивного способов диатермокоагуляции. Мощность источника тока, вызывающего коагулирующий эффект, 50 Вт. Электрокоагуляция не рекоменддуется при истончении стенки органа (при глубоких язвах желудка и двенадцатиперстной кишки, при кровотечении из дивертикула и т.д.) из-за опасности ее перфорации. Коагуляция источника кровотечения током высокой частоты осложняется перфорацией стенки полого органа в 0,6% (Панцырев Ю. М. и соавт., 1984). Методом электрокоагуляции не удается остановить кровотечение из крупных сосудов. При распадающейся злокачественной опухоли последняя “приваривается” к коагулятору, что может усилить кровотечение. При использовании электрокоагуляции необходимо четко видеть источник кровотечения, важно, чтобы его не прикрывала кровь. Зонд подводят к краю язвы или опухоли в непосредственной близости от кровоточащего сосуда. Эффективность электрокоагуляции составляет около 80%.
Лазерную фотокоагуляцию можно применять при любых источниках кровотечения, за исключением глубоких язв и дивертикулов из-за опасности перфорации стенки органа. Перед использованием лазерной фотокоагуляции необходимо промыть желудок “ледяной” водой, так как кровь и сгустки поглощают энергию лазера и в результате резко снижается эффективность коагуляции. Надо точно навести луч на кровоточащий участок. Лазерное воздействие осуществляют кратковременными импульсами (1с). После остановки кровотечения производят дополнительную коагуляцию в радиусе 5 мм от кровоточащего сосуда. Продолжительность воздействия лазерным лучом в среднем составляет 4-45 с. Эффективность гемостаза колеблется от 70 до 94 % [2].
Для выполнения аргоноплазменной коагуляции через биопсийный канал эндоскопа проводят специальный зонд-аппликатор с наружным диаметром 2,3 мм, соединенный с источником аргона АРС-300 и электрокоагулятором ICC-200 [комплект оборудования для аргоноплазменной коагуляции фирмы ERBE (Германия)]. Дистальный конец зонда-аппликатора располагают в 5-10 мм от конца эндоскопа и в 5-8 мм от субстрата. При объемной скорости потока аргона 2 л/мин и электрической мощности 60 Вт производят аргоноплазменную коагуляцию поверхности субстрата 4-5 импульсами по нескольку секунд каждый до достижения надежного гемостаза, чт