Диарея у детей захарова
Эра антибиотиков (АБ) началась всередине ХХв. Широкое ибесконтрольное применение различных групп антибактериальных препаратов, особенно вамбулаторных условиях, привело кразвитию множества нежелательных эффектов, одним изкоторых является диарея. Еепоявление нафоне приема АБобозначается как АБ-ассоциированная диарея (ААД). Согласно определению ВОЗ, ААД характеризуется учащением стула (более 3 р./сут), которое возникает нафоне антибиотикотерапии или втечение 2мес. после ееокончания, сопровождается увеличением объема, изменением консистенции, появлением патологических примесей ввиде слизи, зелени икрови [1]. Поданным различных авторов, ААД развивается у5–30% лиц, получающих АБ[2, 3].
Ежегодно, согласно данным ВОЗ, в мире регистрируются 1–1,2 млрд диарейных заболеваний, а 5 млн случаев заканчиваются летальным исходом. Около 1,87 млн случаев смерти приходится на возраст до 5 лет. В России ежегодно заболевают диареей 500 тыс. детей [1]. Основную долю составляют диареи вирусной и бактериальной этиологии (рис. 1), в 6–7% случаев она обусловлена применением АБ.
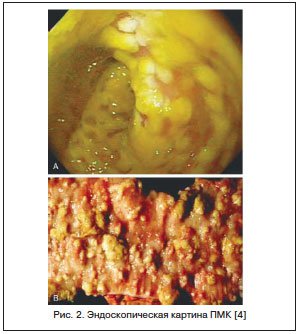
Считается, что в 20–25% случаев ААД отмечается в стационарах, но в последние годы увеличивается ее доля при назначении АБ в амбулаторной практике. Точных данных о частоте развития ААД у детей нет, т. к. чаще всего педиатры при подобной ситуации диагностируют дисбактериоз кишечника. У части пациентов ААД может иметь легкое течение, и при отмене АБ симптомы исчезают. Однако существуют тяжелые формы ААД, проявляющиеся псевдомембранозным колитом (ПМК). ПМК — острое, тяжелое заболевание толстой кишки, связанное с применением АБ и/или хирургическим вмешательством на кишечнике. ПМК характеризуется появлением на слизистой оболочке округлых фибринозных бляшек, сливающихся между собой, на фоне воспалительно-геморрагических изменений (рис. 2).
Механизмы развития диареи на фоне применения АБ:


1. Собственные побочные эффекты АБ (например, усиление перистальтики кишечника при приеме амоксициллина с клавулановой кислотой, макролидов, которые обладают мотилиноподобным действием на рецепторы кишечника) [5].
2. Осмотическая диарея в результате нарушения метаболизма желчных кислот и углеводов в кишечнике (например, при приеме фосфомицина трометамола) [6].
3. Избыточный рост бактерий в результате подавления облигатной интестинальной микрофлоры кишечника [7].
Практически все АБ, особенно активные в отношении анаэробов, способны вызывать ААД. Риск диареи возрастает при применении клиндамицина, линкомицина, аминопенициллинов, цефалоспоринов II и III поколения. По данным L. Mc Farland (1993), ААД встречается в 5–10% случаев при применении ампициллина, в 10–25% — цефалоспоринов II поколения и лишь в 2–5% случаев — при использовании других АБ, таких как тетрациклин, макролиды (эритромицин), нитрофурантоин, ко-тримоксазол, фторхинолоны, аминогликозиды (канамицин, гентамицин) [8]. Терапия цефалоспоринами III поколения предрасполагает к развитию ААД гораздо чаще, чем пенициллинами узкого спектра действия [9]. Следует помнить, что доза препарата, способ и кратность введения мало влияют на возможность развития ААД. Наиболее часто инфекция Clostridium (C.) difficile наблюдается при приеме АБ широкого спектра действия, которые плохо всасываются из кишечника, даже при их однократном введении.
Осмотическая и ААД в результате собственных побочных эффектов антибиотиков чаще всего протекает легко и требует отмены проводимой антибактериальной терапии или изменения пути введения «виновного» антибиотика. При ее развитии необходимо назначение препаратов — энтеросорбентов (Смекта®) от 3 до 7 дней и пробиотиков.
ААД этиологически может быть связана c воздействием различных микробов: C. difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибов рода Candida. Однако наиболее тяжелые формы ААД и ПМК обусловлены наличием C. difficile.
К факторам риска развития ПМК, обусловленного наличием C. difficile, относятся [3, 10, 11]:
- АБ, путь его выведения (чаще препараты, выводящиеся с желчью, например цефтриаксон), длительность антибактериального лечения, повторные курсы, комбинированная терапия разными группами АБ;
- возраст больных (у больных до 5 лет и старше 60 лет частота обнаружения C. difficile увеличивается);
- длительная госпитализация больного (прямо пропорциональна частоте колонизации C. difficile), пребывание в одной палате с больным, имеющим манифестную форму инфекции;
- наличие тяжелых сопутствующих заболеваний (патология ЖКТ, иммунодефицитные состояния, почечная недостаточность, онкология);
- проводимые медицинские манипуляции (операции, инвазивные процедуры).
C. difficile — грамположительный спорообразующий анаэроб, устойчив к воздействию алкогольсодержащих антисептиков, чувствительный к кислой среде желудка (при рН ниже 3,5) [12]. Особенностью жизненного цикла C. difficile является развитие 2-х форм — вегетативной и спор. Споры чрезвычайно устойчивы к различным внешним агрессивным воздействиям и могут оставаться жизнеспособными в течение многих лет в окружающей среде [13]. Вегетативные формы C. difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы энтеротоксин (токсин, А) и цитотоксин (токсин В), повреждающие кишечную стенку [14].
На сегодняшний день доказано, что токсин, А повышает секрецию жидкости в просвет кишечника, способствуя развитию диареи. Токсин В ингибирует процессы синтеза белка в энтероцитах и колоноцитах, оказывает выраженное цитопатогенное действие, нарушая функции клеточных мембран и приводя к потере калия и развитию выраженных электролитных нарушений. Токсин В действует только в присутствии токсина, А, повреждая мембраны в тысячу раз сильнее. Энтеротоксичность C. difficile реализуется 2-мя путями: прямой эффект заключается в непосредственном действии токсинов на энтероциты и нервный аппарат кишечной стенки; непрямой обеспечивается за счет активации макрофагов, тучных клеток и увеличения продукции провоспалительных цитокинов.
В исследованиях, проведенных в Европе и Америке, отмечается, что токсигенные штаммы C. difficile связаны с госпитальными вспышками и являются причиной генерализации инфекции, продуцируя значительно больше токсинов [15–17]. Споры C. difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезинфицирующим средствам, а вегетативные формы резистентны к большинству АБ (природные и полусинтетические пенициллины, ингибитор-защищенные пенициллины, цефалоспорины, линкозамиды и др.) [12].
Инфицирование C. difficile осуществляется фекально-оральным путем, резервуаром могут быть бактерионосители, пациенты и медработники, а также контаминированные поверхности в стационарах и амбулаториях [18]. Контактно-бытовой путь передачи C. difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Кроме этого, контингентами риска по развитию тяжелых форм нозокомиальной C. difficile-инфекции являются дети раннего возраста, ослабленные, а также пациенты, длительно находящиеся в стационаре [19, 20].
Клинические варианты течения C. difficile-ассоциированной диареи у детей могут быть малосимптомными или тяжелыми, вплоть до развития ПМК. Легкое течение часто характеризуется клиническими проявлениями нетяжелого колита (энтероколита), без лихорадки и интоксикации. Дети могут отмечать появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается увеличение количества дефекаций в сутки, часто не приводящее к водно-электролитным нарушениям [18]. В некоторых случаях отмечаются усиление болей в животе, его вздутие, нарастание интоксикации и диареи с прогрессированием процесса при отсутствии адекватной терапии [9].
Клинические проявления ПМК у детей разнообразны и развиваются остро. Для детей младшего возраста характерны лихорадка, отказ от еды, нарастание интоксикации, срыгивания, диарея с водно-электролитными нарушениями и вздутием живота, болезненной пальпацией живота по ходу толстой кишки [9, 18]. Стул частый, в каловых массах — примесь слизи и иногда крови. Иногда большая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение ПМК может осложниться кишечным кровотечением, перфорацией кишечника с развитием перитонита [18]. Для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами инфекции C. difficile необходимо совместное наблюдение педиатром и хирургом [19, 20].
При бактерионосительстве C. difficile и легких вариантах ААД изменений в клиническом анализе крови обычно не отмечается. При манифестных формах инфекции изменения в крови характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево и увеличением СОЭ. Водянистая диарея как главный симптом C. difficile-инфекции обычно появляется через несколько дней после колонизации C. difficile. У каждого четвертого пациента C. difficile-инфекция с диареей сопровождается лихорадкой, болью внизу живота и судорогами на фоне электролитных нарушений, у половины больных в анализе крови отмечается выраженный лейкоцитоз [21].
У здоровых детей бессимптомное носительство C. difficile не требует проведения лечебных мероприятий. При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых АБ. Этиотропная терапия должна назначаться в каждом случае индивидуально, с учетом возраста ребенка, тяжести заболевания и фоновых состояний [19].
У детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ), даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным.
C. difficile-ассоциированная диарея легкого и среднетяжелого течения у детей протекает с клиническими симптомами нетяжелого колита/энтероколита и чаще без лихорадки и с незначительной интоксикацией. Отмечаются умеренные боли в животе, самостоятельные и/или при пальпации, метеоризм, умеренное учащение дефекации, как правило, не приводящее к выраженным водно-электролитным нарушениям. В терапии таких вариантов течения хорошо зарекомендовали себя симптоматические препараты, обладающие энтеросорбирующим, цитопротективным и вяжущим эффектами.
У детей с высоким риском развития ААД стоит уделить внимание профилактике данных состояний, выбирая энтеросорбент, обладающий не только сорбирующими, но и протективными свойствами. И в этом смысле диоктаэдрический смектит (Смекта®) является препаратом выбора, т. к. обладает цитомукопротективными свойствами [22].
В 2008 г. совместная рабочая группа ESPGHAN и ESPID опубликовала научно обоснованные рекомендации по применению противодиарейных препаратов, которые оправданно использовать в качестве дополнительной терапии диарейного синдрома у детей. Среди энтеросорбентов рекомендован диоктаэдрический смектит (Смекта®) с высоким уровнем доказательности (II, B) в комплексе с оральной регидратацией [23]. Диоктаэдрический смектит обладает текучестью и обволакивающей способностью, предохраняет слизистую оболочку кишечника от воздействия агрессивных и токсических факторов. Диоктаэдрический смектит проникает в муциновый слой и изменяет физические свойства слизи, увеличивая энзиматическую активность гликокаликса, тем самым снижая потерю электролитов и воды с калом [24]. Являясь селективным сорбентом, диоктаэдрический смектит выводит из организма бактерии, вирусы, токсины, желчные кислоты, избыточное количество углеводов и уменьшает количество газа [25].
При острых состояниях оправданно применение двойной суточной дозировки диосмектита в течение первых 3-х дней терапии [30]. Смекта® является топическим препаратом и имеет высокий профиль безопасности, т. к. не всасывается из ЖКТ, что позволяет создать в просвете кишки высокую концентрацию активного вещества; при этом препарат быстро и полностью выводится из организма.
Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, сохраняющаяся диарея после отмены АБ, а также рецидив инфекции на фоне повторного приема АБ. C. difficile высокочувствительны к метронидазолу, ванкомицину и фидаксомицину. При этом стартовую этиотропную терапию C. difficile-инфекции в большинстве случаев начинают с введения метронидазола, который считается препаратом выбора. Ванкомицин является альтернативным АБ для лечения данной инфекции и назначается как препарат первой линии лишь в тех случаях, когда введение метронидазола противопоказано (индивидуальная непереносимость, тяжелые поражения печени и нервной системы, выраженная лейкопения). Фидаксомицин в настоящее время для использования в РФ не зарегистрирован.
Метронидазол для лечения C. difficile-инфекции применяется в дозе 30 мг/кг/сут, вводится ребенку в 3–4 приема. В отличие от ванкомицина метронидазол может вводиться как перорально, так и парентерально — путем в/в инфузии. В тех случаях, когда у ребенка с C. difficile-инфекцией выражены тошнота, срыгивания и/или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить в/в введение метронидазола на его пероральный прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность — 80–100%) [26].
Ванкомицин — АБ из группы гликопептидов также обладает выраженным бактерицидным действием на C. difficile. Однако при C. difficile-инфекции его рекомендовано использовать как препарат второй линии, когда отсутствует клинический эффект стартовой терапии, либо в качестве альтернативного АБ у детей с противопоказаниями к применению метронидазола. Ограничения к широкому использованию ванкомицина объясняются попыткой снизить риск развития устойчивости к нему грамположительной флоры, в первую очередь стафилококков и энтерококков. Это связано с тем, что ванкомицин в настоящее время — один из немногих антибактериальных препаратов, эффективных при инфекциях, вызванных метициллин-резистентными штаммами стафилококка. В случаях необходимости применения ванкомицина при C. difficile-инфекции используется только пероральный способ его введения [6, 27]. В исследовании F. A. Zar et al. (2007) установлено, что ванкомицин (пероральный путь введения) имеет преимущество перед метронидазолом (чувствительность к ванкомицину 97% против 76% к метронидазолу). Однако в связи с высокой стоимостью ванкомицина и развитием резистентности к нему некоторых микроорганизмов в качестве препарата первой линии рекомендуется метронидазол [28].
Фидаксомицин — новый представитель узкоспектральных макролидов. Это продукт ферментации актиномицет Dactylosporangium aurantiacum. У него отсутствуют системные эффекты, минимальна абсорбция в кровоток, он обладает бактерицидным действием и выраженной антагонистической активностью к C. difficile с самым минимальным влиянием на нормальную микрофлору. В экспериментах показывает способность снижать частоту повторяющихся инфекций C. difficile. Выпускается в таблетках по 200 мг, назначается 2 р./сут с интервалом 12 ч на 10 дней. Экскретируется со стулом (>90%), незначительная часть — с мочой (0,59%). На данный момент препарат отличается высокой стоимостью, как уже упоминалось, не зарегистрирован в РФ. За рубежом необходимость его применения до сих пор является предметом дискуссии, отсутствуют исследования безопасности его применения у пациентов с воспалительными заболеваниями кишечника.
После отмены антимикробных препаратов детям, перенесшим C. difficile-инфекцию, для полной санации кишечника от спор возбудителя целесообразно провести курсовое лечение пробиотиками [29]. В результате 15 из 16 исследований у пациентов с ААД доказана значимость применения пробиотиков по сравнению с плацебо или без их применения. Для оценки эффективности и безопасности применения пробиотиков в терапии ААД использованы 11 критериев. В настоящее время можно говорить об эффективности применения Lactobacillus rhamnosus и Saccharomyces boulardii в дозе ≥5 млрд КОЕ/сут, для других штаммов рекомендуется проведение дополнительных исследований.
Согласно рекомендациям ESPGHAN и ESPID по применению противодиарейных препаратов, обновленным в 2014 г., диоктаэдрический смектит (Смекта®) в сочетании с пробиотиками Lactobacillus GG эффективен в терапии острой диареи у детей раннего возраста.
Профилактика C. difficile-инфекции заключается в строгом соблюдении правил личной гигиены, а также в неукоснительном выполнении всех требований по соблюдению санитарно-противоэпидемического режима лечебных учреждений. Нельзя также недооценивать и такой фактор профилактики C. difficile-инфекции, как уменьшение частоты бесконтрольного и необоснованного использования АБ.
Заключение
Таким образом, основными резервами снижения заболеваемости у детей C. difficile-инфекцией являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников. Дополнением к перечисленным видам профилактики и лечения C. difficile-инфекции являются различные методы восстановления микробиоты кишечника: прием препарата Смекта® и пробиотиков.
Источник
1. Kazanowski M, Smolarek S, Kinnarney F, Grze-bieniak Z. Clostridium difficile: epidemiology, diagnostic and therapeutic possibilities – a systematic rewiew. Tech Coloproctol. 2014. 18: 223-232.
2. Goossens H, Ferech M, Vander Stichele R, Elseviers M. ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. Lancet. 2005. 365: 579-87.
3. Таточенко В.К., Антибиотико- и химиотерапия инфекций у детей. Москва, 2008.
4. Van Boeckel TP, Gandra S, Ashok A et al. Global antibiotic consumption 2000 to 2010: an analysis of national pharmaceutical sales data. Lancet Infect Dis. 2014. 14: 742-50.
5. Ткаченко Е.И., Рязанцев С.В., Орешко Л.С., Карпов А.А. Антибактериальная терапия инфекций верхних дыхательных путей: защита индигенной микрофлоры. Российская оториноларингология. 2012. 6(61): 190-195.
6. ВОЗ: Лечение диареи, 2006.
7. Guarino А, Albano F, Ashkenazi S et al. European society for paediatric gastroenterology, hepatol-ogy, and nutrition/european society for paediat-ric infectious diseases evidence-based guidelines for the management of acute gastroenteritis in children in europe: executive summary. Journal of Pediatric Gastroenterology and Nutrition. 2008. Vol. 46. 5: 619-621. View at Scopus.
8. Еженедельный эпидемиологический бюллетень. 1 февраля 2013 г., 88-й год №5. 2013, 88.
9. Захарова И.Н., Дмитриева Ю.А. Антибиотикоассоциированные диареи: лечение и профилактика. Consilium medicum. Педиатрия. 2009. 2: 7-10.
10. Bartlett JG. Antibiotic-associated pseudomem-branous colitis due to toxin producing clostrid-ia. N. Engl.J.Med. 1978. 298: 531.
11. Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JNV, Shanman R, Johnsen B, Shekelle PG. Probiotics for the Prevention and Treatment of Antibiotic-Associated Diarrhea. JAMA. 2012. 307(18): 1959-1969.
12. Hogenauer C, Hammer HF, Krejs GJ, Reisinger EC. Mechanisms and management of antibiotic-associated diarrhea. Clin Infect Dis. 1998. 27: 702-710.
13. Захарова И.Н., Мазанкова Л.Н. и соавт. Антибиотик-ассоциированные диареи у детей: проблема и решение. М., 2011. 48 с.
14. McFarland LV Diarrhea acquired in the hospital. Gastroenterol Clin North Am. 1993 22: 563-77.
15. Заплатников А.Л., Захарова И.Н., Коровина Н.А. Clostridium difficile-инфекция у детей. РМЖ. 2004. 5: 373-377.
16. Mitchell DK, Van R, Mason EH at al. Prospective study of toxigenic Clostridium difficilе children given amoxicillin/clavulanate for otitis media. Pediatr. Inf. Dis. J. 1996. 15: 514-519.
17. Lupse M, Flonta M, Cioara A, Filipescu I, Todor N. Predictors of First Recurrence in Clostridium difficile-Associated Disease. A Study of 306 Patients Hospitalized in a Romanian Tertiary Referral Center. J Gastrointestin Liver Dis, December 2013. 22. 4: 397-403.
18. Zilberberg et al. Risk factors for recurrent Clostridium difficile infection (CDI) hospitaliza-tion among hospitalized patients with an initial CDI episode: a retrospective cohort study. BMC Infectious Diseases. 2014. 14: 306. https:// www.biomedcentral.com/1471-2334/14/306.
19. Alam S, Muchatad M., Antibiotic associated diarrhea in children. Indian Pediatr. 2009 Jun. 46(6): 491-6.
20. Малов В.А. Инфекция Clostridium Difficile: современное состояние проблемы. Фарматека. 2010. 4.
21. Hedge Dennis D, Strain Joe D, Heins Jodi R, Farver Debra K. New advances in the treatment of Clostridium difficile infection (CDI). Therapeutics and Clinical Risk Management. 2008. 4(5).
22. Lowy I, Molrine DC, Leav BA, Blair BM, Baxter R, Gerding DN, Nichol G, Thomas WD, Leney M, Sloan S, Hay CA, Ambrosino DM. Treatment with Monoclonal Antibodies against Clostridium difficile Toxins. N Engl J Med. 2010. 362: 197-205. Copyright © 2010 Massachusetts Medical Society.
23. Massey V et al. Clinical usefulness of components of the Triage immunoassay, enzyme immunoassay for toxins A and B, and cytotoxin B tissue culture assay for the diagnosis of Clostridium difficile diarrhea. Am J Clin Pathol. 2003. 119: 45-9.
24. Nyc O, Pituch H, Matejkova J, Obuch-Woszczatynski P, Kuijper EJ. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet. 2011. Apr 23. 377(9775): 1407,
25. Warren CA, Guerrant RL. Pathogenic C. difficile is here (and everywhere) to stay. Lancet. 2011. jan 1. 377(9759): 8-9.
26. Nylund CM, Goudie A, Garza JM, Fairbrother G, Cohen MB. Clostridium difficile infection in hospitalized children in the United States. Arch Pediatr Adolesc Med. 2011. 165: 451-457. (PMID: 21199971 DOI: 10.1001/archpediatrics.2010.282).
27. Учайкин В.Ф. Руководство по инфекционным заболеваниям у детей. М.: Гэотар Медицина, 1998. 492-494.
28. Maha Barakat, yZeinab El-Kady, zMohamed Mostafa, yNaglaa Ibrahim, and yHamdy Ghazaly. Antibiotic-associated Bloody Diarrhea in Infants: Clinical, Endoscopic, and Histopatho-logic Profiles. JPGN. January 2011. 52. 1.
29. Joanne Donovan, MD, PhD. 18th European Congress of Clinical Microbiology and Infectious Diseases: Abstract O464. Presented April 22, 2008.
30. Киргизов К.И, Шульга С.Ю., Пристанскова Е.А., Константинова В.В., Герасимова Ю.В., Сидорова Н.В., Благонравова О.Л., Федорова Н.И., Скоробогатова Е.В. Энтероколит, связанный с Clostridium difficile, в детской гематологии-онкологии – решенная проблема? Обзор литературы и собственный опыт. Российский журнал детской гематологии и онкологии. 2014. 1: 25-31.
31. Лобзин Ю.В., Захаренко С.М., Иванов Г.А. Современные представления об инфекции Clostridium difficile. Клиническая микробиология и антимикробная химиотерапия. 2002. 4. 3: 200-232.
32. Bauer MP, Notermans DW, van Benthem BH, Brazier JS, Wilcox MH, Rupnik M, Monnet DL, van Dissel JT, Kuijper EJ. ECDIS Study Group (2011) Clostridium difficile infection in Europe: a hospital-based survey. Lancet. 2011. 377: 63-73.
33. Wilcox MH. Updated guidance on the management and treatment of Clostridium difficile infection. Crown Copyright 2013 Published May 2013.
34. Bryan F Curtin, Yousef Zarbalian, Mark H Flasar, Erik von Rosenvinge. Clostridium difficile -associated disease: Adherence with current guidelines at a tertiary medical center. World J Gastroenterol. 2013. December. 14. 19(46): 8647-8651. ISSN 1007-9327 (print) ISSN 22192840 (online).
35. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, Pepin J, Wilcox MH; Society for Healthcare Epidemiology of America; Infectious Diseases Society of America (2010) Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare Epidemiology of America (SHEA) and the Infectious Disases Society of America (IDSA). Infect Contr Hosp Epidem. 2010. 5:431-455.
36. Elliott B, Reed R, Chang BJ, Riley TV. Bacteremia with a large clostridial toxin-negative, binary toxin-positive strain of Clostridium difficile. J. Anaerobe. 2009. 15: 249-251.
37. Minino A, Xu J and Kochanek K. (2010) Deaths: preliminary data for 2008. National Vital Statistics Report 59. Hyattsville, MD: National Center for Health Statistics. Available at: https:// www.cdc.gov/ nchs/data/nvsr/nvsr59/ nvsr59_02.pdf.
38. Wistrom J, Norrby SR, Myhre EB, Eriksson S, Granstrom G, Lagergren L, Englund G, Nord CE, Svenungsson B. Frequency of antibiotic-associated diarrhea in 2462 antibiotic-treated hospitalized patients: a prospective study. Journal of Antimicrobial Chemotherapy. 2001. 47: 43-50.
39. Vaishnavi C, Bhassin D, Kochhar R, Singh K. Clostridium difficile toxin and faecal lactofer-rin assays in adult patients. Microbes Infect. 2000. 2: 1827-1830.
40. Hogenauer C, Langner C, Krause R, Gerstgrasser N, Krejs GJ, Hinterleitner TA. Antibiotic-associated segmental hemorrhagic colitis: clinical features, and influence of Klebsiella oxyto-ca in its patogenesis. Abstracts of 12 UEGW, Gut. 2004. 53 (Suppl VI), A135.
41. Шевяков М.А. Антибиотик-ассоциированная диарея и кандидоз кишечника: возможности лечения и профилактики. Антибиотики и химиотерапия. 2004. 49. 10: 26-29.
42. Krause R, Krejs G, Wenisch C, Reisinger E. Elevated fecal Candida counts in patients with antibiotic-associated diarrhea. Clin Diagn Lab Immunol. 2003. 10(1): 167-8.
43. Larson HE, Prise AB, Honour P et al. Pseudomembranous colitis: present of clostrid-ial toxin. Lancet. 1977: 1312-1314.
44. Schwartz et al. Severe clinical outcome is uncommon in Clostridium difficile infection in children: a retrospective cohort study. BMC Pediatrics, 2014. 14: 28.
45. Johnson S et al. Interruption of recurrent Clostridium difficile-associated diarrhea episodes by serial therapy with vancomycin and rifaximin. Clin Infect Dis. 2007. Mar 15. 44(6): 846-8. Epub 2007 Feb 2.
46. Малов В.А. Антибиотик-ассоцированные поражения кишечника. Врач. 2000. 10: 16-19.
47. Friedman ND, Pollard J, Stupart D, Knight DR, Khajehnoori M, Davey EK, Parry L, Riley TV Prevalence of Clostridium difficile colonization among healthcare workers. BMC Infectious Diseases. 2013. 13: 459. Page 2 of 5https://www. biomedcentral.com/1471-2334/13/459.
48. Ковалева Е.П., Семина Н.А., Семененко Т.А., Галкин В.В. Справочник госпитального эпидемиолога. М.: Хризостом, 1999. 136-139.
49. Edward O’Rourke. Harvard University – Harvard Medical School. Nospital epidemiology. 2014.
50. Poutanen SM, Simor AE. Clostridium difficile-associated diarrhea in adults. CMAJ. 2004. 171: 51-8.
51. Barakat M, El-Kady Z, Mostafa M, Ibrahim N, Ghazaly H. Antibiotic-associated Bloody Diarrhea in Infants: Clinical, Endoscopic, and Histopatho-logic Profiles. JPGN. 52, 1, January 2011.
52. Ковалева Е.П., Семина Н.А., Семененко Т.А., Галкин В.В. Справочник госпитального эпидемиолога. М.: Хризостом, 1999. 136-139.
53. Hsu J, Abad C, Dinh M, Safdar Nasia. Prevention of Endemic Healthcare-Associated Clostridium difficile Infection: Reviewing the Evidence. Am J Gastroenterol. 2010. 105: 2327-2339. doi: 10.1038/ ajg.2010.254; published online 6 July 2010.
54. Tatochenko V.K. Antibiotic and chemotherapy of infections in children. Moscow, 2008.
55. Tkachenko E.I., Ryazantsev S.V., Oreshko L.S., Karpov A.A. Antibacterial therapy of upper respiratory infections: protection of indigenous microflora. Rossiyskaya Otorinolaringologiya. 2012. 6(61): 190-195.
56. WHO. Treatment of diarrhea, 2006.
57. Weekly Epidemiological Record. February 1, 2013, year 88, №5. 2013, 88.
58. Zakharova I.N., Dmitrieva Y.A. Antibiotic-associated diarrhea: treatment and prevention. Consilium medicum. Pediatriya. 2009. 2: 7-10.
59. Zakharova I.N., Mazankova L.N. et al. Antibiotic-associated diarrhea in children: problem and solutions. М., 2011. 48 p.
60. Zaplatnikov A.L., Zakharova I.N., Korovina N.A. Clostridium difficile infection in children. RMZ. 2004. 5: 373-377.
61. Malov V.A. Clostridium Difficile Infection: current situation. Pharmateka. 2010. 4.
62. Uchaikin V.F. Guidance on infectious diseases in children. М.: Geotar Medicine, 1998. 492-494.
63. Kirgizov K.I., Shulga S.Y,, Pristanskova E.A., Konstantinova V.V., Gerasimova Y.V., Sidorova N.V., Blagonravova O.L., Fedorova N.I., Skorobogatova E.V. Enterocolitis associated with Clostridium difficile in pediatric hematology-oncology – a problem solved? Review of literature and own experience. Rossiyskiy Zhurnal Detskoy Gematologii i Onkologii. 2014. 1: 25-31.
64. Lobzin Yu.V., Zakharenko S.M., Ivanov G.A. Modern ideas about Clostridium difficile infection. Klinicheskaya Mikrobiologiya i Antimikrobnaya Terapiya. 2002. 4. 3: 200-232.
65. Sheviakov M.A. Antibiotic-associated diarrhea and intestinal candidiasis: treatment and prevention options. Antibiotiki i Khimioterapiya. 2004. 49. 10: 26-29.
66. Malov V.A. Antibiotic-associated bowel lesions. Vrach. 2000. 10: 16-19.
67. Kovaleva E.P., Semina N.A., Semenenko T.A., Galkin V.V. Reference Guide of Hospital Epidemiologist. М.: Khrizostom, 1999. 136-139.
68. Kovaleva E.P., Semina N.A., Semenenko T.A., Galkin V.V. Reference Guide of Hospital Epidemiologist. М.: Khrizostom, 1999. 136-139.
Источник