Дисбактериоз и почечная недостаточность

Какова связь между пробиотическими микроорганизмами в кишечнике и здоровьем почек? Этот вопрос всесторонне изучается учеными. 
Микрофлора кишечника играет важную роль в поддержании здоровья всего организма в целом, и каждого органа – в частности. Если есть нарушения в кишечнике, это вызывает усиление роста патогенных (то есть «плохих») бактерий по сравнению с «хорошими» бактериями, что приводит к образованию уремических токсинов, повреждающих ткань почек. Использование пробиотиков («хороших бактерий») для удаления уремических токсинов из толстой кишки может помочь в поддержании здоровой функции почек.
Что такое пробиотики?
Пробиотики – это микробы, которые при попадании в толстый кишечник в достаточном количестве нормализуют его работу и улучшают пищеварение. Они содержатся в продуктах питания, преимущественно молочных и растительных, а также поступают в организм в форме добавок. В кишечнике обитает почти 100 триллионов пробиотиков, поэтому для получения положительного эффекта каждый должен содержать достаточно большой объем полезных бактерий. Кроме того, эти микробы должны хорошо приживаться в просвете кишки. Подробнее о пробиотиках мы писали тут.
Почки и кишечник: где связь?
Существует около ста видов уремических токсинов, опасных для почек.Среди неблагоприятных веществ для людей, у которых есть заболевания почек, выделяют мочевину, мочевую кислоту и креатинин. Есть еще несколько других веществ, называемых средними молекулами, которые присутствуют у здоровых людей в очень малых концентрациях. Предполагается, что они токсичны для пациентов с хроническими заболеваниями этих органов. Если почки сами не справляются, назначается гемодиализ – аппаратное очищение крови. Многие из средних молекул были связаны либо косвенно, либо напрямую с сердечно-сосудистыми заболеваниями, поэтому они должны как можно скорее выводиться из тела.
Технология снижения уровня кишечных токсинов – это инновационный и неинвазивный подход к поддержанию здоровой функции почек. При этом процессе используются пробиотики, тщательно отобранные бактерии, которые устраняют циркулирующие уремические токсины, когда они диффундируют из крови в толстую кишку. Пробиотические организмы (то есть «полезные бактерии») в толстой кишке действуют как очищающие кровь агенты, которые помогают выводить их из организма в виде отходов (то есть фекальных масс).
Эта новая методика и полезные микробы, вводимые в кишечник, помогают организму выводить вредные токсины. Когда почка повреждается из-за болезни, уремические токсины накапливаются в крови. Большое количество этих токсинов попадает в толстую кишку из-за наличия обширной сети кровеносных сосудов, которые ее окружают. Попав в толстую кишку, микробы поглощают и метаболизируют уремические азотистые отходы в качестве питательных веществ для своего роста.
По мере того как они усваивают уремические токсины, микробы начинают размножаться, и это, в свою очередь, обеспечивает еще большее удаление токсинов из кровотока. В итоге за счет микробов и работы кишечника, поврежденные почки разгружаются. Метод лечения больных при помощи пробиотиков необходим в ситуации, когда болезни почек прогрессируют, тело не справляется с нагрузкой. Ученые, которые разработали этот метод терапии, говорят, что он помогает отодвинуть время, когда пациенту понадобится почечный диализ (аппаратное очищение крови).
Читайте также нашу статью о синдроме уставших надпочечников по ссылке.
Источник
Почки — парные органы, которые фильтруют кровь от конечных продуктов метаболизма, а также токсических веществ, попавших в организм извне. В процессе фильтрации образуется моча, вместе с которой выводятся эти вредные вещества. Кроме того, почки являются частью эндокринной системы, принимая участие в синтезе некоторых гормонов. Также они задействованы в белковом и углеводном метаболическом обмене.
Почечная недостаточность – заболевание, при котором эти органы теряют возможность в достаточной мере осуществлять свою функцию.
Возникает уремия – отравление человека токсическими продуктами обмена, сбой кислотно-щелочного и водно-солевого баланса, и как следствие – нарушение работы всего организма.
Почечная недостаточность – опасное заболевание с высоким риском летальности. которое требует немедленного врачебного вмешательства и строгого контроля.
Функции почек
Выделительная
В нефронах (структурных единицах почек) происходит фильтрация крови, в результате чего образуется моча.
С мочой выводятся:
- Остатки белкового обмена: мочевина, креатинин, соли аммония, серная, фосфорная, мочевая кислоты.
- Избыток воды, солей, микро- и макро-элементов, глюкозы.
- Гормоны.
- Вредные вещества стороннего происхождения, в том числе лекарственные препараты.
Гомеостатическая
Гомеостаз означает равновесие внутренней среды организма. Количество и соотношение жизненно важных веществ (например, воды, натрия, калия и др.) могут колебаться лишь в ограниченных пределах – даже небольшое нарушение баланса ведет заболеванию.
Почки «следят» за тем, чтобы количество выведенных веществ соответствовало количеству поступивших. Так поддерживается водно-солевой, кислотно-щелочной, электролитический, осмотический гомеостаз. А значит обеспечивается постоянный объем крови, внешне- и внутриклеточной жидкости, бесперебойное протекание метаболических процессов, сохраняется нормальный уровень кровяного давления.
Эндокринная
Это синтез некоторых биологически активных веществ и гормонов.
Например, почками вырабатывается гормон эритропоэтин, который стимулирует выработку в костном мозге эритроцитов. Также в них завершается процесс формирования активного витамина D3 (кальцитриола), который формирует костную ткань.
Метаболическая
Участие в расщеплении белков, построении части клеточных мембран. Синтез глюкозы из других веществ.
Что такое почечная недостаточность
Если почки не справляются в полной мере со своими задачами – это состояние называют почечной недостаточностью.
Заболевание делится на две формы – острую и хроническую:
- Острая почечная недостаточность или острое повреждение почек (ОПН) – развивающееся в течение нескольких дней или недель заболевание. Имеет потенциально обратимый характер – часто работа органов восстанавливается. Однако это происходит не всегда, и у больного развивается ХПН.
- Хроническая почечная недостаточность (ХПН) – медленно прогрессирующая патология почек, ведущая к необратимому нарушению их функции. Заболевание развивается от нескольких месяцев до нескольких лет.
ОПН перерастает в ХПН, если острое повреждение длится более 3-х месяцев, и работа почек не восстанавливается в полной мере после ликвидации причин. А также, если причины носят постоянный характер – например, при аутоиммунном разрушении почечных клеток.
Если поражена одна почка, а вторая работает нормально, здоровый орган возьмет на себя функции обоих. Человек будет чувствовать себя здоровым как субъективно, так и по лабораторным показателям. Поэтому почечная недостаточность возникает при поражении обеих почек.
Как острое так и хроническое снижение функции органов может возникнуть в любом возрасте, однако чаще происходит у пожилых людей.
Как проявляется почечная недостаточность
Симптоматика зависит от формы и стадии развития заболевания:
- При ОПП первыми симптомами становится резкое уменьшение или прекращение мочеиспускания.
- При ХПП нарастание симптомов происходит медленно. На ранней стадии следствием нарушения функции почек может стать их неспособность снижать объем мочи в ночное время путем обратного поглощения из нее воды. Поэтому при нетяжелой форме болезни единственным симптомом может стать никтурия – частое ночное мочеиспускание.
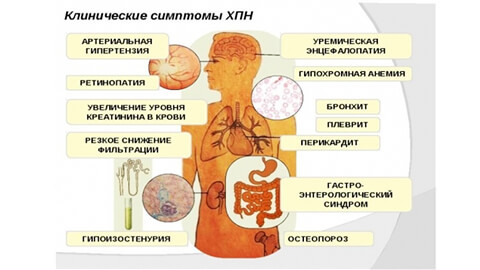
По мере прогрессирования патологии нарушается фильтрующая и выделительная функция почек. Из организма не выводятся кислоты обмена, поэтому кислотно-щелочной баланс крови сдвигается в кислую сторону (ацидоз). В крови накапливается мочевина, фосфорные, азотистые вещества, возникает избыток солей. Такое самоотравление организма называется уремией, или мочекровием.
Как проявляется почечная недостаточность при уремии можно понять по наличию следующих симптомов:
- снижение аппетита;
- апатия, общая слабость;
- жажда;
- неприятный вкус во рту;
- расстройство сна;
- ухудшение памяти;
- понижение температуры тела в среднем до 35С;
- тошнота.
Если лечение не принесло результата, и заболевание развивается дальше, интоксикация распространяется на нервную систему. У человека возникают непроизвольные подергивания мышц, появляется заторможенность реакций.
Организм начинает избавляться от токсинов другими способами, например через непрерывную рвоту и понос. Изо рта возникает запах аммиака.
Азотистые вещества выделяются через кожу и слизистые оболочки, что приводит к их раздражению, а затем к уремическому гастриту, трахеиту, стоматиту. Может возникнуть тяжелая патология – воспаление сердечной мышцы (перикардит).
При заполнении легких жидкостью и поражении перикарда возникает одышка.
На терминальных стадиях развития уремии на носу, подбородке и шее больного выступают белесые кристаллы мочевины (уремический иней). Падает кровяное давление, возникает спутанность сознания.
Смерть может наступить от уремической комы.
При тяжелой стадии почечной недостаточности происходит нарушение работы практически всех систем организма.
При этом почки не могут производить в достаточном количестве гормон эритропоэтин, поэтому у больного падает количество эритроцитов и развивается анемия.
Выработка кальцитриола также снижается, что приводит к хрупкости костей. У детей почечная недостаточность приводит к задержке роста костной ткани.
Развивается гипертоническая болезнь и сердечная недостаточность.
Стойкое повышения количества мочевой кислоты зачастую ведет к подагре.
Причины почечной недостаточности
Почечная недостаточность развивается по трем основным причинам:
- нарушение кровообращения органов;
- поражение нефронов;
- закупорка мочевыводящих путей.
К развитию ХПН чаще всего приводят две патологии:
- Сахарный диабет.
- Тяжелая артериальная гипертензия (повышение артериального давления).
Именно эти заболевания приводят к поражениям мелких сосудов, питающих почки, и стойкому нарушению их кровообращения.
В ряде случаев выявить причину развития болезни невозможно.
Диагностика
Врач выполняют визуальный осмотр пациента и назначает лабораторные и аппаратные исследования.
Биохимический анализ крови:
- Определение уровня конечных продуктов метаболизма в крови: креатинина, мочевой кислоты и азота.
- Установление уровня кислотности крови (выявление ацидоза).
- Определение количества электролитов в крови.
Общий анализ крови:
Определение уровня гемоглобина и эритроцитов. Показатели ниже нормы могут говорить о потере способности почек участвовать в синтезе эритроцитов.
Анализы мочи:
- Общеклинический анализ позволяет определить наличие белка, крови, и патологических клеток в моче.
- Биохимический — выявляет количество электролитов – натрия, калия, кальция, фосфатных соединений.
Из аппаратных исследований чаще назначают УЗИ и КТ (компьютерная томография).
В тяжелых случаях применяют биопсию почек – анализ ткани, позволяющий судить о степени и характере ее поражения. Не назначается, если на УЗИ было выявлено значительное уменьшение органов и рубцовые изменения.
Лечение почечной недостаточности
Заболевание хронической формы, как правило, прогрессирует даже при проведении лечения. Однако скорость процесса можно снизить, а качество жизни пациента повысить.
Это зависит контроля над заболеванием, которое привело к развитию ХПН. Например при сахарном диабете очень важно поддержание уровня сахара в норме, так же, как и уровня АД при гипертонической болезни – иначе качество работы почек будет стремительно снижаться.
Крайне важны мероприятия, предпринимаемые для сохранения функции почек:
- Ограничение потребление жидкости.
- Отказ от приема ряда лекарственных препаратов, дающих повышенную нагрузку на почки.
- Диетотерапия. Ограничение в рационе продуктов и напитков с повышенным содержанием натрия, фосфора, калия. Это поваренная соль, молочные продукты, печень, бобовые, орехи, также строго дозируется количество белка. В случае ОПН диеты нужно придерживаться до выздоровления пациента, при ХПН — на протяжении всей жизни.
- Лекарственная терапия. Назначается врачом по результатам анализов.
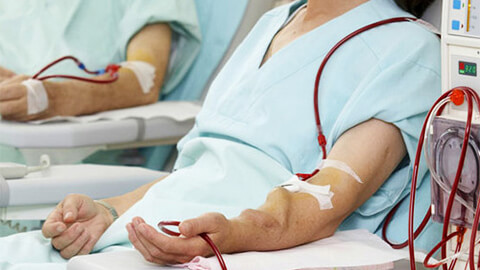
- Диализ. Аппаратное выведение продуктов жизнедеятельности. Проводится при тяжелом и прогнозируемо длительном нарушении функции почек. При тяжелой ХПН применяется на постоянной основе.
Пациент должен постоянно следить за биохимией крови – уровнем креатинина, мочевины и фосфатов в крови, ее кислотностью, а также регулярно сдавать анализы мочи.
В случае возникновения осложнений – анемии, сердечной недостаточности, остеодистрофии и т.д. – необходимо подключать направленную терапию.
При развитии тяжелой ХПН человеку показана операция по пересадке почки.
Без адекватного лечения почечная недостаточность приводит к летальному исходу.
Профилактика
Не всегда возможно предупредить развитие почечной недостаточности.
Однако снизить ее вероятность вам помогут:
- Здоровый образ жизни.
- Контроль веса.
- Ограничение употребления соли, пива, копченостей, белковых продуктов.
- Отказ от курения.
- Физическая активность.
При подозрении на нарушение работы органов мочевыделительной системы обязательно обращайтесь к врачу.
Источник
Нарушение функции почек является результатом сбоя в работе системы внутрипочечного метаболизма, что сопровождается снижением гломерулярной фильтрации, тубулярной секреции и реабсорбции. Это приводит к накоплению в организме больного целого ряда токсических соединений, которые оказывают влияние на все жизненно важные органы. Сердечнососудистые и инфекционные осложнения – это основные причины тяжелого течения хронической болезни почек, возникающие в результате воздействия токсических соединений на организм пациента [1]. В последнее время принято считать, что токсины, которые в больших количествах вырабатываются бактериальной флорой кишечника и не выводятся у больных с хронической почечной недостаточностью (ХПН), проникают в кровоток и оказывают большое влияние на течение этого заболевания. В основном это конечные продукты гликирования, фенолы и индолы [2]. Появились сообщения, которые свидетельствуют, что бактериальная нагрузка и конечные продукты метаболизма кишечной флоры являются звеном патогенеза хронической болезни почек [3,4], а живые культуры пробиотиков обладают большим потенциалом при лечении хронических заболеваний [5]. Последние данные по анализу микробной микрофлоры кишечника показали наличие в ней трех доминантных энтеротипов, которые можно охарактеризовать как виды Bacteroides, Prevotella и Ruminococcus [3, 4] Установлено, что состав микробиоты кишечника в значительной степени зависит от потребляемой пищи и окружающей среды и может меняться в течение 24 часов в зависимости от преобладающих компонентов пищевого рациона. В желудочнокишечном тракте млекопитающих микробиота взаимодействует с организмом хозяина через поверхность слизиcтой кишечника и очень чувствительна к внешним и внутренним воздействиям, которые могут вызвать нарушения во внутреннем гомеостазе кишечника. Показано, что ее состав и метаболическая активность могут привести как к благотворному влиянию на организм хозяина (например, выработка витаминов), так и оказать губительное воздействие путем образования токсических продуктов [3].
У больных с почечной недостаточностью высокая метаболическая нагрузка на желудочно-кишечный тракт в результате жизнедеятельности бактерий, неправильного питания и влияния окружающей среды приводит к сбою в работе энтероцитарного барьера и повышению содержания токсических соединений в организме хозяина [6, 7, 8].
Предшественники уремических токсинов образуются в результате ферментации бактериями таких аминокислот, как фенилаланин, тирозин и триптофан. Это приводит к образованию пара-крезола (р-крезол), фенола, индола, которые после прохождения через кишечник и печень попадают в кровоток или в виде материнской субстанции или в виде конъюгатов (р-крезол сульфата, ркрезол глюкуронида, фенил сульфата, фенил глюкуронида, индол сульфата, индол глюкуронида) [8-13]. Эти соединения обладают провоспалительным эффектом – стимулируют лейкоцитоз и дисфункцию эндотелия [14-17]. Установлено, что длительное течение дисбактериоза кишечника и воспалительных процессов желудочно-кишечного тракта приводит к перенасыщению ткани почек уремическими токсинами, тяжелому течению хронической болезни почек и сокращению промежутка времени до наступления терминальной стадии почечной недостаточности [17-20]. Следует признать наличие взаимосвязи между провоспалительными реакциями в желудочно-кишечном тракте, дисбиозом кишечника и течением хронической болезни почек [20].
Гемодиализ не способен обеспечить эффективную элиминацию тех уремических токсинов, которые связаны с белком, например, р-крезола и индоксил сульфата. Содержание этих соединений в крови коррелирует со смертностью больных на гемодиализе [21]. Больше всего это касается р-крезола, повышенное содержание которого в организме больного с терминальной ХПН ассоциируется с инфекцией, сердечно-сосудистыми заболеваниями, смертностью [22, 23, 24].
Торможение процесса выработки уремических токсинов является одним из эффективных путей снижения их концентрации в крови больных на гемодиализе. В этом отношении наиболее эффективны пробиотики, влияющие на организм больного, пребиотики, включающие в себя полисахариды, усиливающие рост полезных для организма кишечных бактерий, синбиотики – комбинацию пребиотиков и пробиотиков, которые все вместе нормализуют внутрикишечную экологическую нишу и уменьшают концентрацию токсичных продуктов жизнедеятельности бактерий [25,26]. Nomoto K. cчитает, что применение синбиотиков, пробиотиков и пребиотиков при различных заболеваниях, включая хроническую болезнь почек в ее терминальной стадии, эффективно улучшает внутреннюю среду кишечника и, как следствие этого, тормозит процессы ведущие к интоксикации организма [27].
В последнее время появились данные о том, что в терминальной стадии хронической болезни почек наблюдается выраженное изменение флоры именно толстого кишечника и фекальной флоры, что также приводит к синдрому избыточного бактериального роста в тонком кишечнике [28, 29, 30, 31]. Дисбиоз при ХПН связан с целым рядом причин: повышением уровня мочевины и поступлением ее в толстый кишечник, что заканчивается ее гидролизом уреазой микрофлоры и выделением большого количества аммония, изменением рН среды в кишечнике и возникновением энтероколита. В результате толстый кишечник становится основным путем выделения оксалатов, а употребление фосфат-связывающих препаратов значительно изменяют внутреннюю среду всего кишечника. Все это создает условия преимущественного роста для таких бактерий, как клостридии, синтезирующих р-крезол. Keddis MT. et al. cчитают, что повышенные количества этого микроорганизма очень часто встречается у больных с хронической болезнью почек, находящихся на гемодиализе, что может привести к инфекции, вызванной этим возбудителем, увеличению количества осложнений и смертности [32].
Целью настоящего исследования было изучение взаимосвязи содержания уремического токсина p-крезола в крови больных с терминальной стадией почечной недостаточности, находящихся на гемодиализе, при дисбиозе кишечника на фоне применения пробиотиков и без них.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Количественное определение ркрезола проводилось по модифицированному методу Niwa [33]: к 1 мл сыворотки крови больного добавлялось 100 мклитров дистиллированной воды. Проба затем закислялась до pH 1,0 M раствором соляной кислоты и насыщалась 1,0 г хлористого натрия.
После этого проводилась экстракция пробы в этилацетат и она центрифугировалась при 2000 оборотах в минуту. Различные количества надосадка вводились в хроматограф. Для количественного определения р-крезола была построена калибровочная кривая в пределах концентраций 0-150 мкмоль/л. В качестве стандарта использовался р-крезол фирмы Fluka. Был приготовлен его водный раствор, различные разведения которого прошли стандартную процедуру экстракции. Хроматографирование проходило на жидкостном хроматографе фирмы Fennigan на колонке BDS Hypersil С18 в системе ацетонитрил – вода (15/75) в изократическом режиме при скорости потока 0.5 мл в минуту. Использовался диодно-матричный детектор, определение проводилось при 280 нм, время удерживания р-крезола составило 7,5 мин.
Посев кала на микрофлору проводился по стандартой культуральной микробиологической методике [34]. Выделялись следующие микроорганизмы: бифидобактерии, лактобактерии, клостридии, патогенные энтеробактерии, кишечная палочка (типичная, лактозонегативная, гемолитическая), энтерококки, золотистый стафилококк, другие неферментирующие грамотрицательные бактерии, pseudomonas aeruginosa дрожжеподобные грибы типа Candida.
В исследование вошли 18 пациентов с терминальной стадией почечной недостаточности, которые проходили терапию в отделении оперативной нефрологии и пересадки почки ФГБУ «НИИ урологии» Минздрава России. Статистическая достоверность результатов оценивалась по критерию Стьюдента с помощью программы «Статистика».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У больных, находящихся на гемодиализе, при посеве кала которых, выявлен высокий титр клостридий (> 105 КОЕ), концентрация р-крезола в сыворотке крови была 53,5±15,5 мкмоль/литр. При нормальном титре клостридий (< 105) его содержание составляло 26,5±6.7мкмоль/литр, а у больных, постоянно принимающих пробиотики (линекс по 2 капсулы 3 раза в день), – 15,6±5,1 мкмоль/литр (рис.1) У всех трех групп больных титры остальных видов микроорганизмов в были в пределах нормальных показателей, что согласуется с ранее опубликованными данными, согласно которым при посеве кала на твердые питательные среды не было выявлено достоверной разницы по основным видам микроорганизмов между больными на гемодиализе и группой здоровых людей [35]. Полученные нами данные показывают, что содержание р-крезола в сыворотке крови у больных с терминальной стадией ХПН в значительной степени зависит от титра клостридий в желудочно-кишечном тракте. Это согласуется с литературными данными. Установлено, что фенольные соединения такие, как фенолуксусная кислота, фенол, р-крезол образуются из фенилаланина и тирозина целым рядом облигатных и факультативных анаэробов, обитающих в кишечнике и включающих Bacteroides, Lactobacillus, Enterobacter, Bifidobacterium. Подавляющая часть этих веществ вырабатывается Clostridium. Однако процесс разложения ароматических аминокислот микрофлорой кишечника имеет свои пределы. С термодинамической точки зрения он плохо протекает в отсутствии неорганический акцепторов электронов и может происходить преимущественно в аэробных условиях, когда монои диоксигеназы инкорпорируют молекулярный кислород в продукты различных реакций, что наблюдается при ХПН. В связи с этим при терминальной стадии ХПН в кишечнике создаются идеальные условия для обитания этих видов микроорганизмов [32, 36, 37]. Согласно нашим данным у больных с терминальной ХПН, принимающих пробиотики, отмечается снижение концентрации р-крезола. Это может быть только в том случае, когда пробиотики каким-то образом вмешиваются в процесс синтеза или выведения р–крезола. Действительно, в литературе появились данные о том, что лактобактерии способны по неизвестному механизму связывать или метаболизировать ркрезол [38], а в опытах in vitro установлено, что инкубация р-крезола и фенола с Streptococcus thermophilus KB06, Lactobacillus acidophilus KB20, Bifidobacterium longum KB71 снижает содержание этих соединений [ 39]. Показано, что применение у больных на гемодиализе препарата Lebenin, содержащего молочнокислые бактерии приводит к снижению концентрации уремических токсинов [35]. Все это в определенной степени подтверждает полученные нами результаты.
Таким образом, полученные результаты говорят о том, что высокая концентрация р-крезола в сыворотке крови больных с терминальной стадией почечной недостаточности может свидетельствовать о наличии у больного дисбиоза кишечника. Применение пробиотиков снижает содержание этого уремического токсина.

Рис 1. Концентрация паракрезола в сыворотке крови больных с терминальной стадией ХПН при дисбиозе кишечника и при приеме пробиотиков.
ЛИТЕРАТУРА
1. Wen CP, Cheng TY, Tsai MK, Chang YC, Chan HT, Tsai SP, Chiang PH, Hsu CC, Sung PK, Hsu YH, Wen SF. All-cause mortality attributable to chronic kidney disease: A prospective cohort study based on 462 293 adults in Taiwan.// Lancet. 2008. Vol. 371.P.2173–2182.
2. Vitetta L, Gobe G. Uremia and chronic kidney disease: The role of the gut microflora and therapies with proand prebiotics. // Mol Nutr Food Res. 2013.Vol. 57.P. 824–832.
3. Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li H, Bushman FD, Lewis JD. Linking long-term dietary patterns with gut microbial enterotypes. // Science. 2011. Vol.334. P. 105–108.
4. Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, Bertalan M, Borruel N, Casellas F, Fernandez L, Gautier L, Hansen T, Hattori M, Hayashi T, Kleerebezem M, et al. Enterotypes of the human gut microbiome. // Nature. 2011. Vol. 473. P.174–180.
5. Vitetta L, Alford H. The pharmacobiotic potential of the gastrointestinal tract micro-biometabolome-probiotic connect: A brief commentary.// Drug Dev Res. 2013.Vol. 74.P.353–359.
6. Zheng X, Zhao A, Xie G, Chi Y, Zhao L, Li H, Wang C, Bao Y, Jia W, Luther M, Su M, Nicholson JK, Jia W. Melamine-induced renal toxicity is mediated by the gut microbiota. // Sc. Transl Med. 2013. Vol. 5, N 172. P 172ra22.
7. Fasano A. Toxins and the gut: Role in human disease.// Gut. 2002.Vol. 50, Suppl. 3. P. 9–14.
8. Bengmark S. Gut microbiota, immune development and function.// Pharmacol Res. 2013.Vol. 69.P.87–113.
9. Stecher B, Maier L, Hardt WD. Blooming’ in the gut: How dysbiosis might contribute to pathogen evolution. // Nat Rev Microbiol. 2013. Vol. 11. P. 277–284.
10. Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. // Curr Opin Clin Nutr Metab Care. 2007. Vol. 10. P. 729–734.
11. Macfarlane GT, Macfarlane S. Bacteria, colonic fermentation, and gastrointestinal health. // JAOAC Int. 2012.Vol. 95.P. 50–60.
12. Vanholder R, De Smet R, Glorieux G, Argilés A, Baurmeister U, Brunet P, Clark W, Cohen G, De Deyn PP, Deppisch R, Descamps-Latscha B, Henle T, Jörres A, Lemke HD, Massy ZA, Passlick-Deetjen J, Rodriguez M, Stegmayr B, Stenvinkel P, Tetta C, Wanner C, Zidek W . Review on uremic toxins: Classification, concentration, and interindividual variability. // Kidney Int. 2003. Vol. 63. P.1934–1943.
13. Duranton, F, Cohen G, De Smet R, Rodriguez M, Jankowski J, Vanholder R, Argiles A. European Uremic Toxin Work Group. Normal and pathologic concentrations of uremic toxins. // J Am Soc Nephrol. 2012. Vol. 23.P. 1258–1270.
14. Charney DI, Walton DF, Cheung AK. Atherosclerosis in chronic renal failure.// Curr Opin Nephrol Hypertens. 1993. Vol. 2. P. 876–882.
15. Schepers E, Meert N, Glorieux G, Goeman J, Van der Eycken J, Vanholder R. P-cresylsulphate, the main in vivo metabolite of p-cresol, activates leucocyte free radical production. // Nephrol Dia Transplant. 2007. Vol. 22. P. 592–596.
16. Motojima M, Hosokawa A, Yamato H, Muraki T, Yoshioka T. Uremic toxins of organic anions up-regulate PAI-1 expression by induction of NF-kappaB and free radical in proximal tubular cells. // Kidney Int. 2003. Vol 63 .P.1671–1680.
17. Dou L, Bertrand E, Cerini C, Faure V, Sampol J, Vanholder R, Berland Y, Brunet P. The uremic solutes p-cresol and indoxylsulfate inhibit endothelial proliferation and wound repair. // Kidney Int. 2004. Vol. 65. P. 442–451.
18. Vitetta L, Briskey D, Hayes E, Shing C, Peake J. A review of the pharmacobiotic regulation of gastrointestinal inflammation by probiotics, commensal bacteria and prebiotics. // Inflammopharmacology. 2013. Vol. 20. P. 251–266.
19. Anders HJ, Andersen K, Stecher B. The intestinal microbiota, a leaky gut, and abnormal immunity in kidney disease.// Kidney Int. 2013. Vol. 83, P. 1010–1016.
20. Hida M, Aiba Y, Sawamura S, Suzuki N, Satoh T, Koga Y. Inhibition of the accumulation of uremic toxins in the blood and their precursors in the feces after oral administration of lebenin, a lactic acid bacteria preparation, to uremic patients undergoing hemodialysis. // Nephron. 1996. Vol. 74. P. 349–355.
21. Jourde-Chiche N, Dou L, Cerini C, Dignat-George F, Vanholder R, Brunet P. Protein-bound toxins–update 2009. // Semin Dial. 2009. Vol. 22. P. 334–339.
22. De Smet R, Van Kaer J, Van Vlem B, De Cubber A, Brunet P, Lameire N, Vanholder R. Toxicity of free p-cresol: a prospective and cross-sectional analysis.// Clin. Chem. 2003.Vol. 49. P. 470–478.
23. Meijers BK, Bammens B, De Moor B, Verbeke K, Vanrenterghem Y, Evenepoel P. Free p-cresol is associated with cardiovascular disease in hemodialysis patients.// Kidney Int. 2008. Vol.73.P. 1174–1180
24. Bammens B, Evenepoel P, Keuleers H et al. Free serum concentrations of the protein-bound retention solute p-cresol predict mortality in hemodialysis patients.// Kidney Int.2006.Vol. 69. P. 1081–1087.
25. Fooks LJ, Gibson GR. Probiotics as modulators of the gut flora. // Br J Nutr. 2002. Vol. 88. P.39–49.
26. de Vrese M, Schrezenmeir J. Probiotics, prebiotics, and synbiotics. // Adv Biochem Eng Biotechnol. 2008. Vol. 111. P. 1–66.
27. Nomoto K. Prevention of postoperative microbial infection by synbiotics.// Indian J Exp Biol. 2008. Vol. 46. P. 557–561.
28. Ranganathan N, Friedman EA, Tam P, Rao V, Ranganathan P, Dheer R. Probiotic dietary supplementation in patients with stage 3 and 4 chronic kidney disease: a 6-month pilot scale trial in Canada. // Curr Med Res Opin. 2009. Vol. 25. P.1919–1930.
29. F. Fukuuchi, M. Hida, Y. Aiba, Y. Koga, M. Endoh, K. Kurokawa, H. Sakai Intestinal bacteria-derived putrefactants in chronic renal failure.// Clin Exp Nephrol. 2002. Vol. 6. P. 99–104.
30. Vaziri ND, Wong J, Pahl M, Piceno YM, Yuan J, DeSantis TZ, Ni Z, Nguyen TH, Andersen GL. Chronic kidney disease alters intestinal microbial flora. // Kidney Int. 2013.Vol. 83. P. 308–315.
31. Wang IK, Lai HC, Yu CJ, Liang CC, Chang CT, Kuo HL, Yang YF, Lin CC, Lin HH, Liu YL, Chang YC, Wu YY, Chen CH, Li CY, Chuang FR, Huang CC, Lin CH, Lin HC. Real-Time PCR Analysis of the Intestinal Microbiotas in Peritoneal Dialysis Patients. // Appl Environ Microbiol. 2012. Vol.78, 4. P.1107-1112 P. 1107–1112.
32. Keddis MT, Khanna S, Noheria A, Baddour LM, Pardi DS, Qian Q.Clostridium difficile Infection in Patients With Chronic Kidney Disease.// Mayo Clin Proc. 2012. Vol.87. N 11. P.1046-1053.
33. Niwa T. Phenol and p-cresol accumulated in uremic serum measured by HPLC with fluorescence detection. // Clin Chem. 1993.Vol. 39. P. 108–111.
34. Fan K, Morris AJ, Reller LB. Application of rejection criteria for stool cultures for bacterial enteric pathogens. // J Clin Microbiol.1993.Vol.31. P. 2233-2235.
35. Hida M, Aiba Y, Sawamura S, Suzuki N, Satoh T, Koga Y. Inhibition of the accumulation of uremic toxins in the blood and their precursors in the feces after oral administration of Lebenin, a lactic acid bacteria preparation, to uremic patients undergoing hemodialysis. // Nephron. 1996. Vol.74, N2. P. 349-55
36. Evenepoel P, Meijers BK, Bammens BRM, Verbeke K. Uraemic toxins originating from colonic microbial metabolism. // Kidney Int. 2009. Vol. 76. P.12–19.
37. Cummings JH. Fermentation in the human large intestine: evidence and implications for health. // Lancet. 1983. Vol. 1. P.1206–1209.
38. Nowak A, Libudzisz Z. Ability of intestinal lactic bacteria to bind or/and metabolise phenol and p-cresol. //Ann Microbiol. 2007. Vol. 57, N3. P 329-335.
39. Marczely J, Dheer R, Ranganathan P, Patel B, Ranganathan N, FriedmanE.A. Probiotic Formulation in Vitro Effect on Phenol and p-CresolLevels. // J Am Soc Nephrol. 2004. Vol.15. P. 112A F-PO212 .
Источник