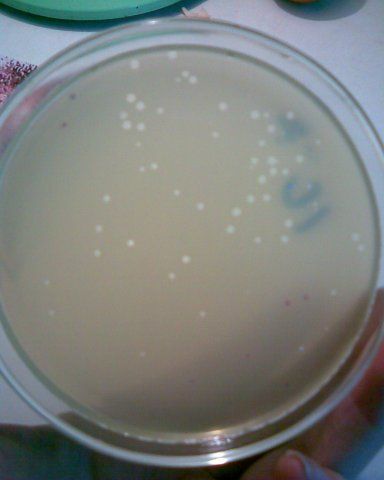
Фото кишечной палочки на среде эндо
Оглавление темы “Эшерихии. Эшерихиозы. Кишечная палочка. Шигеллы. Дизентерия.”:
1. Диагностика энтеробактерий. Выявление энтеробактерий. Диагностические подходы для энтеробактерий.
2. Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
3. Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
4. Патогенез поражений кишечной палочкой. Клинические проявления коли инфекции. Кишечные инфекции ( коли-инфекции ). Энтеротоксигенные кишечные палочки.
5. Энтероинвазивные кишечные палочки. Энтеропатогенные эшерихии. Энтерогеморрагические кишечные палочки.
6. Энтероадгезивные кишечные палочки. Уропатогенные эшерихии. Инфекции мочевыводящих путей вызванные кишечной палочкой. Бактериемия эшерихий.
7. Менингит вызванный кишечной палочкой. Респираторные инфекции вызванные эшерихиями ( кишечной палочкой ).
8. Микробиологическая диагностика кишечной палочки. Диагностика кишечной палочки. Выявление эшерихий.
9. Лечение эшерихиозов. Лечение кишечной инфекции. Профилактика эшерихиозов. Профилактика кишечной инфекции.
10. Шигеллы. Дизентерия. Бактериальная дизентерия. Шигеллез. История дизентерии. Серовары шигелл. Серовары возбудителей дизентерии.
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5×2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
– Также рекомендуем “Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.”
Источник
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
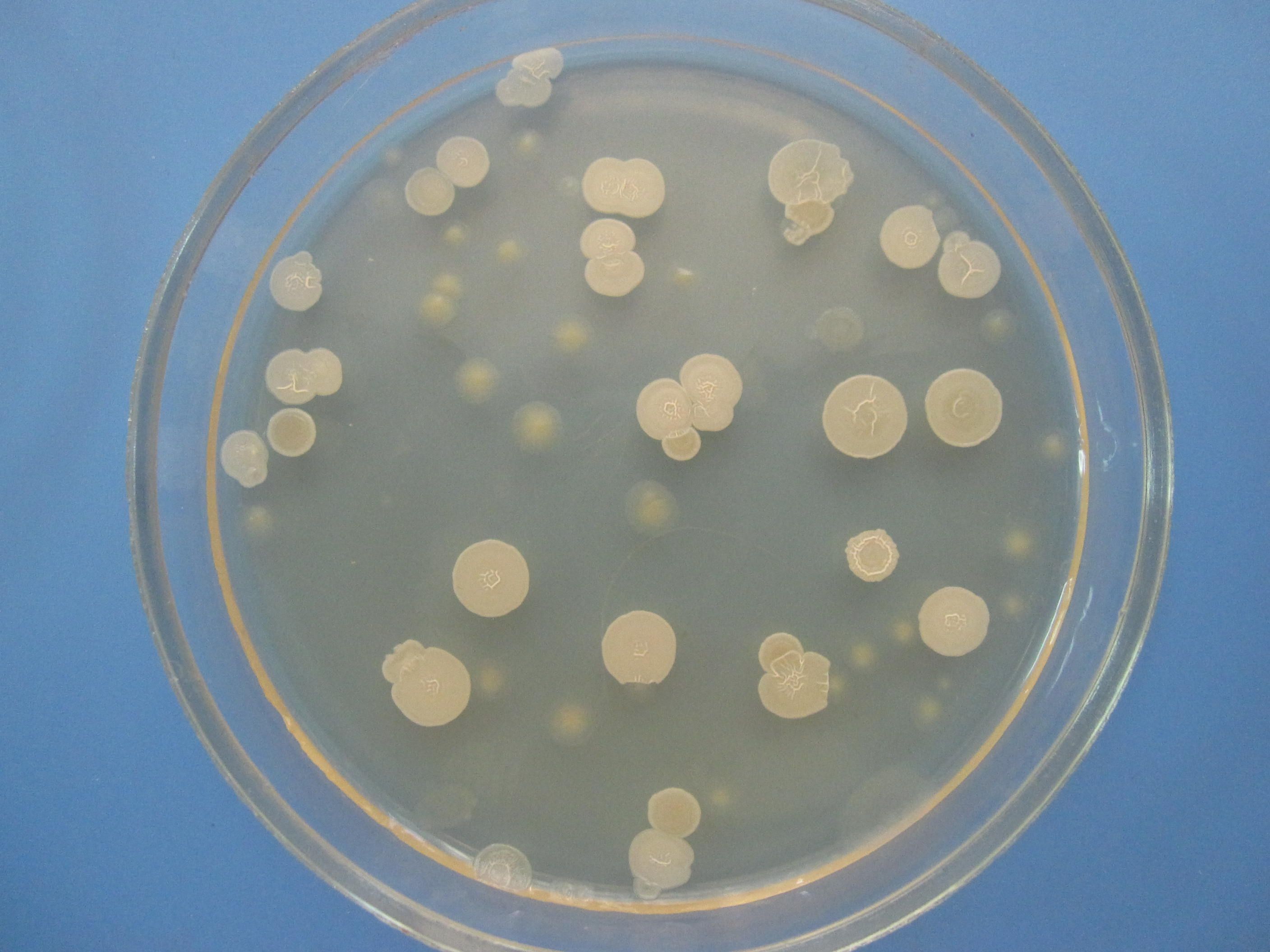 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
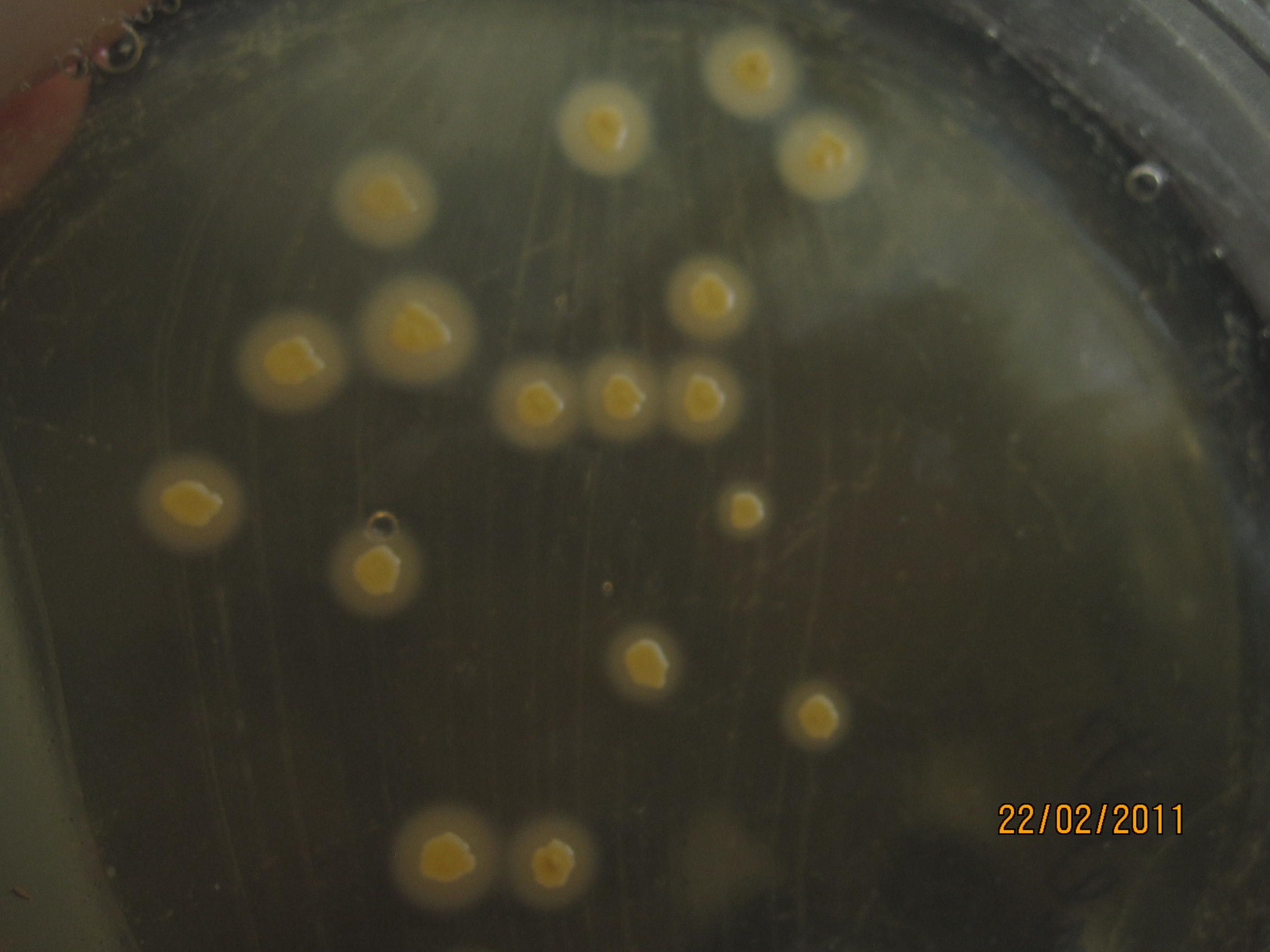
 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
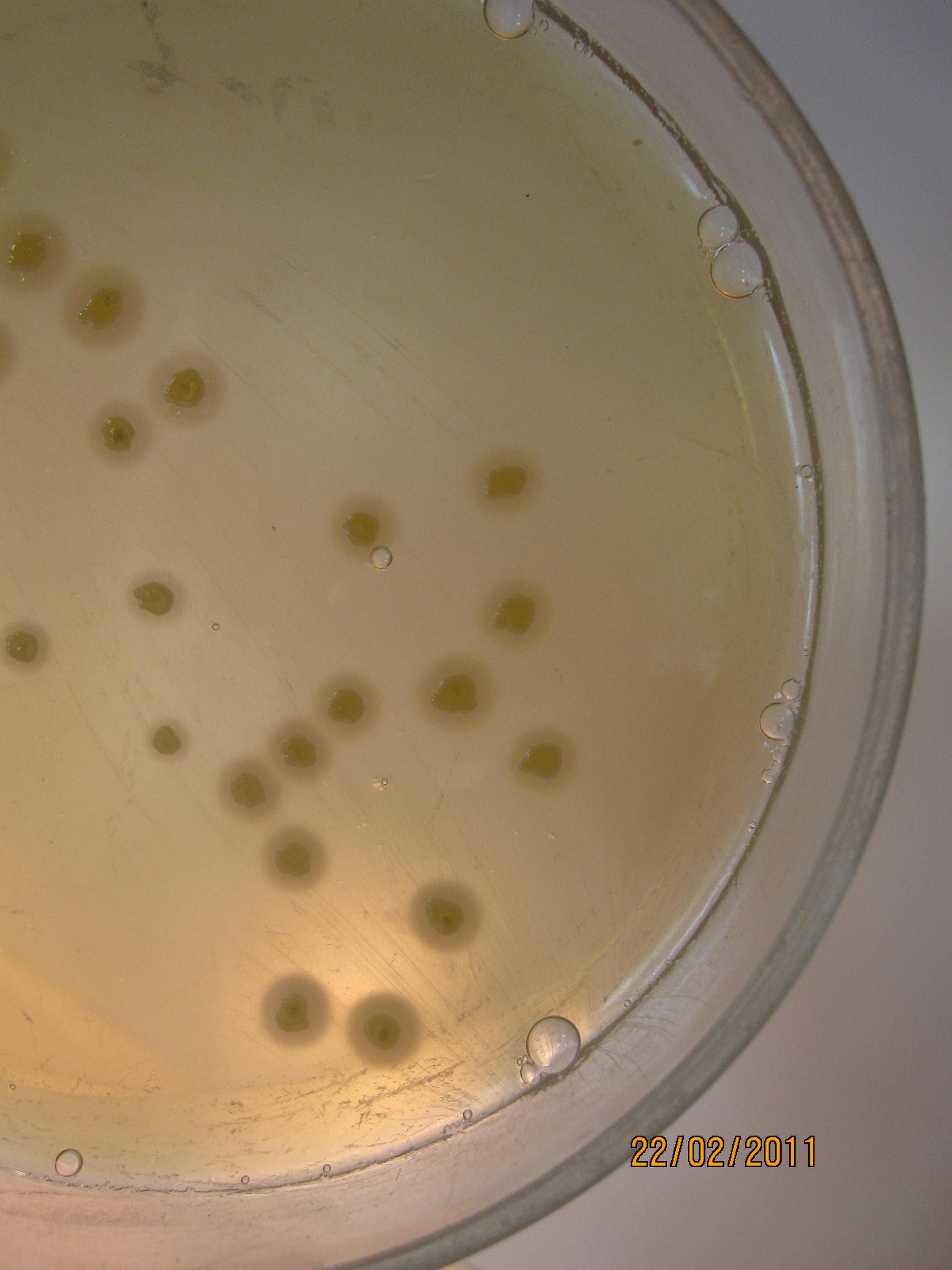
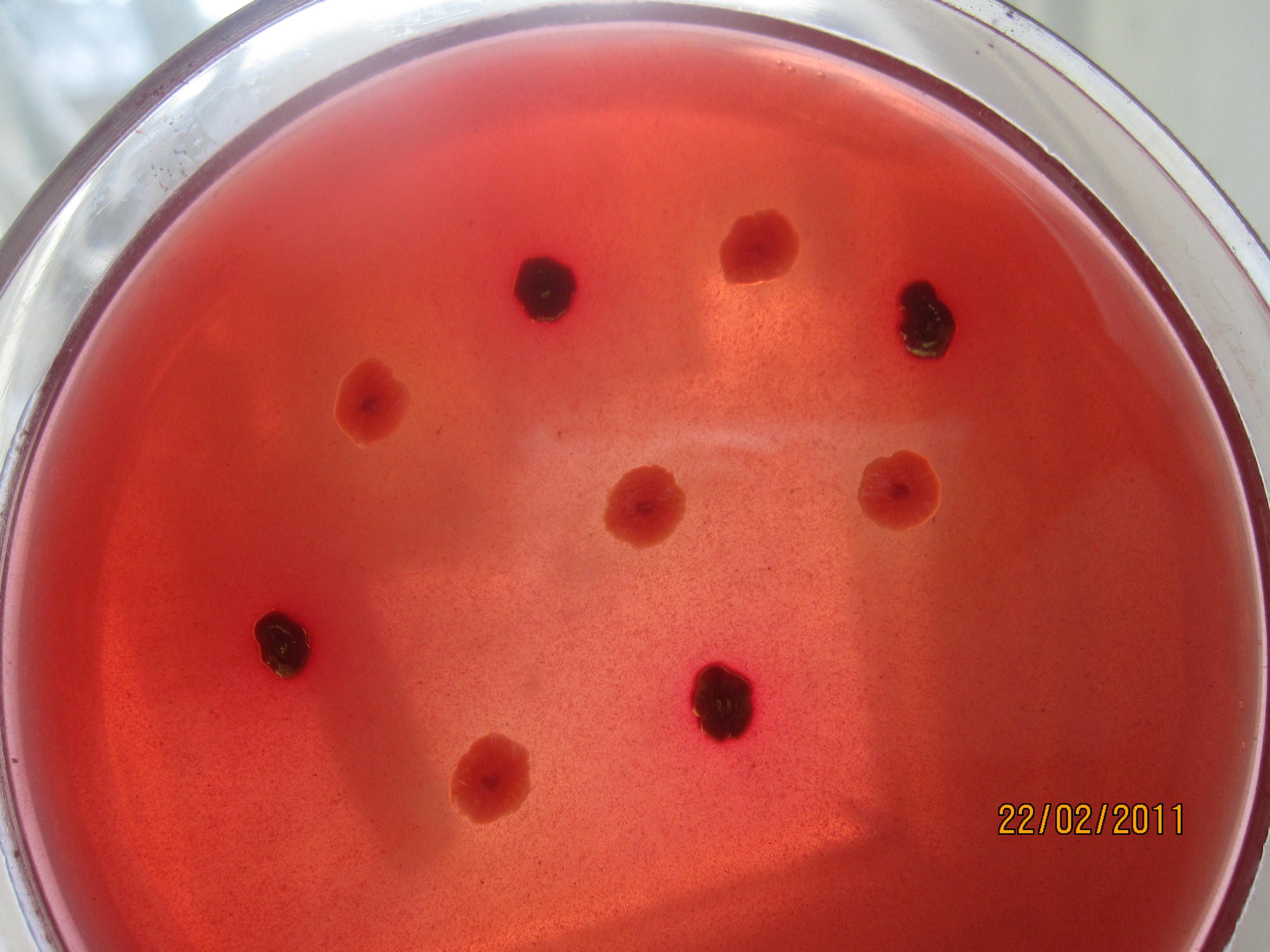
 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.

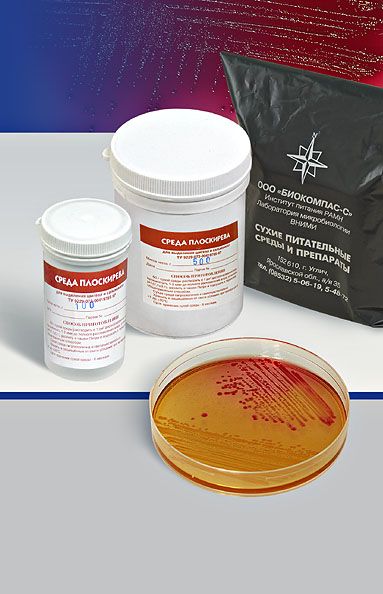
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
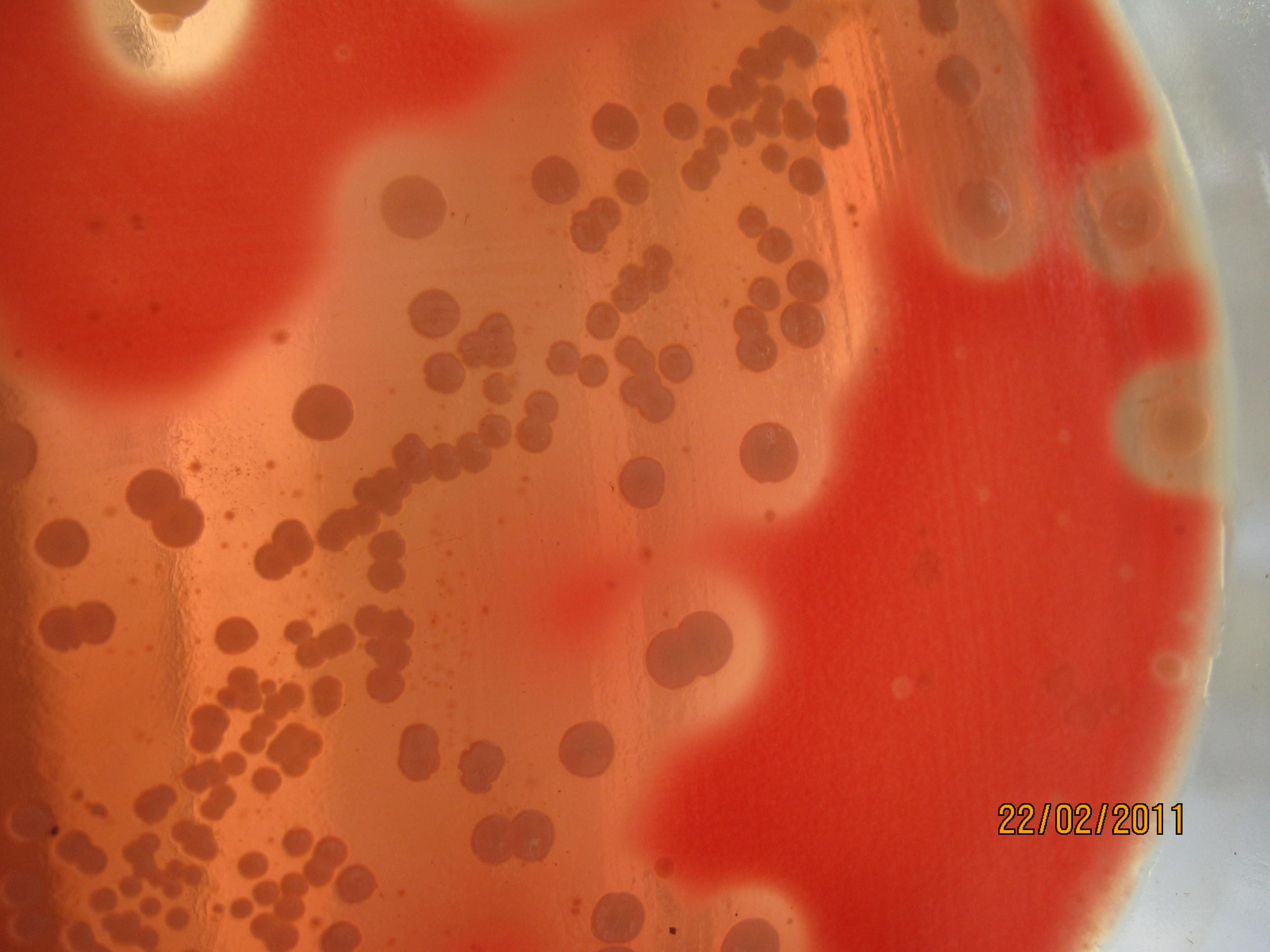
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
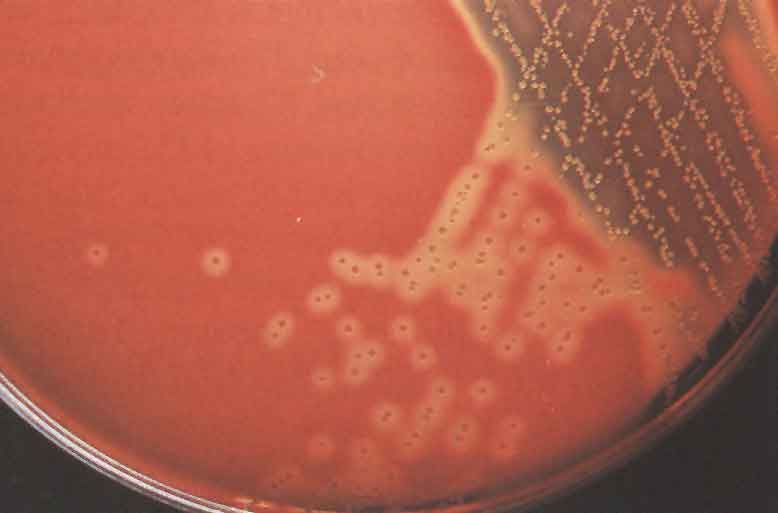
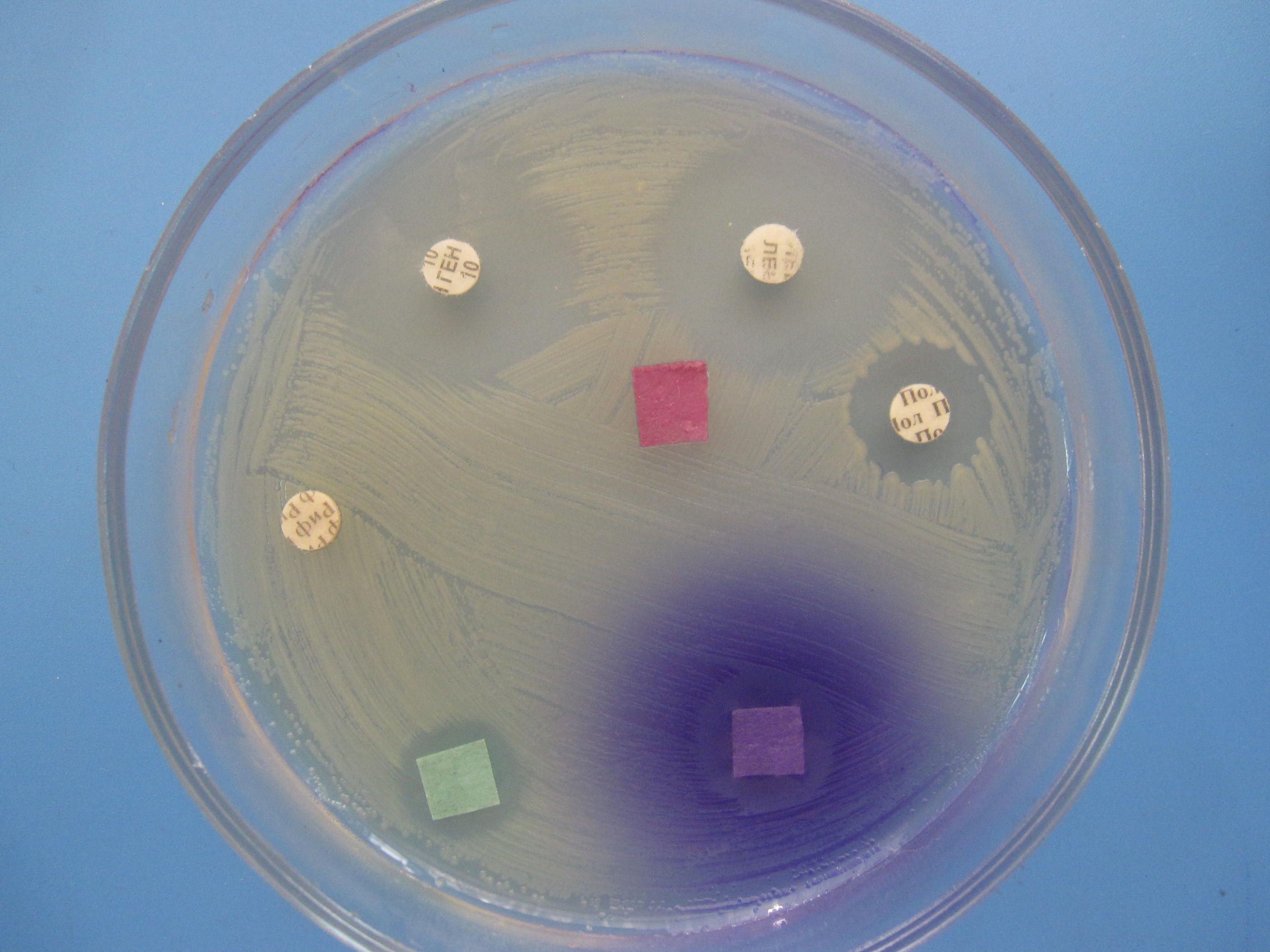 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
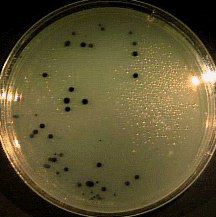
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
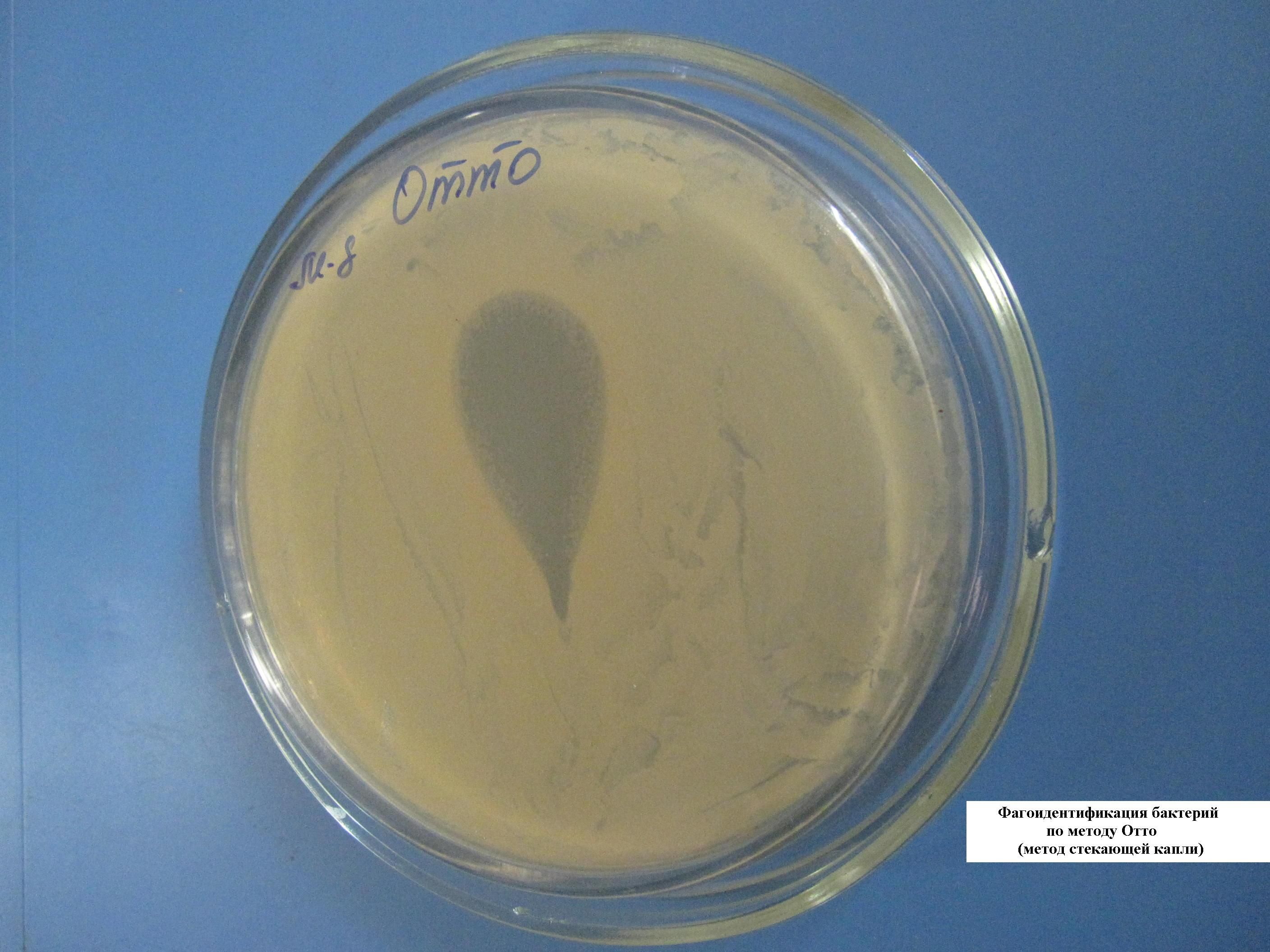
 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
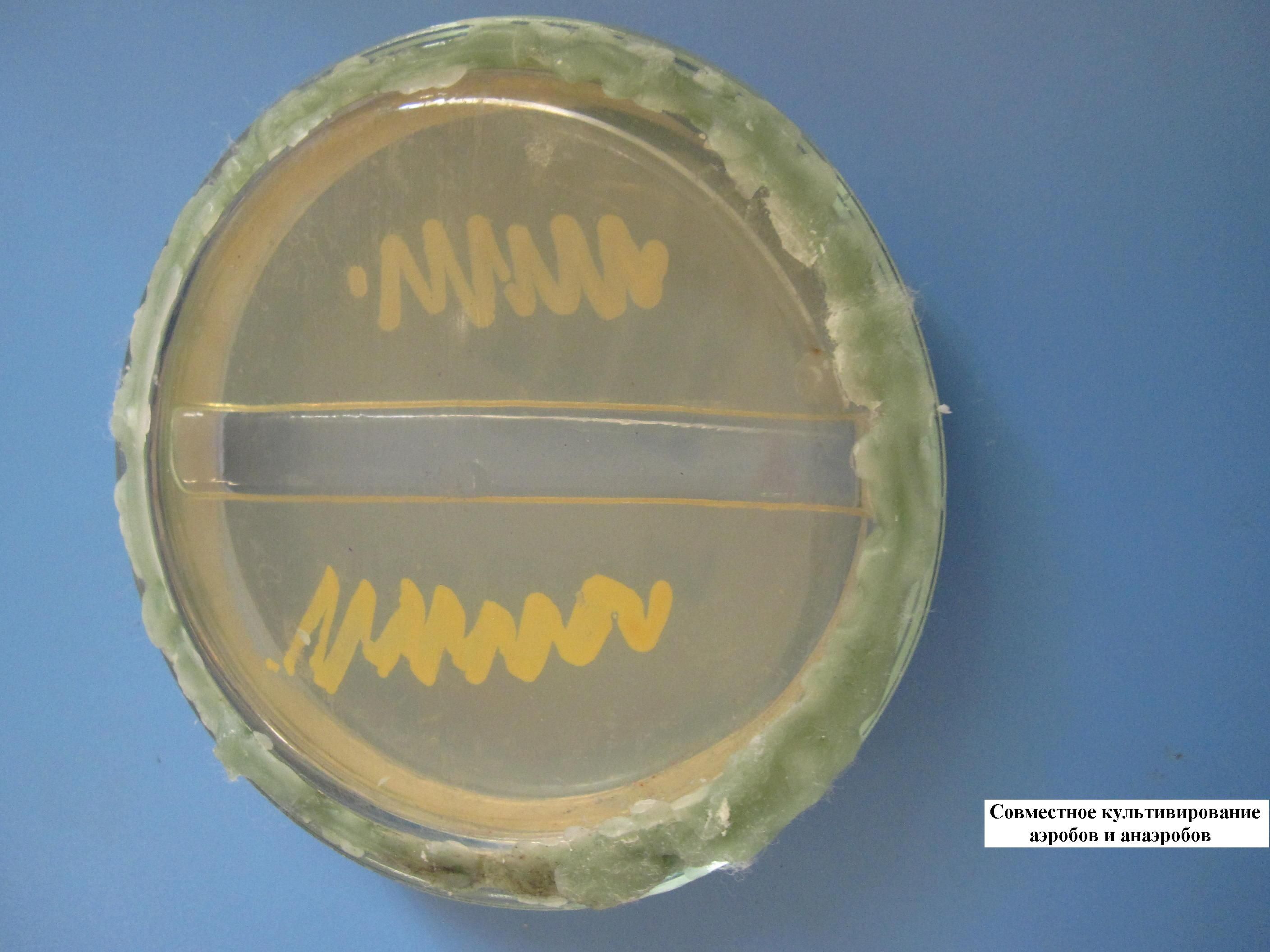
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
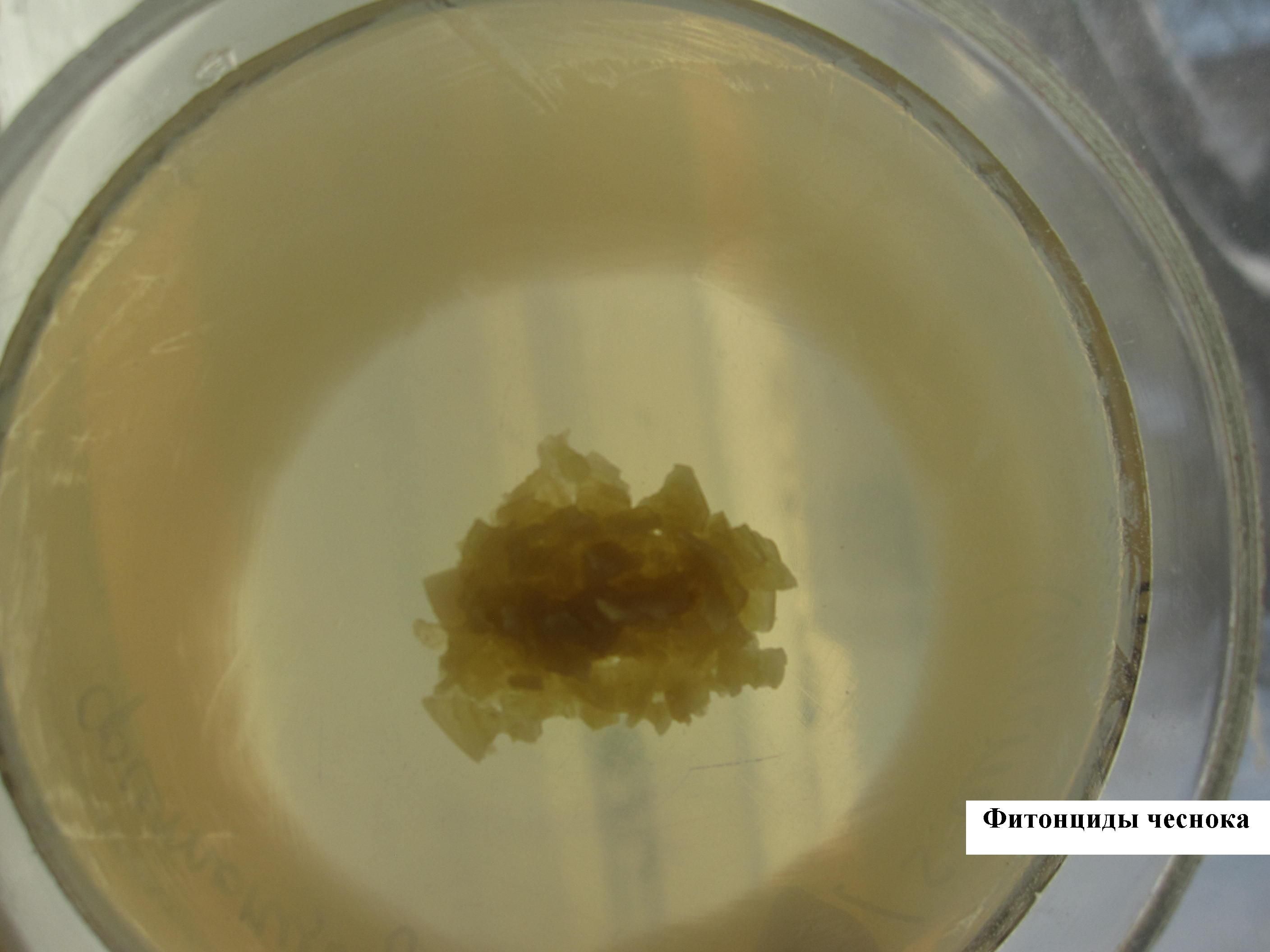 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник
Глава 18. Эшерихии – Л. Б. Богоявленская, Ф. К. Черкес
Этот род представлен только одним видом бактерий – Е. coli, но объединяет множество вариантов. Разновидности кишечной палочки отличаются по биологическим свойствам, у них могут быть разные наборы ферментов (биовары) и разная антигенная структура (серовары).
Кишечная палочка впервые выделена в 1888 г. Эшерихом из испражнений человека и названа по его имени.
Естественным местом обитания E. coli является кишечник человека. Кишечная палочка – представитель нормальной микрофлоры кишечника.
В процессе жизнедеятельности E. coli вырабатывает ферменты, способствующие пищеварению (например, расщепляющие клетчатку), синтезирует некоторые витамины (например, витамины группы В). Кроме того, эти бактерии проявляют антагонистическое действие в отношении патогенных микроорганизмов, таких как возбудители Дизентерии, брюшного тифа, токсикоинфекций. Отсутствие кишечной палочки в толстом кишечнике ведет к тяжелому заболеванию – дисбактериозу. При этом нарушается нормальный состав микрофлоры кишечника, развиваются протей, кокковая флора, грибы и т. п.
При снижении устойчивости организма (голодании, переутомлении и т. п.) эшерихии могут проникнуть в Другие органы и ткани и стать причиной тяжелых патологических процессов. Таким образом, можно считать, что эшерихии – типичные условно-патогенные микроорганизмы: в обычных условиях они являются сапрофитами, а ПРИ изменении условий вызывают заболевания.
Выделяясь с фекалиями, кишечная палочка попадает во внешнюю среду. Обнаружение E. coli в почве, воде и на других объектах свидетельствует об их фекальном загрязнении, а определение количества E. coli (коли-титр, коли-индекс) характеризует санитарное состояние объекта (см. “Санитарная микробиология”).
Морфология. E. coli – короткие, в среднем 0,5-3,0 × 0,5-0,8 мкм палочки. Грамотрицательны. В большинстве случаев они подвижны, перитрихи. Однако некоторые варианты кишечной палочки неподвижны. Многие штаммы образуют капсулу. Спор не образуют.
Культивирование. Кишечная палочка – факультативный анаэроб. Хорошо растет на простых питательных средах при 37° С и рН среды 7,2-7,8. Штаммы E. coli, выделенные из кишечника человека и животных, развиваются и при 43-45° С, а кишечные палочки холоднокровных при этих условиях не размножаются. Это различие в свойствах E. coli разного происхождения используют для определения санитарного состояния объекта, так как только обнаружение E. coli теплокровных свидетельствует о санитарном неблагополучии.
На МПА кишечная палочка образует мутноватые, слегка выпуклые влажные колонии с ровным краем. На МПБ дает равномерное помутнение. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Для идентификации эшерихий используют дифференциально-диагностические среды: Эндо и агар с эозинметиленовым синим (ЭМС). На среде Эндо кишечная палочка растет в виде малиново-красных колоний с металлическим блеском или без него. На среде ЭМС – в виде темно-фиолетовых колоний.
Ферментативные свойства. E. coli обладают значительной ферментативной активностью. Расщепляют лактозу, глюкозу, маннит, мальтозу, сахарозу и другие углеводы и спирты с образованием кислоты и газа. Лротеолитические свойства: образуют индол. Желатин не расщепляют. Отдельные биовары не ферментируют лактозу и сахарозу (табл. 29).
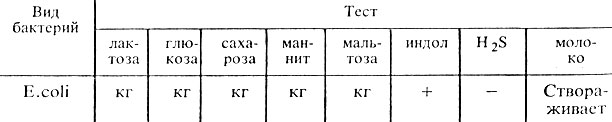
Таблица 29. Ферментативные свойства эшерихий
Примечание, кг – образование кислоты и газа; + наличие признака; – отсутствие признака.
Токсигенность. Эшерихий обладают эндотоксином (лиггополисахарид).
Антигенная структура. Эшерихий различаются по антигенной структуре микробной клетки, что положено в основу классификации бактерий этого рода. Различают три типа антигенов эшерихий: О-антиген (соматический), К-антиген (капсульный) и Н-антиген (жгутиковый). Термостабильный О-антиген является липополисахариднопротеиновым комплексом и расположен в клеточной стенке бактерий. О-антиген определяет принадлежность культуры к серологической группе. Описано более 170 таких групп. Некоторые компоненты О-антигена являются общими для разных О-групп эшерихий, а иногда и других энтеробактерий (шигелл, сальмонелл и др.). К-антигены эшерихий различны: А, В, L и М. Антигены А и М – термостабильны, В и L – термолабильны. К-антиген расположен в микробной клетке более поверхностно, чем О-антиген, и поэтому в его присутствии реакция агглютинации живой культуры с О-сывороткой не происходит. Для выявления О-антигена культуру прогревают в течение часа при 100° С: К-антиген при прогревании разрушается, а О-антиген становится способным вступать во взаимодействие с сывороткой. Установлено, что у эшерихий имеется около 100 типов К-антигенов, в основном типа В-антигенов (термолабильных). Н-антиген имеется только у подвижных штаммов, так как он связан с жгутиками. У эшерихий известно более 50 типов Н-антигена. Определение Н-антигена позволяет установить серовариант выделенной культуры (рис. 40).
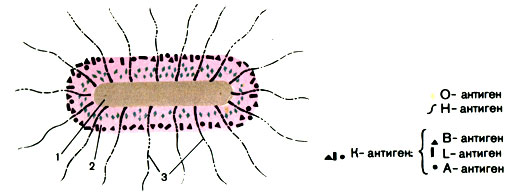
Рис. 40. Антигенная структура энтеропатогенной кишечной палочки. 1 – цитоплазма; 2 – клеточная стенка; 3 – жгутики
Характеристику антигенного состава выделенной культуры эшерихий дают на основании результатов реакции агглютинации с сыворотками, содержащими О-, К- и Н-антитела. При этом определяют, какие антигены имеются в культуре, а их сочетание характеризует антигенную формулу выделенной культуры, т. е. ее серовариант. В табл.30 представлены примеры антигенной структуры некоторых серовариантов E. coli, у которых К-антигены являются В-антигенами.
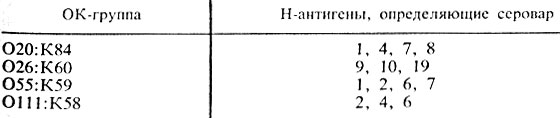
Таблица 30. Антигенная структура эшерихий
Если культура агглютинируется ОК-сывороткой ОП1:К58 (В4) и Н-сывороткой “6”, то значит выделен серовариант E. coli О111:В4:Н6; если отмечена реакция агглютинации с ОК-сывороткой О26:К60 (В6) и с Н-сывороткой “11” – выделена культура E. coli 026:В6:Н11 и т. п.
Кроме определения сероварианта E. coli, можно определить и фаговар выделенной культуры. Имеются наборы бактериофагов, которые лизируют эшерихии отдельных серогрупп. По лизису культуры одним из фагов устанавливают ее фаговар. Определение фаговаров имеет эпидемиологическое значение.
Антагонистическое действие E. coli, их способность подавлять рост гнилостных и патогенных бактерий используют для создания бактерийных препаратов для лечения дисбактериоза и различных заболеваний кишечника (колибактерин, бификол).
Устойчивость к факторам окружающей среды. E. coli довольно устойчивы. При 55° С они погибают в течение часа, при 60° С – за 15 мин. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Восприимчивость животных. Эшерихии отдельных серогрупп патогенны для различных животных и вызывают у них заболевания желудочно-кишечного тракта. Из лабораторных животных наиболее чувствительны к E. coli морские свинки, кролики, белые мыши. В зависимости от способа введения культура кишечной палочки вызывает различные патологические процессы: воспаление и абсцесс при подкожных инъекциях, перитонит и сепсис – при внутрибрюшинном и внутривенном введении.
Источники инфекции. Больной человек. При этом бактерии проникают в организм из внешней среды (экзогенная инфекция). Кишечная палочка может также вызвать развитие патологического процесса “изнутри” (эндогенная инфекция).
Пути передачи. Основной путь передачи при экзогенной форме инфекции – контактно-бытовой (непрямой контакт). Возбудители могут быть перенесены на грязных руках, через посуду, игрушки, белье, пищу, мух.
Патогенез. Заболевания, вызываемые эшерихиями, называют эшерихиозами. Развитие эшерихиозов зависит от пути внедрения возбудителя в организм и от серогруппы, к которой принадлежит возбудитель. При проникновении бактерий через рот могут возникнуть кишечные заболевания детей и взрослых. Некоторые О-группы эшерихии (серовары) наиболее часто являются возбудителями заболеваний человека. Такие бактерии называют энтеропатогенными кишечными палочками (ЭПКП). В настоящее время известно много вариантов ЭПКП, обусловливающих разное течение эшерихиозов. Различают несколько групп ЭКПК:
группа I – возбудители колиэнтерита у детей раннего возраста (серогруппы О111, О26, О55, О86 и др.);
группа II – возбудители дизентериеподобных заболеваний у детей и взрослых (О25, О124, О143, О144 и др.);
группа III – возбудители холероподобных заболеваний (О1, О5, О6, О78 и др.).
Попадая в пищевые продукты, кишечная палочка может в них размножаться. Употребление в пищу таких продуктов ведет к развитию пищевой токсикоинфекции.
Развитие эндогенной инфекции приводит к поражению различных органов: воспалению желчного пузыря (холецистит), мочевого пузыря (цистит), заражению крови (сепсис) и др.
Иммунитет. Иммунитет вырабатывается только в отношении одного сероварианта эшерихии – возбудителя данного заболевания. Многообразие эшерихии делает практически этот иммунитет недейственным. В развитии иммунного состояния при заболевании детей большое значение имеет образование IgM-антител, которые не проходят через плаценту, а значит не передаются от матери. IgA-антитела к эшерихиям передаются ребенку от матери с грудным молоком.
Профилактика. Соблюдение личной гигиены и санитарно-гигиенического режима. Специфическая профилактика отсутствует.
Лечение. Антибиотики: ампициллин, тетрациклин и др. В настоящее время выпускают колипротейный фаг, использование которого дает хорошие результаты.
Контрольные вопросы
1. Каковы основные признаки бактерий семейства кишечных?
2. Какие антигены имеются у эшерихии?
3. Какие лечебные препараты готовят из кишечных палочек?
Микробиологическое исследование
Цель исследования: выделение и идентификация ЭПКП.
Материал для исследования
1. Испражнения.
2. Рвотные массы.
При необходимости исследует отделяемое из носа и зева, гной из уха, кровь, мочу, кусочки органов трупа.
При возникновении очага заболеваний коли-энтеритом исследуют (по эпидемиологическим показаниям) пищевые продукты, смывы с рук обслуживающего персонала, игрушек и других предметов.
Способы сбора материала

Способы сбора материала
Примечание. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя.
Основной метод исследования
Бактериологический
Ход исследования
Первый день исследования

Первый день исследования
Второй день исследования
Вынимают из термостата засеянные накануне чашки и просматривают их в падающем или проходящем свете. При наличии малиново-красных колоний на среде Эндо (с металлическим блеском или без него) или фиолетовых на среде ЭМС ставят пробную реакцию агглютинации на стекле для дифференциации ЭПКП от других разновидностей эшерихий.
Для постановки пробной реакции агглютинации отбирают не менее 10 изолированных колоний, отмечая или нумеруя их на обратной стороне чашки; часть каждой намеченной колонии снимают петлей и агглютинируют в капле поливалентной сыворотки или иммуноглобулина. Испытывают только часть колонии, чтобы в случае положительной реакции агглютинации можно было из оставшейся части колонии выделить чистую культуру.
Типовые или поливалентные эшерихиозные сыворотки (или иммуноглобулины) изготовляют в производственных условиях. Поливалентные эшерихиозные ОК-сыворотки (или ОК-иммуноглобулины) содержат антитела к нескольким О- и К-антигенам эшерихий. С их помощью ориентировочно определяют принадлежность выделенной культуры к ЭПКП. Например, поливалентная сыворотка О26, О55, О111 позволяет выявить одноименные культуры эшерихий. Сыворотки разводят согласно указанию на этикетке.
В лаборатории можно приготовить смесь отдельных ОК-сывороток, соединяя не более 5 сывороток, чтобы разведение каждой было не выше 1:10.
Постановка пробной реакции агглютинации. На одно или два хорошо обезжиренных предметных стекла наносят 10 капель поливалентной сыворотки (или иммуноглобулина). В каждую каплю вносят часть намеченной колонии и растирают ее. Колонии, давшие реакцию агглютинации, отсевают в пробирки со скошенным агаром и ставят в термостат на 18-20 ч. Если ни одна из 10 колоний не дала реакции агглютинации, дают отрицательный ответ.
Третий день исследования
Вынимают из термостата посевы и просматривают их. На МПА энтеропатогенные кишечные палочки образуют обычно влажный, блестящий, сероватый налет, реже он бывает мутным. Выросшую на скошенном агаре культуру проверяют повторно в реакции агглютинации на стекле с поливалентными эшерихиозными сыворотками (или иммуноглобулинами). Если выделенная культура дает реакцию агглютинации с поливалентной сывороткой (иммуноглобулином), то ее агглютинируют с каждой типовой сывороткой (иммуноглобулином) раздельно в разведении 1:5 – 1:10. Агглютинация с живой культурой имеет ориентировочное значение.
Далее необходимо подтвердить принадлежность выделенной культуры к роду Эшерихия биологическими тестами. Для этого производят посев культуры на полужидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой и другими сахарами, а также на бульон или пептонную воду для определения образования индола и сероводорода. Для этого в пробирки под пробку опускают две индикаторные бумажки, смоченные реактивами, выявляющими образование этих веществ. Одна бумажка при наличии индола краснеет, другая при наличии сероводорода чернеет.
При ферментации Сахаров реакция среды становится кислой и цвет индикатора изменяется. Если, помимо кислоты, образуется газ, в среде появляются пузырьки. Одновременно определяют подвижность бактерий: делают посев в полужидкий (0,2%) агар уколом. Подвижные бактерии дают помутнение всей среды, неподвижные – растут только по уколу.
Для окончательной идентификации выделенной культуры ставят развернутую реакцию агглютинации с живой и гретой культурами: с живой – для определения К-антигена, с гретой – для определения О-антигена. Для постановки развернутой реакции агглютинации антиген готовят следующим образом: 3-5 мл изотонического раствора натрия хлорида смывают культуру со скошенного агара. Полученную суспензию разливают в две пробирки. Одну из них прогревают на водяной бане при 100° С в течение часа.
Развернутую реакцию агглютинации ставят в двух рядах пробирок. Сыворотку в обоих рядах разводят в соотношении 1:50 – 1:100 (в 1-й пробирке) до титра, указанного на этикетке ампулы с сывороткой. В первый ряд добавляют по 2 капли живой культуры, во второй – по 2 капли гретой культуры.
Пробирки встряхивают и помещают в термостат на 18-24 ч.
Четвертый день исследования
Производят учет изменений сред Гисса, регистрируют образование индола и сероводорода.
Большинство представителей эшерихий ферментирует углеводы с образованием кислоты и газа, расщепляет белковый питательный субстрат до образования индола.
Учет пробирочной реакции агглютинации проводят при помощи лупы или агглютиноскопа. Агглютинация с живой культурой крупнохлопчатая, с убитой – мелкозернистая. Реакцию считают положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а живая культура агглютинируется сывороткой, разведенной не менее чем 1:200. Играет роль и соотношение антител к гретой и живой культуре. Разведение сыворотки, в котором отмечается агглютинация с гретой культурой, должно превышать разведение сыворотки, в котором агглютинируется живая культура, не менее чем в 2 раза. В табл. 31 приведены различные варианты результата реакции агглютинации.
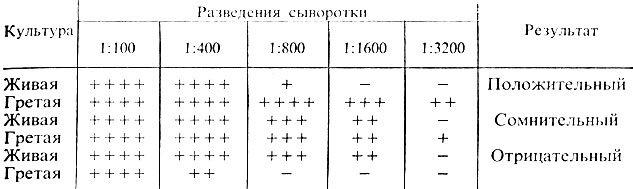
Таблица 31. Результаты реакции агглютинации с культурами эшерихий
Примечание. Возможны три варианта реакции: 1) гретая культура агглютинируется сывороткой в больших разведениях, чем живая, реакция – положительная; 2) живая и гретая культура дают агглютинацию в одинаковых разведениях сыворотки. Такой результат может свидетельствовать об отсутствии в культуре К-антигена; агглютинация живой и гретой культур вызвана О-антигеном. В этих случаях необходима повторная постановка реакции агглютинации; 3) агглютинация живой культуры при отсутствии агглютинации гретой позволяет дать отрицательный ответ. Очевидно, в культуре нет О-антигена, соответствующего O-антителам в сыворотке (рис. 41).
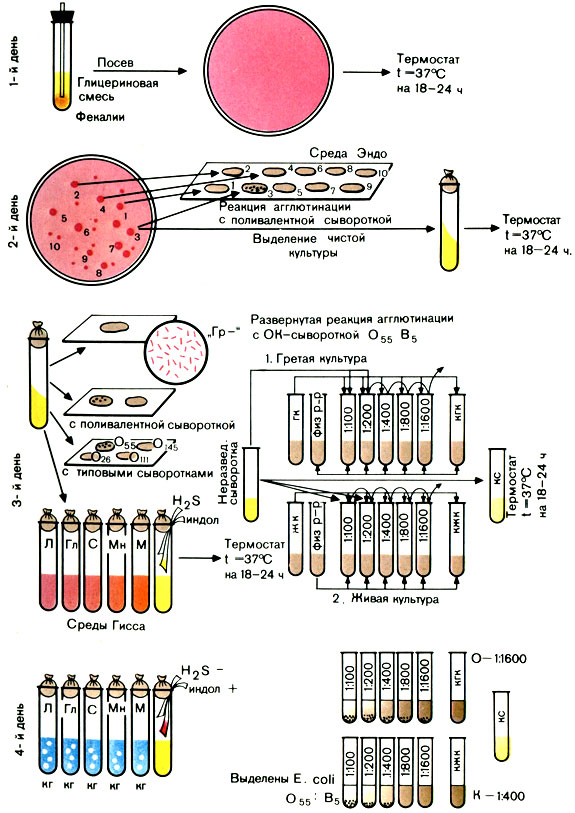
Рис. 41. Схема выделения и идентификации энтеропатогенных кишечных палочек
Контрольные вопросы
1. Какой материал исследуют для выделения эшерихий?
2. С помощью каких сывороток можно дифференцировать ЭПКП?
3. Для чего ставят развернутую реакцию агглютинации с живой и гретой культурами эшерихий?
Задание
1. Получите у преподавателя чашки Петри с засеянной на среде Эндо культурой и произведите пересев на пробирку со скошенным агаром.
2. Возьмите у преподавателя культуру ЭПКП на скошенном агаре, смойте изотоническим раствором натрия хлорида. Часть смыва прогрейте на водяной бане при 100° С. Разведите сыворотку в двух рядах пробирок и поставьте реакцию агглютинации описанным выше способом.
Питательные среды
Дифференциальные среды Эндо и ЭМС служат для выращивания кишечных бактерий. Выпускаются в виде сухого порошка. Согласно указаниям на этикетке отвешивают определенное количество сухой среды, растворяют в соответствующем количестве воды, кипятят, помешивая, и разливают в стерильные чашки Петри.
В вашей приватной жизни безотносительная пустота? Нет постоянной девушки? Они соблазнительные шлюхи будут всемерно благоприятны возможности удовлетворить ваши половые надобности смазливыми способами.
Источник