Инсулин вырабатываемый кишечной палочкой
Инсулин – это белок, который является гормоном поджелудочной железы. Действие инсулина в основном направлено на обмен углеводов и проявляется снижением уровня сахара в крови (гипогликемический эффект). Это происходит за счет того, что инсулин облегчает переход глюкозы в клетки органов и тканей, где стимулирует ее активирование путем образования глюкозо-6-фосфата.
Последний, окисляясь, обеспечивает клетки энергией. Таким образом, инсулин способствует периферическому окислению глюкозы. Наряду с этим инсулин тормозит распад гликогена в клетках печени. При этом снижаются процессы распада жиров и превращение аминокислот в глюкозу и происходит активирование синтеза жиров и белков.
При недостатке инсулина развивается тяжелое заболевание – диабет; при этом разрушается нормальный обмен веществ. Диабетики должны получать инсулин ежедневно, если этого не происходит, то развивается тяжелое состояние – диабетическая кома, и организм погибает. Потребность в инсулине огромна. Долгое время источником инсулина служили железы коров и свиней. Учитывая, что поджелудочная железа коровы весит 200-250 г, для получения 100 г кристаллического инсулина нужно 800-1000 кг исходного сырья. Понятно, что животный инсулин не мог обеспечить всех больных. Например, в 1979 г. из 60-ти млн больных диабетом во всем мире, только 4 млн получали препарат инсулина.
Инсулин построен из двух полипептидных цепей А и В длиной 20 и 30 аминокислот, последовательность которых была установлена Сэнгером в 1955 г. Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены тремя коллективами исследователей в Сша, Китае и ФРГ в 1963 и 1965 гг. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, который включает 170 химических реакций, оказалось трудно. Тем не менее в 1980 г. в Дании (компанией «Ново индастри») был разработан способ превращения инсулина свиньи в инсулин человека замещением остатка аланина, который является 30-й аминокислотой в цепи В на остаток треонина.
Это удалось достигнуть путем ферментативного замещения с последующей хроматографической очисткой продукта; в результате был получен однокомпонентный инсулин человека 99 %-й чистоты. Исследования двух однокомпонентных инсулинов (человеческого и свиного) показали, что они не различались по активности и по времени действия. В 1982 г. инсулин производили главным образом две компании «Эли Лилли» (85 % сбыта инсулина в США и патент на его производство с 1923 г.) и «Ново индастри» (47,5 % сбыта гормона в Европе).
В организме животного две полипептидные цепи инсулина исходно являются частями одной белковой молекулы длиной 109 аминокислот – препроинсулина. При синтезе препроинсулина в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для прохождения молекулы сквозь мембрану клетки; эти аминокислоты отщепляются, образуется проинсулин длиной 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный ее сегменты сближаются, а центральная часть молекулы удаляется с помощью ферментов.
Так образуется инсулин. Роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
Гилберт с сотрудниками выделили и-РНК из поджелудочной железы крысы, синтезировали ДНК-копию (комплементарная ДНК), которая была встроена в плазмиду E. coli в среднюю часть гена пенициллиназы (этот фермент в норме секретируется из клеток), и получили рекомбинантную плазмиду. Как показало определение последовательности ДНК, рекомбинантная плазмида содержала информацию о структуре проинсулина, но не препроинсулина.
При трансляции и-РНК в клетках кишечной палочки синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Далее отщепляли пенициллиназу и удаляли средний сегмент проинсулина действием трипсина. Позднее было показано, что полученные таким образом молекулы влияют на сахарный обмен, как гормон, выделенный из поджелудочной железы крысы.
В 1979 г. в США были синтезированы гены, кодирующие А и Б цепи инсулина. Далее каждый синтетический ген встраивали в плазмиду E. coli в конце гена -галактозидазы. После этого синтезированные полипептиды отщепляли от фермента, проводили их очистку и цепи соединяли in vitro для получения полной молекулы инсулина.
В клетках E. coli был также осуществлен биосинтез проинсулина, а не только отдельных ее цепей. Для этого на и-РНК проинсулина синтезировали ее ДНК-копию с помощью обратной транскриптазы (ДНК-полимераза). Этот способ имеет серьезное преимущество, поскольку различные этапы экстракции и выделения гормона сведены к минимуму. С помощью этого метода был получен высокий выход гормона -200 г на 1000 л культуральной жидкости (это эквивалентно количеству инсулина, выделенного из 1600 кг поджелудочной железы животных).
Исследователям из компании «Генентек» потребовалось 10 месяцев, чтобы в сентябре 1978 г. получить инсулин человека в специально сконструированном штамме кишечной палочки. Этот инсулин прошел самые серьезные и длительные испытания, которые показали, что он не вызывает никаких побочных явлений, как инсулин животных (у одного из каждых 20-ти больных инсулин животных вызывает аллергию; часто наблюдаются также расстройства почек и зрения ).
Кроме того, при длительном применении препарат не вызывал отрицательных иммунологических реакций.
Технология производства инсулина в бактериальных клетках имеет огромные преимущества перед получением инсулина из поджелудочной железы животных: не зависит от перебоев или количества сырья, конечный продукт всегда имеет одинаковый состав и степень чистоты.
В октябре 1982 г. был налажен выпуск «хемулина» (препарата синтетического инсулина человека) фирмой «Эли Лилли», которая затратила 100 млн долларов, чтобы начать поставку продукта на рынок.
Л.В. Тимощенко, М.В. Чубик
Опубликовал Константин Моканов
Источник
Кишечная палочка Esherichia coli, бактерия, известная
человечеству уже полтора века,
– обычнейший обитатель нашего кишечника. Она – излюбленный объект
исследований микробиологов, биохимиков и генетиков всего мира, и
не случайно именно Esherichia coli стала первым живым
генно-модифицированным организмом, появившимся на свет в 1973
году. В ее геном был встроен ген человека, кодирующий
синтез инсулина.

В настоящее время генетически модифицированные микроорганизмы
используются для производства фармацевтических препаратов,
вакцин, продуктов тонкого органического синтеза, пищевых добавок
и многого другого. Новые штаммы кишечной палочки уже не просто
производят инсулин: они стимулируют восстановление собственных
способностей организма пациента вырабатывать этот гормон. При
диабете первого типа бета-клетки поджелудочной железы утрачивают
способность синтезировать инсулин. Ученые Корнельского
университета (Итака, штат Нью-Йорк), работающие под руководством
Джона Марча (John March), решили попытаться восстановить
этот механизм с помощью сигнальной системы, используемой
выстилающими кишечник эпителиальными клетками и населяющими его
полезными бактериями. Созданный в лаборатории Марча штамм
непатогенной кишечной палочки синтезирует белок GLP-1 –
глюкагоноподобный пептид. В организме здорового человека этот
белок синтезируется клетками кишечника и, среди прочих эффектов,
запускает продукцию инсулина в поджелудочной железе. Авторы
продемонстрировали, что в лабораторных условиях в присутствии
глюкозы секретирующие GLP-1 бактерии запускают синтез инсулина в
культуре клеток кишечника человека. Механизмы, лежащие в основе
этого феномена, пока не ясны. Спектр применения – колоссальный, к
примеру, обычный йогурт, обогащенный такими бактериями, сможет
заменить больным диабетом инъекции инсулина! Кроме бактерий для
лечения диабета, группа Марча работает над созданием целого ряда
целебных штаммов микроорганизмов, в том числе предназначенных для
борьбы с кариесом, синтеза витаминов, лечения непереносимости
лактозы и профилактики холеры.

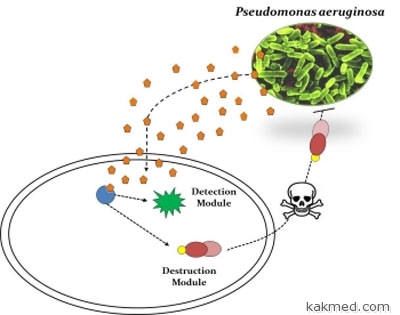
Стало известно о результатах исследования группы генетиков из
Массачусетского технологического института под руководством
профессора Рона Вайса (Ron Weiss), специалиста в области
синтетической биологии. В этом исследовании ученые пытаются
сделать кишечную палочку бактерией-охотником за одной из самых
опасных внутрибольничных инфекций – синегнойной палочкой
(Pseudomonas aeruginosa), олицетворяющей одну из главных проблем
современной медицины — резистентности патогенных микробов к
антибиотикам. Если пациенту в больнице внезапно становится плохо,
и антибиотики не помогают, то обычно главной причиной этого
оказывается именно “синегнойка” — агрессивный обитатель
хирургических отделений, виновник тысяч жертв. Ученые в
буквальном смысле «натравили» кишечную палочку на «синегнойку» –
модифицировали бактерию так, что она научилась «выслеживать» и
убивать клетки Pseudomonas, обитающие в ранах и абсцессах.
Esherichia coli находит клетки синегнойной палочки, что
называется, «по запаху». Дело в том, что клетки опасного патогена
общаются друг с другом внутри своей колонии с помощью различных
сигнальных веществ. Модифицированная E.Coli реагирует на это
вещество, связываясь с ним особым протеином, и, обнаружив
псевдомонаду, убивает ее с помощью яда, получившего название
бактериоцин. Попадая внутрь клетки синегнойной палочки, подвижной
и устойчивой к большинству антибиотиков, бактериоцин разрушает ее
ДНК. Рон Вайс и его коллеги показали, что генетически
модифицированная кишечная палочка в лабораторной жидкой культуре
убивает “синегнойку”, не причиняя вреда себе, а также другим
неопасным бактериям. Этот метод испытан пока лишь в лаборатории,
но ученые считают, что возможно сделать лечебный штамм кишечной
палочки в 20 раз сильнее опытного экземпляра. И тогда испытать на
млекопитающих, а также подумать о возможных лекарственных формах
пробиотиков.

Генно-модифицированные штаммы кишечной палочки ученые намерены
использовать и для решения одной из проблем века – ожирения. Как
показывают исследования, добавление в еду подопытным мышам
особого штамма E.Coli , в геном которой введен ген растения
резуховидки, помогает избавить от лишнего веса подопытных мышей.
Бактерии ориентированы на синтез особого вещества под названием
NAPE, которое организм млекопитающих превращает в гормон,
вырабатываемый в процессе переваривания пищи. Этот гормон
поступает через кровь в мозг и, сигнализируя о насыщении,
уменьшает аппетит. Получается, что бактерия заставляет мышей
думать, что они едят больше, чем на самом деле. В исследовании,
опубликованном в журнале The Journal of Clinical Investigation,
грызунов, которым добавляли бактерии в питьевую воду, и грызунов
из контрольной группы кормили высококалорийной пищей. У мышей,
которые употребляли бактерии, снизился аппетит, они перестали
набирать вес и начали показывать меньшую инсулиновую
устойчивость. Эффект сохранялся около четырех недель. Ученые
считают, что эти бактерии можно использовать в пробиотиках для
употребления людьми. Если препарат окажется действенным и
безопасным, то он даст большую фору существующим лекарствам
против ожирения.

Пробиотики, изготовленные с добавлением модифицированной кишечной
палочки, как считают ученые – это одно из лекарств будущего, ведь
для этой бактерии кишечник человека – естественное местом ее
обитания. Однако, несмотря на первые успехи, авторы отмечают, что
им еще предстоит ответить на несколько непростых вопросов.
Например, необходимо выяснить, насколько опасны подобные
вмешательства в естественную микрофлору кишечника, индивидуальную
для каждого человека.
Источник
Истечение сахара
Сахарный диабет известен человечеству тысячи лет. Его первыми заметными симптомами обычно бывают сильнейшая жажда и соответствующее ей увеличение объема мочи. Выглядит это так, словно вся жидкость, которую человек выпивает, тут же покидает его тело. Поэтому в древние времена считалось, что диабет — это невозможность удерживать жидкость в организме. Больные быстро худели, практически «высыхали», что, казалось бы, подтверждало гипотезу.
Позже было замечено, что моча таких больных привлекает больше насекомых, чем моча здорового человека. Оказалось, что это происходит благодаря содержанию в ней сахара. К термину diabetes («истечение») был добавлен эпитет mellītus («сладкий, медовый»), однако до понимания причин недуга было еще далеко. Единственным средством, которое тогда предлагалось больным, была полуголодная диета. На ней больные кое-как жили 3–4 года, а потом все равно погибали.
Доказательство «от противного»
Первый серьезный поворот в изучении диабета произошел в Германии в 1889 году. И произошел он случайно.
Физиолог Оскар Минковски, убежденный, что значение поджелудочной железы для пищеварения переоценено, решительно удалил ее у подопытной собаки. Он был уверен, что с животным ничего не случится. Однако через некоторое время ученый обнаружил тот самый феномен сладкой мочи, на которую слетались мухи: собака заболела сахарным диабетом. Внезапно стало ясно, что «антидиабетическое вещество» нужно искать именно в поджелудочной железе.
Эта железа нашего организма словно бы состоит из двух частей, функции которых различны. Одна часть — железистые ацинусы — выделяет в кишечник специальный секрет, участвующий в переваривании пищи. Другая сегодня известна миру под названием «островки Лангерганса» — именно там у здорового человека вырабатывается инсулин — гормон, регулирующий содержание сахара в крови.
В 1900 году русский ученый Леонид Соболев сумел выяснить, что если разрушить только железистую часть органа, диабет у подопытных животных не возникает. При этом вскрытия, которые проводились после смерти больных диабетом, почти всегда показывали поражение островков Лангерганса.
Из этих двух фактов Соболев сделал вывод о том, что средство от диабета надо искать именно в островковой части железы. Он же первым предложил использовать для этого поджелудочные железы новорожденных животных и описал методы выделения «антидиабетического вещества».
От теории — к практике
Реализовать теоретическую разработку Соболева на практике удалось ученым, работавшим в Университете Торонто. Фредерик Бантинг и Чарльз Бест хирургическим путем разрушили «пищеварительную» часть поджелудочной железы собаки, после чего из оставшейся островковой части получили некое вещество, названное «айлетин». У собак с искусственно вызванным сахарным диабетом айлетин снижал уровень сахара в моче и в крови.
Читайте также:
Предиабет
Прежде чем переходить к опытам с участием людей, необходимо было научиться очищать айлетин от примесей — первоначально это был фактически экстракт поджелудочной железы животных. Эта задача была решена биохимиком Джеймсом Коллипом, а очищенный белок назвали «инсулин» (от лат. insula — «островок»).
Первая в мире инъекция инсулина человеку, больному сахарным диабетом, была сделана в 1922 году. Однако опыт оказался не совсем удачным — из-за недостаточной очистки инсулина у 14-летнего Леонарда Томпсона развилась сильная аллергическая реакция. Коллип утроил свои усилия по очистке белка, и уже через 12 дней инъекцию повторили. На этот раз успех был полным: уровень сахара в крови Леонарда снизился, и мальчик сам заметил, что чувствует себя гораздо лучше.
Везучее человечество
«Как же так? — скажет любой человек, не прогуливавший в школе биологию. — Ведь белок, полученный из организма другого биологического вида, должен вызвать аллергию у человека, будь он хоть сто раз очищен?».
Это правда — и в этом суть аллергических реакций: иммунная система распознает «чужаков» и реагирует на них быстро и безжалостно. Однако человечеству удивительно, невероятно повезло. Случайный каприз эволюции: инсулины млекопитающих оказались по строению похожи как близнецы.
Эксперименты показали, что ближе всего к человеческому строение свиного инсулина. Именно он, выделяемый из поджелудочных желез новорожденных поросят, и использовался до 80-х годов прошлого века.
Генномодифицированные организмы
Среди везучего человечества попадались отдельные невезучие диабетики, иммунная система которых была особенно бдительна. У таких людей возникала аллергия на жизненно необходимый им свиной инсулин.
Задача синтеза «инсулина, идентичного натуральному» не теряла своей актуальности. В 1978 году генетик Артур Риггс и биохимик Кэйити Итакура, работавшие в исследовательском институте Бекмана в Калифорнии, сумели ее разрешить. В геном обычной кишечной палочки ввели человеческий ген, «заставляющий» бактерию синтезировать инсулин. Получившийся белок оказался и лучше, и в производстве дешевле свиного. Однако и свиной инсулин пока не ушел в прошлое: его молекулу научились изменять таким образом, что она становится идентичной человеческой.
Но даже после этого биохимики не успокоились. Научившись делать человеческий инсулин, ничем не отличающийся от природного, они захотели добавить ему уникальных свойств. Итогом стали две группы препаратов, получившие название «аналоги инсулина человека».
Первая группа улучшает и ускоряет усвоение принятой пищи, а вторая — нормализует уровень сахара в крови между приемами пищи. Эти лекарства вместе с синтетическими и полусинтетическими инсулинами различной длительности действия составляют «арсенал» современных диабетологов, позволяющий подбирать индивидуальную коррекцию для каждого больного.
Лидия Куликова
Фото istockphoto.com
Источник
Кишечная палочка Esherichia coli, бактерия, известная человечеству уже полтора века – обычнейший обитатель нашего кишечника. Она – излюбленный объект исследований микробиологов, биохимиков и генетиков всего мира, и не случайно именно Esherichia coli стала первым живым генно-модифицированным организмом, появившимся на свет в 1973 году. В ее геном был встроен ген человека, кодирующий синтез инсулина.
В настоящее время генетически модифицированные микроорганизмы используются для производства фармацевтических препаратов, вакцин, продуктов тонкого органического синтеза, пищевых добавок и многого другого. Новые штаммы кишечной палочки уже не просто производят инсулин: они стимулируют восстановление собственных способностей организма пациента вырабатывать этот гормон. При диабете первого типа бета-клетки поджелудочной железы утрачивают способность синтезировать инсулин. Ученые Корнельского университета (Итака, штат Нью-Йорк), работающие под руководством Джона Марча (John March), решили попытаться восстановить этот механизм с помощью сигнальной системы, используемой выстилающими кишечник эпителиальными клетками и населяющими его полезными бактериями. Созданный в лаборатории Марча штамм непатогенной кишечной палочки синтезирует белок GLP-1 – глюкагоноподобный пептид. В организме здорового человека этот белок синтезируется клетками кишечника и, среди прочих эффектов, запускает продукцию инсулина в поджелудочной железе. Авторы продемонстрировали, что в лабораторных условиях в присутствии глюкозы секретирующие GLP-1 бактерии запускают синтез инсулина в культуре клеток кишечника человека. Механизмы, лежащие в основе этого феномена, пока не ясны. Спектр применения – колоссальный, к примеру, обычный йогурт, обогащенный такими бактериями, сможет заменить больным диабетом инъекции инсулина! Кроме бактерий для лечения диабета, группа Марча работает над созданием целого ряда целебных штаммов микроорганизмов, в том числе предназначенных для борьбы с кариесом, синтеза витаминов, лечения непереносимости лактозы и профилактики холеры.
Генно-модифицированные штаммы кишечной палочки ученые намерены использовать и для решения одной из проблем века – ожирения. Как показывают исследования, добавление в еду подопытным мышам особого штамма E.Coli , в геном которой введен ген растения резуховидки, помогает избавить от лишнего веса подопытных мышей. Бактерии ориентированы на синтез особого вещества под названием NAPE, которое организм млекопитающих превращает в гормон, вырабатываемый в процессе переваривания пищи. Этот гормон поступает через кровь в мозг и, сигнализируя о насыщении, уменьшает аппетит. Получается, что бактерия заставляет мышей думать, что они едят больше, чем на самом деле. В исследовании, опубликованном в журнале The Journal of Clinical Investigation, грызунов, которым добавляли бактерии в питьевую воду, и грызунов из контрольной группы кормили высококалорийной пищей. У мышей, которые употребляли бактерии, снизился аппетит, они перестали набирать вес и начали показывать меньшую инсулиновую устойчивость. Эффект сохранялся около четырех недель. Ученые считают, что эти бактерии можно использовать в пробиотиках для употребления людьми. Если препарат окажется действенным и безопасным, то он даст большую фору существующим лекарствам против ожирения.
Пробиотики, изготовленные с добавлением модифицированной кишечной палочки, как считают ученые – это одно из лекарств будущего, ведь для этой бактерии кишечник человека – естественное местом ее обитания. Однако, несмотря на первые успехи, авторы отмечают, что им еще предстоит ответить на несколько непростых вопросов. Например, необходимо выяснить, насколько опасны подобные вмешательства в естественную микрофлору кишечника, индивидуальную для каждого человека.
Информация
Добавить в ЗАКЛАДКИ
| Поделиться: | ИнтерферонИнтерферон — белок, который синтезируется аирусзараженными клетками животных и человека и который препятствует заражению этих клеток другим вирусом.[ . ] Интерфероны — белки, синтезируемые клетками главным образом в ответ на заражение организма вирусами. Интерфероны характеризуются видовой специфичностью. Например, у человека установлены три группы интерферонов, продуцируемых различными клетками под контролем соответствующих генов. Интерес к интерферонам определяется тем, что их широко используют в клинической практике для лечения многих болезней человека, особенно вирусных.[ . ] У рыб доказано наличие интерферона. При вирусных инфекциях усиление его синтеза предшествует образованию специфических антител.[ . ] Наибольшие успехи в производстве различных веществ, в том числе лекарственных (инсулин, соматостатин, интерферон и др.), связаны с генетической инженерией, составляющей сейчас основу биотехнологии.[ . ] Установлено, например, что в кодировании яичного альбумина цыплят участвует несколько генов. Лейкоцитарный интерферон человека кодируется девятью неаллельными генами, а 8-кристаллин цыплят — двумя генами.[ . ] Препараты РНК, приготовленные из частично очищенных препаратов вируса, были активными как стимуляторы образования интерферона. Такая .активность исчезала при инкубации с панкреатической рибонуклеазой гв 0,03 М фосфатном буфере. Рибоиуклеаза не оказывала какого-либо определенного действия в 0,2 М растворе поваренной соли, что свидетельствует о том, что вирусная РНК, вероятно, является двухценочечной.[ . ] Соответствующая тепловая обработка спор штамма АТСС 14586 привела к образованию субштамма, в котором данный вирус не обнаруживался и который не обладал способностью индуцировать образование интерферона. Таким образом, этот субштамм был похож па другие свободные от вируса изоляты P. stoloniferum. Зараженный вирусом штамм рос медленнее, чем штаммы, свободные от вируса, или субштамм, освобожденный от вируса путем тепловой обработки. Колонии зараженного штамма отличались от незаражеиного тем, что росли медленнее, края их были неровными и для них были характерны различные оттенки зеленого цвета.[ . ] Генная инженерия оказалась очень перспективной для медицины, прежде всего, в создании новых технологий получения физиологически активных белков, используемых в качестве лекарств (инсулин, соматостатин, интерфероны, соматотропин и другие). Инсулин используют для лечения больных диабетом, который стоит на третьем месте (после болезней сердца и рака) по частоте вызываемых смертельных случаев. Мировая потребность инсулина составляет несколько десятков килограммов. Традиционно его получают из панкреатических желез свиней и коров, но гормоны этих животных слегка отличаются от инсулина человека. Инсулин свиней различается по одной аминокислоте, а коровий — по трем. Считают, что инсулин животных часто вызывает побочные эффекты. Хотя химический синтез инсулина осуществлен давно, но до сих пор промышленное производство гормона оставалось очень дорогим. Сейчас получают дешевый инсулин с помощью генно-инженерного метода путем химико-ферментативного синтеза гена инсулина с последующим введением этого гена в кишечную палочку, которая затем синтезирует гормон. Такой инсулин более «биологичен , т. к. химически идентичен инсулину, вырабатываемому клетками поджелудочной железы человека.[ . ] После этого другими исследователями было показано, что хеленин оказывает антивирусное действие, стимулируя •образование интерферона, и что действующим агентом является, по-видимому, двухцепочечная РНК. Вирусы, выделенные из двух видов Pénicillium, оказались серологически не родственными. Несмотря иа то что эти вирусные частицы обладают физическими и химическими свойствами мелкого полиэдрического вируса, о заражении ими культур здоровых грибов пока не сообщалось.[ . ] Бактерии брожения используются в биотехнологических производствах. Продукты брожения используются как источники пищи (в молочной промышленности) и топлива (биогаз из растительных остатков). Бактерии применяют в генетической инженерии, например, для биотехнологического получения инсулина, интерферона и других ценных лекарственных препаратов.[ . ] Маука сейчас владеет методами клонирования генов и конструирования на их основе плазмид, обеспечивающих встраивание генов в генном организме реципиента. Сейчас уже клонировано значительное число генов высших организмов, таких как гормон роста — соматотропип, гормон инсулина, лейкоцитарного интерферона, миозина и др.[ . ] Различные ингибиторы, идентифицированные более или менее определенно как белки, были обнаружены в здоровых растепиях-хозяевах, например выделены из листьев Nicoiiana tabacum [1980] и из Dianthus caryo])hyllus h [1375, 1370]. Внимание исследователей было привлечено физическим и химическим сходством между подобного рода факторами из гвоздики и птичьим интерфероном, полученным из клеток птиц, однако данных о том, что фактор, выделенный из гвоздики, играет какую-либо роль в возникновении устойчивости к вирусной инфекции у этого растения, пока не имеется [505].[ . ] Читайте также:
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания – обратитесь к врачу. |
Источник