Из энтодермы кишечной трубки
Регуляция специализации энтодермы при формировании желудочно-кишечного тракта у плодаРазвитие ЖКТ происходит в три этапа. Первый этап — первичная специализация энтодермы. Второй этап заключается в формировании и структурировании кишечной трубки, что определяет передне-заднюю ось эмбриона и границы между различными органами. На третьем этапе начинается образование органов, которые в процессе развития выходят за границы кишечной трубки, например печени и поджелудочной железы. В экспериментах на лабораторных животных установлены эволюционно консервативные группы генов, принимающих участие в специализации энтодермы, и ряд других генов, участвующих только в процессе развития ЖКТ позвоночных. Эпителий этого тракта формируется из энтодермы — одного из эмбриональных зародышевых листков, возникающих в процессе гаструляции. Исследования, проведенные на таких лабораторных организмах, как круглые черви (почвенные нематоды Caenorhabdilis elegans), плодовые мушки (род Drosophila), африканские шпорцевые лягушки (род Xenopus), аквариумные рыбки Danio rerio и лабораторные мыши, позволили установить некоторые основные молекулярные механизмы регуляции процесса развития энтодермы. Моделирование на лабораторных мышах, у которых был проведен нокаут определенных генов для исследования их функций, в настоящее время рассматривается в качестве основы для изучения таких заболеваний ЖКТ у человека, как стеноз привратника, различные атрезии, неперфорированный анус. Специализация энтодермы может быть прослежена на самых ранних стадиях развития эмбриона. В классических экспериментальных исследованиях продемонстрирована способность эксплантатов куриных эмбрионов еще до процесса гаструляции, в культуре, к развитию ЖКТ, что свидетельствует о четкой детерминации процесса уже на данном этапе эмбрионального развития. Энтодерма куриных эмбрионов, выделенная и помещенная в лабораторных условиях в культуру до формирования ЖКТ, характеризуется экспрессией молекулярных маркеров, которые должны в норме появиться in vivo, что свидетельствует о наличии феномена ранней специализации. Появляются доказательства в поддержку гипотезы, что отличительные особенности энтодермы обусловлены функциональной клеточной независимостью, однако для нормального развития органов необходимо тесное взаимодействие энтодермы и мезодермы. В настоящее время на многочисленных лабораторных организмах установлены целые группы генов, способствующих специализации энтодермы. Один класс генов кодирует факторы транскрипции, которые, в свою очередь, непосредственно активируют гены-мишени. Второй класс генов кодирует синтез сигнальных молекул, обеспечивающих процесс межклеточной кооперации. Как минимум несколько факторов транскрипции, участвующих в процессе специализации энтодермы, продолжают экспрессироваться в тканях ЖКТ в течение всего последующего его развития, например семейства генов Fox и факторов GATA (семейство факторов транскрипции, характеризующихся способностью связываться с фрагментом дезоксирибонуклеиновой кислоты (ДНК) и с GATA-последовательностью нуклеотидов). В регуляции развития ЖКТ принимают участие, действуя в строго определенное время в различных локусах, сигнальные пути, или механизмы передачи регуляторных стимулов внутри клетки через определенную цепь молекул-посредников, представители группы факторов роста — трансформирующие факторы роста b в том числе непосредственно трансформирующий фактор роста b (TGF-b), и белок морфогенеза костной ткани (BMP), а также сигнальные пути hedgehog (сигнальные системы млекопитающих, представленные тремя различными белками). Продемонстрировано, что фактор транскрипции Sox-17 играет крайне важную роль в развитии энтодермы у мышей на ранних этапах эмбриогенеза, однако роль Sox-17 в дальнейшем не установлена. В последнее время выявлено, что сигнальный путь Notch (рецепторзависимый латентный фактор транскрипции, локализованный в клеточной цитоплазме) также выполняет важную функцию в регуляции развития ЖКТ. До настоящего времени не удалось выяснить, существует ли «главный ген», запускающий формирование энтодермы и последующее развитие ЖКТ. При исследовании некоторых животных моделей установлены гены, присутствие которых является необходимым и в то же время достаточным условием для формирования энтодермы, например ген mixer у шпорцевых лягушек. Ген мышей mixl1 играет основную роль в дифференцировке эмбриональных клеток в энтодерму. У других лабораторных животных обнаружены гены, необходимые для обеспечения данного процесса, однако недостаточные для формирования полноценной энтодермы. В исследованиях на лабораторных животных установлены начальные этапы индукции образования энтодермы. Энтодерма у мышей формируется из передней части первичной полоски эпибласта. Ключевой регулятор ранних этапов развития энтодермы — nodal-лиганд факторов роста суперсемейства TGF-b. Nodal экспрессируется в расположенном в бластодерме организационном центре или в узелке первичной бороздки эмбриона мыши. В отсутствие экспрессии nodal эмбрионы мыши не способны к гаструляции или к формированию дифинитивной энтодермы. Аналогично у эмбрионов Danio rerio в отсутствие экспрессии гомологов nodal также не образуется энтодерма. Напротив, экспрессия функционально активных рецепторов к TGF-b способствует преобразованию эмбриональных клеток в энтодерму. Реализация сигнального пути TGF осуществляется посредством стабильного комплекса промежуточных белков Smad. Необходимым для развития энтодермы является белок Smad2, и нокаут этого белка приводит к нарушению формирования энтодермы задней кишки, а разные мутации в гене, кодирующем Smad2, вызывают различные аномалии передней/головной кишки. FoxA2 также играет важную роль в развитии энтодермы, являясь мишенью сигнального пути, запущенного фактором nodal через белок Smad2. Smad2 и Smad3 совместно регулируют процесс развития энтодермы у мышей, оказывая различное влияние на формирование передней кишки и задней кишки. Кроме того, сигнальная система Smad необходима для развития печени. Основную роль в формировании печени играет ген Hex, экспрессия которого отсутствует либо существенно снижена при нарушенной продукции белков Smad. Этапы развития желудочно-кишечного тракта у плода
Установлено, что энтодерма находится в тесном контакте с мезодермой на протяжении всего ЖКТ. В экспериментальных исследованиях, выполненных на культурах тканей, было показано, что формирование энтодермы и ее дифференцировка в отдельные органы представляет собой результат взаимодействия мезодермы и энтодермы. Раньше всего было показано, что для формирования переднезадней оси энтодермы мышей необходимо сигнальное воздействие мезодермы на энтодерму посредством фактора роста фибробластов (FGF). Другие члены семейства FGF и рецепторы к ним необходимы для формирования печени. Еще три семейства генов крайне необходимы в процессе взаимодействия мезодермы и энтодермы — гены, кодирующие факторы сигнальных путей hedgehog и BMP, гены box. У почвенной нематоды Caenorhabditis elegans для специализации клеток, из которых развивается кишечный эпителий, необходимы два гена, кодирующие факторы транскрипции GATA, в то время как фактор GATA у плодовых мушек рода Drosophila кодируется одним геном serpent, наличие которого нужно для дифференцировки кишечной энтодермы. В кишечнике позвоночных экспрессируются три фактора группы GATA. Предполагается, что в процессах пролиферации и дифференцировки кишечного эпителия факторы GATA4, -5 и -6 выполняют различные функции, однако их функциональное значение на ранних этапах развития кишечной трубки у млекопитающих пока не установлено. Помимо факторов GATA, представители семейства forkhead-related факторов (кодируемые генами Fox) и сигнального пути WNT/Tcf являются важными регуляторами развития энтодермы. У позвоночных важную роль в инициации формирования энтодермы играют представители суперсемейства TGF-b. Молекула цитоскелета ELF3 задействована в сигнальном пути через факторы TGF-P, а также необходима для развития энтодермы. В отсутствие гена, кодирующего ELF3, у мышей полностью отсутствует кишечная энтодерма. Многочисленные факторы транскрипции, первоначально считавшиеся специфическими для формирования печени, играют роль и в развитии кишечника. При изучении эмбрионов мыши было отмечено, что некоторые из факторов транскрипции имеют характерные паттерны экспрессии, что позволило предположить их участие в развитии кишечника. Например, нуклеарный печеночный фактор (HNF) 3b (сейчас известный как FoxA2) оказался важным элементом в процессе самых ранних этапов дифференцировки ЖКТ и продолжает экспрессироваться в производных энтодермы у взрослых. Гомозиготные мутанты с полным отсутствием HNF3b не способны к формированию первичной полоски, предшествующей образованию кишечной трубки и ряда других структур. HNF3b участвует в образовании передней и средней, но не задней кишки. Идентифицировано большое количество факторов семейства Fox, некоторые из которых характеризуются преимущественной или специфической экспрессией в кишечнике. Один из представителей данного семейства, Foxl1, в норме экспрессируется кишечной мезодермой и представляет собой основной медиатор взаимодействия между эпителием и мезенхимой. Отсутствие указанного фактора сопровождается патологической пролиферацией эпителиальных клеток и нарушением развития кишечника. Этот фактор действует через экспрессию протеогликанов, проявляющих себя как корецепторы к компонентам сигнального пути WNT, и таким образом активирует комплекс WNT/P-катенин, регулирующий пролиферацию клеток. Группа исследователей во главе с Zaret предложила модель, в которой факторы FoxA2 и GATA открывают ДНК в клетках энтодермы, обеспечивая ее доступность для последующего связывания с факторами транскрипции, регулирующими клеточно-специфические гены. Таким образом, вероятно, при развитии кишечника многочисленные представители семейства факторов Fox играют важную роль в этом сложном процессе, который окончательно не изучен. У мышей некоторые гены, гомологичные гену caudal у дрозофил, экспрессируются исключительно в кишечнике. Cdx-1, экспрессирующийся в кишечнике взрослых организмов, также широко экспрессируется в тканях развивающегося эмбриона. Другой ген, Cdx-2, экспрессируется в висцеральной энтодерме на ранних стадиях эмбрионального развития, но впоследствии его паттерн экспрессии ограничен исключительно кишечником. Чрезмерная экспрессия Cdx-2 приводит к дальнейшей дифференцировке популяции клеток кишечника, которые в норме должны оставаться недифференцированными. В то же время эктопическая экспрессия Cdx-2 в стенке желудка приводит к формированию ткани, аналогичной кишечнику. Cdx-2 представляет собой важный фактор дифференцировки кишечника, однако до настоящего времени его роль в формировании кишечной трубки на ранних стадиях эмбрионального развития точно не установлена.
– Также рекомендуем “Генетическая регуляция формирования кишечной трубки” Оглавление темы “Эмбриогенез желудочно-кишечного тракта”:
|
Источник
Формирование желудочно-кишечного тракта у плода – эмбриология, морфогенез
Жизнеспособность новорожденного определяется благополучным переходом от периода внутриутробного развития к неонатальному периоду жизни. Основной определяющий фактор в данном процессе — функциональная зрелость желудочно-кишечного тракта (ЖКТ), способная обеспечить адекватное питание. После рождения ребенка его ЖКТ адаптирован к всасыванию грудного молока и содержащихся в нем компонентов, обеспечивает выведение из организма чужеродных антигенов, патогенных микроорганизмов, а также некоторых ксенобиотиков, колонизацию кишечной микрофлорой и вместе с почками поддерживает необходимый водный баланс.
У доношенных новорожденных данные механизмы полностью сформированы и обеспечивают нормальный рост и развитие ребенка.
Большинство адаптивных механизмов к моменту рождения хорошо функционируют, однако окончательное становление некоторых (например, связывание и выведение билирубина и метаболизм лекарственных средств в печени) завершается лишь в начале неонатального периода. После рождения взаимодействие изначально стерильного ЖКТ с колонизирующими его микроорганизмами является основным этапом постнатального развития пищеварительной системы.
Сравнительно поздно после родов формируется структура и устанавливается функция пищеводного сфинктера, секреторная функция желудка — продукция кислоты и желудочная перистальтика, а также эндокринные факторы, всасывание в кишечнике глюкозы, витамина В12 и солей желчных кислот, образование и накопление желчных кислот, секреторная реакция в ответ на действия бактериальных токсинов. Экзокринная функция поджелудочной железы устанавливается ориентировочно через 6 мес после рождения. Эндокринная функция, выражающаяся в продукции инсулина, — в течение сравнительно длительного временного интервала.
Подробно морфогенез желудочно-кишечного тракта человека описан в фундаментальных руководствах, а развитие ЖКТ детально обсуждается в нескольких обзорах. В данной главе представлено подробное описание морфогенеза с акцентом на современных представлениях о молекулярных механизмах развития ЖКТ. Основные этапы структурного и функционального развития ЖКТ обобщены в таблице.
Этапы развития желудочно-кишечного тракта у плода
| Этап | Минимальный срок гестации |
| Гаструляция | 3-я неделя |
| Формирование первичной кишки; закладка печени и поджелудочной железы | 4-я неделя |
| Рост кишечной трубки | 7-я неделя |
| Образование кишечных ворсин | 8-я неделя |
| Погружение первичной кишки в брюшную полость | 10-я неделя |
| Завершение органогенеза | 12-я неделя |
| Появление обкладочных клеток желудка, формирование островков поджелудочной железы, секреция желчи, появление кишечных ферментов | 12-я неделя |
| Появление глотательных движений | 16—17-я недели |
| Функциональная зрелость | 36-я неделя |
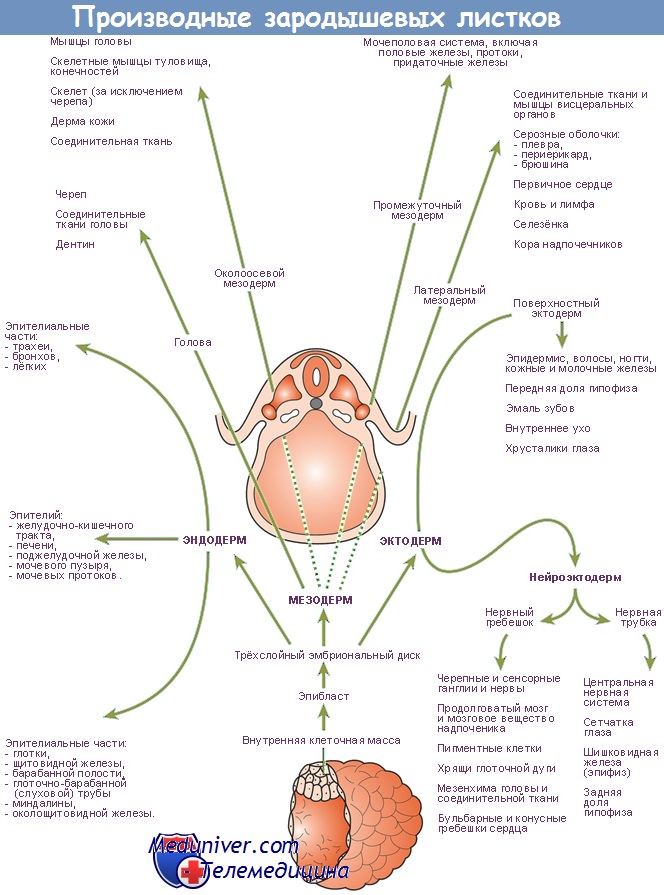
В процессе деления клеток из оплодотворенной яйцеклетки формируется бластоциста. Собственно эмбрион развивается из внутренней клеточной массы (компактного скопления клеток на одной из стенок бластоцисты). Впоследствии происходит разделение внутренней клеточной массы на два слоя — эпибласт и гипобласт, образующие двухслойный зародышевый диск, из которого развивается эмбрион. В начале 3-й недели беременности формируется первичная полоска, представляющая собой срединное углубление на поверхности эпибласта вблизи каудального отдела зародышевого диска. В процессе гаструляции клетки, расположенные вдоль первичной полоски, обособляются и мигрируют вглубь — в пространство между двумя зародышевыми листками.
Процесс гаструляции приводит к образованию клеток энтодермы, из которых в дальнейшем происходит формирование внутренней выстилки всего ЖКТ. Часть клеток, мигрируя из области первичной полоски, оттесняют нижний зародышевый листок (гипобласт) и формируют энтодерму. Именно в процессе гаструляции устанавливается двусторонняя симметрия эмбриона, а также образуются вентральная/дорсальная (передняя/задняя) и краниокаудальная оси эмбриона. Образование трех зародышевых листков сопровождается формированием скоплений однотипных клеток, из которых впоследствии, после каскада индукционных взаимодействий, происходит развитие органов эмбриона.
В настоящее время изучены молекулярные механизмы большинства перечисленных процессов.
Формирование кишечной трубки происходит в результате двух процессов — роста эмбриона и отделения зародышевой части от внезародышевой. Тканевые листки, сформировавшиеся в течение 3-й недели беременности, продолжают дифференцироваться, в результате образуются зачатки большинства систем органов. Формирование туловищных складок, разделяющих зародышевую и внезародышевую части, и поворот эмбриона — весьма сложные процессы, которые обусловлены разной скоростью роста различных участков эмбриона.
В результате этих процессов плоский зародышевый диск преобразуется в трехмерную структуру и головной, боковые и каудальный края зародышевого диска располагаются определенным образом относительно срединной вентральной линии. В дальнейшем слои энтодермы, мезодермы и эктодермы с противоположных сторон соединяются друг с другом, в результате образуется кишечная трубка.
Процесс формирования туловищных складок сначала приводит к закрытию кишечной трубки в области головного и каудального концов эмбриона. В переднем и заднем отделах развивающейся кишечной трубки образуются передние и задние кишечные ворота. Первоначально кишка состоит из слепо заканчивающихся краниальной и каудальной трубок, передней кишки и задней кишки, которые впоследствии будут разделены средней кишкой. Средняя кишка остается связанной с желточным мешком. По мере соединения боковых туловищных складок эмбриона вдоль срединной вентральной линии средняя кишка стремительно превращается в трубку.
Шейка желточного мешка подвергается обратному развитию, превращаясь в желточный канал. Иногда части данного канала не подвергаются обратному развитию и образуется дивертикул Меккеля.
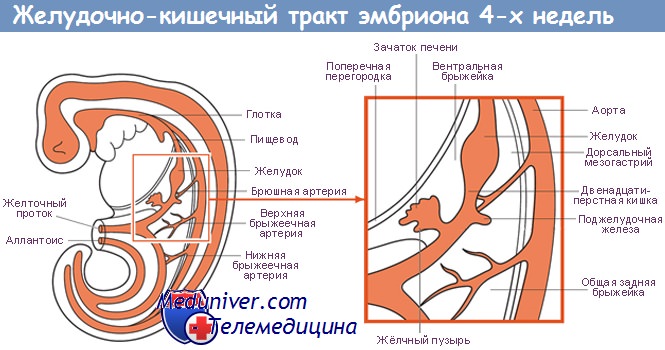
Ниже диафрагмы формируются три пары крупных кровеносных сосудов, которые должны обеспечить кровоснабжение развивающегося брюшного отдела кишечной трубки. Зоны кровоснабжения данных артериальных стволов составляют анатомическую основу разделения брюшного отдела ЖКТ на переднюю, среднюю и заднюю кишку. Первая артерия — чревная артерия, или чревный ствол. В результате развития указанного сосуда формируются артериальные ветви, кровоснабжающие переднюю кишку на протяжении от брюшного отдела пищевода до нисходящего сегмента двенадцатиперстной кишки, а также печень, желчный пузырь и поджелудочную железу.
Развитие печени, желчного пузыря и поджелудочной железы также происходит из передней кишки. За счет верхней брыжеечной артерии осуществляется кровоснабжение развивающейся средней кишки — от нисходящего отдела двенадцатиперстной кишки до поперечной ободочной кишки. Нижняя брыжеечная артерия участвует в кровоснабжении задней кишки — конечного отдела поперечной ободочной кишки, нисходящей, сигмовидной и прямой кишки. Отдельно формирующийся нижний отдел аноректального канала кровоснабжается за счет ветвей подвздошных артерий.
В начале 4-й недели гестации каудальный отдел передней кишки, расположенный непосредственно за диафрагмой, слегка расширяется и начинает формироваться желудок. В области указанного веретенообразного расширения обращенная кзади стенка передней кишки растет быстрее, чем передняя стенка, вследствие чего в течение 5-й недели происходит образование большой кривизны желудка. Дно желудка формируется за счет продолжающегося характерного выпячивания верхнего отдела большой кривизны желудка. В течение 7-й и 8-й недель гестации происходит поворот формирующегося желудка вокруг продольной оси эмбриона на 90°.
В результате образуются своеобразная левая сторона вентральной поверхности и правая сторона дорсальной поверхности желудка. Передняя поверхность желудка у взрослых иннервируется левым, а задняя — правым блуждающим нервом. Впоследствии дополнительный поворот желудка вдоль переднезадней оси приводит к тому, что большая кривизна желудка слегка смещается в каудальном направлении, а малая кривизна обращена в сторону головы эмбриона.
Около 3-й недели гестации кишка представляет собой относительно прямую трубку, разделенную на три части: переднюю кишку, из которой впоследствии развиваются глотка, пищевод, желудок и начальные отделы двенадцатиперстной кишки; среднюю кишку, сообщающуюся по передней поверхности с желточным мешком, впоследствии дающую начало оставшейся части двенадцатиперстной, тонкой и начальным отделам толстой кишки; заднюю кишку в дальнейшем преобразующуюся в дистальные отделы толстой и прямую кишку. Зачатки печени и поджелудочной железы формируются на границе передней и средней кишки.
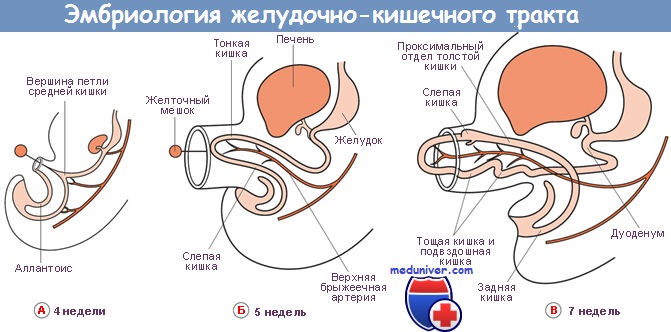
Быстрый рост средней кишки приводит к ее удлинению и повороту. К 5 нед гестации кишка вытягивается и начинает образовывать петлю, которая выпячивается вместе с пупочным канатиком. Вскоре после этого вентральный зачаток поджелудочной железы поворачивается и сливается с дорсальным зачатком. В 7 нед образовавшаяся тонкая кишка начинает свой поворот вокруг оси, образованной верхней брыжеечной артерией. Поворот осуществляется против часовой стрелки (если взглянуть на эмбрион со стороны передней поверхности) примерно на 90°. Начиная с 9 нед дальнейший рост кишечной трубки приводит к грыжевому выпячиванию в области пупочного кольца.
Средняя кишка продолжает свой поворот и удлинение, вследствие чего вновь погружается в брюшную полость. Примерно к 10 нед гестации угол поворота кишки достигает 180°. Примерно к 11 нед процесс поворота продолжается еще на 90°, достигая в целом величины 270°, после чего и происходит погружение кишки в брюшную полость. Данный феномен обусловлен не только процессами роста кишки, но и регрессией первичной почки и замедлением темпов роста печени. Механизм процесса обратного погружения тонкой кишки в брюшную полость окончательно не изучен, однако он происходит весьма быстро. Первой погружается тощая кишка и занимает левую половину брюшной полости.
Подвздошная кишка при погружении располагается в правой половине брюшной полости. В последнюю очередь происходит погружение начальных отделов толстой кишки. Слепая кишка фиксируется вблизи гребня подвздошной кости, а восходящая и поперечная ободочная кишки располагаются в брюшной полости косо — в направлении селезеночного угла. Дальнейшее развитие толстой кишки приводит к ее удлинению и образованию печеночного угла и собственно поперечной ободочной кишки. Упорядочение органов в брюшной полости завершается после фиксации восходящей ободочной кишки в области правого бокового кармана. Этот феномен представляет собой основу для формирования сложной иннервации и кровоснабжения органов ЖКТ у взрослых. Основные этапы данного процесса завершаются к 12 нед гестации.
Клоака служит основой для формирования прямой кишки и мочеполового синуса. На ранних стадиях эмбриогенеза происходит выпячивание конечного отдела задней кишки, приводящее к образованию клоаки. В период между 4-й и 6-й неделями гестации за счет развития уроректальной перегородки клоака разделяется на задний отдел (прямую кишку) и передний отдел (первичный мочеполовой синус). Соответственно, верхний и нижний отделы аноректального канала имеют различное эмбриональное происхождение. Первичная мембрана клоаки за счет уроректальной перегородки разделяется на переднюю (мочеполовую мембрану) и заднюю (заднепроходную мембрану). Заднепроходная мембрана разделяет отделы аноректального канала, формирующиеся из энтодермы и эктодермы.
Изначальное положение заднепроходной мембраны, которая вскрывается в течение 8-й недели гестации, соответствует у взрослых гребешковой линии. Конечные отделы задней кишки дают начало верхним 2/3 аноректального канала, в то время как инвагинация эктодермы или проктодеум составляют основу для нижней трети данного канала. Некоторые структурные аномалии, например неперфорированный задний проход, возникают вследствие нарушений описанного процесса. Гребешковая линия также представляет собой границу бассейнов кровоснабжения верхнего и нижнего сегментов аноректального канала. Верхние (по отношению к гребешковой линии) отделы аноректального канала кровоснабжаются за счет ветвей нижней брыжеечной артерии, а венозный дренаж осуществляется за счет вен задней кишки.
Сегмент, расположенный ниже гребешковой линии, кровоснабжается за счет ветвей внутренних подвздошных артерий и вен. Иннервация аноректального канала также отражает различное эмбриональное происхождение его верхнего и нижнего отделов: верхний отдел иннервируется нижним брыжеечным ганглием и тазовыми чревными нервами, нижний отдел — ветвями нижнего прямокишечного нерва.
Печеночный дивертикул изначально появляется в виде небольшой почки каудального отдела передней кишки. В процессе эмбриогенеза спецификация печени, желчных протоков и поджелудочной железы происходит по упорядоченной схеме. Печень, желчный пузырь, поджелудочная железа и система протоков развиваются из энтодермальных дивертикулов, отпочковывающихся от двенадцатиперстной кишки в период с 4-й по 6-ю неделю гестации.
Примерно на 30-й день эмбрионального развития поджелудочная железа представлена двумя закладками — дорсальной (задней) и вентральной (передней), происходящими из энтодермы с противоположных сторон двенадцатиперстной кишки. Дорсальная закладка растет быстрее. При этом вентральная закладка растет в направлении от двенадцатиперстной кишки вдоль развивающегося общего желчного протока. Вследствие того что рост двенадцатиперстной кишки в различных отделах неодинаков, происходит вращение кишки, в результате которого передняя закладка поджелудочной железы перемещается кзади и прилегает к задней закладке в области дорсальной брыжейки двенадцатиперстной кишки.
Объединение двух закладок происходит на сроке гестации около 7 нед. Головка и крючковидный отросток дефинитивной поджелудочной железы развиваются из передней закладки, в то время как оставшаяся часть тела и хвост берут начало из задней закладки. Впоследствии выносящие протоки обеих закладок сливаются вместе и образуют вирсунгов проток. Впрочем, проксимальный отдел протока задней поджелудочной железы обычно сохраняется в виде добавочного санториниева протока. Такие структурные аномалии, как кольцевидная поджелудочная железа, возникают вследствие нарушений процесса формирования поджелудочной железы.
Превертебральные симпатические ганглии развиваются возле мест отхождения основных ветвей нисходящей аорты. Постганглионарные симпатические аксоны ганглиев растут в периферическом направлении вдоль артериальных стволов и иннервируют те же ткани, которые кровоснабжаются данными сосудами. Постганглионарные волокна чревного ганглия иннервируют отделы ЖКТ, развивающиеся из дис-тального сегмента передней кишки — от брюшного отдела пищевода до уровня устья желчного протока в двенадцатиперстной кишке. Волокна верхнего брыжеечного ганглия участвуют в иннервации производных средней кишки (оставшегося сегмента двенадцатиперстной кишки), тощей кишки, подвздошной кишки, отделов толстой кишки (восходящей ободочной кишки) и проксимальных 2/3 поперечной ободочной кишки. За счет нижнего брыжеечного ганглия иннервируются отделы, развивающиеся из задней кишки: дистальная треть поперечной ободочной кишки, нисходящая ободочная кишка, сигмовидная кишка и верхние 2/3 аноректального канала.
Блуждающий нерв и тазовые чревные нервы обеспечивают преганглионарную парасимпатическую иннервацию для ганглиев, расположенных непосредственно в стенках внутренних органов. В отличие от симпатических, парасимпатические ганглии закладываются в непосредственной близости от иннервируемых органов и характеризуются наличием только коротких постганглионарных волокон. Центральные нейроны парасимпатической нервной системы расположены в головном либо спинном мозге.
Преганглионарные парасимпатические нервные окончания, ассоциированные с X парой черепно-мозговых нервов, формируют блуждающий нерв, который участвует в иннервации органов брюшной полости: в ней нервные окончания парасимпатических ганглиев переключаются на органы-мишени, включая печень и отделы ЖКТ проксимальнее толстой кишки. Преганглионарные парасимпатические нервные окончания, берущие свое начало в спинном мозге, формируют тазовые чревные нервы, взаимодействующие с ганглиями, расположенными в стенках нисходящей ободочной, сигмовидной и прямой кишки. Клетки нервного гребня, которые с 7-й недели гестации мигрируют в развивающиеся отделы ЖКТ, образуют основную часть энтеральной нервной системы. Генетически обусловленные нарушения данного процесса приводят к развитию болезни Гиршпрунга.
Учебное видео по развитию желудочно-кишечного тракта (эмбриогенезу)
– Также рекомендуем “Регуляция специализации энтодермы при формировании желудочно-кишечного тракта у плода”
Оглавление темы “Эмбриогенез желудочно-кишечного тракта”:
- Формирование желудочно-кишечного тракта у плода – эмбриология, морфогенез
- Регуляция специализации энтодермы при формировании желудочно-кишечного тракта у плода
- Генетическая регуляция формирования кишечной трубки
- Генетическая регуляция формирования органов желудочно-кишечного тракта
- Формирование пищевода у плода – эмбриогенез, морфогенез
- Формирование желудка у плода – эмбриогенез, морфогенез
- Формирование печени у плода – эмбриогенез, морфогенез
- Формирование поджелудочной железы у плода – эмбриогенез, морфогенез
- Формирование тонкой кишки у плода – эмбриогенез, морфогенез
- Дифференциация стволовых клеток тонкой кишки – эмбриогенез, морфогенез
Источник