Эпидуральная блокада при кишечной непроходимости
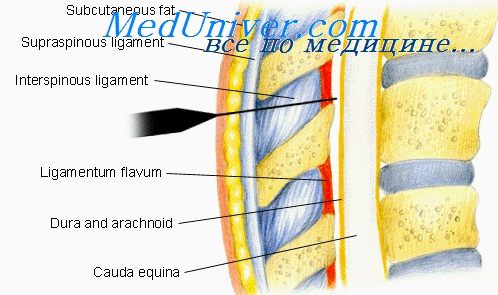
Эпидуральная блокада — это эффективный и оперативный метод купирования сильных болевых ощущений, которые возникают при различных заболеваниях позвоночника. Одна из разновидностей местной анестезии.
Содержание статьи:
- Показания для проведения эпидуральной блокады позвоночника
- Методика проведения эпидуральной блокады
- Противопоказания к эпидуральной блокаде
- Осложнения после эпидуральной блокады позвоночника
Основная цель эпидуральной блокады позвоночника — снять болевой синдром и устранить чувствительность в области воздействия. После процедуры специалисты также наблюдают у пациента незначительное расслабление мышц и устранение излишнего напряжения в них. Основан механизм данной манипуляции на быстром проникновении в субарахноидальное пространство лекарственных веществ через дуральные муфты, что способствует формированию блокады и непроходимости импульсов в спинной мозг по корешковым нервам. Введение препаратов осуществляют в эпидуральную зону с помощью катетера.
Если в шприце во время эпидуральной блокады наблюдается кровь, тогда следует поменять направление иглы. В дальнейшем контроль за положением иглы осуществляют за счет аспирации шприца. При отсутствии крови после проникновения процедуру можно продолжать. Вводят лекарственные средства медленно, их объем не должен превышать 60 мл (допустимая минимальная норма — 30 мл).
В состав вещества для эпидуральной блокады входят:
- опиаты (бупренорфин, фентанил, промедол, морфин);
- анестетики (лидокаин, ропивакаин, бупивакаин);
- витамины группы В;
- кортизон либо гидрокортизон;
- кетамин или клонидин (клофелин).
Показания для проведения эпидуральной блокады позвоночника
Наиболее часто применяется эпидуральная блокада при грыжах и тяжелой родовой деятельности, когда во время операций необходимо радикальное обезболивание. Иные показания таковы:
- реактивные и асептические эпидуриты;
- пояснично-крестцовый радикулит;
- радикулопатии, образовавшиеся по причине наличия протрузии и межпозвоночной грыжи;
- опухолевые процессы;
- травмы позвоночника;
- присутствие латеральных стенозов в спинномозговом канале.
Методика проведения эпидуральной блокады
Определенная подготовка перед проведением эпидуральной блокады не потребуется. Применять ее можно ко всем позвоночным отделам (шейному, грудному, поясничному, крестцовому).
Саму процедуру осуществляют одним из следующих способов:
- Интраламинарным. При введении препарата иглу шприца направляют по средней линии между отростками позвоночника;
- Трансфораминальным. Согласно этому методу вводимые препараты поступают из межпозвонкового отверстия к выходу спинномозгового нерва.
Начинается эпидуральная блокада позвоночника с того, что пациент ложится на бок и сильно поджимает ноги к животу. Нижние конечности необходимо согнуть в коленном суставе, а верхние — прижать к голове. Также требуется произвести в заднем проходе полную изоляцию. Для таких целей берут тампоны и стерильные полотенца, которые фиксируются на коже с помощью клеола.
После принятия человеком нужного положения область, где будут проводить инъекцию, тщательно дезинфицируют спиртовым раствором йода. Далее можно приступать к анестезии. Для эпидуральной блокады используют иглу с коротким срезом и длиной около 5 см. Во время введения препаратов может возникнуть чувство распирания, оно не считается аномальным.
После окончания эпидуральной блокады пациент должен лежать неподвижно еще в течение 40 минут. Все этапы проведения проходят под четким наблюдением специалистов. Не исключено развитие общей слабости и онемения конечностей. Эффект наступит практически сразу и будет длиться до 3-4 часов. Если по завершению процедуры отсутствуют осложнения, тогда больному для восстановления сил разрешают легко перекусить. Строго запрещено водить автомобиль первые сутки после манипуляции.
Противопоказания к эпидуральной блокаде
Данную манипуляцию не проводят при:
- беременности;
- почечной, печеночной либо сердечно-сосудистой недостаточности;
- поражении тканевого покрова какой-либо инфекцией;
- генерализованных воспалительных процессах;
- лихорадке;
- геморрагическом синдроме;
- болезнях нервной системы;
- индивидуальной непереносимости к препаратам состава для инъекций.
Осложнения после эпидуральной блокады позвоночника
Наблюдаются негативные последствия крайне редко. К возможным осложнениям относятся:
- головные боли;
- образование гематом;
- спазмы;
- паралич;
- отеки.
Рассмотрим причины, из-за которых они возникают. В некоторых случаях невозможно избежать прокола твердой оболочки спинного мозга с последующим истечением ликворея. Все это приводит к падению внутричерепного давления, сопровождающегося головной болью. Также при введении в субарахноидальное пространство анестетика усложняется дыхание.
Крайне опасно повреждение спинного мозга либо его корешка, так как зачастую образуется неврологический дефицит прогрессирующего типа. Травматизация крупного сосуда может привести к кровотечению, инфицированию и гематомам.
Длительность процедуры также играет не последнюю роль. При затянувшемся проведении наблюдается растяжение мочевого пузыря и трудности при мочеиспускании. Происходит это по причине блокировки сакральных нервов при местной анестезии.
Источник
Эпидуральная блокада. Показания и техника эпидуральной блокадыЭпидуральной блокадой условились называть блокаду корешков спинномозговых нервов, осуществляемую путем введения новокаина в эпидуральное пространство крестцового отдела позвоночника. При этом виде блокады раствор новокаина подводят фактически к корешковым нервам Нажотта, проходящим в эпидуральной клетчатке между основной линией твердой мозговой оболочки и внутренним краем межпозвоночного отверстия. Вообще говоря, эпидуральное пространство — это щелевидное замкнутое пространство цилиндрической формы между надкостницей позвоночного канала и твердой мозговой оболочкойа. Это позволяет вводить эпидурально анестезирующий раствор без вреда для больного. Эпидуральное пространство заполнено очень рыхлой жировой клетчаткой, которая окружает корешковые нервы и массивные венозные сплетения. Условились различать «собственно эпидуральное пространство» — на уровне крестца в крестцовом канале — и «перидуральное пространство» — на всем остальном протяжении позвоночного канала. На границе поясничного и крестцового отделов позвоночника эти пространства отделены друг от друга соединительнотканными тяжами, которые тянутся между твердой мозговой оболочкой и надкостницей. Анестезирующий раствор, введенный в эпидуральное пространство, разъединяя эти тяжи, проникает в перидуральное пространство. Вот почему при повторных блокадах новокаин легче и выше распространяется в перидуральное пространство поясничного отдела позвоночника. При проведении эпидуральной блокады необходимо помнить, что в полости крестцового канала находится дуральный мешок, нижний конец которого заканчивается на уровне SII—III позвонков, т. е. на расстоянии 6—8 см от крестцового отверстия. Вот почему при более глубоком продвижении иглы она может проникнуть через твердую мозговую оболочку, и тогда становится реальной опасность введения новокаина в субарахноидальное пространство, распространение его в область вышележащих отделов спинного мозга со всеми вытекающими отсюда последствиями. Крестцовый канал заканчивается отверстием, в области которого эпидуральное пространство отграничено соединительнотканной мембраной, подкожной клетчаткой и кожей. Ориентирами входа в крестцовый канал служат крестцовые рожки, расположенные по бокам от входа и обычно хорошо пальпируемые под кожей.
Показаниями к эпидуральной блокаде являются те клинические формы пояснично-крестцового радикулита, при которых отмечается множественное поражение крестцовых и поясничных корешковых нервов. Блокада показана также при асептических, реактивных эпидуритах этой локализации. Блокады не эффективны при арахнорадикулитах, менингорадикулитах, менингорадикулитах и неврите седалищного нерва. Методику эпидуральной блокады В.К.Романов (1971) описывает следующим образом. Больной принимает коленно-локтевое положение или положение на боку с согнутыми и приведенными к животу ногами (желательно — на стороне поражения корешков). Необходимо полностью изолировать задний проход, что осуществляется с помощью тампонов и стерильного полотенца, которое фиксируют к коже клеолом. После тщательной дезинфекции кожи спиртом и спиртовым раствором йода пальпаторно определяют вход в крестцовый канал — нижнее крестцовое отверстие, расположенное между ножками копчика. В этом месте очень тонкой иглой производят внутрикожную анестезию, так чтобы не утратить пальпаторные ориентиры входа в крестцовый канал. Для эпидуральной блокады используют иглу длиной 5—6 см, желательно с более коротким, чем обычно, срезом, что позволяет предотвратить ранение вен эпидуральной клетчатки. Быстрым коротким «ударом» перпендикулярно мембране, закрывающей вход в канал, прокалывают кожу, подкожную клетчатку и саму мембрану. Затем изменяют направление иглы, опуская ее павильон вниз на 20—30°, т. е. почти до горизонтального уровня. Иглу вводят в крестцовый канал на глубину не более 4—5 см, осуществляя при этом контроль за местонахождением кончика иглы путем отсасывания шприцем. При появлении в шприце крови иглу перемещают обратно и вновь контролируют ее положение путем аспирации шприцем. Отсутствие в шприце крови и СМЖ дает право приступить к введению раствора новокаина. Раствор новокаина 0,25—0,5% вводят очень медленно, порциями по несколько миллилитров, при этом ощущается отсутствие сколько-нибудь значительного сопротивления. Общее количество новокаина, вводимого при эпидуральной блокаде, обычно 30—60 мл. При проведении эпидуральной блокады вместе с новокаином могут быть введены 3 мл 5% раствора тиамина (витамин B1) и 200—500 мкг цианокобаламина (витамин В12). С успехом применяют также новокаинокортизоновые и новокаиногидрокортизоновые эпидуральные блокады. Эффект их связывают с противоотечным действием кортикостероидов, что делает их применение для лечения дискогенных радикулитов теоретически обоснованным, так как в патогенезе этой болезни большую роль играет реактивный отек диска и корешков. Во время блокады врач должен тщательно контролировать состояние больного. По окончании блокады больного направляют в палату, где он должен 30—40 мин лежать на больной стороне с несколько приподнятым головным концом кровати. – Также рекомендуем “Перидуральная блокада. Показания и техника перидуральной блокады” Оглавление темы “Современные методы блокад в неврологии”: |
Источник
Наибольшее практическое значение в хирургии неотложных состояний у детей имеет паралитическая непроходимость кишечника, которая является самым частым и серьезным осложнением послеоперационного периода. При перитоните, даже после ликвидации источника его происхождения, парез кишечника в большинстве случаев становится основным в сложной цепи развивающихся системных и локальных расстройств. По данным О. М. Мишарева (1977), именно наличие пареза в 52,5% случаев служило основным показанием к релапаротомии.
Повышенное в результате пареза внутрикишечное давление усугубляет нарушение кровообращения в кишечной стенке. Функциональные изменения внутрикишечных нервных окончаний сменяются их органическим поражением. Потеря жидкости, белков, электролитов в просвет кишки, нарушения процесса всасывания в ней приводят к гиповолемии, нарушениям центральной и периферической гемодинамики. Повышается проницаемость кишечной стенки и возникает опасность вторичного инфицирования брюшной полости. Дегидратация, бактериемия замыкают возникший порочный круг, разорвать который тем труднее, чем больше прошло времени с момента возникновения пареза.
Предложены и используются многочисленные методы лечения пареза кишечника. Опубликованные данные относительно эффективности каждого из них в отдельности и сочетанного их применения неоднородны и разноречивы. Доказательством тому служат мало оправданные повторные операции при тяжелых парезах кишечника, справиться с которыми консервативными мероприятиями не удается.
Безуспешность консервативного лечения послеоперационного пареза кишечника, по нашим представлениям, обусловлена главным образом следующими причинами:
1) недостаточной оценкой системных нарушений, возникающих при парезе, и их роли в поддержании его;
2) отсутствием достаточно четких представлений о характере локальных патофизиологических нарушений, развивающихся в кишечной стенке;
3) нерациональным лечением, игнорирующим стадийность системных и локальных расстройств в клиническом течении послеоперационного пареза.
Возникшее после операции ограничение моторной функции кишечника следует, вероятно, рассматривать как биологически оправданную, рефлекторную защитную реакцию, развивающуюся в ответ на бактериальное, механическое или химическое раздражение брюшины и нервных окончаний органов брюшной полости. Цепь этого рефлекса может замыкаться не только в высших, но и в спинальных отделах центральной нервной системы. Последним, очевидно, и обусловлено возникновение пареза кишечника при пневмониях, травмах и воспалительных процессах в мочевыводящих путях.
В соответствии с современными и патофизиологическими воззрениями мы считаем, что, независимо от причин, вызвавших парез кишечника, поддержанию его способствуют главным образом два взаимосвязанных обстоятельства: степень нарушений периферического нервного аппарата и выраженность расстройств микроциркуляции в кишечной стенке.
На основании изложенных теоретических соображений и анализа клинического течения послеоперационного пареза кишечника мы выделили три стадии его развития, отличающиеся друг от друга степенью выраженности системных и локальных расстройств [Баиров Г. А., Пар-нес Д. И., 1976]. Проведенные в клинике лабораторные исследования подтвердили обоснованность данной классификации.
Клиническая картина. I стадия. Возникает непосредственно вслед за оперативным вмешательством. В этой стадии пареза отсутствуют органические изменения в интрамуральных сплетениях; микроцир-куляторные изменения в кишечной стенке носят преходящий характер (спазм артериол и метаартериол с артериовенозным шунтированием в сосудах кишки).
Общее состояние больных, показатели гемодинамики и внешнего дыхания, изменения водно-электролитного баланса обусловлены травматич-ностью и длительностью оперативного вмешательства, и при восполненной кровопотере не носят угрожающего характера.
Живот умеренно равномерно вздут, во всех его отделах отчетливо выслушиваются неравномерные по силе перистальтические шумы; рвота частая (светлым содержимым желудка) либо редкая (с небольшой примесью дуоденального содержимого). Возможно что -этой стадии паралитической непроходимости предшествует спастическая стадия, однако клинически у послеоперационного больного выявить ее не удается.
II стадия. При ней, наряду с функциональными, имеют место и органические изменения в периферических нервных приборах, обусловленные более выраженными нарушениями микроциркуляции.
Общее состояние больных тяжелое. Дети беспокойны, отмечаются одышка, тахикардия; артериальное давление удерживается на нормальных величинах либо повышено. При исследовании водно-электролитного баланса выявляются гипонатриемия, гипохлоремия, в ряде случаев гипо-калиемия; объем циркулирующей крови (ОЦК) снижается до 25% от исходных данных, главным образом за счет объема плазмы.
Живот значительно вздут, изредка удается прослушать единичные вялые перистальтические шумы; часто повторяется рвота дуоденальным содержимым.
III стадия. В этой стадии пареза преобладают морфологические изменения в нервном аппарате кишечной стенки и абдоминальных вегетативных нервных сплетениях; изменения микроциркуляции характеризуются паретическим расширением прекапилляров и патологическим депонированием крови в емкостных сосудах. Общее состояние больных очень тяжелое. Дети редко возбуждены, чаще заторможены. Отмечаются резкая тахикардия и тахипноэ, снижение систолического артери-
эльного давления до 90 мм рт. ст. (12 кПа) и ниже, олигурия вплоть до анурии. При биохимических исследованиях выявляются снижение ОЦК. в пределах от 25 до 40% от исходных данных, гипонатриемия, гипохло-ремия, гипокалиемия, сдвиг КОС в сторону метаболического ацидоза (у детей в возрасте до 1 года довольно часто отмечается метаболический алкалоз).
Живот равномерно вздут, иногда возвышается над реберными дугами; при аускультации его на всем протяжении прослушать перистальтику не удается («немой живот»). При перкуссии чаще всего определяется притупление в отлогих местах; последнее в большей степени обусловлено скоплением жидкости в просвете растянутых петель («тяжелая кишка»), нежели ее наличием в свободной брюшной .полости. Для этой стадии пареза характерна рвота с примесью застойного «кишечного» содержимого.
II и III стадии пареза кишечника чаще всего являются проявлением продолжающегося перитонита, несмотря на оперативное устранение источника его возникновения. Поэтому лечение пареза кишечника поздних стадий практически идентично лечению перитонита.
Клиническая картина паралитической непроходимости, развивающейся у детей при тяжелых токсикозах любой этиологии, обычно соответствует состоянию, характерному для II—III стадии.
Дифференциальную диагностику проводят с ранней послеоперационной спаечной непроходимостью. Механическая непроходимость отличается от паралитической остротой первых проявлений (схваткообразные боли в животе, рвоты, задержка газа и стула, усиленная перистальтика кишечника и др.). Значительно сложнее диагностировать раннюю послеоперационную спаечную непроходимость спустя 8 ч после ее начала и позже, когда уже отсутствует или почти не проявляется симптом видимой перистальтики. Л. М. Рошаль в таких случаях рекомендует использовать ирригографию. Наличие спавшейся толстой кишки свидетельствует о механической непроходимости, нормальный или увеличенный ее диаметр позволяет заподозрить парез кишечника. В сложных случаях для дифференциальной диагностики следует провести комплекс мероприятий-, направленных на восстановление мотор-но-эвэкуаторной функции кишечника; после повторных перидуральных блокад (2—3, с интервалом в 2—2’/2 ч) ввести ребенку внутривенно возрастную дозу прозерина. При динамической непроходимости улучшается состояние больного, прекращается рвота, восстанавливается от-хождение газов, иногда отходит кал. При механической непроходимости вслед за проведенными мероприятиями усиливаются боли в животе и его вздутие, рвота становится более частой, а отхождение газов и кала не .происходит.
Лечение паралитической непроходимости кишечника слагается из коррекции системных нарушений гомеостаза и борьбы с локальными проявлениями пареза. В ликвидации системных нарушений ведущая роль принадлежит рациональной инфузионной терапии.
Мероприятия по лечению локальных проявлений пареза условно разделены на три группы:
1) мероприятия, направленные на пассивную эвакуацию застойного содержимого — постоянное зондирование желудка; оперативные методы декомпрессии кишечника путем его зондирования через гастростому [Исаков Ю. Ф. и др., 1980], через энтеростому [Миша-рев О. С, Котович Л. Е., 1977], через цекостому, ретроградное введение зонда через прямую кишку;
2) мероприятия, направленные на усиление моторики кишечника за счет непосредственной активации его нервно-мышечного аппарата:
а) усиление тонуса парасимпатической иннервации с помощью ингибиторов холинэстеразы (прозерин, нибуфин), М-холиномиметиков (ацеклидин);
б) активация гладкой мускулатуры кишки (питуитрин);
в) усиление «местных» рефлексов (клизмы, электростимуляции кишечника);
г) воздействие на осморецепторы кишечника внутривенным введением гипертонического раствора натрия хлорида, сорбита, сормантола;
3) мероприятия, направленные на улучшение регионарного кровотока, на прерывание потока патологических импульсов из воспалительного очага и создание «функционального покоя» кишечника:
а) повторные одноразовые паранефральные блокады; продленная паранефральная блокада;
б) повторное введение в брюшную полость 0,25% раствора новокаина;
в) внутримышечное и внутривенное введение ганглиолитиков;
г) гипербарическая оксигенация.
На основании клинических наблюдений и лабораторных исследований мы считаем, что выбор того или иного метода лечения пареза кишечника, последовательность использования различных мероприятий и их рациональное сочетание должны определяться в первую очередь стадией пареза.
При лечении I стадии пареза действенны все мероприятия, ведущие к усилению моторики кишечника. Однако последние необходимо проводить на фоне эффективного послеоперационного обезболивания. Великолепный эффект дает при этом длительная эпидуральная блокада; отхождение газов, а в ряде случаев и кала мы наблюдали после 1—2-го введения анестетика в эпидуральное пространство у 97% больных с этой стадией пареза.
Значительно большую трудность представляет лечение больных со II и III стадиями пареза. Терапия поздних стадий пареза должна быть комплексной, направленной на коррекцию локальных и в первую очередь системных нарушений. При лечении локальных проявлений поздних стадий пареза первостепенное значение приобретает использование средств, способствующих созданию состояния «функционального покоя»
кишечника. Для этого в клинике с 1968 г. предпочтение отдают продленной эпидуральной блокаде.
У детей со II стадией пареза отхождение газов отмечено только лишь после 4—6 эпидуральных блокад, проводимых с интервалом в 2 1/2—3 1/2 ч. Рвоты прекращались после 2—3-й блокады. Стул появлялся после 7—9-й блокады, т.е. к середине 2-х суток.
У детей с III стадией пареза после 3—4 эпидуральных блокад исчезают самостоятельные боли в животе, уменьшаются тахикардия и одышка; частые рвоты застойного характера становятся более редкими. Однако живот по-прежнему остается «немым». Появление хотя бы слабой перистальтики, определяемой аускультативно, как правило, лишь после б—8-й эпидуральной блокады, косвенно указывает на функциональную «готовность* кишечника к усилению моторной функции. Вслед за этим внутривенное введение возрастной дозы прозерина одновременно с очередной блокадой почти во всех случаях сопровождается отчетливым отхождением газов и обильного жидкого стула. Отхождение застойного жидкого кишечного содержимого приводит к снижению гипертермии.
При лечении пареза поздних стадий непременным условием является постоянная трансназальная интубация желудка до тех пор, пока сохраняется застойный характер содержимого. Необходимо учитывать объем потерь каждые 6 ч и адекватно восполнять его при проведении парентерального питания. Дробное кормление жидкой пищей с постепенным расширением диеты (с учетом основного заболевания и характера оперативного вмешательства) начинают только после ликвидации застойных явлений в желудке.
Использование мероприятий 2-й группы у детей с III стадией пареза только усугубляет его и, в конечном итоге, может вынудить хирурга к крайне рискованной и малооправданной релапаротомии.
Для восстановления нарушенной, функции кишечника первостепенное значение приобретает проведение регионарных вегетативных блокад (паранефральной, эпидуральной). Антипаретический эффект эпидуральной блокады наиболее выражен при профилактическом ее применении. В связи с этим мы считаем абсолютно показанной продленную эпиду-ральную анестезию у.всех детей, оперированных по поводу перитонита, кишечной непроходимости и других тяжелых заболеваний органов брюшной полости.
При использовании длительной эпидуральной анестезии у детей, оперированных по поводу перитонита, явления пареза кишечника II—III стадии купируются в абсолютном большинстве случаев не позднее 2-х — начала 3-х суток. Длительная эпидуральная блокада приводит к восстановлению моторно-эвакуаторной функции кишечника в первые дни после операции и тем самым в значительной мере предупреждает нарастание интоксикации.
Благоприятное влияние эпидуральной блокады в лечении послеоперационного пареза обусловлено следующими факторами:
1) длительной регионарной’симпатической блокадой;
2) обезболиванием и уменьшением внутрибрюшного давления за счет снижения мышечного напряжения;
3) отчетливым эффектом усиления перистальтики кишечника и ранним восстановлением его моторно-эвакуаторной функции.
Трудно переоценить значение любого из этих факторов. Тем не менее, ведущее значение имеет первый. Только в том случае, когда при проведении эпидуральной анестезии достигается регионарная симпатическая блокада, можно рассчитывать на максимальный эффект в лечении поздних стадий пареза и перитонита. При этом, по аналогии с известным действием паранефральной блокады по А. В. Вишневскому, эпидуральная анестезия активно воздействует на воспалительный процесс в органах брюшной полости за счет ликвидации ангиоспазма и улучшения микроциркуляции в кишечной стенке и брюшине.
Косвенным доказательством благоприятного влияния эпидуральной блокады на регионарную микроциркуляцию служит выявленное нами значительное повышение концентрации антибиотика оксиглюкоциклина в ткани червеобразного отростка и экссудате брюшной полости при перитоните у детей в сравнении с аналогичной группой больных, которым не проводилась предоперационная эпидуральная блокада [Парнес Д. И., Комиссаров И. А., 1979].
Максимальная блокада симпатической иннервации в наибольшей степени способствует активации деятельности парасимпатической, приводящей к усилению моторики кишечника.
Для достижения регионарной симпатической блокады при проведении эпидуральной анестезии (в случае ее использования для лечения поздних стадий пареза) необходимо, чтобы вводимый анестетик блокировал корешки IV—XI грудных спинальных сегментов — место формирования чревных нервов. Как известно, большой, малый и наименьшие чревные нервы составляют симпатическую порцию чревного сплетения— основного вегетативного центра регуляции трофики и моторной функции кишечника.
Систематический рентгенологический контроль, проводимый нами, и анализ результатов лечения позволили выявить закономерную зависимость антипаретического эффекта от высоты расположения конца катетера, введенного в эпидуральное пространство. По нашим данным, оптимальным является расположение внутреннего конца катетера, введенного в эпидуральное пространство, на уровне IV—V грудных позвонков. У детей в возрасте до 3 лет это достижимо при пункции и катетеризации в нижнегрудном отделе; ввиду небольших размеров эпидурального пространства введенный анестетик охватит и верхнегрудные сегменты. У более старших детей необходимо катетеризовать эпидуральное пространство на уровне VI—VIII грудных позвонков.
Во всех случаях необходимо производить рентгенологический контроль положения катетера, вводимого в эпидуральное пространство. Для контрастирования катетера необходимо ввести в его просвет любое водорастворимое контрастирующее вещество (уротраст, диодон, верографин) из расчета 0,1—0,15 мл раствора на каждые 20 см длины катетера; предпочтение следует отдавать рентгеноконтрастным катетерам. Расположение тени катетера медиальнее основания поперечных отростков на прямой рентгенограмме и впереди основания остистых отростков на боковой позволяет считать, что катетер находится в проекции костного спинального канала. Отсутствие симптомов спинальной блокады после введения «дозы действия» тримекаина свидетельствует о расположении катетера в эпидуральном пространстве.
При рентгенологическом подтверждении расположения катетера в эпидуральном пространстве на соответствующем уровне (IV—VI грудные позвонки) полное отсутствие признаков ликвидации пареза кишечника после последовательного проведения 6 – 8 эпидуралъных блокад позволяет с большой степенью вероятности предположить возникновение ситуации, требующей повторного оперативного вмешательства (механическая непроходимость). В равной мере это положение относится и к случаям возобновления пареза кишечника после временной его ликвидации в более ранние сроки. Таким образом, проведение длительной эпидуральной анестезии позволяет своевременно выявить развившиеся осложнения, которые при обычном лечении маскируются «закономерным» парезом кишечника в первые 3—5 дней послеоперационного периода. Длительность проведения эпидуральной анестезии у детей со II—III стадией пареза составляла 4—5 дней; прекращение ее проведения в более ранние сроки в ряде случаев приводит к возобновлению пареза и вынуждает повторно катетеризовать эпидуральное пространство.
С 1968 г. и по настоящее время длительная эпидуральная блокада является методом выбора при лечении послеоперационного пареза кишечника во всех детских хирургических отделениях С.-Петербурга, и опыт ее использования насчитывает более 5000 наблюдений. За этот период ни разу не были применены декомпрессивные операции для лечения пареза.
В заключение необходимо еще раз подчеркнуть, что лечение пареза кишечника у детей необходимо проводить дифференцированно в зависимости от стадии заболевания; эти больные нуждаются в интенсивной терапии, проводимой совместно хирургом и реаниматологом.
Источник