Как получают инсулин из кишечной палочки

Инсулин – это белок, который является гормоном поджелудочной железы. Действие инсулина в основном направлено на обмен углеводов и проявляется снижением уровня сахара в крови (гипогликемический эффект). Это происходит за счет того, что инсулин облегчает переход глюкозы в клетки органов и тканей, где стимулирует ее активирование путем образования глюкозо-6-фосфата.
Последний, окисляясь, обеспечивает клетки энергией. Таким образом, инсулин способствует периферическому окислению глюкозы. Наряду с этим инсулин тормозит распад гликогена в клетках печени. При этом снижаются процессы распада жиров и превращение аминокислот в глюкозу и происходит активирование синтеза жиров и белков.
При недостатке инсулина развивается тяжелое заболевание – диабет; при этом разрушается нормальный обмен веществ. Диабетики должны получать инсулин ежедневно, если этого не происходит, то развивается тяжелое состояние – диабетическая кома, и организм погибает. Потребность в инсулине огромна. Долгое время источником инсулина служили железы коров и свиней. Учитывая, что поджелудочная железа коровы весит 200-250 г, для получения 100 г кристаллического инсулина нужно 800-1000 кг исходного сырья. Понятно, что животный инсулин не мог обеспечить всех больных. Например, в 1979 г. из 60-ти млн больных диабетом во всем мире, только 4 млн получали препарат инсулина.
Инсулин построен из двух полипептидных цепей А и В длиной 20 и 30 аминокислот, последовательность которых была установлена Сэнгером в 1955 г. Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены тремя коллективами исследователей в Сша, Китае и ФРГ в 1963 и 1965 гг. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, который включает 170 химических реакций, оказалось трудно. Тем не менее в 1980 г. в Дании (компанией «Ново индастри») был разработан способ превращения инсулина свиньи в инсулин человека замещением остатка аланина, который является 30-й аминокислотой в цепи В на остаток треонина.
Это удалось достигнуть путем ферментативного замещения с последующей хроматографической очисткой продукта; в результате был получен однокомпонентный инсулин человека 99 %-й чистоты. Исследования двух однокомпонентных инсулинов (человеческого и свиного) показали, что они не различались по активности и по времени действия. В 1982 г. инсулин производили главным образом две компании «Эли Лилли» (85 % сбыта инсулина в США и патент на его производство с 1923 г.) и «Ново индастри» (47,5 % сбыта гормона в Европе).
В организме животного две полипептидные цепи инсулина исходно являются частями одной белковой молекулы длиной 109 аминокислот – препроинсулина. При синтезе препроинсулина в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для прохождения молекулы сквозь мембрану клетки; эти аминокислоты отщепляются, образуется проинсулин длиной 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный ее сегменты сближаются, а центральная часть молекулы удаляется с помощью ферментов.
Так образуется инсулин. Роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
Гилберт с сотрудниками выделили и-РНК из поджелудочной железы крысы, синтезировали ДНК-копию (комплементарная ДНК), которая была встроена в плазмиду E. coli в среднюю часть гена пенициллиназы (этот фермент в норме секретируется из клеток), и получили рекомбинантную плазмиду. Как показало определение последовательности ДНК, рекомбинантная плазмида содержала информацию о структуре проинсулина, но не препроинсулина.
При трансляции и-РНК в клетках кишечной палочки синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Далее отщепляли пенициллиназу и удаляли средний сегмент проинсулина действием трипсина. Позднее было показано, что полученные таким образом молекулы влияют на сахарный обмен, как гормон, выделенный из поджелудочной железы крысы.
В 1979 г. в США были синтезированы гены, кодирующие А и Б цепи инсулина. Далее каждый синтетический ген встраивали в плазмиду E. coli в конце гена -галактозидазы. После этого синтезированные полипептиды отщепляли от фермента, проводили их очистку и цепи соединяли in vitro для получения полной молекулы инсулина.
В клетках E. coli был также осуществлен биосинтез проинсулина, а не только отдельных ее цепей. Для этого на и-РНК проинсулина синтезировали ее ДНК-копию с помощью обратной транскриптазы (ДНК-полимераза). Этот способ имеет серьезное преимущество, поскольку различные этапы экстракции и выделения гормона сведены к минимуму. С помощью этого метода был получен высокий выход гормона -200 г на 1000 л культуральной жидкости (это эквивалентно количеству инсулина, выделенного из 1600 кг поджелудочной железы животных).
Исследователям из компании «Генентек» потребовалось 10 месяцев, чтобы в сентябре 1978 г. получить инсулин человека в специально сконструированном штамме кишечной палочки. Этот инсулин прошел самые серьезные и длительные испытания, которые показали, что он не вызывает никаких побочных явлений, как инсулин животных (у одного из каждых 20-ти больных инсулин животных вызывает аллергию; часто наблюдаются также расстройства почек и зрения ).
Кроме того, при длительном применении препарат не вызывал отрицательных иммунологических реакций.
Технология производства инсулина в бактериальных клетках имеет огромные преимущества перед получением инсулина из поджелудочной железы животных: не зависит от перебоев или количества сырья, конечный продукт всегда имеет одинаковый состав и степень чистоты.
В октябре 1982 г. был налажен выпуск «хемулина» (препарата синтетического инсулина человека) фирмой «Эли Лилли», которая затратила 100 млн долларов, чтобы начать поставку продукта на рынок.
Л.В. Тимощенко, М.В. Чубик
Опубликовал Константин Моканов
Источник

Инсулин – это основное лекарство для лечения больных сахарным диабетом 1 типа. Иногда он также используется для стабилизации состояния пациента и улучшения его самочувствия при втором типе заболевания. Это вещество по своей природе является гормоном, который способен в малых дозах влиять на обмен углеводов.
В норме поджелудочная железа вырабатывает достаточное количество инсулина, который помогает поддерживать физиологический уровень сахара в крови. Но при серьезных эндокринных нарушениях единственным шансом помочь больному часто становятся именно инъекции инсулина. Принимать его перорально (в виде таблеток), к сожалению, нельзя, поскольку он полностью разрушается в пищеварительном тракте и утрачивает биологическую ценность.
Варианты получения инсулина для использования в медицинской практике
Многие диабетики наверняка хоть раз задавались вопросом, из чего делают инсулин, который применяется в медицинских целях? В настоящее время чаще всего это лекарство получают с помощью методов генной инженерии и биотехнологии, но иногда его извлекают из сырья животного происхождения.
Препараты, получаемые из сырья животного происхождения
Получение этого гормона из поджелудочной железы свиней и крупного рогатого скота – старая технология, которая сегодня используется довольно редко. Это связано с невысоким качеством получаемого лекарства, его склонностью вызывать аллергические реакции и недостаточной степенью очистки. Дело в том, что, поскольку гормон – это белковое вещество, оно состоит из определенного набора аминокислот.
Инсулин, вырабатываемый в организме свиньи, отличается по аминокислотному составу от инсулина человека на 1 аминокислоту, а инсулин быка – на 3.
В начале и середине 20 столетия, когда аналогичных препаратов не существовало, даже такой инсулин стал прорывом в медицине и позволил вывести лечение диабетиков на новый уровень. Гормоны, полученные таким методом, снижали сахар крови, правда, при этом они часто вызывали побочные эффекты и аллергию. Отличия в составе аминокислот и примеси в лекарстве сказывались на состоянии пациентов, особенно это проявлялось у более уязвимых категорий больных (детей и пожилых людей). Еще одна причина плохой переносимости такого инсулина – наличие его неактивного предшественника в лекарстве (проинсулина), избавиться от которого в данной вариации лекарства было невозможно.
В наше время существуют усовершенствованные свиные инсулины, которые лишены этих недостатков. Их получают из поджелудочной железы свиньи, но после этого поддают дополнительной обработке и очистке. Они являются многокомпонентными и содержат в своем составе вспомогательные вещества.

Модифицированный свиной инсулин практически ничем не отличается от человеческого гормона, поэтому его до сих пор используют на практике
Такие лекарства переносятся пациентами гораздо лучше и практически не вызывают побочных реакций, они не угнетают иммунитет и эффективно снижают сахар в крови. Бычий инсулин на сегодняшний день в медицине не используется, так как из-за своей чужеродной структуры он отрицательно влияет на иммунную и другие системы организма человека.
Генноинженерный инсулин
Человеческий инсулин, который применяется для диабетиков, в промышленном масштабе получают двумя способами:
- с помощью ферментативной обработки свиного инсулина;
- с использованием генномодифицированных штаммов кишечной палочки или дрожжей.
При физико-химическом изменении молекулы свиного инсулина под действием специальных ферментов становятся идентичными инсулину человека. Аминокислотный состав полученного препарата ничем не отличается от состава натурального гормона, который вырабатывается в организме людей. В процессе производства лекарство проходит высокую очистку, поэтому не вызывает аллергических реакций и других нежелательных проявлений.
Но чаще всего инсулин получают с помощью модифицированных (генетически измененных) микроорганизмов. Бактерии или дрожжи с помощью биотехнологических методов изменены таким образом, что могут сами производить инсулин.
Помимо самого получения инсулина, важную роль играет его очистка. Чтобы препарат не вызывал никаких аллергических и воспалительных реакций, на каждой стадии необходимо следить за чистотой штаммов микроорганизмов и всех растворов, а также используемых ингредиентов.
Существует 2 методики подобного получения инсулина. Первая из них основана на использовании двух разных штаммов (видов) какого-то одного микроорганизма. Каждый из них синтезирует только одну цепь молекулы ДНК гормона (всего их две, и они спирально закручены между собой). Затем эти цепи соединяются, и в полученном растворе уже можно отделить активные формы инсулина от тех, которые не несут никакого биологического значения.
Второй способ получения лекарства с помощью кишечной палочки или дрожжей основан на том, что микроб сначала производит неактивный инсулин (то есть его предшественник – проинсулин). Потом с помощью ферментативной обработки эту форму активируют и используют в медицине.

Персонал, который имеет доступ в определенные производственные помещения, всегда должен быть одет в стерильный защитный костюм, благодаря чему контакт препарата с биологическими жидкостями человека исключается
Все эти процессы обычно автоматизированы, воздух и все соприкасающиеся поверхности с ампулами и флаконами стерильны, а линии с оборудованием герметично закрыты.
Методы биотехнологии дают возможность ученым думать об альтернативных решениях проблемы сахарного диабета. Например, на сегодняшний день проводятся доклинические исследования производства искусственных бета-клеток поджелудочной железы, которые могут быть получены с помощью методов генной инженерии. Возможно, в будущем их будут использовать для улучшения функционирования этого органа у больного человека.

Производство современных препаратов инсулина – сложный технологический процесс, который предусматривает автоматизацию и минимальное вмешательство человека
Дополнительные компоненты
Производство инсулина без вспомогательных веществ в современном мире практически невозможно представить, ведь они позволяют улучшить его химические свойства, продлить время действия и достичь высокой степени чистоты.
По своим свойствам все дополнительные ингредиенты можно разделить на такие классы:
- пролонгаторы (вещества, которые используются для обеспечения более длительного действия лекарства);
- дезинфицирующие компоненты;
- стабилизаторы, благодаря которым в растворе лекарства поддерживается оптимальная кислотность.
Пролонгирующие добавки
Существуют инсулины продленного действия, биологическая активность которых продолжается в течение 8 – 42 часов (в зависимости от группы препарата). Такой эффект достигается, благодаря добавлению в инъекционный раствор специальных веществ – пролонгаторов. Чаще всего с этой целью применяется одно из таких соединений:
- белки;
- хлористые соли цинка.
Белки, которые продлевают действие лекарства, проходят детальную очистку и являются низкоаллергенными (например, протамин). Соли цинка также не оказывают отрицательного влияния ни на активность инсулина, ни на самочувствие человека.
Антимикробные составляющие
Дезинфекторы в составе инсулина необходимы для того, чтобы при хранении и использовании в нем не размножалась микробная флора. Эти вещества являются консервантами и обеспечивают сохранность биологической активности лекарства. К тому же, если пациент вводит гормон из одного флакона только самому себе, то лекарства ему может хватить на несколько дней. За счет качественных антибактериальных компонентов у него не будет потребности выбрасывать неиспользованный препарат из-за теоретической возможности размножения в растворе микробов.
В качестве дезинфицирующих составляющих при производстве инсулина могут использоваться такие вещества:
- метакрезол;
- фенол;
- парабены.

Если в растворе содержатся ионы цинка, они также выступают дополнительным консервантом из-за своих антимикробных свойств
Для производства каждого вида инсулина подходят определенные дезинфицирующие компоненты. Их взаимодействие с гормоном обязательно исследуют на этапе доклинических испытаний, поскольку консервант не должен нарушать биологическую активность инсулина или как-то по-другому отрицательно влиять на его свойства.
Использование консервантов в большинстве случаев позволяет вводить гормон под кожу без ее предварительной обработки спиртом или другими антисептиками (производитель обычно упоминает об этом в инструкции). Это упрощает введение лекарства и сокращает количество подготовительных манипуляций перед самой инъекцией. Но данная рекомендация работает только в случае введения раствора с помощью индивидуального инсулинового шприца с тонкой иглой.
Стабилизаторы
Стабилизаторы необходимы для того, чтобы pH раствора поддерживался на заданном уровне. От уровня кислотности зависит сохранность лекарства, его активность и стабильность химических свойств. При производстве инъекционного гормона для больных диабетом с этой целью обычно используют фосфаты.
Для инсулинов с цинком стабилизаторы растворов нужны не всегда, поскольку ионы металла помогают поддерживать необходимый баланс. Если же они все-таки применяются, то вместо фосфатов используют другие химические соединения, так как комбинация этих веществ приводит к выпадению осадка и непригодности лекарства. Важное свойство, предъявляемое ко всем стабилизаторам – безопасность и отсутствие возможности вступать в любые реакции с инсулином.
Подбором инъекционных лекарств при диабете для каждого конкретного пациента должен заниматься компетентный эндокринолог. Задача инсулина – не только удерживать нормальный уровень сахара в крови, но и не вредить другим органам и системам. Препарат должен быть нейтральным в химическом плане, низкоаллергенным и желательно доступным по цене. Довольно удобно также, если подобранный инсулин можно будет смешивать с другими его версиями по длительности действия.
Аделина Павлова
Медсестра общего профиля. Более 40 лет рабочего стажа. Копирайтер на пенсии. Подробнее об авторе
Последнее обновление: 3 сентября, 2020
Источник
Кишечная палочка Esherichia coli, бактерия, известная
человечеству уже полтора века,
– обычнейший обитатель нашего кишечника. Она – излюбленный объект
исследований микробиологов, биохимиков и генетиков всего мира, и
не случайно именно Esherichia coli стала первым живым
генно-модифицированным организмом, появившимся на свет в 1973
году. В ее геном был встроен ген человека, кодирующий
синтез инсулина.
В настоящее время генетически модифицированные микроорганизмы
используются для производства фармацевтических препаратов,
вакцин, продуктов тонкого органического синтеза, пищевых добавок
и многого другого. Новые штаммы кишечной палочки уже не просто
производят инсулин: они стимулируют восстановление собственных
способностей организма пациента вырабатывать этот гормон. При
диабете первого типа бета-клетки поджелудочной железы утрачивают
способность синтезировать инсулин. Ученые Корнельского
университета (Итака, штат Нью-Йорк), работающие под руководством
Джона Марча (John March), решили попытаться восстановить
этот механизм с помощью сигнальной системы, используемой
выстилающими кишечник эпителиальными клетками и населяющими его
полезными бактериями. Созданный в лаборатории Марча штамм
непатогенной кишечной палочки синтезирует белок GLP-1 –
глюкагоноподобный пептид. В организме здорового человека этот
белок синтезируется клетками кишечника и, среди прочих эффектов,
запускает продукцию инсулина в поджелудочной железе. Авторы
продемонстрировали, что в лабораторных условиях в присутствии
глюкозы секретирующие GLP-1 бактерии запускают синтез инсулина в
культуре клеток кишечника человека. Механизмы, лежащие в основе
этого феномена, пока не ясны. Спектр применения – колоссальный, к
примеру, обычный йогурт, обогащенный такими бактериями, сможет
заменить больным диабетом инъекции инсулина! Кроме бактерий для
лечения диабета, группа Марча работает над созданием целого ряда
целебных штаммов микроорганизмов, в том числе предназначенных для
борьбы с кариесом, синтеза витаминов, лечения непереносимости
лактозы и профилактики холеры.

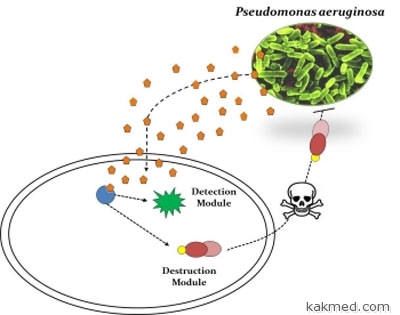
Стало известно о результатах исследования группы генетиков из
Массачусетского технологического института под руководством
профессора Рона Вайса (Ron Weiss), специалиста в области
синтетической биологии. В этом исследовании ученые пытаются
сделать кишечную палочку бактерией-охотником за одной из самых
опасных внутрибольничных инфекций – синегнойной палочкой
(Pseudomonas aeruginosa), олицетворяющей одну из главных проблем
современной медицины — резистентности патогенных микробов к
антибиотикам. Если пациенту в больнице внезапно становится плохо,
и антибиотики не помогают, то обычно главной причиной этого
оказывается именно “синегнойка” — агрессивный обитатель
хирургических отделений, виновник тысяч жертв. Ученые в
буквальном смысле «натравили» кишечную палочку на «синегнойку» –
модифицировали бактерию так, что она научилась «выслеживать» и
убивать клетки Pseudomonas, обитающие в ранах и абсцессах.
Esherichia coli находит клетки синегнойной палочки, что
называется, «по запаху». Дело в том, что клетки опасного патогена
общаются друг с другом внутри своей колонии с помощью различных
сигнальных веществ. Модифицированная E.Coli реагирует на это
вещество, связываясь с ним особым протеином, и, обнаружив
псевдомонаду, убивает ее с помощью яда, получившего название
бактериоцин. Попадая внутрь клетки синегнойной палочки, подвижной
и устойчивой к большинству антибиотиков, бактериоцин разрушает ее
ДНК. Рон Вайс и его коллеги показали, что генетически
модифицированная кишечная палочка в лабораторной жидкой культуре
убивает “синегнойку”, не причиняя вреда себе, а также другим
неопасным бактериям. Этот метод испытан пока лишь в лаборатории,
но ученые считают, что возможно сделать лечебный штамм кишечной
палочки в 20 раз сильнее опытного экземпляра. И тогда испытать на
млекопитающих, а также подумать о возможных лекарственных формах
пробиотиков.

Генно-модифицированные штаммы кишечной палочки ученые намерены
использовать и для решения одной из проблем века – ожирения. Как
показывают исследования, добавление в еду подопытным мышам
особого штамма E.Coli , в геном которой введен ген растения
резуховидки, помогает избавить от лишнего веса подопытных мышей.
Бактерии ориентированы на синтез особого вещества под названием
NAPE, которое организм млекопитающих превращает в гормон,
вырабатываемый в процессе переваривания пищи. Этот гормон
поступает через кровь в мозг и, сигнализируя о насыщении,
уменьшает аппетит. Получается, что бактерия заставляет мышей
думать, что они едят больше, чем на самом деле. В исследовании,
опубликованном в журнале The Journal of Clinical Investigation,
грызунов, которым добавляли бактерии в питьевую воду, и грызунов
из контрольной группы кормили высококалорийной пищей. У мышей,
которые употребляли бактерии, снизился аппетит, они перестали
набирать вес и начали показывать меньшую инсулиновую
устойчивость. Эффект сохранялся около четырех недель. Ученые
считают, что эти бактерии можно использовать в пробиотиках для
употребления людьми. Если препарат окажется действенным и
безопасным, то он даст большую фору существующим лекарствам
против ожирения.

Пробиотики, изготовленные с добавлением модифицированной кишечной
палочки, как считают ученые – это одно из лекарств будущего, ведь
для этой бактерии кишечник человека – естественное местом ее
обитания. Однако, несмотря на первые успехи, авторы отмечают, что
им еще предстоит ответить на несколько непростых вопросов.
Например, необходимо выяснить, насколько опасны подобные
вмешательства в естественную микрофлору кишечника, индивидуальную
для каждого человека.
Источник