Как происходит переваривание нуклеиновых кислот в желудочно кишечном тракте
С пищей в сутки в организм поступает около 1 г нуклеиновых кислот.
Переваривание нуклеиновых кислот происходит в тонком кишечнике. Сначала, поступившие с пищей нуклеиновые кислоты под действием ферментов панкреатического сока – нуклеаз – превращаются в мононуклеотиды. Затем уже под влиянием ферментов тонкого кишечника от мононуклеотидов отщепляется фосфорная кислота, и образуются нуклеозиды. Часть нуклеозидов расщепляется затем на азотистое основание и углевод.
Продукты переваривания нуклеиновых кислот поступают в кровь, а затем в печень и другие органы.
В клетках организмов обмен РНК протекает значительно более интенсивно, чем обмен ДНК. В конечном итоге нуклеиновые кислоты расщепляются на азотистые основания, углеводы и фосфорную кислоту.
Далее пуриновыеазотистые основания в процессе катаболизма теряют аминогруппу в виде аммиака, окисляются и превращаются в мочевую кислоту.
Пиримидиновые основания подвергаются более глубокому расщеплению до углекислого газа, воды и аммиака.
Углеводывовлекаются в ГМФ-путь распада и превращаются в глюкозу.
Фосфорная кислотараспаду не подвергается. Она используется в реакциях фосфорилирования и фосфолиза или при избытке выделяется из организма с мочой.
Синтез нуклеотидов.
Все клетки организма способны синтезировать необходимые нуклеиновые кислоты и не нуждаются в наличии в пище готовых нуклеиновых кислот или их составных частей. Поэтому содержание готовых нуклеиновых кислот в пище для организма принципиального значения не имеет, хотя продукты их распада могут частично использоваться организмом.
Синтез пуриновых и пиримидиновых нуклеотидов происходит на основе рибозо-5-фосфата. из глюкозы при её распаде по ГМФ-пути. Свободные азотистые основания обычно для этого синтеза не используются.
При синтезе пуриновых нуклеотидов к рибозо-5-фосфату присоединяются атомы углерода и азота, из которых образуется пуриновое кольцо. Источниками этих атомов являются аминокислоты глицин, глутамин, аспарагиновая кислота.Часть атомов углерода поставляется коферментами, содержащими в своём составе фолиевую кислоту и биотин. Промежуточным продуктом синтеза пуриновых нуклеотидов является инозиновая кислота. Далее из инозиновой кислоты образуются пуриновые нуклеотиды.
Синтезу пиримидиновых нуклеотидов предшествует образование необычного азотистого основания оротовой кислоты,содержащей пиримидиновое кольцо. Синтезируется оротовая кислота из аммиака и аспарагиновой кислоты. Оротовая кислота присоединяется к рибозо-5-фосфату и возникает пиримидиновый нуклеотид оротидинмонофосфат.Далее оротовая кислота в составе этого нуклеотида преобразуется в обычные азотистые основания, в результате чего появляются пиримидиновые нуклеотиды.
В связи с высокой важностью оротовой кислоты в спортивной практике в качестве пищевой добавки используется её соль оротат калия.
Дезоксирибонуклеотидыобразуются из соответствующих рибонуклеотидов путём восстановления входящей в них рибозы в дезоксирибозу.
Синтез нуклеиновых кислот.
Для синтеза нуклеиновых кислот используются мононуклеотиды обязательно в трифосфатной форме. Такие нуклеотиды содержат в своей молекуле три остатка фосфорной кислоты и обладают повышенным запасом энергии. Переход нуклеотидов в трифосфатную форму осуществляется путем взаимодействия с АТФ. Для синтеза РНК используются АТФ, ГТФ, УТФ, ЦТФ. А для синтеза ДНК, соответственно, дАТФ, дГТФ, дТТФ, дЦТФ.
Процесс репликации или редупликацииДНК иначе можно назвать удвоением.Он происходит перед делением клетки. Осуществляет его специальный фермент ДНК полимераза. Этот фермент разделяет две цепи двойной спирали и достраивает к каждой из них комплементарную ей цепь. Таким образом, из одной молекулы образуется две одинаковые дочерние молекулы, причем обе цепи ДНК служат матрицами для дочерних цепей. По мере присоединения к матрице нуклеотиды связываются в полинуклеотидные нити, которые сразу же закручиваются в двойную спираль. Биологический смысл репликации состоит в том, что из одной молекулы ДНК появляются две ее полные копии. Процесс этот идет с очень высокой точностью – ошибки крайне редки.
Процесс синтеза РНК называется транскрипцией. Процесс образования белков на матрицах информационной РНК называется трансляцией.
Транскрипцию осуществляет фермент РНК-полимераза. Этот фермент соединяет между собой рибонуклеотиды, составляющие остов молекулы РНК. Делает это фермент на основании считывания последовательности молекулы ДНК и, достраивая комплементарные ей последовательности. Показано, что в этом процессе только одна из двух цепей ДНК играет роль матрицы. Бывают, правда, и исключения – это ДНК некоторых вирусов. В процессе транскрипции участвует только ограниченный участок ДНК. Именно этот участок ДНК и понимают в молекулярной биологии, как ген.
ОБМЕН БЕЛКОВ.
1. Переваривание и всасывание белков.
2. Катаболизм белков.
3. Синтез белков.
4. Метаболизм аминокислот.
5. Азотистый баланс. Обезвреживание аммиака.
Источник
Пищевые нуклеопротеины,
попадая в организм человека, в желудке
отщепляют белковый компонент и
денатурируют под действием НС1 желудочного
сок. Далее полинуклеотидная часть этих
молекул гидролизуется в кишечнике до
мононуклеотидов.
В расщеплении нуклеиновых
кислот принимают участие ДНК-азы
и РНК-азы панкреатического
сока, которые, будучи эндонуклеазами,
гидролизуют макромолекулы до
олигонуклеотидов. Последние под действием
фосфодиэстераз панкреатической железы
расщепляются до смеси 3′- и 5′-мононуклеотидов.
Нуклеотидазы и
неспецифические фосфатазы
гидролитически отщепляют фосфатный
остаток нуклеотидов и превращают их в
нуклеозиды, которые либо всасываются
клетками тонкого кишечника, либо
расщепляются нуклеозидфосфорилазами
кишечника с образованием рибозо- или
дезоксирибозо-1-фосфата, пуриновых и
пиримидиновых оснований.
Пищевые пурины и пиримидины
не являются незаменимыми пищевыми
факторами и очень мало используются
для синтеза нуклеиновых кислот тканей.
В энтероцитах обнаружена высокая
активность ксантиноксидазы – фермента,
который большую часть пуринов, поступающих
в клетки, превращает в мочевую кислоту,
удаляющуюся с мочой. Пиримидиновые
основания, не успевшие поступить в
энтероциты, под действием микрофлоры
кишечника расщепляются до NH3,
CO2,
β-аланина и β-аминоизобутирата.
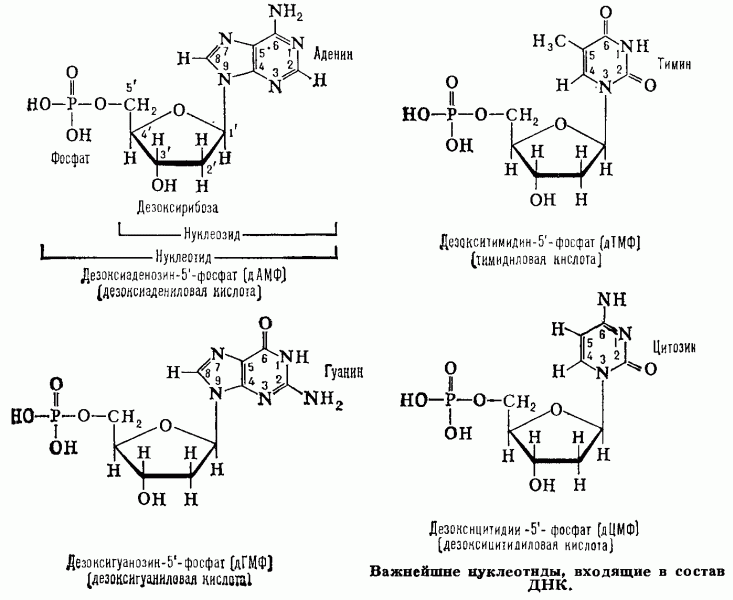
Вопрос № 2.Структура нуклеотида
В
каждом нуклеотиде можно выделить 3
части:
1.
Углевод – это пятичленный сахар-пентоза
(рибоза или дезоксирибоза).
2.
Фосфорный остаток (фосфат) – это остаток
фосфорной кислоты.
3.
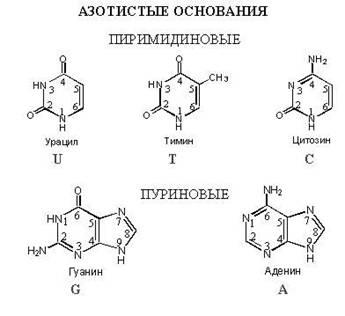
Азотистое основание – это соединение, в
котором много атомов азота. В нуклеиновых
кислотах используется всего 5 видов
азотистых оснований : Аденин, Тимин,
Гуанин, Цитозин, Урацил. В ДНК – 4 вида:
Аденин, Тимин, Гуанин, Цитозин. В РНК
– тоже 4 вида: Аденин, Урацил, Гуанин,
Цитозин, Легко заметить, что в РНК
происходит замещение Тимина на Урацил
по сравнению с ДНК.
Общая
структурная формула пентозы (рибозы
или дезоксирибозы), молекулы которой
образуют “скелет” нуклеиновых
кислот:
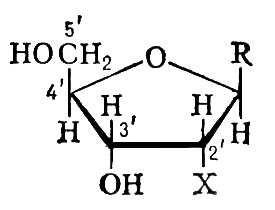
Если
Х заменить на Н (Х = Н) – то получаются
дезоксирибонуклеозиды; если Х заменить
на ОН (Х = ОН) – то получаются рибонуклеозиды.
Если вместо R подставить азотистое
основание (пуриновое или пиримидиновое)
– то получится конкретный нуклеотид.
Важно обратить внимание на
те положения атомов углерода в
пентозе, которые обозначены как 3′ и
5′. Нумерация атомов углерода начинается
от атома кислорода вверху и идёт по
часовой стрелке. Последним получается
атом углерода (5′), который располагается
за пределами пентозного кольца и
образует, можно сказать, “хвостик”
у пентозы. Так вот, при наращивании
цепочки из нуклеотидов фермент может
присоединить новый нуклеотид только к
углероду 3′ и ни к какому другому. Поэтому
5′-конец нуклеотидной цепочки никогда
не сможет иметь продолжения, удлинняться
может только 3′-конец.
Азотистые основания

Нуклеотиды
Наращивание нуклеотидной цепочки днк
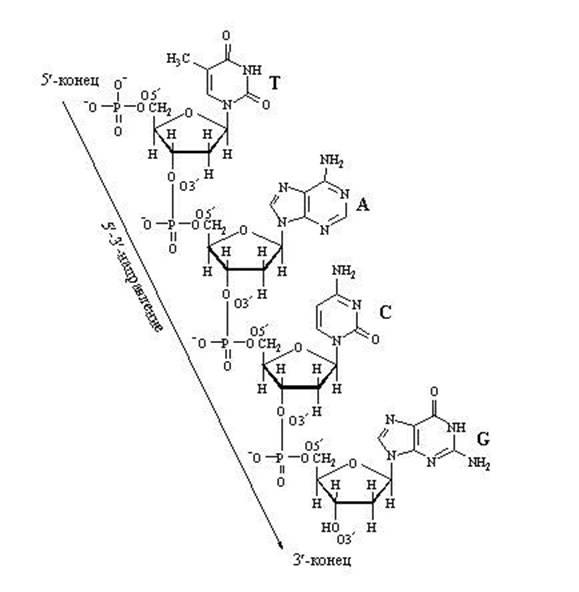
Наращивание цепочки за
счёт “продольных” связей между
нуклеотидами может идти только в одном
направлении: от 5′ ⇒
к 3′, т.к. новый нуклеотид можно присоединить
только к 3′-концу цепочки, но не к
5′-концу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Оглавление по разделу: «Ответы на вопросы по биохимии»
Навигация
- Переваривание нуклеопротеинов и нуклеиновых кислот в ЖКТ: ферменты, химизм, конечные продукты и их всасывание
- Пути использования в организме продуктов гидролиза нуклеиновых кислот экзо — и эндогенного происхождения
- Основной путь синтеза пиримидиновых нуклеотидов: химизм, ферменты
- Основной путь синтеза пуриновых нуклеотидов: начальные стадии биосинтеза (от рибозо-5- фосфата до 5-фосфорибозиламина). Инозиновая кислота и ее роль. Происхождение атомов пуринового ядра
- Дополнительные пути синтеза нуклеотидов
- Биосинтез дезоксирибонуклеотидов
- Распад пиримидиновых нуклеотидов, конечные продукты и их судьба
- Распад пуриновых нуклеотидов, конечные продукты их судьба
- Нарушение обмена пуринов: подагра, мочекаменная болезнь, гиперурикемия, ксантинурия
- Количественное определение мочевой кислоты в сыворотке крови: принцип метода, показатели нормы, диагностическое значение
- Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания экзогенного железа
- Синтез железосодержащих хромопротеинов в тканях. Глицино-янтарный цикл Шемина
- Распад гемоглобина в тканях. Прямой и непрямой билирубин. Химизм образования прямого билирубина
- Нарушение пигментного обмена. Желтухи, механизм их возникновения
Переваривание нуклеопротеинов и нуклеиновых кислот в ЖКТ: ферменты, химизм, конечные продукты и их всасывание
Нуклеотиды поступают в организм с пищей в составе нуклеопротеинов. После воздействия протеолитических ферментов желудка и кишечника из них освобождаются нуклеиновые кислоты и белковая часть.
Белки перевариваются обычным порядком, нуклеиновые кислоты с помощью дополнительных ферментов.
Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы, гидролизующие нуклеиновые кислоты до полинуклеотидов.
После действия панкреатических нуклеаз полинуклеотидазы (или фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований.
Пути использования в организме продуктов гидролиза нуклеиновых кислот экзо- и эндогенного происхождения
В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой.
Большая часть тех пуринов, что всосались, в энтероцитах также превращается в мочевую кислоту, при этом не происходит их включения во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот. Как и пурины, свободные пиримидины в основном катаболизируют и выделяются без их использования в организме.
Таким образом, нуклеиновые кислоты пищи не поступают из кишечника в кровоток и не выступают в роли поставщика непосредственных предшественников ДНК и РНК клеток организма. И хотя млекопитающие потребляют значительные количества нуклеиновых кислот и нуклеотидов, их жизнедеятельность не зависит от всасывания этих веществ или соответствующих продуктов распада.
Основной путь синтеза пиримидиновых нуклеотидов: химизм, ферменты
Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует глутамин, СО2, аспартат, затрачивается 2 молекулы АТФ.
Условно можно выделить этапы синтеза:
- Образование карбамоилфосфата, но в отличие от синтеза мочевины эта реакция идет в цитозоле.
- Образование пиримидинового кольца после присоединения аспарагиновой кислоты и реакции дегидратации. Первым пиримидиновым основанием является оротовая кислота.
- Синтез оротидилмонофосфата и уридинмонофосфорной кислоты (УМФ). В реакции с фосфорибозилдифосфатом (ФРДФ) к оротовой кислоте присоединяется рибозо-5-фосфат и образуется оротидилмонофосфат, непосредственный предшественник УМФ.
- Синтез УТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ.
- Синтез ЦТФ происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося источником NH2-группы.
Основной путь синтеза пуриновых нуклеотидов: начальные стадии биосинтеза. Инозиновая кислота и ее роль. Происхождение атомов пуринового ядра
Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени.
Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа. Но будет рассмотрен только первый этап — начальные стадии биосинтеза пуриновых нуклеотидов.
Первый этап: синтез 5′-фосфорибозиламина.
Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Первая реакция синтеза пуринов заключается в активации углерода в первом положении рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ).
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5-фосфорибозиламина. Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Инозиновая кислота и его роль
Инозиновая кислота или инозин монофосфат (ИМФ) — нуклеотид, являющийся монофосфатом соответствующего рибонуклеозида гипоксантина. Инозиновая кислота играет важную роль в метаболизме.
Биологически важными производными инозиновой кислоты являются пуриновые нуклеотиды, входящие в состав нуклеиновых кислот, а также АТФ, который служит для сохранения химической энергии в клетках.
Происхождение атомов пуринового ядра
Дополнительные пути синтеза нуклеотидов (реутилизация оснований)
Реутилизация пуриновых оснований
Реутилизация пуриновых оснований – это процесс повторного их использования. Он особенно актуален в быстрорастущих тканях (эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот и недопустима потеря их предшественников.
Сущность реутилизации заключается в присоединении к аденину, гуанину или гипоксантину рибозо-5-фосфата и образовании АМФ, ГМФ или ИМФ. Эту реакцию осуществляют соответствующие трансферазы.
Наиболее характерным примером является реутилизация гипоксантина и гуанина под влиянием фермента гипоксантин-гуанин-фосфорибозилтрансферазы. В качестве источника рибозo-5-фосфата используется фосфорибозилдифосфат.
Реутилизация пиримидиновых оснований
Реутилизация пиримидиновых оснований сводится к повторному использованию пиримидиновых нуклеозидов. Свободные основания реутилизироваться не способны. Источником фосфатной группы является АТФ.
Биосинтез дезоксирибонуклеотидов
Особенностью обмена пуринов и пиримидинов является то, что они могут образовывать не только рибонуклеотиды, но и дезоксирибонуклеотиды.
Дезоксирибонуклеотидтрифосфаты необходимы клетке для синтеза ДНК.
Их образование протекает в три реакции:
- В начале процесса происходит дефосфорилирование рибонуклеозидтрифосфатов с образованием АДФ, ГДФ, ЦДФ, УДФ.
- Далее фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин, его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
- После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Синтез тимидилтрифосфата
Три дезоксинуклеотида – dАТФ, dГТФ, dЦТФ сразу после синтеза используются для синтеза ДНК. Однако известно, что в составе ДНК нет уридиловых нуклеотидов, поэтому dУДФ не превращается в dУТФ, а идет на образование тимидилового нуклеотида.
Участие в этом принимает фермент тимидилатсинтаза.
Донором метильной группы является N5N10-метилен-ТГФК.
Восстановление дигидрофолиевой кислоты до N5N10-метилен-ТГФК происходит при участии двух ферментов – дигидрофолатредуктазы и сериноксиметилтрансферазы.
Распад пиримидиновых нуклеотидов, продукты распада, их судьба
Конечными продуктами реакции являются СО2, NH3, мочевина, β-аланин и β-аминоизомасляная кислота.
β-аланин может служить источником для синтеза ансерина и карнозина, а также для образования КоА. В тканях животных открыта специфическая аминотрансфераза, катализирующая трансаминирование между β-аланином и пировиноградной кислотой. В процессе этой обратимой реакции синтезируются α-аланин и формилацетат (полуальдегид малоновой кислоты):
Образовавшийся формилацетат далее подвергается окислительному декарбоксилированию с образованием углекислоты и ацетил-КоА,который используется для энергетических целей.
Распад пуриновых нуклеотидов, продукты распада, их судьба
Конечный продукт — мочевая кислота, которая выводится из организма вместе с мочой.
Нарушения обмена пуринов
Гиперурикемия
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии.
Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой.
В зависимости от длительности и тяжести гиперурикемия проявляется:
- Появление тофусов (греч. tophus – пористый камень, туф) – отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах.
- Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь.
- Подагра – поражение мелких суставов.
Подагра
Подагра — хроническое заболевание,связанное с нарушением мочекислого обмена веществ: повышенным содержанием в крови мочевой кислоты и отложением в тканях ее солей-уратов. Клинически заболевание проявляется рецивирующим острым артритом и образованием тофусов (уплотнение подкожной клетчатки).
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой.
Главным провоцирующим фактором кристаллизации является увеличение кислотности мочи. При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах.
Ксантинурия
Наследственная болезнь, обусловленная недостаточностью фермента ксантиноксидазы и характеризующаяся нарушением пуринового обмена; проявляется рецидивирующей гематурией и болями в поясничной области, повышением содержания ксантина в плазме крови и моче.
В плазме крови и моче может наблюдаться 10-ти кратное снижение уровня мочевой кислоты, но увеличивается в 10 и более раз экскреция ксантина и гипоксантина.
Основное клиническое проявление – образование ксантиновых конкрементов, величиной до нескольких миллиметров, коричневого цвета, сравнительно мягкой консистенции. Постепенно может развиться патология почек.
Почечная недостаточность — одно из наиболее грозных осложнений у этой категории больных. Это связано с нефролитиазом.
Определение содержания мочевины в сыворотке крови
Принцип метода
Метод основан на образовании мочевины с диацетилмонооксимом продукта красного цвета в присутствии тиосемикарбазида и солей железа. Интенсивность окраски образовавшегося соединения пропорциональна содержанию мочевины и определяется колориметрически при длине волны 540-560 нм (зеленый светофильтр).
Клинико-диагностическое значение
У здорового человека содержание мочевины составляет в сыворотке крови 3,0-8,3 ммоль/л, в слюне – 2,3-2,8 ммоль/л.
Повышение мочевины в крови отмечается при заболеваниях почек (нарушении выделительной функции), при избыточном белковом питании, при интенсивном распаде белка, при обезвоживании (диарея, лихорадка).
Концентрация мочевины в слюне тесно связана с ее содержанием в крови. Основная часть мочевины секретируется в слюну околоушной железой, с увеличением скорости слюноотделения содержание мочевины в смешанной слюне снижается.
Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания экзогенного железа
Fе соединяется со специфическим белком и связывается с рецепторами мембраны энтероцита. Поступившее внутрь клетки железо переносится к противоположной стороне мембраны специфическим белком, который отдаёт железо в кровь, а сам разрушается в лизосомах.
При дефиците железа в организме происходит расширение зон всасывания на слизистой оболочке верхнего отдела подвздошной кишки, сопровождающееся усилением синтеза железосвязывающего белка.
Всасывается лишь 5-10% железа, поступившего в организм (около 1 мг в сутки).
Всасыванию способствуют витамин Е, фолиевая кислота, НСl. Тормозят абсорбцию железа ионы Са и Р (поэтому препараты железа нельзя запивать молоком), а также фитиновая кислота (её много в крупах).
Поступление железа из энтероцитов в кровь регулируется синтезом особого белка энтероцитов – апоферритина, который способен связывать абсорбированное железо, что снижает возможность всасывания последнего в капилляры крови из клеток кишечника. При этом из апоферритина образуется ферритин. При дефиците железа в организме последний отдаёт железо в кровь, а если такой необходимости нет, то через несколько дней внутриклеточный ферритин выделяется с калом при десквамации эпителиальных клеток.
Синтез железосодержащих хромопротеинов в тканях
Исходными веществами в этом метаболическом пути являются аминокислота глицин и метаболит цикла Кребса сукцинил-КоА.
Синтез происходит в ретикулоцитах (незрелых эритроцитах, содержащих клеточное ядро). Реакции идут в митохондриях и цитоплазме клеток.
Первая стадия в последовательности реакций, ведущих к синтезу гема, катализируется δ-аминолевулинат-синтазой. Фермент абсолютно специфичен к субстратам; кофакторами фермента являются пиридоксаль-5-фосфат и ионы Mg2+.
Имеются данные о том, что некоторые лекарственные препараты, а также стероидные гормоны, напротив, индуцируют синтез печёночной δ-аминолевулинат-синтазы.
Во второй реакции, катализируемой δ -аминолевулинат-дегидратазой, при конденсации двух молекул δ-аминолевулината образуется порфобилиноген.
В дальнейшем из четырёх молекул порфобилиногена в результате ряда сложных ферментативных реакций образуется протопорфирин IX – непосредственный предшественник гема.
При участии митохондриального фермента феррохелатазы двухвалентное железо включается в уже готовую структуру протопорфирина. Для протекания этой реакции необходимы аскорбиновая кислота и цистеин в качестве восстановителей. Ингибитором феррохелатазы является свинец.
На заключительном этапе происходит соединение гема с белковыми цепями, характерными для синтезируемого хромопротеина. Конечные продукты этого биосинтеза (гем, гемоглобин) подавляют начальные реакции по механизму отрицательной обратной связи.
Распад гемоглобина в тканях. Прямой и непрямой билирубин. Химизм образования прямого билирубина.
Эритроциты имеют время жизни примерно 120 дней. При физиологических условиях в организме взрослого человека разрушается около 1 — 2×1011 эритроцитов в сутки. Их катаболизм происходит главным образом в ретикулоэндотелиальных клетках селезёнки, лимфатических узлах, костного мозга и печени.
Этапы образования желчных пигментов:
- в РЭС (ретикуло-эндотелиальная система);
- в гепатоцитах;
- в кишечнике.
Первый этап образования желчных пигментов — в клетках РЭС. Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Фермент катализирует расщепление α-метинового мостика между двумя пиррольными кольцами. При этом выделяется эндогенный угарный газ — СО (поступает в эритроциты, где образуется карбоксигемоглобин, норма — до 1,5%). В результате реакции образуется вердоглобин:
Затем от него спонтанно отщепляется белковая часть (глобин) и атом железа. В результате реакции образуется линейный тетрапиррол — биливердин (первый желчный пигмент, имеет зеленый цвет, хорошо растворяется в воде и не проявляющий токсичности). Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных:
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Транспортной формой железа в плазме крови является белок трансферрин; резервная форма железа в тканях – ферритин.
Нарушения пигментного обмена. Виды желтух
- Гемолитическая желтуха — ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза любого происхождения — сепсис, лучевое поражение, несовместимость крови по системе АВ0 или резус-фактору, дефект глюкозо-6-фосфатдегидрогеназы, отравление гемолитическими ядами, малярия и т.д.
- Механическая желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока. Прямой билирубин поступает в кровь, развивается гипербилирубинемия.
- Паренхиматозная желтуха. Причиной может быть нарушение на всех трех стадиях превращения билирубина в печени:
- извлечение билирубина из крови печеночными клетками,
- конъюгирование билирубина,
- АТФ-зависимая секреция в желчь.
Источник