Кишечная микробиота что это
Микробиота кишечника (нормофлора, микрофлора) – это совокупность микроорганизмов, которая является обязательной составляющей нормальной жизнедеятельности человеческого организма. Присутствие микробов в кишечнике человека является своеобразной взаимовыгодной формой сосуществования.
Функции
- Защитная. Микробные агенты в пищеварительном канале человека располагаются и размножаются по принципу антагонизма. То есть в первые часы после рождения человека его организм получает определенные бактерии, которые образуют колонии на поверхности слизистой. При проникновении патогенных бактерий в организм для развития заболевания для них должно освободится место, то есть они должны вытеснить нормальную микрофлору. Микробиота вырабатывает определенные защитные вещества, которые препятствуют попаданию и размножению патогенных бактерий и вирусов.
- Иммуностимулирующая. Именно микробиота является одной из важных составляющих неспецифического звена иммунной защиты. Явление фагоцитоза, выработка поверхностных иммуноглобулинов класса А, других факторов защиты обеспечивает обезвреживание токсинов, патогенных микробов и других вредоносных для человеческого организма факторов. Повреждение микробиоты способствует развитию иммунодефицитного состояния и формированию некоторых хронических процессов (аллергические болезни у детей).
- Антитоксическая. Микробиота выполняет функцию своеобразной губки-сорбента, которая нейтрализует и выводит попадающие в кишечник человека токсины синтетического и органического происхождения, токсичные химические вещества, канцерогены. Таким образом реализуется и противоопухолевая защита человеческого организма.
- Пищеварительная. Процессы всасывания и переваривания пищи невозможны без нормально функционирующей микробиоты. Бактерии в кишечнике человека участвуют в расщеплении белков, углеводов и жиров; обеспечивают синтез витаминов РР, группы В, К. Микробиота регулирует некоторые процессы жирового обмена, что обеспечивает ее антихолестериноновое действие.
- Моторно-эвакуаторная. Микробиота регулирует газовый состав внутри кишечника, определяет своевременное и регулярное выведение продуктов жизнедеятельности организма.
Микробиота кишечника выполняет много полезных функций. Именно поэтому важно соблюдать ее баланс и ни в коем случае не преследовать цель уничтожения микробной ассоциации.
Представители кишечной микрофлоры
Все представители микробиоты кишечника важны, однако количество отдельных групп микроорганизмов неравномерно. Важно процентное соотношение содержания отдельных групп, так как такое равновесие и обеспечивает правильное функционирование кишечной микрофлоры.
Всех представителей микробиоты человеческого пищеварительного тракта можно разделить на 3 большие группы. Для каждой из них типичны свои определенные группы.
- Нормальные микроорганизмы. Это бифидо- и лактобактерии, а также бактероиды. Наиболее многочисленная, то есть доминирующая составляющая микробиоты человеческого кишечника. Эти микробные агенты выполняют пищеварительную, защитную, иммуностимулирующую функции. Патогенными свойствами не обладают, то есть не могут вызвать заболевание. В целом можно сказать, что чем больше нормальных микроорганизмов в микробиоте, тем лучше для человека.
- Условно-патогенные микроорганизмы. Название этой группы микробных агентов очень точно отражает их особенности и возможности. Это та составляющая, которая может играть как положительную, так и отрицательную роль в организме человека. При небольшом количестве она выполняет защитную роль, то есть препятствует колонизации патогенными бактериями и вирусами. При значительном количестве, в том случае, когда условно-патогенная флора начинает доминировать над нормальной, она вызывает клинически значимые заболевания пищеварительного канала, то есть кишечные инфекции.
- Патогенные микроорганизмы. Этих микробных агентов в организме человека быть не должно, так как никаких положительных действий они не осуществляют. Как следует из названия, они могут спровоцировать только клинически манифестные заболевания пищеварительного канала. Есть только некоторые исключения, например Clostridium tetani – возбудитель столбняка. Манифестные формы болезни развиваются только при попадании этого микроба в глубокую рану (безвоздушные условия). В кишечнике он не выделяет токсин, поэтому не представляет опасности для человека.
Наибольшее количество микроорганизмов заселяют дистальные (ближе к концу) отделы кишечника. Содержание микробных агентов в тонкой кишке несколько меньше, чем в толстой. Наименьшее микробное обсеменение регистрируется в желудке и двенадцатиперстной кишке, так как в этой части пищеварительного канала действие пищеварительных соков и ферментов наиболее агрессивно.
| Нормальные | Условно-патогенные | Патогенные |
|
|
|
Количественное соотношение различных групп может иметь индивидуальный характер, поэтому оценить состав микробиоты конкретного человека может только врач.
От чего зависит состояние микробиоты кишечника?
На состав и количественное соотношение микрофлоры оказывают влияют внешние и внутренние факторы. Среди них наиболее значимы:
- хроническая патология пищеварительного канала (язвенное поражение, ферментопатии);
- системные эндокринные заболевания;
- иммунодефицитные состояния;
- повторные эпизоды острых инфекционных болезней;
- стрессовое состояние;
- длительное несбалансированное питание и неправильный питьевой режим;
- длительное проживание в условиях жаркого или холодного климата, ионизирующей радиации и др.
Повреждающее действие на микробиоту оказывает длительно действующий фактор. Однократное воздействие, например, эпизод переедания на фоне рационального питания, существенного вреда не нанесет.
Какие симптомы указывают на проблемы с микрофлорой?
Клинические проявления дисбактериоза, то есть нарушения микробиоты кишечника, зависят от степени нарушения и могут быть явно выражены, либо не проявляться вовсе.
Среди возможных признаков дисбактериоза следует рассматривать:
- склонность к поносу или, наоборот, к запорам;
- появление метеоризма, диффузной боли в животе умеренной интенсивности;
- ухудшения аппетита, эпизоды тошноты и рвоты;
- снижение работоспособности, постоянная усталость и сонливость.
Заподозрить развитие именно дисбактериоза в такой ситуации практически невозможно, так как специфических симптомов нет. Поэтому потребуется лабораторное обследование и консультация специалиста.
Как проверить микрофлору кишечника?
Существует несколько методов, каждый из которых имеет свои преимущества и недостатки. Наиболее распространен метод бактериологический, то есть исследование каловых масс с помощью традиционного бактериологического посева. Выделяются отдельные виды бактерий, исследуются все их свойства, в том числе и чувствительность к антибиотикам. Исследование длится 4-5 дней. Достаточно доступно по цене, может быть проведено в любой лаборатории, так как особенного технического оснащения не требуется. Результат может значительно варьировать, так как высоко влияние человеческого фактора.
Хроматографический метод по Осипову заключается в определении компонентов микробных клеток, то есть быстрой идентификации микроба по специфическим морфологическим составляющим. Метод отличается высокой специфичностью – обнаруживают более 50 видов микробных агентов. Недостатками являются высокая стоимость, ограниченная доступность, так как необходимо хорошее техническое оснащение лаборатории.
Профилактика и терапии нарушения микрофлоры
Лечение и профилактические мероприятия, направленные на сохранение микробиоты человека, имеют много общего, но должны иметь комплексный и системный характер.
Питание
Все что входит в понятие «здоровое питание», может быть рассмотрено как лечебная и профилактическая составляющая.
| Рекомендуемые продукты | Нерекомендуемые продукты |
|
|
Не следует ставить знак равенства между здоровым питанием и скучной диетой. Важно соблюдать главные принципы, чтобы питание было разнообразным и полноценным, а кишечник – здоровым.
Препараты
Лекарственные средства должен назначать только доктор. Прием любых медикаментов «на всякий случай для профилактики» может нанести серьезный вред кишечной микробиоте. При патологии доктор может назначить такие группы препаратов:
- пробиотики – средства, содержащие лакто- и бифидобактерии; при введении в организм они вытесняют условно-патогенную и патогенную флору по принципу антагонизма;
- пребиотики – вещества, способствующие росту нормальной микрофлоры, например, лактулоза;
- симбиотики – лекарственные средства, сочетающие свойства пробиотиков и пребиотиков.
Длительность лечения и необходимая дозировка устанавливается в индивидуальном порядке.
Пересадка микробиоты
Процедура которая еще называется «пересадкой кала». Ее принцип заключается в искусственном внедрении микробной ассоциации в пищеварительный канал человека. Наиболее целесообразна при поражении клостридиями. Необходимый микробный комплекс может быть внедрен в процессе колоноскопии, с помощью клизмы или в виде капсул.
Источник
Кишечная микробиота – это совокупность различных видов микроорганизмов, населяющих кишечник человека. По последним данным, число ее представителей не меньше, чем клеток в человеческом организме, а число родов и видов, по оценкам, превышает 50 и 500 соответственно. В ходе обширного исследования европейской (MetaHIT) и американской (HMP) популяций было выяснено, что доминируют в составе микробиоты микроорганизмы типов Bacteroidetes и Firmicutes. В настоящее время активно обсуждается концепция энтеротипов кишечной микробиоты, которая постулирует существование устойчивых кластеров ключевых родов бактерий в организме человека, не являющихся континент- и популяционно-специфичными – это энтеротипы с преобладанием Bacteroides, Prevotella и Ruminococcus. Доминирование тех или иных видов зависит во многом от возраста макроорганизма. Имеются данные о том, что микроорганизмы могут заселять пищеварительный тракт плода еще до рождения. Микробиота кишечника выполняет защитную функцию, участвует в регуляции иммунной, нервной и эндокринной систем, является важным участником пищеварительных процессов, синтезирует витамины групп В и К, местные антибиотики, короткоцепочечные жирные кислоты, играет важную роль в нейтрализации лекарств и ксенобиотиков. В статье приводятся краткое описание и сравнение особенностей традиционных и современных методов исследования микробиоты.
Ключевые слова: микробиота, точная медицина, энтеротип, культуральный метод, секвенирование, полимеразная цепная реакция, ПЦР, ПЦР в реальном времени, масс-спектрометрия, 16s рРНК, shotgun-sequencing, RT-Q-PCR.
Для цитирования: Кожевников А.А., Раскина К.В., Мартынова Е.Ю. и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования. РМЖ. 2017;17:1244-1247.
Intestinal microbiota: modern concepts of the species composition, functions and diagnostic techniques
Kozhevnikov A.A.1, Raskina K.V.2, Martynova E.Yu.2, Tyakht A.V.3, Perfiliev A.V.4, Drapkina O.M.5, Sychev D.A.6, Fatkhutdinov I.R.4, Musienko S.V.3, Nikogosov D.A.3, Zhegulina I.O.4, Bavykina L.G.4, Karshieva A.V.4, Selezneva K.S.4, Alekseev D.G.3,7, Poteshkin Yu.E.1, 4
1 Russian National Research Medical University named after N.I. Pirogov, Moscow; 2 First Moscow State Medical University named after I.M. Sechenov;
3 Biomedical Holding «Atlas», Moscow; 4 «Atlas Medical Center», Moscow; 5 National Medical Research Center for Preventive Medicine, Moscow; 6 Russian Medical Academy of Postgraduate Education, Moscow; 7 Novosibirsk State National Research University
Intestinal microbiota is a community of different types of microorganisms inhabiting the human intestine. According to the latest data, the number of its representatives is not less than the number of cells in the human body, and the number of genera and species is estimated to exceed 50 and 500, respectively. In the course of an extensive study of the European (MetaHIT) and American (HMP) populations, it was found that Bacteroidetes and Firmicutes are the dominant types of microorganisms in microbiota. Currently, the concept of the intestinal microbiota enterotypesis is actively discussed. It postulates the existence of stable clusters of key bacterial genera in the human body that are not continent-specific and population-specific: they are enterotypes with the predominance of Bacteroides, Prevotella and Ruminococcus. The dominance of these or other species depends largely on the age of the individual. There is evidence that microorganisms can colonize the digestive tract of the fetus even before birth. The intestinal microbiota performs a protective function, participates in the regulation of the immune, nervous and endocrine systems, is an important participant in the digestive processes, synthesizes B and K vitamins, local antibiotics, short-chain fatty acids, plays an important role in neutralizing drugs and xenobiotics. The article briefly describes and compares the features of traditional and modern methods of microbiota research.
Key words: microbiota, precision medicine, enterotype, culture method, sequencing, polymerase chain reaction, PCR, real-time PCR, mass spectrometry, 16s rRNA, shotgun-sequencing, RT-Q-PCR.
For citation: Kozhevnikov A.A., Raskina K.V., Martynova E.Yu. et al. Intestinal microbiota: modern concepts of the species composition, functions and diagnostic techniques // RMJ. 2017. № 17. P. 1244–1247.
Источник
Статья на конкурс «био/мол/текст»: Каждый из нас хоть раз в жизни мечтал похудеть без изнурительных физических нагрузок и соблюдения строгой диеты. «Невозможно!» — скажете вы? «Нет ничего невозможного», — ответит наука. Ведь у каждой девушки есть стройная подруга, которая, не соблюдая принципы правильного питания, остается худой. «Хороший метаболизм», — мило улыбаясь, отвечает она. «Хорошая микрофлора в кишечнике», — скажу я. Эта статья расскажет вам о взаимосвязи между кишечной микрофлорой и объемом талии. Интересно? Тогда читайте дальше!
Проблема ожирения остро стоит в 21 веке — эпохе гиподинамии и фастфуда. За последние четыре года количество людей с ожирением выросло с 11,5 процентов (565 миллионов человек) до 13 процентов (670 миллионов) и продолжает стремительно расти. Если в дальнейшем тенденция не изменится, то к 2025 году от ожирения будут страдать уже около 17 процентов населения планеты. Также стоит отметить, что ожирение — это системное заболевание, которое ведет к сердечно-сосудистым патологиям и серьезным метаболическим нарушениям
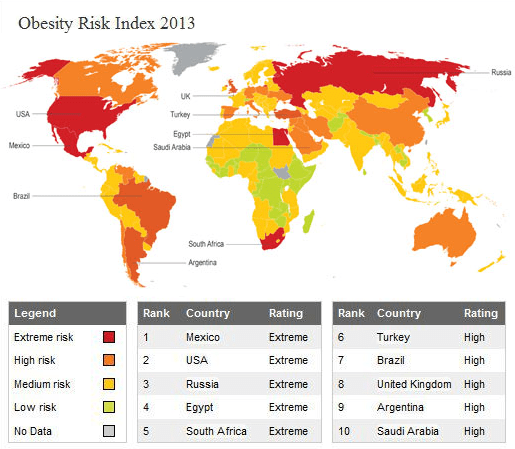
Проблема ожирения касается всего мира, что наглядно показывает карта на рисунке 1. Разумеется, мы не можем оставаться равнодушными к ней. Так давайте разберемся, в чем причина этого заболевания, и можно ли побороть ожирение?

Рисунок 1. Степень риска ожирения в странах мира в 2013 г.
Микробиота кишечника — ключ к пониманию причин проблемы?
Микробиота кишечника — это микроорганизмы, которые живут в желудочно-кишечном тракте в симбиозе с человеком. Они делятся на полезных (которые помогают нашему организму, выполняя ряд жизненно важных функций), условно патогенных (которые в норме находятся в кишечнике в небольшом количестве, но при снижении иммунитета и увеличении их популяции могут приводить к ряду заболеваний) и патогенных (которые приносят вред здоровью человека). Нормофлора, или полезная микрофлора (бифидобактерии, бактероиды, лактобактерии, фузобактерии, кишечная палочка, энтерококки, стафилококки) обеспечивает ряд важных функций:
- Защитная функция выполняется за счет формирования защитного барьера слизистой оболочки кишечника. Нормофлора (облигатная микрофлора) подавляет или уменьшает прилипание патогенных агентов путем конкурентного исключения. Например, лактобактерии пристеночной (мукозной) микрофлоры занимают определенные рецепторы на поверхности эпителиальных клеток. Патогенные бактерии, которые могли привязаться к тем же рецепторам, устраняются из кишечника из-за того, что им просто некуда прикрепиться. Также облигатная микрофлора может более «агрессивно» бороться с чужаками: например, бифидобактерии за счет ферментации олиго- и полисахаридов продуцируют молочную кислоту и ацетат, которые подавляют рост патогенных бактерий, что повышает резистентность организма к кишечным инфекциям.
- Также микробиота выполняет иммуногенную функцию (за счет стимуляции иммунной системы, местного иммунитета, в том числе выработки иммуноглобулинов). Например, энтерококки могут активировать В-лимфоциты и повышать синтез IgA (который отвечает за местный иммунитет), а кишечная палочка вырабатывает колицин В, чем подавляет рост патогенной микрофлоры. Лактобактерии воздействуют на специфические скопления лимфоидной ткани, благодаря этому происходит стимуляция клеточного и гуморального иммунных ответов.
- Также эти микроорганизмы участвуют в обмене веществ, обеспечивая мембранное пищеварение, регулируя биотрансформацию желчных кислот путем уменьшения всасывания холестерина из пищеварительного тракта. А холестерин, как известно, является материалом для образования желчных кислот в печени. Вместе с тем они формируют иммунологическую толерантность к пищевым и микробным агентам. Нормальная микрофлора участвует в синтезе и всасывании витаминов группы В, фолиевой и никотиновой кислот, кальция, железа и витаминов D и K. Кроме того, благодаря ферментам микроорганизмов переваривается клетчатка (например, целлюлоза), которая без их помощи не усваивается. После анаэробного расщепления клетчатки образуется водород, двуокись углерода, метан и летучие жирные кислоты (большая часть которых всасывается в кровь и используется для энергетических целей). Исходя из этого, появляется еще одна важная функция — выработка и снабжение организма энергией или энергетическим субстратом (бутиратом).
Анализируя эти данные, мы понимаем, насколько важный вклад в наше здоровье вносит кишечная микробиота. Как говорил Георгий Ратнер: «Только подумать, какие умнейшие и сложнейшие процессы непрерывно ведет организм, чтобы сохранить нам здоровье, и как глупо и бездарно в жизни действуем мы сами».
От чего зависит состав кишечной микробиоты (КМ)?
Количественный и качественный состав зависит от многих факторов:
- возраст (у людей пожилого возраста снижается процент лактобактерий и бифидобактерий);
- общее состояние организма (наличие хронических заболеваний ЖКТ);
- прием лекарственных препаратов (антибиотиков);
- генетические особенности организма;
- питание.
Например, у приверженцев западной диеты (с высоким содержанием жиров) наблюдается уменьшение популяции Bacteroidetes и увеличение Firmicutes в составе кишечной микробиоты (КМ) [1]. Разумеется, тот факт, что регулярный прием жирной пищи приводит к ожирению, не является новым, но какую роль тут играет кишечная микрофлора? И что будет, если перенести часть кишечной микробиоты от мыши, страдающей ожирением, в организм стерильной (лишенной микрофлоры кишечника)? И могут ли определенные группы микроорганизмов приводить к ожирению? Давайте попробуем найти ответы на все эти вопросы.
Есть ли связь между ожирением и составом КМ?
Ванесса Ридаура и ее коллеги поставили очень интересный эксперимент [2], [3]. Они получили образцы микрофлоры кишечника у четырех пар человеческих близнецов (в которых один из каждой пары был худым, а другой страдал ожирением). Эти образцы вводили выращенным в стерильных условиях мышам (в кишечнике этих грызунов не было микроорганизмов) и наблюдали за тем, как животные набирают массу (рис. 2). Кормили мышек кормом, богатым клетчаткой и с нормальным процентом жира.
Оказалось, что те мыши, которые получили микрофлору худых людей, спустя несколько недель сохраняли нормальный процент жира в теле, а те, которым досталась кишечная микрофлора толстяков, начинали набирать вес (хоть и питались нежирной пищей). Когда мышей обеих групп после заражения помещали в одну клетку, и они начинали обмениваться микрофлорой (мыши иногда поедают фекалии), то микробиота худых «побеждала» микробиоту толстяков: обе группы мышей оставались худыми.

Рисунок 2. Обычная мышь и мышь страдающая ожирением.
рисунок The Rockefeller University / AP
Похожий эксперимент проводили исследователи из Медицинской школы Мичиганского университета [4]. Поначалу биологи вырастили поколение стерильных мышек (без кишечной микрофлоры). После этого заселили их кишечник человеческими бактериями (материал взяли из фекалий здорового человека с нормальной массой тела). Далее лабораторных грызунов разделили на две группы. Первую кормили едой с большим содержанием клетчатки, вторую — жирной и калорийной пищей, которая практически лишена клетчатки. Изначально в обеих группах показатели кала почти не отличались, но позднее были обнаружены существенные изменения. У мышей, которые употребляли мало клетчатки, обнаруживались типичные для ожирения изменениям КМ: снижение содержания в просвете толстой кишки Bacteroidetes и увеличение численности Firmicutes. Примечательно, что животные с подобными изменениями КМ были способны усваивать больше жиров из кишечника. Увеличение численности бактерий типа Firmicutes в кишечнике мышей при кормлении жиром находили на протяжении нескольких месяцев. Вернуть потерянную микрофлору помог только метод трансплантации фекалий. В этом случае по прошествии десяти дней после процедуры состав и разнообразие бактерий кишечника грызунов из разных групп уже нельзя было отличить. По мнению ученых, снижение разнообразия КМ является одной из причин ожирения, и прием жирной пищи бедной клетчаткой способствует этому [1], [5].
Подобное влияние на КМ пищи с высоким содержанием жиров найдено также у человека. Увеличение потребления калорий с 2400 до 3400 ккал/сут., как у людей с ожирением, так и без него, приводили к быстрым изменениям КМ: в фекалиях наблюдалось 20-процентное увеличение количества Firmicutes и соответствующее уменьшение Bacteroidetes [6].
Исходя из результатов этих экспериментов мы можем предположить, что в организме все же есть популяция бактерий, отвечающая за ожирение, и популяция, отвечающая за снижение массы тела. И прием жирной с пониженным содержанием клетчатки пищи способствует изменениям КМ в сторону увеличения популяции бактерий, способствующих избыточному весу [7].
Как же может кишечная микробиота вызывать ожирение?
Разумеется, мы не можем сказать, что дисбиоз является единственной причиной ожирения, так как это полиэтиологический процесс. Тем не менее он вместе с другими предрасполагающими генетическими, экологическими и социальными факторами может привести к метаболическим нарушениям в организме. Ожирение возникает тогда, когда поступление и образование энергии превышает ее потребность, а остаток неиспользованных ресурсов депонируется в жировой ткани.
Что же является одним из основных источников энергии в организме? Разумеется, это глюкоза. Результаты эксперимента [8] выявили, что у мышей с повышенным уровнем глюкозы в крови (страдающих сахарным диабетом) состав кишечной микрофлоры аналогичен составу КМ мышей с ожирением. Значит, эти процессы тесно связаны между собой [9].
Разумеется, не все люди, имеющие лишний вес, болеют сахарным диабетом, но 80% людей с сахарным диабетом имеют ожирение и чаще по абдоминальному типу, при котором жировые отложения, в основном, формируются в области живота. В народе этот тип фигуры называют «яблоком» (рис. 3).
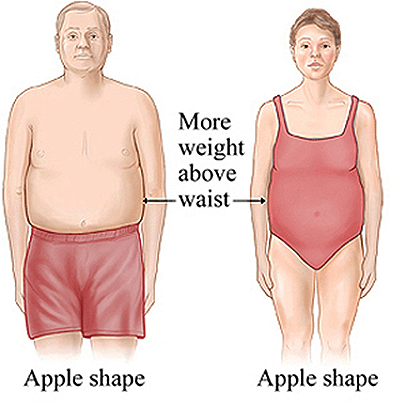
Рисунок 3. Тип фигуры «яблоко» (скопление жировой клетчатки больше в районе живота).
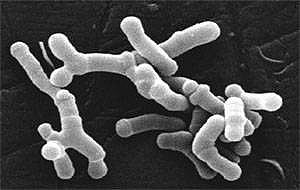
Рисунок 4. Бифидобактерии Bifidobacterium longum под электронным микроскопом. Их длина — около 5 микрометров.
Давайте попробуем разобрать механизм, при котором глюкоза способствует ожирению. Глюкоза, попадая в кровь, повышает выработку инсулина (гормона-регулятора уровня глюкозы в крови). Инсулин в свою очередь стимулирует синтез жиров и их отложение (за счет увеличения активности ферментов липогенеза, и в первую очередь АТФ-зависимого цитратрасщепляющего фермента) и тормозит их распад [5]. При этом если человек ведет «сидячий» образ жизни, синтезированные липиды откладываются в адипоцитах (так как энергия, поступающая извне, не используется и вынуждена откладываться в виде жировой ткани про запас).
Но эти процессы происходят постоянно и в здоровом организме. Значит, для того чтобы липогенез вышел за пределы нормы, нужно либо много глюкозы, либо мало инсулина, либо нарушение взаимодействия инсулина и глюкозы. Так как мышей из эксперимента, описанного выше, кормили кормами с высоким процентом жиров, а не углеводов, значит дело не в чрезмерном поступлении глюкозы в организм. Инсулин вырабатывается β-клетками поджелудочной железы, а у мышей из предыдущих экспериментов функция железы нарушена не была. Это свидетельствало о том, что проблема не в дефиците инсулина. Хотя в 2015 году ученые выдвинули теорию о прямой связи бифидобактерий (рис. 4) с синтезом глюкагоноподобного пептида-1 [8], [10]. Глюкагоноподобный пептид-1 — это инкретин, то есть вырабатывается в кишечнике в ответ на пероральный прием пищи. Он оказывает влияние на различные органы и системы, в том числе усиливает секрецию инсулина. Пептид вырабатывается L-клетками, которые располагаются в слизистой оболочке подвздошной и толстой кишок, а бифидобактерии могут стимулировать его синтез. Соответственно, если в кишечнике уменьшается количество бифидобактерий, то уменьшается количество этого пептида, а следовательно, и уровень инсулина. Но эта теория еще требует детального изучения, поэтому назвать ее основной причиной повышения сахара в организме мы пока не можем. Значит, остается вариант с нарушением усвоения глюкозы.
Кишечная микробиота и сахарный диабет 2 типа
Сахарный диабет 2-го типа (СД II или инсулинонезависимый диабет) — это метаболическое заболевание, которое проявляется нарушением обмена углеводов. В результате патологических изменений — приобретения инсулинорезистентности, то есть невосприимчивости клеток организма к этому гормону, — развивается гипергликемия (увеличение концентрации глюкозы в крови). Простыми словами, в организме — нормальный уровень инсулина и повышенный уровень глюкозы, которая по каким-то причинам не может попасть в клетки. Давайте рассмотрим механизм образования инсулинорезистентности.
Мы видим на рисунке 5 рецептор инсулина, который состоит из двух субъединиц:
- α — реагирует с инсулином вне клетки;
- β — субъединица, которая уже связана со вторичными мессенджерами, субстратами инсулинового рецептора 1-го и 2-го типов.
Рецептор инсулина представляет собой тирозинкиназу [12]. Посредством аутофосфорилирования активируются различные пути, в частности, путь PI3K (фосфоинозитид-3-киназы), за счет которого и происходит транспорт глюкозы внутрь клетки, так как приходит в свое активное рабочее состояние транспортер глюкозы GLUT4. Так глюкоза попадает в клетку в норме.
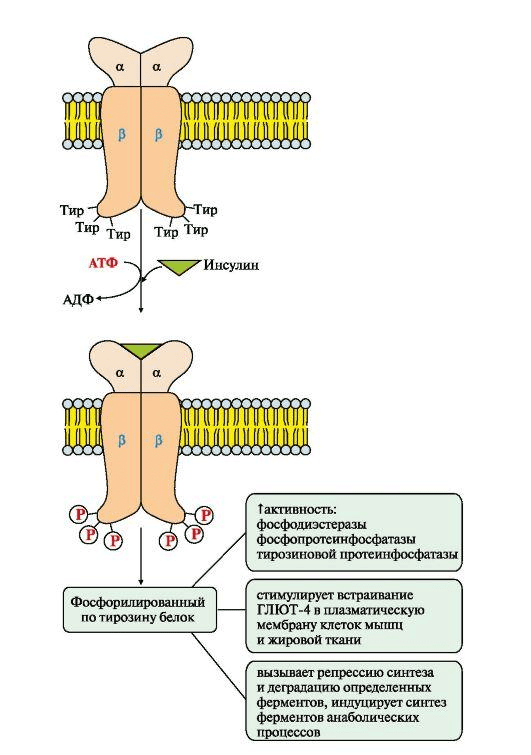
Рисунок 5. Схема активации рецептора инсулина
Рассмотрим, что происходит с этим механизмом при дисбиозе [7]. В организме увеличивается количество вредных бактерий, которые при взаимодействии с рецепторами на стенках кишечника могут вызывать процесс воспаления и активировать иммунную систему. Вы никогда не задумывались, почему наш организм не отвергает полезных микроорганизмов и как он различает, какие из них полезные, а какие вредные? А все потому, что в кишечной стенке присутствуют энтероциты, бокаловидные, дендритные и эндокринные клетки, которые помимо выполнения своей основной функции содержат толл-подобные рецепторы (англ. toll-like receptor, TLR; от нем. toll — замечательный) [13]. Эти рецепторы как раз и участвуют в распознавании «своих» и «чужих» микроорганизмов. Толл-подобные рецепторы реагируют на патоген-ассоциированные молекулярные структуры. Несмотря на то, что этих рецепторов 10 разновидностей, каждый из них распознает только свою «маркерную» часть микроорганизма. Например, TLR4 распознает бактериальный липополисахарид (ЛПС), TLR2 — бактериальный пептидогликан и липопептид, TLR3 — двухцепочечные молекулы РНК, TLR8 способен определить одноцепочечные молекулы РНК, TLR9 — бактериальные ДНК. Благодаря этим рецепторам наш организм не отвечает воспалительной реакцией на присутствие в кишечнике нормофлоры. Если же в нем нарушается соотношение полезной и транзиторной микрофлоры, толл-подобные рецепторы возбуждаются и передают сигнал тревоги внутрь клетки, что приводит к включению продукции целого ряда провоспалительных цитокинов, хемокинов и ко-стимуляционных молекул (которые индуцируют возбуждение Т-лимфоцитов). В итоге развивается воспаление как защитная реакция организма со стороны неспецифического иммунитета, и делаются первые шаги по развитию специфического (адаптивного) иммунитета.
При чем же тут инсулинорезистентность, спросите вы? Все довольно просто: эти толл-подобные рецепторы при контакте с патогенным организмом стимулируют иммунный ответ в надежде расправиться с чужаком. В ходе каскадных реакций стимулируется система макрофагов. Активированные M1-макрофаги (их еще называют классически активированными макрофагами, они отвечают за уничтожение чужеродных агентов) производят большое количество провоспалительных цитокинов: TNF-α (фактор некроза опухоли-альфа), IL-1 (интерлейкин-1) и IL-6, которые влияют на субстраты инсулинового рецептора и тем самым блокируют путь PI3K [14]. В результате путь не оказывает влияние на обмен глюкозы, и глюкоза не может войти в клетку. Таким способом развивается инсулинорезистентность, т.к. инсулиновые рецепторы становятся нечувствительны к инсулину, и его биологическая роль извращается. В условиях инсулиновой резистентности печень начинает активно синтезировать жирные кислоты, триглицериды, ускоряется липолиз, но уже в жировой ткани.
Вот мы и разобрали механизм инсулинорезистентности и его влияние на ожирение. Ученые подтвердили роль микробиоты на инсулинорезистентность экспериментально [15] путем пересадки микрофлоры от здорового донора к пациенту с сахарным диабетом 2 типа. В результате эксперимента у пациентов увеличилась чувствительность к инсулину на несколько недель. Также есть интересная теория о взаимосвязи дефицита TLR5 и ожирения [16], но это уже совсем другая история.
Вывод
К решению проблемы ожирения необходимо подходить комплексно. Физически активный образ жизни, рациональное питание, предусматривающее избегание переедания, ограничение калорийности, уменьшение количества насыщенных жирных кислот (животных жиров), относительное увеличение ненасыщенных жирных кислот (растительных жиров) и продуктов с повышенным содержанием балластных веществ остаются основными мероприятиями в профилактике и лечении ожирения. При этом если удастся подтвердить вклад конкретных микроорганизмов в снижение веса, то, возможно, будут созданы эффективные препараты-пробиотики, которые станут включать в комплексные программы лечения ожирения.
- Harakeh S.M., Khan I., Kumosani T., Barbour E., Almasaudi S.B., Bahijri S.M. et al. (2016). Gut microbiota: a contributing factor to obesity. Front. Cell Infect. Microbiol. 6, 95;
- Ridaura V.K., Faith J.J., Rey F.E., Cheng J., Duncan A.E., Kau A.L. et al. (2013). Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science. 341, 1241214;
- Owens B. (2013). Bacteria from lean cage-mates help mice stay slim. Nature News;
- Martens E.C. (2016). Microbiome: fibre for the future. Nature. 529, 158–159;
- Million M., Maraninchi M., Henry M., Armougom F., Richet H., Carrieri P. et al. (2012). Obesity-associated gut microbiota is enriched in Lactobacillus reuteriand depleted in Bifidobacterium animalis and Methanobrevibacter smithii. Int. J. Obes. (Lond). 36, 817–825;
- Ожирение и кишечная микрофлора. Сайт PreventAge;
- Ussar S., Fujisaka S., Kahn C.R. (2016). Interactions between host genetics and gut microbiome in diabetes and metabolic syndrome. Mol. Metab. 5, 795–803;
- Egshatyan L., Kashtanova D., Popenko A., Tkacheva O., Tyakht A., Alexeev D. et al. (2016). Gut microbiota and diet in patients with different glucose tolerance. Endocr. Connect. 5, 1–9;
- Исследователи описали характерные для диабета изменения кишечной микрофлоры. (2015). «Импульс»;
- Wei P., Yang Y., Li T., Ding Q., Sun H. (2014). A engineered Bifidobacterium longum secreting a bioative penetratin-Glucagon-like peptide 1 fusion protein enhances Glucagon-like peptide 1 absorption in the intestine. J. Microbiol. Biotechnol. 24;
- Полюби свои жировые клетки!;
- Северин Е.С. Биохимия. М.: ГЭОТАР-Медиа, 2003. — 779 с.;
- Yiu J.H., Dorweiler B., Woo C.W. (2016). Interaction between gut microbiota and toll-like receptor: from immunity to metabolism. J. Mol. Med. (Berl). 1, 13–20;
- Troutman T.D., Bazan J.F., Pasare C. (2012). Toll-like receptors, signaling adapters and regulation of the pro-inflammatory response by PI3K. Cell Cycle. 11, 3559–3567;
- Vrieze A., Van Nood E., Holleman F., Salojärvi J., Kootte R.S., Bartelsman J.F. et al. (2012). Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 143, 913–916;
- Al-Daghri N.M., Clerici M., Al-Attas O., Forni D., Alokail M.S., Alkharfy K.M. et al. (2013). A nonsense polymorphism (R392X) in TLR5 protects from obesity but predisposes to diabetes. J. Immunol. 190, 3716–3720.
Источник