Кишечная палочка имеет рибосомы
Систематика кишечной палочки
Научная классификация
Домен: Бактерии
Тип: Протеобактерии
Класс: Гамма-протеобактерии
Порядок: Enterobacteriales
Семейство: Энтеробактерии
Род: Escherichia
Вид: Coli (Кишечная палочка)
Международное научное название
Escherichia coli (Migula 1895)
Строение и химический состав бактериальной клетки
Внутренняя организация бактериальной клетки сложна. Каждая систематическая группа микроорганизмов имеет свои специфические особенности строения.
Клетка бактерий одета плотной оболочкой. Этот поверхностный слой, расположенный снаружи от цитоплазматической мембраны, называют клеточной стенкой. Стенка выполняет защитную и опорную функции, а также придает клетке постоянную, характерную для нее форму (например, форму палочки или кокка) и представляет собой наружный скелет клетки. Эта плотная оболочка роднит бактерии с растительными клетками, что отличает их от животных клеток, имеющих мягкие оболочки. Внутри бактериальной клетки осмотическое давление в несколько раз, а иногда и в десятки раз выше, чем во внешней среде. Поэтому клетка быстро разорвалась бы, если бы она не была защищена такой плотной, жесткой структурой, как клеточная стенка.
Толщина клеточной стенки 0,01-0,04 мкм. Она составляет от 10 до 50% сухой массы бактерий. Количество материала, из которого построена клеточная стенка, изменяется в течение роста бактерий и обычно увеличивается с возрастом.
Основным структурным компонентом стенок, основой их жесткой структуры почти у всех исследованных до настоящего времени бактерий является муреин (гликопептид, мукопептид). Это органическое соединение сложного строения, в состав которого входят сахара, несущие азот, – аминосахара и 4-5 аминокислот. Причем аминокислоты клеточных стенок имеют необычную форму (D-стереоизомеры), которая в природе редко встречается.
С помощью способа окраски, впервые предложенного в 1884 г. Кристианом Грамом, бактерии могут быть разделены на двегруппы: грамположительные и грамотрицательные.
Грамположительные организмы способны связывать некоторые анилиновые красители, такие, как кристаллический фиолетовый, и после обработки иодом, а затем спиртом (или ацетоном) сохранять комплекс иод-краситель. Те же бактерии, у которых под влиянием этилового спирта этот комплекс разрушается (клетки обесцвечиваются), относятся к грамотрицательным.
Химический состав клеточных стенок грамположительных и грамотрицательных бактерий различен. У грамположительных бактерий в состав клеточных стенок входят, кроме мукопептидов, полисахариды (сложные, высокомолекулярные сахара), тейхоевые кислоты (сложные по составу и структуре соединения, состоящие из сахаров, спиртов, аминокислот и фосфорной кислоты). Полисахариды и тейхоевые кислоты связаны с каркасом стенок – муреином. Какую структуру образуют эти составные части клеточной стенки грамположительных бактерий, мы пока еще не знаем. С помощью электронных фотографий тонких срезов (слоистости) в стенках грамположительных бактерий не обнаружено. Вероятно, все эти вещества очень плотно связаны между собой.
В стенках грамотрицательных содержится значительное количество липидов (жиров), связанных с белками и сахарами в сложные комплексы – липопротеиды и липополисахариды. Муреина в клеточных стенках грамотрицательных бактерий в целом меньше, чем у грамположительных бактерий. Структура стенки грамотрицательных бактерий также более сложная. С помощью электронного микроскопа было установлено, что стенки этих бактерий многослойные.
Внутренний слой состоит из муреина. Над ним находится более широкий слой из не плотно упакованных молекул белка. Этот слой в свою очередь покрыт слоем липополисахарида. Самый верхний слой состоит из липопротеидов.
Клеточная стенка проницаема: через нее питательные вещества свободно проходят в клетку, а продукты обмена выходят в окружающую среду. Крупные молекулы с большим молекулярным весом не проходят через оболочку.
Клеточная стенка многих бактерий сверху окружена слоем слизистого материала – капсулой. Толщина капсулы может во много раз превосходить диаметр самой клетки, а иногда она настолько тонкая, что ее можно увидеть лишь через электронный микроскоп, – микрокапсула.
Капсула не является обязательной частью клетки, она образуется в зависимости от условий, в которые попадают бактерии. Она служит защитным покровом клетки и участвует в водном обмене, предохраняя клетку от высыхания.
По химическому составу капсулы чаще всего представляют собой полисахариды. Иногда они состоят изгликопротеидов (сложные комплексы сахаров и белков) и полипептидов (род Bacillus), в редких случаях – из клетчатки (род Acetobacter).
Слизистые вещества, выделяемые в субстрат некоторыми бактериями, обусловливают, например, слизисто-тягучую консистенцию испорченного молока и пива.
Все содержимое клетки, за исключением ядра и клеточной стенки, называется цитоплазмой. В жидкой, бесструктурной фазе цитоплазмы (матриксе) находятся рибосомы, мембранные системы, митохондрии, пластиды и другие структуры, а также запасные питательные вещества. Цитоплазма обладает чрезвычайно сложной, тонкой структурой (слоистая, гранулярная). С помощью электронного микроскопа раскрыты многие интересные детали строения клетки.
Внешний липопротвидный слой протопласта бактерий, обладающий особыми физическими и химическими свойствами, называется цитоплазматической мембраной.
Внутри цитоплазмы находятся все жизненно важные структуры и органеллы.
Цитоплазматическая мембрана выполняет очень важную роль – регулирует поступление веществ в клетку и выделение наружу продуктов обмена.
Через мембрану питательные вещества могут поступать в клетку в результате активного биохимического процесса с участием ферментов. Кроме того, в мембране происходит синтез некоторых составных частей клетки, в основном компонентов клеточной стенки и капсулы. Наконец, в цитоплазматической мембране находятся важнейшие ферменты (биологические катализаторы). Упорядоченное расположение ферментов на мембранах позволяет регулировать их активность и предотвращать разрушение одних ферментов другими. С мембраной связаны рибосомы – структурные частицы, на которых синтезируется белок. Мембрана состоит из липопротеидов. Она достаточно прочна и может обеспечить временное существование клетки без оболочки. Цитоплазматическая мембрана составляет до 20% сухой массы клетки.
На электронных фотографиях тонких срезов бактерий цитоплазматическая мембрана представляется в виде непрерывного тяжа толщиной около 75A, состоящего из светлого слоя (липиды), заключенного между двумя более темными (белки). Каждый слой имеет ширину 20-30А. Такая мембрана называется элементарной.
Между плазматической мембраной и клеточной стенкой имеется связь в виде десмозов – мостиков. Цитоплазматическая мембрана часто дает инвагинации – впячивания внутрь клетки. Эти впячивания образуют в цитоплазме особые мембранные структуры, названные мезосомами. Некоторые виды мезосом представляют собой тельца, отделенные от цитоплазмы собственной мембраной. Внутри таких мембранных мешочков упакованы многочисленные пузырьки и канальцы. Эти структуры выполняют у бактерий самые различные функции. Одни из этих структур – аналоги митохондрий. Другие выполняют функции зндоплазматической сети или аппарата Гольджи. Путем инвагинации цитоплазматической мембраны образуется также фотосинтезирующий аппарат бактерий. После впячивания цитоплазмы мембрана продолжает расти и образует стопки, которые по аналогии с гранулами хлоропластов растений называют стопками тилакоидов. В этих мембранах, часто заполняющих собой большую часть цитоплазмы бактериальной клетки, локализуются пигменты (бактериохлорофилл, каротиноиды) и ферменты (цитохромы), осуществляющие процесс фотосинтеза.
В цитоплазме бактерий содержатся рибосомы – белок-синтезирующие частицы диаметром 200А. В клетке их насчитывается больше тысячи. Состоят рибосомы из РНК и белка. У бактерий многие рибосомы расположены в цитоплазме свободно, некоторые из них могут быть связаны с мембранами.
В цитоплазме клеток бактерий часто содержатся гранулы различной формы и размеров. Однако их присутствие нельзя рассматривать как какой-то постоянный признак микроорганизма, обычно оно в значительной степени связано с физическими и химическими условиями среды. Многие цитоплазматические включения состоят из соединений, которые служат источником энергии и углерода. Эти запасные вещества образуются, когда организм снабжается достаточным количеством питательных веществ, и, наоборот, используются, когда организм попадает в условия, менее благоприятные в отношении питания.
У многих бактерий гранулы состоят из крахмала или других полисахаридов – гликогена и гранулезы. У некоторых бактерий при выращивании на богатой сахарами среде внутри клетки встречаются капельки жира. Другим широко распространенным типом гранулярных включений является волютин (метахроматиновые гранулы). Эти гранулы состоят из полиметафосфата (запасное вещество, включающее остатки фосфорной кислоты). Полиметафосфат служит источником фосфатных групп и энергии для организма. Бактерии чаще накапливают волютин в необычных условиях питания, например на среде, не содержащей серы. В цитоплазме некоторых серных бактерий находятся капельки серы.
Помимо различных структурных компонентов, цитоплазма состоит из жидкой части – растворимой фракции. В ней содержатся белки, различные ферменты, т-РНК, некоторые пигменты и низкомолекулярные соединения – сахара, аминокислоты.
В результате наличия в цитоплазме низкомолекулярных соединений возникает разность в осмотическом давлении клеточного содержимого и наружной среды, причем у разных микроорганизмов это давление может быть различным. Наибольшее осмотическое давление отмечено у грамположительных бактерий – 30 атм, у грамотрицательных бактерий оно гораздо ниже 4-8 атм.
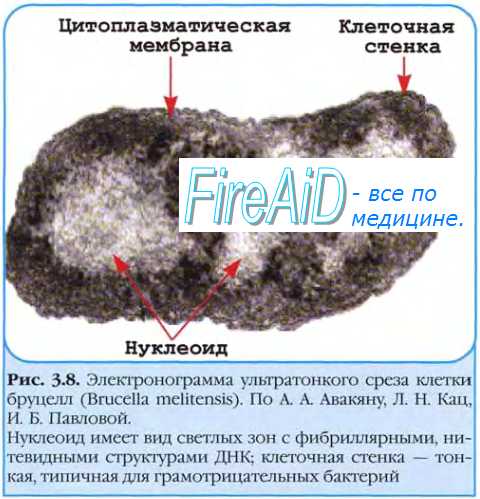
В центральной части клетки локализовано ядерное вещество – дезоксирибонуклеиновая кислота (ДНК).
У бактерий нет такого ядра, как у высших организмов (эукариотов), а есть его аналог – «ядерный эквивалент» – нуклеоид, который является эволюционно более примитивной формой организации ядерного вещества. Микроорганизмы, не имеющие настоящего ядра, а обладающие его аналогом, относятся к прокариотам. Все бактерии – прокариоты. В клетках большинства бактерий основное количество ДНК сконцентрировано в одном или нескольких местах. У бактерий ДНК упакована менее плотно, в отличие от истинных ядер; нуклеоид не обладает мембраной, ядрышком и набором хромосом. Бактериальная ДНК не связана с основными белками – гистонами – и в нуклеоиде расположена в виде пучка фибрилл.
На поверхности некоторых бактерий имеются придаточные структуры; наиболее широко распространенными из них являются жгутики – органы движения бактерий.
Жгутик закрепляется под цитоплазматической мембраной с помощью двух пар дисков. У бактерий может быть один, два или много жгутиков. Расположение их различно: на одном конце клетки, на двух, по всей поверхности. Жгутики бактерий имеют диаметр 0,01-0,03 мкм, длина их может во много раз превосходить длину клетки. Бактериальные жгутики состоят из белка – флагеллина – и представляют собой скрученные винтообразные нити.
Источник
Оглавление темы “Анатомия бактериальной клетки. Физиология бактерий.”: Цитоплазма бактерий. Бактериальный геном. Бактериальные рибосомы. Запасные гранулы бактерии.Цитоплазма бактерий представляет собой коллоидный матрикс, служащий для реализации жизненно важных функций. Цитоплазма большинства бактерий содержит ДНК, рибосомы и запасные гранулы; остальное пространство занимает коллоидная фаза. Её основные составляющие — растворимые ферменты и растворимые РНК (мРНК и тРНК). Разнообразные органеллы, характерные для эукариотической клетки, у бактерий отсутствуют, а их функции выполняет бактериальная ЦПМ, отделяющая цитоплазму от клеточной стенки. У подавляющего числа бактерий цитоплазма относительно неподвижна, но у видов Streptococcus, Proteus, Clostridium имеются специальные трубочки — рапидосомы, аналогичные микротрубочкам простейших. Бактериальный геномВ бактериальной клетке нет ядерной мембраны, ДНК сконцентрирована в цитоплазме в виде клубка. Поскольку в эукариотических клетках ДНК обычно находится в ядре, то по аналогии ДНК бактерий назвали нуклеоидом [от лат. nucleus, ядро + греч. eidos, сходство]. Её также называют генофором, или бактериальной хромосомой. Генофор бактерий представлен двойной спиральной, кольцевой, ковалентно замкнутой суперспирализованной молекулой ДНК. Она составляет 2-3% сухой массы клетки (более 10% по объёму). Генофор не содержит гистонов. Объём генетической информации, кодируемой в генофоре, различается в зависимости от вида бактерии (например, геном Escherichia coli кодирует примерно 4000 различных полипептидов). У бактерий может присутствовать дополнительная ДНК в виде включений. Эти включения, или плазмиды, несут ряд различных генов, кодирующих дополнительные свойства бактерий, но информация, содержащаяся в плазмидах, не является абсолютно необходимой для бактериальной клетки.
Бактериальные рибосомыБактериальные рибосомы — сложные глобулярные образования, состоящие из различных молекул РНК и связанных с ними белков. Всё образование функционирует как локус синтеза полипептидов. В зависимости от интенсивности роста бактериальная клетка может содержать от 5000 до 50 000 рибосом. Диаметр бактериальных рибосом около 16-20 нм. Скорость их осаждения при ультрацентрифугировании составляет 70 S (единиц Свёдберга), тогда как у эукариотических клеток — 80 S. Рибосомы бактерий состоят из двух субъединиц с коэффициентом седиментации 50 S и 30 S (у эукариотов 40 S и 60 S). Объединение субъединиц происходит перед началом трансляции. Рибосомы прокариот и эукариотов имеют сходную молекулярную структуру и механизмы функционирования, но различаются, помимо размеров, по составу белков и белковых факторов. Эти различия делают рибосомы эукариотов практически резистентными к действию антибиотиков, блокирующих синтез белка у бактерий. Запасные гранулы бактерииЗапасные гранулы содержат временный избыток метаболитов; наличие и количество гранул изменяется в зависимости от вида бактерий и их метаболической активности. В виде гранул могут запасаться полисахариды (крахмал, гликоген, гранулёза), жиры (триглицериды, сходные с жирами высших животных, запасаются у дрожжей рода Candida), воска — у микобактерий и нокардий; полимеры р-оксимасляной кислоты (например, в клетках Bacillus megaterium), полифосфаты (волютин) у Spirillum volutans и Corynebacterium diphtheriae, сера (у бактерий, окисляющих сульфиды), кристаллизованные белки (например, токсичный для насекомых протоксин у Bacillus thuringiensis). – Также рекомендуем “Физиология бактерий. Питание бактерий. Тип питания бактерии. Голозои. Голофиты. Вода. Значимость воды для бактерий.” |
Источник
Модель рибосомы Escherichia coli. Красным цветом выделена большая субьединица, синим — малая субьединица. Более светлым оттенком показаны рибосомные белки, более темным — рРНК
Рибосо́ма — важнейшая немембранная органелла всех живых клеток, служащая для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц. Малая субъединица считывает информацию с матричной РНК, а большая — присоединяет соответствующую аминокислоту к синтезируемой цепочке белка.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Схема синтеза рибосом в клетках эукариот.
1. Синтез мРНК рибосомных белков РНК полимеразой II. 2. Экспорт мРНК из ядра. 3. Узнавание мРНК рибосомой и 4. синтез рибосомных белков. 5. Синтез предшественника рРНК (45S — предшественник) РНК полимеразой I. 6. Синтез 5S pРНК РНК полимеразой III. 7. Сборка большой рибонуклеопротеидной частицы, включающей 45S-предшественник, импортированные из цитоплазмы рибосомные белки, а также специальные ядрышковые белки и РНК, принимающие участие в созревании рибосомных субчастиц. 8. Присоединение 5S рРНК, нарезание предшественника и отделение малой рибосомной субчастицы. 9. Дозревание большой субчастицы, высвобождение ядрышковых белков и РНК. 10. Выход рибосомных субчастиц из ядра. 11. Вовлечение их в трансляцию.
Состав рибосомы[править | править код]
Рибосома представляют собой нуклеопротеид и состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Соотношение РНК/белок в рибосомах составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки. Рибосомы эукариот включают четыре молекулы рРНК, из них 18S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Рибосомные РНК[править | править код]
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы[править | править код]
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы[править | править код]
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки[править | править код]
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты[править | править код]
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции[править | править код]
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы[править | править код]
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Примечания[править | править код]
- ↑ 1 2 Спирин, 2011, с. 109.
- ↑ Спирин, 2011, с. 120—121.
- ↑ 1 2 Спирин, 2011, с. 110.
- ↑ 1 2 3 Спирин, 2011, с. 110—111.
- ↑ Спирин, 2011, с. 133—134.
- ↑ Спирин, 2011, с. 136—137.
- ↑ Спирин, 2011, с. 84—85.
- ↑ 1 2 Спирин, 2011, с. 84.
- ↑ Sievers A., Beringer M., Rodnina M. V., Wolfenden R. The ribosome as an entropy trap. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2004. — 25 May (vol. 101, no. 21). — P. 7897—7901. — doi:10.1073/pnas.0402488101. — PMID 15141076. [исправить]
- ↑ Schmeing T. M., Huang K. S., Strobel S. A., Steitz T. A. An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. (англ.) // Nature. — 2005. — 24 November (vol. 438, no. 7067). — P. 520—524. — doi:10.1038/nature04152. — PMID 16306996. [исправить]
- ↑ Hesslein A. E., Katunin V. I., Beringer M., Kosek A. B., Rodnina M. V., Strobel S. A. Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes. (англ.) // Nucleic Acids Research. — 2004. — Vol. 32, no. 12. — P. 3760—3770. — doi:10.1093/nar/gkh672. — PMID 15256541. [исправить]
- ↑ Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis. (англ.) // Science (New York, N.Y.). — 2000. — 11 August (vol. 289, no. 5481). — P. 920—930. — PMID 10937990. [исправить]
- ↑ Schmeing T. M., Huang K. S., Kitchen D. E., Strobel S. A., Steitz T. A. Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction. (англ.) // Molecular Cell. — 2005. — 11 November (vol. 20, no. 3). — P. 437—448. — doi:10.1016/j.molcel.2005.09.006. — PMID 16285925. [исправить]
- ↑ PALADE GE. A small particulate component of the cytoplasm. (англ.) // The Journal Of Biophysical And Biochemical Cytology. — 1955. — January (vol. 1, no. 1). — P. 59—68. — doi:10.1083/jcb.1.1.59. — PMID 14381428. [исправить]
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. Crystal structure of the eukaryotic ribosome. (англ.) // Science (New York, N.Y.). — 2010. — 26 November (vol. 330, no. 6008). — P. 1203—1209. — doi:10.1126/science.1194294. — PMID 21109664. [исправить]
- ↑ Bokov K., Steinberg S. V. A hierarchical model for evolution of 23S ribosomal RNA. (англ.) // Nature. — 2009. — 19 February (vol. 457, no. 7232). — P. 977—980. — doi:10.1038/nature07749. — PMID 19225518. [исправить]
Литература[править | править код]
- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки[править | править код]
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009 [1]
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных [2] (англ.)
Источник