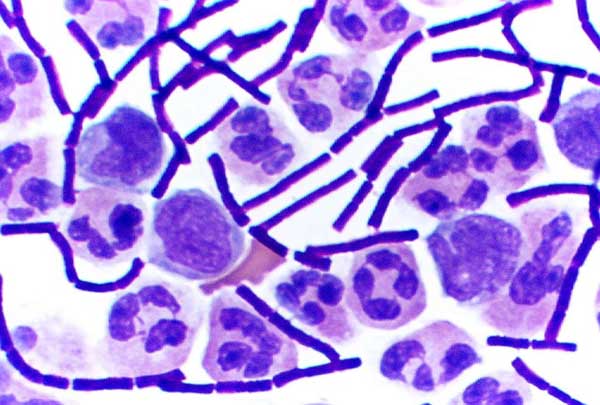
Кишечная палочка окрашенная по граму
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 июля 2019; проверки требуют 4 правки.
У этого термина существуют и другие значения, см. Метод (значения).
Метод Грама — метод окраски микроорганизмов для исследования, позволяющий дифференцировать бактерии по биохимическим свойствам их клеточной стенки. Предложен в 1884 году датским врачом Гансом Кристианом Грамом.
По Граму бактерии окрашивают анилиновыми красителями — генциановым или метиловым фиолетовым и др., затем краситель фиксируют раствором иода. При последующем промывании окрашенного препарата спиртом те виды бактерий, которые оказываются прочно окрашенными в синий цвет и имеющие толстую клеточную стенку, называют грамположительными бактериями, обозначаются Грам (+), — в отличие от грамотрицательных (тонкая клеточная стенка), Грам (−), которые при промывке обесцвечиваются.
После промывания растворителем при окрашивании по Граму добавляется контрастный красный краситель, который окрашивает все грамотрицательные бактерии в красный или розовый цвет. Это происходит из-за наличия внешней мембраны, препятствующей проникновению красителя внутрь клетки. Тест классифицирует бактерии, разделяя их на две группы относительно строения их клеточной стенки.
Использование в диагностике[править | править код]
Окраска по Граму имеет большое значение в систематике бактерий, а также для микробиологической диагностики инфекционных заболеваний.
Грамположительны кокковые (кроме представителей рода Neisseria) и спороносные (за исключением Coxiella burnetii) формы бактерий, они окрашиваются в сине-чёрный (тёмно-синий) цвет.
Грамотрицательны многие неспороносные бактерии, они окрашиваются в красный или розовый цвет.
Техника проведения окраски[править | править код]
Окраска по Граму относится к сложному способу окраски, когда на мазок воздействуют двумя красителями, из которых один является основны́м, а другой — дополнительным. Кроме красящих веществ при сложных способах окраски применяют обесцвечивающие вещества: спирт, кислоты и др.
Для окраски по Граму чаще используют анилиновые красители трифенилметановой группы: генциановый, метиловый фиолетовый или кристаллвиолет. Грамположительные микроорганизмы дают прочное соединение с указанными красителями и йодом. При этом они не обесцвечиваются при воздействии на них спиртом, вследствие чего при дополнительной окраске фуксином грамположительные микроорганизмы не изменяют первоначально принятый фиолетовый цвет.
Грамотрицательные микроорганизмы образуют с основными красителями и иодом легко разрушающееся под действием спирта соединение. В результате микробы обесцвечиваются, а затем окрашиваются фуксином, приобретая красный цвет.
Подготовка материала для окраски[править | править код]
- Исследуемый материал распределяют тонким слоем по поверхности хорошо обезжиренного предметного стекла.
- Приготовленный мазок высушивают на воздухе и после полного высыхания фиксируют.
- Гистологические срезы готовят по стандартной методике, фиксируя кусочки тканей в формалине и заливая в парафин.
Фиксация[править | править код]
При фиксировании мазок закрепляется на поверхности предметного стекла, и поэтому при последующей окраске препарата микробные клетки не смываются. Кроме того, убитые микробные клетки окрашиваются лучше, чем живые.
Различают физический способ фиксации, в основу которого положено воздействие высокой температуры на микробную клетку, и химические способы, предусматривающие применение химических средств, вызывающих коагуляцию белков цитоплазмы.
Физический способ фиксации[править | править код]
Предметное стекло с препаратом берут пинцетом или I и II пальцами правой руки за рёбра мазком кверху и плавным движением проводят 2—3 раза над верхней частью пламени горелки. Весь процесс фиксации должен занимать не более 2 с.
Надёжность фиксации проверяют следующим приёмом: свободную от мазка поверхность предметного стекла прикладывают к тыльной поверхности левой кисти. При правильном фиксировании мазка стекло должно быть горячим, но не вызывать ощущения ожога (70—80°C).
Химический способ фиксации[править | править код]
Для фиксации мазков применяют метиловый спирт, ацетон, смесь Никифорова (смесь этилового спирта 96 % и наркозного эфира в соотношении 1:1), жидкость Карнуа (96-процентного этилового спирта — 60 %, хлороформа — 30 %, ледяной уксусной кислоты — 10 %), спирт-формол (40-процентного формалина — 5 мл, 96-процентного этилового спирта — 95 мл). Предметное стекло с высушенным мазком погружают в склянку с фиксирующим веществом на 10—15 минут и затем высушивают на воздухе. Применяется также фиксация в парах 40-процентного формалина в течение нескольких секунд.
Процесс окрашивания мазков[править | править код]
- На фиксированный мазок наливают один из осно́вных красителей на 2—3 минуты. Во избежание осадков окрашивают через фильтровальную бумагу.
- Сливают краску, аккуратно удаляют фильтровальную бумагу. Мазок заливают раствором Люголя или йодистым раствором по Граму (водный раствор йодида калия и кристаллического йода в соотношении 2:1) на 1—2 минуты до почернения препарата.
- Раствор сливают, мазок прополаскивают 96° этиловым спиртом или ацетоном, наливая и сливая его, пока мазок не обесцветится и стекающая жидкость не станет чистой (приблизительно 20—40—60 секунд).
- Тщательно промывают стекла в проточной или дистиллированной воде 1—2 мин.
- Для выявления грамотрицательной группы бактерий препараты дополнительно окрашивают фуксином или сафранином (2—5 мин).
- Промывают в проточной воде и высушивают фильтровальной бумагой.
Техника окраски бактерий в гистологических срезах по Граму-Вейгерту[править | править код]
- Депарафинированные срезы доводят до воды.
- Окрашивают 20 мин в 1 % растворе парарозанилина или основного фуксина в 1 % уксусной кислоте (раствор красителя нагревают до кипения, охлаждают и фильтруют).
- Промывают в 3 сменах дистиллированной воды.
- Окрашивают 5 мин в 1 % кристаллического фиолетового в дистиллированной воде.
- Быстро ополаскивают в 1 % растворе хлорида натрия.
- Обрабатывают 30 с в смеси: 1 часть иода + 2 части йодида калия + 100 частей дистиллированной воды.
- Промокают фильтровальной бумагой.
- Дифференцируют, нанося на срез смесь равных объёмов анилина и ксилола (1 — 2 мл); растворы сливают до тех пор, пока облачка красителя не перестанут отходить от среза.
- Проводят через 3 смены ксилола.
- Заключают в бальзам или любую смолу, растворённую в ксилоле.
Результат: грамположительные бактерии — сине-чёрные, фибрин — фиолетовый, ядра — красные.
См. также[править | править код]
- Окраска микроорганизмов
- Анилиновые красители
Литература[править | править код]
- Грама метод // Гоголь — Дебит. — М. : Советская энциклопедия, 1972. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 7).
На немецком языке
- Gram, HC (англ.)русск.. Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten (нем.) // Fortschritte der Medizin : magazin. — 1884. — Bd. 2. — S. 185—189.
На английском языке
- Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath. Bergey’s Manual of Determinative Bacteriology (англ.). — 9th ed.. — Lippincott Williams & Wilkins (англ.)русск., 1994.
- Madigan, MT; Martinko J; Parker J. Brock Biology of Microorganisms (неопр.). — 10th Edition. — Lippincott Williams & Wilkins (англ.)русск., 2004.
- Ryan, KJ; Ray, C. G. Sherris Medical Microbiology (неопр.). — 4th ed.. — McGraw Hill., 2004.
- Application of stains in clinical microbiology // Biotechnic & Histochemistry, Volume 76, Number 3, May 01, 2001, pp. 119—125(7)
Источник
Данный метод окраски является базовым в микробиологии, т.к. на его основе бактерии классифицируются на две большие группы – грамположительные и грамотрицательные. Основой данного подразделения бактерий является их отношение к даннной окраске. Изначально бактерии не имеют цвета, т.е. прозрачны. Но за счет различного строения своих оболочек они по-разному воспринимают тот или иной краситель. И данное свойство воспринимать окраску – строго врожденное, видовое и практически неизменное. Поэтому такое свойсво бактерий (свойство восприятия краски) и легло в основу их классификации. Деление бактерий на грамположительных и грамотрицательных можно встретить, например, в любой инструкции к антибиотикам.
При классической окраске по Граму чаще применяются такие компоненты: карболовый раствор генцианового фиолетового, карболовый раствор фуксина, раствор Люголя, спирт этиловый. Концентрированный карболовый фуксин называется еще фуксин Циля, разведенный водой – фуксин Пфейфера. Все наименования компонентов по фамилиям ученых (как и собственно само название метода: по Граму).
Методика проведения окрашивания.
Предметное стекло перед исследованием обезжиривают и делают на нем мазки исследуемых культур. Мазки следует делать тонкими, чтобы клетки равномерно распределялись на поверхности стекла и не образовывали скоплений. Препарат высушивают при температуре 20-22 0C, фиксируют над пламенем горелки (спиртовки).
1. На фиксированный мазок нанести раствор генцианового фиолетового на 1-2 мин.
2. Не промывая водой, нанести на препарат раствор Люголя и выдержать 1 мин – до полного почернения мазка.
3. Раствор Люголя слить и обесцветить мазок 70% спиртом этиловым, несколько раз наливая его на предметное стекло и покачивая стекло. Процесс обесцвечивания считается завершенным, когда от мазка перестают отделяться окрашенные в фиолетовый цвет струйки жидкости (но не более 30 сек.).
4. Препарат промыть водой.
5. На препарат нанести на 1-2 мин раствор карболового фуксина, разведенного 1:9 водой (фуксин Пфейфера).
6. Краску слить, препарат промыть водой, осушить фильтрованной бумагой или высушить на воздухе, и микроскопировать с иммерсионной системой.
Грамположительные микроорганизмы окрашиваются в сине-фиолетовый цвет, грамотрицательные – в красный. Поэтому основополагающим здесь является результат окраски – цвет. По инструкции все бактерии красятся одними и теми же красителями, а в итоге получается разный цвет. Почему? Все заключается в строении клеточной стенки. У одних бактерий она толстая, и поэтому глубоко прокрашивается фиолетовым красителем, не воспринимая уже последующий краситель. Это будут грамположительные бактерии. А у других клеточная стенка тонкая. Первым красителем она так же окрашивается, но потом вымывается спиртом и докрашивается вторым красителем.
Набор для классической окраски по Граму
Если схематично описать метод, то происходит следующее:
– окраска бактерий в фиолетовый цвет (генциановым фиолетовым) – все бактрии становятся фиолетовыми;
– прочная связь красителя в толще оболочки с молекулами йода (при добавлении раствора Люголя) – мазок приобретает бурый цвет;
– обесцвечивание тонкостенных бактерий этиловым спиртом (вымывание красителя из оболочки) – толстостенные бактерии остаются фиолетовыми, тонкостенные становятся бесцветными;
– докрашивание в красный цвет – толстостенные бактерии остаются фиолетовыми, тонкостенные перекрашиваются в красный цвет.
Грамположительные кокковые колонии. Увеличение 1000х.
Помимо классической методики существует и множество модификаций: модификация по Эткинсу, по Калине, по Синеву, по Николля и др. Суть практически везде сохраняется, но немного изменена сама методика окрашивания, либо заменены красители на другие. Например, фуксин часто заменяется на 2% раствор сафранина. Это вносит определенное удобство в работу, т.к. разведенный водой фуксин (фуксин Пфейфера) не очень стоек (хранится 1-2 суток), и приходится каждый раз готовить свежий раствор, а раствор сафранина не требует разведения и используется без подготовки.
Примечательна методика окраски по Граму в модификации по Синеву. Специфика окраски заключается в том, что вместо растворов красителей используются кусочки фильтровальной бумаги, которые заранее пропитываются данными расворами и высушиваются. Окраска происходит при наложении сухой окрашенной бумажки на мазок и нанесении капли воды на бумажку. Бумага мгновенно пропитывается и краситель вымывается на мазок.
Набор для окраски по Граму в модификации по Синеву
Какие возможные ошибки бывают при окраске по Граму и как с ними не столкнуться?
Чаще это ошибки технического характера.
1. Все бактерии в итоге грамположительные. Такое действительно бывает, когда, например, в мазок попали колонии стрептококков, стафилококков и др. (они по природе практически все грамположительные). Но если рассматривать с позиции ошибки, то это случается, когда мазок недостаточно контактировал со спиртом, т.е. не обесцветились тонкостенные бактерии. В итоге все остались фиолетовыми.
2. Все бактерии в итоге грамотрицательные. Если опять отмести возможность присутствия только действительно грамотрицательных бактерий, то ошибка заключается в обратном. Т.е. в переобесцвечивании спиртом. В итоге все обесцвечиваются, и все перекрашиваются в красный цвет. Поэтому при нанесении спирта очень важно соблюдать время контакта с мазком.
3. Отсутствие бактерий в мазке. Это из-за неправильного забора материала, или неправильной фиксации материала (все бактерии смываются при первой же отмывке).
4. Мазок не побурел при нанесении раствора Люголя. Причина – испорченный раствор. Раствор Люголя предпочтительно хранить в стеклянной емкости, из пластиковой емкости со временем йод улетучивается, а сам раствор становится светло-коричневым. Как итог – все бакетрии могут получиться грамотрицательными.
5. Большие фиолетовые образования правильной круглой формы, видимые в микроскоп. Это не кокки – это несмытые капельки генцианового фиолетового после некачественной промывки спиртом.
6. Бактерии в виде объемных нагромождений. Причина в недостаточном распределении бактерий по стеклу на начальном этапе. Мазок нужно равномерно распределять тонким слоем.
7. Другие ошибки. Это может быть несоблюдение времени окраски (недокрашивание, перекрашивание), несоответствие концентрации спирта, чрезмерная тепловая фиксация мазка и т.п.
Небольшие хитрости в вопросах-ответах.
Можно ли использовать аптечный раствор Люголя? Нет! Он другого состава.
Можно ли использовать аптечный этиловый спирт? Да. Но главное чтобы был без добавок типа хлоргексидина, муравьиной кислоты и т.п.
А водку вместо спирта? Нет, в ней недостаточная концентрация спирта, надо 70%.
Можно ли заменить этиловый спирт на изопропиловый? При необходимости можно. Но немного сократить время контакта с мазком.
Можно ли использовать химическую фиксацию вместо тепловой? Да, но это немного сложнее. (Об этом в другой статье).
Как использовать мазок многократно? Очень удачный препарат можно еще несколько раз в дальнейшем просматривать, не смотря на то, что на мазке находится иммерсионное масло. Удалить его никак не получится. Но можно стекло с мазком защитить от пыли помещением в футляр. А в дальнейшем наносить новую каплю масла и вновь микроскопировать.
Подводя итог сказанному, главное – придерживаться методики. Методика сама по себе не строгая, но ошибки на начальных этапах случаются. После нескольких окрашиваний всегда можно понять недочеты и в дальнейшем их легко предотвращать, получая очень красивые и качественные результаты.
Источник
Окрашивание по Граму — это экспрессный метод исследования, позволяющий установить наличие бактерий в образце и дифференцировать их как грамположительные либо грамотрицательные. Метод основан на химических и физических свойствах клеточной оболочки.[1]
Метод Грама почти всегда применяют в качестве первого шага при диагностике бактериальных инфекций.
Метод был предложен датским ученым Г.К.Грамом, который разработал его в 1882 и опубликовал в 1884 году, как способ, позволяющий дифференцировать сходные по симптомам бактериальные инфекции: Streptococcus pneumoniae (пневмококк) и Klebsiella pneumoniae.[2]
Подготовка образца
1
Приготовьтесь к работе. Наденьте перчатки и подвяжите длинные волосы, чтобы не загрязнить исследуемый образец. Выберите рабочее место под вытяжкой или в другом хорошо проветриваемом месте и продезинфицируйте его. Прежде чем приступить к работе, проверьте, исправны ли горелка Бунзена и оптический микроскоп.
2
Продезинфицируйте предметное стекло. Если предметное стекло недостаточно чистое, вымойте его водой с мылом, чтобы удалить жир и грязь. После этого продезинфицируйте его этанолом, очистителем для стекол или другим способом, который принят в вашей лаборатории.
3
Поместите образец на предметное стекло. Окрашивание по Граму позволяет увидеть отдельные бактерии в медицинских образцах или культуры бактерий в чашке Петри. Для начала нанесите на предметное стекло тонкий слой исследуемой жидкости. Рекомендуется не выдерживать образец дольше 24 часов, так как со временем у бактерий повреждаются клеточные стенки, и их реакция на окрашивание по Граму становится менее предсказуемой.[3]
- Если вы исследуете образец тканей, нанесите на предметное стекло 1–2 капли. Распределите жидкость тонким слоем по предметному стеклу с помощью края другого чистого стекла. Подождите, пока образец высохнет.
- Если вы окрашиваете бактерии из чашки Петри, стерилизуйте бактериологическую петлю в пламени горелки Бунзена, пока она не начнет светиться, а затем дайте ей остыть. Нанесите петлей каплю стерилизованной воды на стекло, затем повторно стерилизуйте петлю, дайте ей остыть, аккуратно захватите крохотный образец культуры бактерий и растворите его в воде.[4]
- Бактерии в питательной среде сначала следует перемешать в вихревом смесителе, а затем петлей перенести образец на предметное стекло без добавления воды.[5]
- Если вы исследуете мазок, слегка прижмите его к предметному стеклу.[6]
4
Зафиксируйте образец. Под действием тепла бактерии пристанут к стеклу, и их не смоет при окрашивании. Быстро проведите 2-3 раза предметным стеклом над верхней частью пламени горелки или нагрейте его на электрическом нагревателе. Не перегрейте предметное стекло, чтобы не внести изменения в образец. Если вы используете горелку Бунзена, следите, чтобы пламя было небольшим и имело вид голубого конуса, а не высокого оранжевого столба.[7]
- Можно зафиксировать препарат и метанолом. Нанесите на высушенный образец 1-2 капли метилового спирта, слейте излишки спирта и высушите предметное стекло на воздухе. Данный способ предпочтительнее в силу того, что он меньше повреждает исследуемые клетки и дает более чистый фон.
5
Поместите предметное стекло в лоток для окрашивания. Этот лоток представляет собой неглубокое металлическое, стеклянное или пластиковое блюдце с мелкой сеткой для поддержки образцов. Положите стекло с препаратом на сетку, так чтобы используемая при окраске жидкость стекала в лоток.
- Если у вас нет лотка для окрашивания, предметное стекло можно положить поверх пластиковой формы для льда.[8]
Проведение окрашивания по Граму
1
Нанесите на образец раствор кристаллического фиолетового (кристаллвиолета). Наберите раствор кристаллического фиолетового (его иногда называют генциановым фиолетовым) в пипетку и нанесите несколько капель на препарат. Подождите 30-60 секунд. Кристаллический фиолетовый (КФ) диссоциирует в воде с образованием ионов КФ+ и хлора (Cl–). Эти ионы проникают через клеточную оболочку и мембрану как грамположительных, так и грамотрицательных клеток. Ионы КФ+ взаимодействуют с отрицательно заряженными компонентами бактериальных клеток и окрашивают их в фиолетовый цвет.
- Во многих лабораториях используют “кристаллвиолет Хукера”. В эту модификацию входит щавелевокислый аммоний, который предотвращает выпадение осадка.[9]
2
Аккуратно смойте краситель водой. Наклоните предметное стекло и пустите на него слабую струю дистиллированной или водопроводной воды из промывной склянки. Направляйте струю в сторону от препарата, чтобы вода лишь слегка омывала его.[10]
Будьте осторожны, так как слишком сильный напор может смыть грамположительные бактерии.3
Нанесите на образец йод, затем смойте его. С помощью пипетки покройте образец йодом. Оставьте йод хотя бы на 60 секунд, после чего аккуратно смойте его водой так же, как раньше смыли краситель.[11]
Йод в виде отрицательно заряженных ионов взаимодействует с ионами КФ+, в результате чего во внешних и внутренних слоях клеток формируются крупные комплексы кристаллвиолета и йода. Это фиксирует попавший в клетки кристаллвиолет.- Йод является едким веществом. Избегайте контакта йода с кожей, не глотайте его и не вдыхайте его пары.
4
Добавьте обесцвечивающее вещество и сразу же смойте его. Обычно используют смесь ацетона и этанола в пропорции 1:1, при этом следует аккуратно выдержать время. Расположите предметное стекло под углом и добавляйте на него обесцвечивающее средство до тех пор, пока стекающая жидкость не потеряет фиолетовый оттенок и станет прозрачной. Обычно это занимает не более 10 секунд, особенно если обесцвечивающий раствор содержит большое количество ацетона. Если вы вовремя не остановитесь, раствор может вымыть краситель как из грамположительных, так и грамотрицательных клеток, и вам придется повторить процедуру окрашивания. Немедленно смойте остатки обесцвечивающего раствора так же, как делали это ранее с красителем.
- В качестве обесцвечивающего вещества можно также использовать чистый (95% и выше) ацетон.[12]
Чем больше в обесцвечивающем растворе ацетона, тем быстрее произойдет обесцвечивание, что потребует большей точности. - Если вам сложно угадать со временем, добавляйте обесцвечивающий раствор по одной капле.[13]
- В качестве обесцвечивающего вещества можно также использовать чистый (95% и выше) ацетон.[12]
5
Нанесите на образец контрастный краситель и смойте его водой. Контрастный краситель, в качестве которого используют обычно сафранин или фуксин, позволяет получить дополнительный контраст между грамположительными и грамотрицательными клетками за счет того, что окрашивает бесцветные (грамотрицательные) бактерии в розовый или красный цвет.[14]
[15]
Оставьте контрастный краситель на образце хотя бы на 45 секунд, после чего смойте его водой.[16]- Фуксин придает многим грамотрицательным бактериям (к примеру, таким как haemophilus и legionella) более интенсивный цвет.[17]
Ввиду этого его рекомендуется использовать новичкам.
- Фуксин придает многим грамотрицательным бактериям (к примеру, таким как haemophilus и legionella) более интенсивный цвет.[17]
6
Высушите предметное стекло. Можно просто оставить его на воздухе, либо промокнуть фильтровальной бумагой.[18]
После этого окрашивание по Граму завершено.
Проверка результатов
1
Подготовьте оптический микроскоп. Положите стекло с образцом на предметный столик. Бактерии значительно различаются по размерам, поэтому вам может понадобиться увеличение от 400x до 1000x.[19]
При тысячекратном увеличении для лучшего контраста рекомендуется использовать объектив с масляной иммерсией. Нанесите на предметное стекло каплю иммерсионного масла, и при этом старайтесь, чтобы стекло не двигалось, иначе в масле могут образоваться пузырьки.[20]
Затем с помощью турели микроскопа выставьте необходимый вам объектив так, чтобы он коснулся масла.- Метод масляной иммерсии применим лишь для специальных, а не “сухих” объективов.
2
Определите грамположительные и грамотрицательные бактерии. Рассмотрите предметное стекло под оптическим микроскопом. Грамположительные бактерии будут окрашены в фиолетовый цвет, поскольку внутри их толстых клеточных стенок оказался кристаллвиолет. Грамотрицательные бактерии должны быть розовыми или красными, так как кристаллвиолет был вымыт через их тонкие клеточные стенки, после чего в них проник розовый контрастный краситель.
- Если образец слишком толст, это может привести к ошибочным положительным результатам. Если бактерии всех типов выглядят как грамположительные, окрасьте еще один образец, чтобы удостовериться в правильности результатов.
- Если образец слишком долго находился под воздействием обесцвечивающего раствора, это может привести к ошибочным отрицательным результатам. Окрасьте еще один образец, чтобы убедиться в том, что все бактерии действительно грамотрицательные.
3
Сравните свои результаты с эталонными изображениями. Если вы не уверены в том, какие бактерии видите, то просмотрите набор эталонных изображений, которые отсортированы по форме бактерий и результатам окрашивания по Граму. Подобный набор можно найти в Интернете на National Microbial Pathogen Database, Bacteria in Photos и многих других сайтах. Ниже приведены наиболее распространенные или важные для диагностики примеры, которые помогут вам идентифицировать бактерии.
4
Распознайте грамположительные бактерии по форме. Вид бактерий можно определить по их форме в микроскопе: часто это бывают кокки (округлые) и бациллы (палочковидные). Вот несколько распространенных форм грамположительных (фиолетовых) бактерий:
- Грамположительные кокки — как правило это стафилококки (в виде виноградных гроздьев) или стрептококки (образуют цепочки).
- Грамположительные палочки включают в себя бациллы, клостридии, коринебактерии и листерии. Представители рода актиномицеты часто имеют ответвления и нити.[21]
5
Распознайте грамотрицательные бактерии. Часто грамотрицательные (розовые) бактерии разделяют на три группы: кокки (округлые), палочковидные (длинные и тонкие) и кокковидные, которые имеют промежуточную форму.
- Грамотрицательные кокки чаще всего представлены различными видами Neisseria.
- Грамотрицательные палочки включают в себя кишечную палочку, энтеробактерии, клебсиеллы, цитробактерии, серратии, протеи, сальмонеллы, шигеллы, псевдомонады и многие другие. Холерные вибрионы также могут иметь вид обычных или изогнутых палочек.[22]
- Грамотрицательные “кокковидные” палочки (или “коккобацилы”) включают в себя бордетеллы, бруцеллы, гемофилы и пастереллы.
6
Оцените неоднозначные результаты. Некоторые бактерии не поддаются однозначному окрашиванию из-за того, что их клеточные стенки непрочны или покрыты жирами. Такие бактерии могут одновременно окрашиваться в фиолетовый и розовый цвет в пределах одной клетки, либо клетки одного и того же вида могут окрашиваться по-разному в одном мазке. Подобная проблема может наблюдаться на любом образце бактерий, который пролежал более 24 часов, однако некоторые виды бактерий подвержены этому независимо от свежести образца. В этом случае для точного определения бактерий могут понадобиться более специализированные методы, такие как окраска по Цилю-Нильсену, наблюдение за ростом культуры, тест TSI (тройной сахар железа), генетическое тестирование.[23]
- Актиномицеты, артробактерии, коринебактерии, микобактерии и пропионбактерии считаются грамположительными, однако часто их окрашивание по Граму приводит к неоднозначным результатам.[24]
- Мелкие и тонкие бактерии, такие как трепонемы, хламидии и риккетсии, плохо поддаются окрашиванию по Граму.[25]
7
Выбросьте использованные материалы. Процедура утилизации отходов зависит от конкретной лаборатории и того, какие материалы использовались. Как правило, жидкость из лотка для окрашивания считается опасным материалом и переливается в плотно закрывающиеся бутылки. Использованные предметные стекла вымачиваются в 10%-ном растворе отбеливателя, после чего помещаются в контейнеры для сбора и утилизации игл и медицинских отходов.
Советы
- Помните о том, что результаты окрашивания по Граму во многом определяются тем, насколько хорош образец. Необходимо научить пациентов получать хорошие образцы для анализа (например, мокроту после глубокого кашля, а не простую слюну).
- При обесцвечивании этиловый спирт действует медленнее, чем ацетон.
- При работе в лаборатории соблюдайте стандартную технику безопасности.
- Для практики используйте ватную палочку, поскольку образец должен содержать как грамположительные, так и грамотрицательные бактерии. Если наблюдается лишь один тип бактерий, то это, скорее всего, означает, что вы либо недостаточно, либо слишком сильно обработали образец обесцвечивающим раствором.[26]
- Предметные стекла можно брать деревянной прищепкой.[27]
Предупреждения
- Ацетон и спирт огнеопасны. При попадании на ладони ацетон обезжиривает кожу, в результате чего в нее легче впитываются другие вещества. Надевайте перчатки и соблюдайте другие меры предосторожности.
- Следите за тем, чтобы препарат не высох, прежде чем вы смоете основной или контрастный краситель.[28]
Что вам понадобится
- Образец ткани
- Стеклянные предметные стекла
- Пипетка
- Источник пламени, нагреватель предметных стекол или метанол
- Вода
- Кристаллический фиолетовый
- Йод
- Обесцвечивающая жидкость, например спирт или ацетон
- Сафранин
- ↑ https://iws.collin.edu/mweis/Microbiology/Lab/Lab%20Discussions_Handouts/Gram%20Stain%20Steps.pdf
- ↑ https://amrita.vlab.co.in/?sub=3&brch=73&sim=208&cnt=2
- ↑ https://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ https://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ Beveridge TJ, Davies JA (November 1983). “Cellular responses of Bacillus subtilis and Escherichia coli to the Gram stain”. Journal of bacteriology 156 (2): 846–58.
- ↑ Davies JA, Anderson GK, Beveridge TJ, Clark HC (November 1983). “Chemical mechanism of the Gram stain and synthesis of a new electron-opaque marker for electron microscopy which replaces the iodine mordant of the stain”. Journal of bacteriology 156 (2): 837–45.
- ↑ https://amrita.vlab.co.in/?sub=3&brch=73&sim=208&cnt=2
- ↑ https://www.uphs.upenn.edu/bugdrug/antibiotic_manual/gram1.htm
- ↑ https://amrita.vlab.co.in/?sub=3&brch=73&sim=208&cnt=2
- ↑ https://www.microscope.com/education-center/how-to-guides/grams-stain/
- ↑ https://www.cargille.com/immersionoilmicroscope.shtml
- ↑ https://www.ncbi.nlm.nih.gov/books/NBK8385/
- ↑ https://amrita.vlab.co.in/?sub=3&brch=73&sim=208&cnt=2
- ↑ https://archive.crohn.ie/primer/bactid.htm
- ↑ https://www.microrao.com/micronotes/pg/Gram%20stain.pdf
- ↑ https://www.microrao.com/micronotes/pg/Gram%20stain.pdf
- ↑ https://www.microscope.com/education-center/how-to-guides/grams-stain/
- ↑ https://www.flinnsci.com/teacher-resources/biology/frequently-asked-biology-questions/culture-media-and-stains-preparation-and-use-tips/how-do-i-perform-a-gram-stain/
- ↑ https://www.flinnsci.com/teacher-resources/biology/frequently-asked-biology-questions/culture-media-and-stains-preparation-and-use-tips/how-do-i-perform-a-gram-stain/
- Isenberg, H.D. (ed). 1992. Clinical Microbiology Procedures Handbook . American Society for Microbiology, Washington, D.C.
- Isenberg, H.D. (ed). 1995. Essential Procedures for clinical Microbiology. American Society for Microbiology, Washington, D.C.
Об этой статье
Эту страницу просматривали 47 850 раз.
Была ли эта статья полезной?
Источник