Кишечная палочка устойчивая к антибиотикам

4149 просмотров
1 декабря 2016
После отравления за границей не могу вылечить дисбактериоз, вызванный гемолитической E.coli 10 в 7-ой степени. Сдавала анализ кала на дисбактериоз 4 раза в двух разных лабораториях. После первого раза лечить ничем не стала, т.к. сдала потом анализ повторно и ничего не нашли. После второго и третьего раза помимо кишечной палочки в анализе находили другие бактерии (E.coli лактозонегативная 10 в 3, золотистый стафилокок). E.coli была чувствительна к цефтриаксону,цефотаксиму,цефалотину,хлорамфениколу,доксициклину,цефуроксиму,ампициллину. Лечилась бактисубтилом, альфанормиксом, бифиформом.
Последняя проверка показала,что кишечная палочка устойчива ко всем антибиотикам (амоксициллину,клавулановой кислоте,доксициклину, ко-тримоксазолу,налидиксовойкислоте,цефиксиму,цефотаксиму,ципрофлоксацину) и бактериофагам,используемым в лаборатории.Также,нашли протеи sp. 10 в 6-ой степени ( они ко всем вышесказанным антибиотикам чувствительны (кроме, ко-тримоксазолу)) и сниженное число лактобактерий ,также 10 в 6-ой степени.
Подскажите пожалуйста чем вылечить дисбактериоз? Хочу попробовать эрсефурил (как советовала когда-то инфекционист). Будет ли от него толк и нужно ли что-то принимать совместно с антибиотиком?
Заранее большое спасибо!
На сервисе СпросиВрача доступна консультация гастроэнтеролога онлайн по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!
Педиатр, Терапевт, Массажист
Бактериофаг интести, завязывайте с антибитиками, они больше калечат. Новые пробиотики Флувир или Према.
Педиатр, Терапевт, Массажист
Елена, 2 декабря 2016
Клиент
Наталья, спасибо большое за ответ! К сожалению, к интестифагу, колипротейному фагу и поливалентному пиобактериофагу она тоже устойчива (исходя из анализов)
Педиатр, Терапевт, Массажист
А вы пропейте он комбинированный, результат может быть хорошим. Еще эрсефурил- тот же фурозолидон, он энтеросептик. Его пропить 10 дней стоит. Фурозолидон дешевле по моему- по 2 т – 4р. 10 дней. Очень хороший.
Педиатр, Терапевт, Массажист
А ваш дисбактериоз клинически как проявляется? Если потравить патологическую флору не получается, попробуйте ее выселить- флувир или према, и хилакфорте для лучшего приживления. Пропить фуразолидон, или ко- тримоксазол 10 дней. Затем интести 10 дней, вместе с флувир или премой с хилакфорте месяц. Вот такой стратегический план.
Елена, 2 декабря 2016
Клиент
Честно говоря, он никак не проявляется. Только на основе анализов. Я просто решила периодически делать анализ на дисбактериоз,т.к. один раз у меня эта же гемолитическая палочка попала в мочу, я её вылечила и боюсь,что она снова может попасть туда
Педиатр, Терапевт, Массажист
Легче пропить уроваксом, для профилактики урологических инфекций,чем лечить кишечник.
Оцените, насколько были полезны ответы врачей
Проголосовал 1 человек,
средняя оценка 5
Что делать, если я не нашел ответ на свой вопрос?
Если у Вас похожий или аналогичный вопрос, но Вы не нашли на него ответ – получите свою 03 онлайн консультацию от врача эксперта.
Если Вы хотите получить более подробную консультацию врача и решить проблему быстро и индивидуально – задайте платный вопрос в приватном личном сообщении. Будьте здоровы!
Источник
29.07.2019 00:19
Штаммы уропатогенной кишечной палочки могут длительно сохраняться в кишечниках здоровых женщин и вызывать бактериурию

На рисунке: Раскрашенное изображение (полученное с помощью растрового электронного микроскопа) уропатогенных Е. coli, эпителия и нейтрофилов на поверхности слизистой оболочки мочевого пузыря.
Пандемическая уропатогенная устойчивая к фторхинолонам кишечная палочка Escherichia coli обладает повышенной способностью сохраняться в кишечнике и вызывать бактериурию у здоровых женщин
Прим. ред.: Бактериурия – это наличие бактерий в моче. Бактериурия, сопровождаемая симптомами, является инфекцией мочевыводящих путей, в тоже время есть и бессимптомная бактериурия. Диагноз ставится путем анализа мочи или посева мочи. Кишечная палочка Escherichiacoli является наиболее распространенной бактерией при бактериурии.
В конце страницы, в рамках рассматриваемой темы, см. также результаты более раннего исследования об антиадгезионной терапии (альтернаьтиве антибиотикотерапии), которая может уменьшить колонизацию уропатогенной Escherichiacoli.
ИССЛЕДОВАНИЕ
Исследование более 1000 здоровых женщин без симптомов инфекции мочевыводящих путей показало, что почти 9% носили в кишечнике штаммы Escherichia coli с множественной лекарственной устойчивостью. Дополнительные результаты указывают на вероятные причины пандемии резистентных штаммов E.coli. Они показывают ценность проверки статуса пациента-носителя для прогнозирования резистентных инфекций, а также необходимость переосмысления клинического значения бактерий в моче без симптомов, поскольку пандемические штаммы могут быть высокопатогенными для мочевыделительной системы и устойчивыми к лечению.
Это вызывает клиническую озабоченность, поскольку болезнетворные бактерии E. coli могут переноситься из пищеварительного тракта в женский мочевой тракт через мочеиспускательный канал, который короче и расположен по-разному у женщин, чем у мужчин. Затем бактерии могут попасть в мочевой пузырь и другие части мочевыводящих путей.
Более трети образцов мочи, предоставленных теми, кто имел устойчивую к фторхинолонам (Ципро) кишечную кишечную палочку, дали положительный результат на рост E. coli. Из них около 77% были Ципро-устойчивы, и клональный тип бактерий соответствовал образцу кала.
Большая часть обнаруженной патогенной кишечной палочки принадлежала к пандемическим клональным группам ST131-H30R или ST1193 с множественной лекарственной устойчивостью, которые в настоящее время вызывают большинство лекарственно-устойчивых инфекций мочевыводящих путей и кровотока. Они были обнаружены в два раза чаще в моче людей, у которых эти специфические штаммы были в кишечнике, по сравнению с другими штаммами кишечной палочки E. coli в целом.
Кроме того, присутствие группы ST ST131-H30R в кишечнике в этом исследовании было связано с более старшим возрастом.
Исследователи также проверили, какие участники могли иметь назначение антибиотиков во время исследования для любого типа инфекции, включая респираторную.
Через три месяца после этого более раннего сбора мочи инфекции мочевыводящих путей были диагностированы почти в 7% из 45 ранее бессимптомных носителей, которые дали согласие на последующее электронное медицинское обследование. Участники исследования были из района Пьюджет-Саунд (Puget Sound).
«Два пандемических фторхинолон-резистентных патогенных штамма E. coli, обнаруженных в клинических образцах, являются превосходными колонизаторами кишечника и, как правило, сохраняются там», – отметили исследователи. «Они также могут обнаруживаться с необычно высокой частотой в моче здоровых женщин, у которых не было документированного диагноза инфекции мочевыводящих путей во время тестирования образцов. Оба явления, по-видимому, взаимосвязаны».
Исследователи отметили, что уже давно известно, что микробная флора кишечника пациента часто содержит штаммы, вызывающие инфекцию мочевыводящих путей. Не было точно установлено, имеют ли пандемические, лекарственно-устойчивые штаммы отчетливые паттерны (очаги) в кишечнике или нижних мочевых путях здоровых людей.
Исследование было опубликовано в журнале Oxford University Press Journal, Clinical Infectious Diseases («Клинические Инфекционные Заболевания»).
По словам Евгения Сокуренко, профессора микробиологии в Медицинской школе Вашингтонского университета (UW), полученные результаты могут иметь несколько клинических последствий для лечения и инфекционного контроля. Он был старшим научным сотрудником по исследованию. Несколько других преподавателей микробиологии UW и исследователей Постоянного НИИ Кайзера в Сиэтле (Kaiser Permanent Research Institute investigators in Seattle) сотрудничали в этой работе. Ведущим научным сотрудником была Вероника Леонидовна Чеснокова, заведующая кафедрой микробиологии Медицинской школы UW.
Результаты показывают, что определенные штаммы кишечной палочки с множественной лекарственной устойчивостью, обнаруженные в этом исследовании, занимают гораздо более длительное пребывание в кишечнике, чем некоторые другие устойчивые штаммы, а также могут присутствовать в моче здоровых женщин, не вызывая жжения, крови в моче или других предупреждающих признаков бактериальной инфекции.
Сокуренко объяснил, что знание того, присутствуют ли в кишечнике женщины множественные лекарственно-устойчивые штаммы, может помочь предсказать профиль резистентности последующей клинической инфекции. Усилия по избавлению от пандемических штаммов кишечной палочки в кишечнике носителей могут снизить частоту возникновения множественных лекарственно-устойчивых инфекций и, возможно, защитить их домашние или другие контакты.
Сокуренко также сказал, что медицине, возможно, потребуется пересмотреть клиническую значимость обнаружения бактерий в моче, даже без симптомов, во время этой пандемии множественных устойчивых к антибиотикам штаммов E. coli, поскольку эти штаммы могут подвергнуть носителей риску возникновения трудно поддающегося лечению бактериального заболевания.
Фторхинолоны являются наиболее часто назначаемыми препаратами при инфекциях мочевыводящих путей. Несмотря на усилия по ограничению их использования, согласно исследователям, штаммы, устойчивые к этой категории антибиотиков, процветают и распространяются по всему миру.
Исследователи предположили, что превосходная способность двух пандемических штаммов, ST131-H30R и ST119, длительно занимать место в кишечнике людей, возможно, способствовала их быстрому глобальному распространению. Они могут сохраняться и передаваться среди здоровых людей даже в отсутствие применения антибиотиков, что может нарушить микробную структуру кишечной флоры.
Ученые пришли к выводу, что это исследование выдвигает на первый план вероятные физиологические причины пандемии этих устойчивых штаммов кишечной палочки. Оно также указывает на ценность определения статуса носителя у пациенток для прогнозирования будущих резистентных инфекций, а также на необходимость переосмысления клинического значения бактерий, присутствующих в моче без симптомов, особенно с учетом того, что эти пандемические штаммы могут быть супербактериями: высокопатогенными для мочевой системы и устойчивыми к лечению.
Источник: Материалы предоставлены Вашингтонским университетом медицинских наук – University of Washington Health Sciences / UW Medicine
Статья в журнале: Veronika L Tchesnokova, Evgeni V Sokurenko, etal. Pandemic uropathogenic fluoroquinolone-resistant Escherichia coli have enhanced ability to persist in the gut and cause bacteriuria in healthy women. ClinicalInfectiousDiseases, 2019
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
У уропатогенной кишечной палочки понизили способность «прилипать» к эпителию кишечника

На рисунке: Ингибиторы адгезии (красные точки) связываются пилями бактерий, препятствуя их соединению с рецепторами клеток организма-хозяина
Выборочное истощение уропатогенных штаммов E. coli из кишечника с помощью ингибирующего высокоаффинного маннозида
Инфекции мочевыводящих путей (ИМП), вызванные уропатогенной кишечной палочкой (UPEC), поражают 150 миллионов человек ежегодно. Несмотря на эффективную терапию антибиотиками, у 30–50% пациентов наблюдаются рецидивирующие ИМП. Кроме того, растущая распространенность UPEC, которые устойчивы к антибиотикам последней линии, а в последнее время к карбапенемам и колистину, делает ИМП ярким примером кризиса устойчивости к антибиотикам и подчеркивает необходимость новых подходов к лечению и профилактике бактериальных инфекций. Штаммы UPEC устанавливают резервуары в кишечнике, из которых они выделяются с фекалиями, и могут колонизировать периуретральную область или влагалище и впоследствии подниматься через мочеиспускательный канал к мочевыводящим путям, где они вызывают ИМП.
Известно, что бактериальные пили (ворсинки) играют жизненно важную роль в взаимодействиях организма-хозяина и E. coli, опосредуя прикрепление (адгезию) к эпителиальным клеткам мочевого пузыря и почек. Однако в настоящее время недостаточно информации о механизмах колонизации и устойчивости UPEC в кишечнике.
Молекулы адгезии выносятся на поверхность бактерии и собираются с помощью системы секреции chaperon-usher (‘Chaperon-usher pathway’, сокращенно — CUP). Она состоит из двух белков. Один из них получил английское название «chaperone», которое переводится как «компаньон», «сопровождающее лицо», а в транскрипции — «шаперон», а второй компонент получил английское название «usher», которое переводится как «швейцар», «привратник», в транскрипции – «ашер».
Изоляты UPEC кодируют до 16 различных пилей пути CUP, и каждый тип пилей может обеспечивать колонизацию среды обитания в хозяине или окружающей среде.
В исследовании 2017 года, результаты которого опубликованы в журнале Nature, американские ученые продемонстрировали, что механизм шаперон-ашер (CUP) играет роль в колонизации кишечника штаммами UPEC. В частности, авторы создали девять бактерий с одиночными делециями (отсутствующими участками ДНК), у каждого из которых отсутствовал один из генов, кодирующих белки CUP. Эффект этих мутаций тестировали в модели колонизации кишечника мыши. Обнаружилось, что одиночная делеция двух генов, fim и ucl, которые кодируют пили типа 1 и пили типа F17, соответственно, вызвали заметное снижение способности бактерии колонизировать кишечник. Более того, удаление обоих генов в одном штамме приводило к большему дефекту, чем одиночная делеция, что доказывает, что их роли не являются вырожденными.
Операторы fim и ucl кодируют адгезины, которые расположены на дистальном конце каждой ворсинки. Эти адгезины, FimH и UclD, соответственно, опосредуют связывание с клетками организма-хозяина. Путем тестирования очищенных фрагментов этих двух адгезинов в анализах in vitro авторы продемонстрировали четкую специфичность связывания с гликанами, присутствующими на поверхности эпителиальных клеток хозяина, располагающимися в криптах кишечной стенки; FimH связан преимущественно с N-связанными гликанами, которые содержат маннозу (т.е. адгезин пилей типа 1 FimH в дальнейшем связывает маннозу на поверхности мочевого пузыря и опосредует колонизацию мочевого пузыря), тогда как UclD связаны с O-связанными гликанами.
В предыдущих исследованиях было показано, что потеря пилей типа 1 отразилась в потере способности UPEC колонизировать мочевой пузырь. Чтобы попытаться предотвратить связывание пилей типа 1 с эпителиальными клетками кишечника, авторы протестировали маннозид M4284, который представляет собой небольшую синтетическую молекулу, которая связана с маннозой и связывается с адгезином FimH пилей 1 типа с высокой аффинностью.
Прим. ред.: Справедливости ради стоит отметить, что уже ранее (судя по публикациям), для целей терапии рецидивирующих инфекций мочеполовых путей, вызываемых уропатогенными штаммами E.coli, рассматривалось применение маннозидов, т.е. D-маннозы, которая чаще встречается именно в виде «маннозидов» – гликозидов, содержащих маннозу. В свободном же состоянии D-манноза, которая представляет 1 из 2-х стереоизомеров маннозы (т.е. и есть сама манноза) лишь иногда встречается в некоторых растениях (в Amorphophallus Konjac, в кожуре апельсинов), при этом, D-манноза является основным стереоизомером маннозы, встречающимся в природе. Однако в описываемом исследовании речь идет о тестировании более эффективного варианта маннозида, что указывает на возможность более успешной антиадгезионной терапии.
У мышей, которые перорально получали это соединение, произошло снижение колонизации кишечника штаммами UPEC по сравнению с контрольной группой. То есть этот маннозид может эффективно конкурировать за связывание с маннозой на клетках хозяина и, таким образом, непосредственно вмешиваться во взаимодействие “хозяин-патоген”. Авторы также показывают, что введение маннозида может снизить вероятность развития ИМП путем одновременного удаления UPEC из кишечника и лечения активной инфекции мочевого пузыря.
Исследование показало, ингибирующий высокоаффинный маннозид, уменьшает кишечную колонизацию генетически разнообразных изолятов UPEC, одновременно обрабатывая ИМП, без заметного нарушения структурной конфигурации микробиоты кишечника. Избирательно истощая резервуары UPEC в кишечнике, маннозиды могут заметно снизить частоту ИМП и рецидивирующих ИМП.
Иными словами, лечение не вызывало существенных изменений в составе микробиоты кишечника, в отличие от применяемых в настоящее время антибиотиков. Таким образом, антиадгезионная терапия может уменьшить колонизацию конкретными бактериями и представляет собой альтернативу антибиотикотерапии.
Источник: Caitlin N. Spaulding. et al. Selective depletion of uropathogenic E. coli from the gut by a FimH antagonist. Nature 546, 529–532 (2017)
Об адгезии микроорганизмов (в т.ч. про “пили”, “фимбрии”, адгезины и т.д.) см. дополнительно в подразделе Адгезия микроорганизмов: общие сведения
Пожалуйста, авторизуйтесь, чтобы оставить комментарий.
Источник
 Автор: Трубачева Е.С., врач – клинический фармаколог
Автор: Трубачева Е.С., врач – клинический фармаколог
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli).
Актуальность обсуждения данного микроорганизма состоит в том, что кишечная палочка – это чемпион по созданию проблем как для пациентов, так и для медицинского персонала стационаров и в амбулаторной службе. Хуже нее только клебсиелла, но о ней поговорим попозже. При этом E.coli не летает по воздуху и не имеет ножек для самостоятельного перемещения и инфицирование ею – это почти всегда «болезнь грязных рук». С патологией, вызванной этим возбудителем, пациент может прийти к любому врачу, а медицинский персонал может принести уже на своих руках кишечную палочку любому пациенту с одной лишь разницей – это будет не дикий и симпатичный зверек, убиваемый обычным амоксицилином, а вооруженная до зубов особь, умеющая очень эффективно убивать сама. То есть это один из тех врагов, которых совершенно точно надо знать в лицо.
Микробиологические аспекты
E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем.
К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
- Штамм серотипа O157:H7 (STEC O157) или так называемый энтерогеморрагический штамм E.coli, который является причиной 90% случаев геморрагических колитов и 10% случаев гемолитико-уремического синдрома. Встречается достаточно часто, а если вы работаете в стационарах плановой помощи, то это один из обязательных анализов для принятия решения о госпитализации, так что так или иначе он на слуху. Проблема инфицирования этим возбудителем связана с употреблением плохо термически обработанной пищи и передачи штамма контактным путем от человека к человеку, проще говоря, через руки.
- Второй крайне опасный высоко-патогенный штамм кишечной палочки – O104:H4, вызвавший в Германии 2011 году эпидемию с высоким уровнем смертности среди пациентов с пищевыми токсико-инфекциями вследствие развития гемолитико-уремического синдрома. Если помните, это была очень громкая история с перекрытиями границ для испанских огурцов, потом вообще для всей плодоовощной продукции из Европы в Россию, пока искали хотя бы источник, не говоря уж о виновнике тех событий. Окончательно виновными тогда были обозначены листья салата, в поливе которых использовалась вода с признаками фекального заражения, а затем речь пошла уже о пророщенных семенах, которые так же полили фекально-зараженной водичкой. Так вышли на конкретный штамм E.coli – O104:H4, который, подвергшись санации антибиотиком, выплескивает эндотоксин, вызывающий гемолиз и острую почечную недостаточность. В итоге – массовая летальность пациентов, получавших антибиотики.
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше.
И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
- Кроме вышеперечисленных существуют энтеротоксические (вызывают «диарею путешественников»), энтероинвазивные (вызывают кровавую диарею) и энтеропатогенные (водянистая диарея у новорожденных) штаммы.
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
- Заболевания мочевыводящий путей. Здесь E.coli является абсолютным лидером и играет ведущую роль в развитии:
- Острых циститов
- Пиелонефритов
- Абсцессов почек и
- Простатитов
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
- Заболевания желудочно-кишечного тракта:
- Диарея путешественников
- Интраабдоминальные абсцессы и перитониты, чаще всего носящие вторичный характер (прободение кишки в результате первичного заболевания, либо при дефектах оперативного вмешательства)
- Инфекции центральной нервной системы у очень ослабленных пациентов, результатом чего будет развитие менингитов. Встречается в основном у лиц старческого возраста и новорожденных. Кроме того, в случае внутрибольничного заражения менингит может развиться в результате плохой обработки рук медицинского персонала перед оперативным вмешательством или перевязками.
- Инфекции кровотока, а именно сепсис, как продолжение развития заболеваний мочевыводящих путей, ЖКТ и билиарного тракта вследствие метастазирования очага инфекции. Лечению поддается крайне тяжело, особенно если задействованы внутрибольничные штаммы, летальность чрезвычайно высокая.
- Инфекции кожи и мягких тканей как следствие раневых инфекций после вмешательств на органах брюшной полости.
- Внутрибольничные пневмонии, вызванные устойчивыми штаммами кишечной палочки, целиком связаны с дефектами ухода за пациентом и фактором чистоты, точнее ее отсутствия, рук медицинского персонала или ухаживающих родственников. Факт внутрибольничного заражения доказывается элементарно, что будет наглядно продемонстрировано в следующем разделе.
- Послеродовые (и не только) эндометриты. Вынуждены упомянуть и эту патологию, так как инфицирование кишечной палочкой встречается все чаще и чаще, а большой настороженности нет. Как результат, можно очень сильно промахнуться с антибактериальной терапией и, как следствие, прийти к экстирпации органа в виду неэффективности антибиотикотерапии. Натолкнуть на мысль может более позднее, чем обычно, поступление и более агрессивное, чем обычно течение. Дополнительный осмотр прианальной области так же может натолкнуть на вероятность развития именно такого инфицирования.
(часть вторая) Практические вопросы диагностики и лечения.
Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
- Пациенты с диареей, приехавшие из отпуска и все-таки смогшие прийти на прием (диарея путешественников или энтеротоксигенные штаммы E.coli).
- Пациенты со всеми заболеваниями мочевыделительной системы, в том числе беременные, но строго с наличием симптоматики (не надо лечить бессимптомную бактериурию, иначе вырастите резистентные штаммы и создадите проблему и себе, и женщине, и роддому в последующем).
- В стационарах – нозокомиальные пневмонии, послеоперационные менингиты, перитониты, сепсисы и т. д., носящие вторичный характер.
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать?
Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
- Начнем с дикого и крайне симпатичного штамма E.coli, который живет в кишечнике и обеспечивает синтез витамина К. С ним сталкиваются доктора амбулаторной службы у пациентов с инфекциями мочевыводящих путей или в случае госпитализации у пациентов, которые не получали антибиотики около года. И именно такую чувствительность мы имеем в виду, когда назначаем эмпирическую антибиотикотерапию
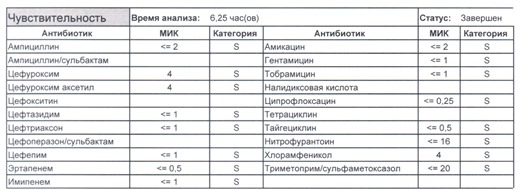
Чем лечим?
- Как видите, зверь чувствителен абсолютно ко всему, и это как раз тот случай, когда можно свободно пользоваться табличными материалами справочников или клинических рекомендаций, так как механизмы резистентности полностью отсутствуют.
- Если в ваши руки попал пациент, которого в течение последнего полугодия лечили антибиотиками пенициллинового ряда, то антибиотикограмма может выглядеть следующим образом.
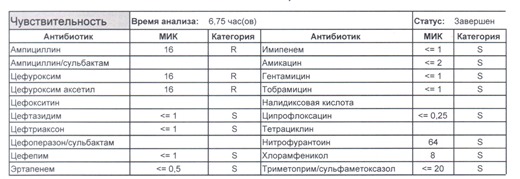
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
- Отдельно хотелось бы обратить внимание на следующий штамм E.coli, как типичного обладателя бета-лактамаз расширенного спектра. И эти БЛРС чаще всего вырабатываются в результате неуемного использования цефалоспоринов третьего поколения и совершенно конкретного его представителя – цефтриаксона.
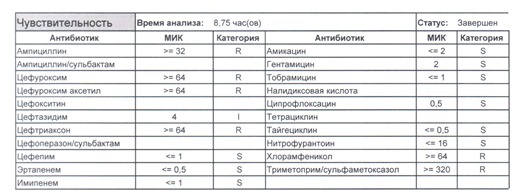
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
- Пациент сам рассказывает, что получал цефтриаксон в промежутке полугодия
- Пациент был переведен из другого стационара (хотя там можно будет и следующую картинку обнаружить)
- Пациент ничего не получал, и вообще в больнице не лежал, но возбудитель попал с рук медицинского персонала, вызвав внутрибольничную инфекцию
- И самый простой случай – посев был взят в момент проведения терапии цефтриаксоном
Что делать?
- Помнить, что перед вами пациент – носитель возбудителя, который может быть перенесен и создаст серьезную опасность жизни более слабому. Поэтому и персонал, и сам пациент, должны неукоснительно соблюдать санитарные правила для недопущения переноса.
- Чем лечить? Так как ни один ингибитор бета-лактамаз тут уже не работает, БЛРС отлично их разрушают, то выбор будет невелик, и лучше, чтобы этот выбор делал специально-обученный специалист – врач-клинический фармаколог, так как в данной ситуации важную роль играют не только данные о чувствительности и резистентности, но и МПК возбудителя, например. Не говоря уже о факторе фармакодинамики и самом очаге локализации инфекции.
- Если клин. фарма нет или он не специально обученный – тогда лечим в соответствии с клиническими рекомендациями по соответствующей нозологии из раздела «препараты резерва». Не лишним будет обсудить ситуацию с врачом-бактериологом клинической лаборатории, делающей для вас посевы.
- Один из самых плохих вариантов, который вы можете увидеть
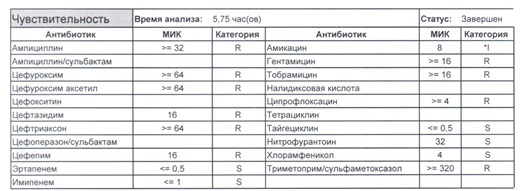
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер.
Когда можем его обнаружить:
- вторичные перитониты,
- нозокомиальные пневмонии,
- пиелонефриты,
- послеоперационные менингиты,
- сепсис и т. п.
И всегда это будет ятрогенное поражение как следствие неправильной гигиены рук персонала либо обработки инструментария. Можно возразить «но как же тяжелые перитониты?». Отвечу тем, что для тяжелых перитонитов без дефектов ухода наиболее характерен штамм на третьем рисунке, так как для того, чтобы вырастить такую зверюгу, тяжелому перитониту здоровья не хватит, он от осложнений погибнуть успеет, а сама кишечная палочка ножками ходить не умеет, мы ее исключительно неправильно мытыми ручками разносим, и доказать это элементарно, так как точно такие же штаммы будут высеваться при плановых проверках эпидемиологической службы.
Что делать?
- Для эрадикации такого возбудителя нужен не просто отдельный обученный специалист и имеющая весь набор препаратов резерва аптека, но и напряженная работа эпидемиологической службы, так как подобный пациент должен быть изолирован в отдельную палату, а лучше изолятор (не подумайте, что бред – при правильной организации такие вещи вполне реальны) с проведением карантинных мероприятий, так как основная проблема появления подобного рода возбудителей в том, что они очень быстро разбегаются по всему корпусу (или стационару, если корпуса не изолированы) и обсеменяют все и вся, нанося вред другим ослабленным тяжелой болезнью пациентам и заселяя кишечники всего медицинского персонала.
- И еще одно крайне мерзкое свойство таких возбудителей – они умеют осуществлять горизонтальный перенос механизмов резистентности с другой флорой семейства Enterobacteriaceae, и даже если вы избавились от E.coli, неприятным сюрпризом может стать ее подруга клебсиелла, наносящая еще больший вред и по сути добивающая больного. Избавится полностью от этих возбудителей невозможно, для этого надо избавится от медицинского персонала как основных носителей, но контролировать можно – мероприятия подробно расписаны в действующих СанПиН 2.1.3.2630-10. Так что в случае выявления подобного возбудителя речь пойдет не только о лечении того пациента, у которого он обнаружен, но и проведения мероприятий по недопущению инфицирования всех остальных пациентов (а это, напомню, почти всегда ПИТ или ОРИТ), находящихся рядом.
- И в заключение необходимо упомянуть о панрезистентной E.coli, вооруженной полным спектром механизмов резистентности. В антибиотикограмме будут тотальные R, а МПК возбудителей пробьют все возможные потолки. К счастью для автора, она с таким зверем пока не сталкивалась, что связано с наличием работающей системы эпиднадзора, поэтому картинки не будет, хотя ее несложно представить. Такие пациенты, если кишечная палочка окажется патогеном, а не колонизатором (мало ли с чьих рук, например, в рану упала), к сожалению, почти не выживают, так как изначально являются крайне тяжелыми соматически, а кишечная палочка обычно подводит черту к их существования на бренной земле.
Что делать?
- Не допускать развития такой, не побоюсь этого слова, зверюги в ваших стационарах, а если появилась – гонять эпидемиологическую службу, чтобы избавляла руки и поверхности от такого рода заражения, что возможно только при условии наличия достаточного количества расходных материалов, перчаток и дезинфицирующих средств.
А теперь подведем небольшой итог нашего непростого разговора:
- Кишечная палочка – возбудитель очень серьезный и не следует его недооценивать. В ее типах также необходимо четко ориентироваться.
- В первую очередь о ней мы думаем при лечении инфекций мочевыводящих путей, особенно у беременных.
- Если перед нами пациент с признаками кишечной инфекции, то подход к терапии антибиотиками должен быть сугубо индивидуальным, и если состояние позволяет, то до ?