Кишечная палочка в инсулине
Инсулин – это белок, который является гормоном поджелудочной железы. Действие инсулина в основном направлено на обмен углеводов и проявляется снижением уровня сахара в крови (гипогликемический эффект). Это происходит за счет того, что инсулин облегчает переход глюкозы в клетки органов и тканей, где стимулирует ее активирование путем образования глюкозо-6-фосфата.
Последний, окисляясь, обеспечивает клетки энергией. Таким образом, инсулин способствует периферическому окислению глюкозы. Наряду с этим инсулин тормозит распад гликогена в клетках печени. При этом снижаются процессы распада жиров и превращение аминокислот в глюкозу и происходит активирование синтеза жиров и белков.
При недостатке инсулина развивается тяжелое заболевание – диабет; при этом разрушается нормальный обмен веществ. Диабетики должны получать инсулин ежедневно, если этого не происходит, то развивается тяжелое состояние – диабетическая кома, и организм погибает. Потребность в инсулине огромна. Долгое время источником инсулина служили железы коров и свиней. Учитывая, что поджелудочная железа коровы весит 200-250 г, для получения 100 г кристаллического инсулина нужно 800-1000 кг исходного сырья. Понятно, что животный инсулин не мог обеспечить всех больных. Например, в 1979 г. из 60-ти млн больных диабетом во всем мире, только 4 млн получали препарат инсулина.
Инсулин построен из двух полипептидных цепей А и В длиной 20 и 30 аминокислот, последовательность которых была установлена Сэнгером в 1955 г. Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены тремя коллективами исследователей в Сша, Китае и ФРГ в 1963 и 1965 гг. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, который включает 170 химических реакций, оказалось трудно. Тем не менее в 1980 г. в Дании (компанией «Ново индастри») был разработан способ превращения инсулина свиньи в инсулин человека замещением остатка аланина, который является 30-й аминокислотой в цепи В на остаток треонина.
Это удалось достигнуть путем ферментативного замещения с последующей хроматографической очисткой продукта; в результате был получен однокомпонентный инсулин человека 99 %-й чистоты. Исследования двух однокомпонентных инсулинов (человеческого и свиного) показали, что они не различались по активности и по времени действия. В 1982 г. инсулин производили главным образом две компании «Эли Лилли» (85 % сбыта инсулина в США и патент на его производство с 1923 г.) и «Ново индастри» (47,5 % сбыта гормона в Европе).
В организме животного две полипептидные цепи инсулина исходно являются частями одной белковой молекулы длиной 109 аминокислот – препроинсулина. При синтезе препроинсулина в клетках поджелудочной железы первые 23 аминокислоты служат сигналом для прохождения молекулы сквозь мембрану клетки; эти аминокислоты отщепляются, образуется проинсулин длиной 86 аминокислот. Молекула проинсулина сворачивается таким образом, что начальный и конечный ее сегменты сближаются, а центральная часть молекулы удаляется с помощью ферментов.
Так образуется инсулин. Роль центральной части сводится к правильному взаимному расположению двух цепей инсулина.
Гилберт с сотрудниками выделили и-РНК из поджелудочной железы крысы, синтезировали ДНК-копию (комплементарная ДНК), которая была встроена в плазмиду E. coli в среднюю часть гена пенициллиназы (этот фермент в норме секретируется из клеток), и получили рекомбинантную плазмиду. Как показало определение последовательности ДНК, рекомбинантная плазмида содержала информацию о структуре проинсулина, но не препроинсулина.
При трансляции и-РНК в клетках кишечной палочки синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина. Далее отщепляли пенициллиназу и удаляли средний сегмент проинсулина действием трипсина. Позднее было показано, что полученные таким образом молекулы влияют на сахарный обмен, как гормон, выделенный из поджелудочной железы крысы.
В 1979 г. в США были синтезированы гены, кодирующие А и Б цепи инсулина. Далее каждый синтетический ген встраивали в плазмиду E. coli в конце гена -галактозидазы. После этого синтезированные полипептиды отщепляли от фермента, проводили их очистку и цепи соединяли in vitro для получения полной молекулы инсулина.
В клетках E. coli был также осуществлен биосинтез проинсулина, а не только отдельных ее цепей. Для этого на и-РНК проинсулина синтезировали ее ДНК-копию с помощью обратной транскриптазы (ДНК-полимераза). Этот способ имеет серьезное преимущество, поскольку различные этапы экстракции и выделения гормона сведены к минимуму. С помощью этого метода был получен высокий выход гормона -200 г на 1000 л культуральной жидкости (это эквивалентно количеству инсулина, выделенного из 1600 кг поджелудочной железы животных).
Исследователям из компании «Генентек» потребовалось 10 месяцев, чтобы в сентябре 1978 г. получить инсулин человека в специально сконструированном штамме кишечной палочки. Этот инсулин прошел самые серьезные и длительные испытания, которые показали, что он не вызывает никаких побочных явлений, как инсулин животных (у одного из каждых 20-ти больных инсулин животных вызывает аллергию; часто наблюдаются также расстройства почек и зрения ).
Кроме того, при длительном применении препарат не вызывал отрицательных иммунологических реакций.
Технология производства инсулина в бактериальных клетках имеет огромные преимущества перед получением инсулина из поджелудочной железы животных: не зависит от перебоев или количества сырья, конечный продукт всегда имеет одинаковый состав и степень чистоты.
В октябре 1982 г. был налажен выпуск «хемулина» (препарата синтетического инсулина человека) фирмой «Эли Лилли», которая затратила 100 млн долларов, чтобы начать поставку продукта на рынок.
Л.В. Тимощенко, М.В. Чубик
Опубликовал Константин Моканов
Источник
Кишечная палочка Esherichia coli, бактерия, известная
человечеству уже полтора века,
– обычнейший обитатель нашего кишечника. Она – излюбленный объект
исследований микробиологов, биохимиков и генетиков всего мира, и
не случайно именно Esherichia coli стала первым живым
генно-модифицированным организмом, появившимся на свет в 1973
году. В ее геном был встроен ген человека, кодирующий
синтез инсулина.
В настоящее время генетически модифицированные микроорганизмы
используются для производства фармацевтических препаратов,
вакцин, продуктов тонкого органического синтеза, пищевых добавок
и многого другого. Новые штаммы кишечной палочки уже не просто
производят инсулин: они стимулируют восстановление собственных
способностей организма пациента вырабатывать этот гормон. При
диабете первого типа бета-клетки поджелудочной железы утрачивают
способность синтезировать инсулин. Ученые Корнельского
университета (Итака, штат Нью-Йорк), работающие под руководством
Джона Марча (John March), решили попытаться восстановить
этот механизм с помощью сигнальной системы, используемой
выстилающими кишечник эпителиальными клетками и населяющими его
полезными бактериями. Созданный в лаборатории Марча штамм
непатогенной кишечной палочки синтезирует белок GLP-1 –
глюкагоноподобный пептид. В организме здорового человека этот
белок синтезируется клетками кишечника и, среди прочих эффектов,
запускает продукцию инсулина в поджелудочной железе. Авторы
продемонстрировали, что в лабораторных условиях в присутствии
глюкозы секретирующие GLP-1 бактерии запускают синтез инсулина в
культуре клеток кишечника человека. Механизмы, лежащие в основе
этого феномена, пока не ясны. Спектр применения – колоссальный, к
примеру, обычный йогурт, обогащенный такими бактериями, сможет
заменить больным диабетом инъекции инсулина! Кроме бактерий для
лечения диабета, группа Марча работает над созданием целого ряда
целебных штаммов микроорганизмов, в том числе предназначенных для
борьбы с кариесом, синтеза витаминов, лечения непереносимости
лактозы и профилактики холеры.


Стало известно о результатах исследования группы генетиков из
Массачусетского технологического института под руководством
профессора Рона Вайса (Ron Weiss), специалиста в области
синтетической биологии. В этом исследовании ученые пытаются
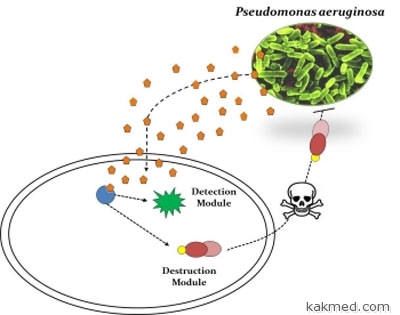
сделать кишечную палочку бактерией-охотником за одной из самых
опасных внутрибольничных инфекций – синегнойной палочкой
(Pseudomonas aeruginosa), олицетворяющей одну из главных проблем
современной медицины — резистентности патогенных микробов к
антибиотикам. Если пациенту в больнице внезапно становится плохо,
и антибиотики не помогают, то обычно главной причиной этого
оказывается именно “синегнойка” — агрессивный обитатель
хирургических отделений, виновник тысяч жертв. Ученые в
буквальном смысле «натравили» кишечную палочку на «синегнойку» –
модифицировали бактерию так, что она научилась «выслеживать» и
убивать клетки Pseudomonas, обитающие в ранах и абсцессах.
Esherichia coli находит клетки синегнойной палочки, что
называется, «по запаху». Дело в том, что клетки опасного патогена
общаются друг с другом внутри своей колонии с помощью различных
сигнальных веществ. Модифицированная E.Coli реагирует на это
вещество, связываясь с ним особым протеином, и, обнаружив
псевдомонаду, убивает ее с помощью яда, получившего название
бактериоцин. Попадая внутрь клетки синегнойной палочки, подвижной
и устойчивой к большинству антибиотиков, бактериоцин разрушает ее
ДНК. Рон Вайс и его коллеги показали, что генетически
модифицированная кишечная палочка в лабораторной жидкой культуре
убивает “синегнойку”, не причиняя вреда себе, а также другим
неопасным бактериям. Этот метод испытан пока лишь в лаборатории,
но ученые считают, что возможно сделать лечебный штамм кишечной
палочки в 20 раз сильнее опытного экземпляра. И тогда испытать на
млекопитающих, а также подумать о возможных лекарственных формах
пробиотиков.

Генно-модифицированные штаммы кишечной палочки ученые намерены
использовать и для решения одной из проблем века – ожирения. Как
показывают исследования, добавление в еду подопытным мышам
особого штамма E.Coli , в геном которой введен ген растения
резуховидки, помогает избавить от лишнего веса подопытных мышей.
Бактерии ориентированы на синтез особого вещества под названием
NAPE, которое организм млекопитающих превращает в гормон,
вырабатываемый в процессе переваривания пищи. Этот гормон
поступает через кровь в мозг и, сигнализируя о насыщении,
уменьшает аппетит. Получается, что бактерия заставляет мышей
думать, что они едят больше, чем на самом деле. В исследовании,
опубликованном в журнале The Journal of Clinical Investigation,
грызунов, которым добавляли бактерии в питьевую воду, и грызунов
из контрольной группы кормили высококалорийной пищей. У мышей,
которые употребляли бактерии, снизился аппетит, они перестали
набирать вес и начали показывать меньшую инсулиновую
устойчивость. Эффект сохранялся около четырех недель. Ученые
считают, что эти бактерии можно использовать в пробиотиках для
употребления людьми. Если препарат окажется действенным и
безопасным, то он даст большую фору существующим лекарствам
против ожирения.

Пробиотики, изготовленные с добавлением модифицированной кишечной
палочки, как считают ученые – это одно из лекарств будущего, ведь
для этой бактерии кишечник человека – естественное местом ее
обитания. Однако, несмотря на первые успехи, авторы отмечают, что
им еще предстоит ответить на несколько непростых вопросов.
Например, необходимо выяснить, насколько опасны подобные
вмешательства в естественную микрофлору кишечника, индивидуальную
для каждого человека.
Источник
ПОЛУЧЕНИЕ ИНСУЛИНА НА ОСНОВЕ МЕТОДОВ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
СИНТЕЗ СОМАТОСТАТИНА
СИНТЕЗ СОМАТОТРОПИНА
Инсулин — гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний — сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин — небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжелая форма, для лечения которой больному необходим инсулин (инсулин зависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе). Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800— 1000 кг исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путем замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и времени действия.
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к 3′-концу гена фермента бета-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента бета-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисупьфидных мостиков между образованными цепями инсулина происходило с трудом.

В 1981 г. синтезирован ген-аналог проинсулина — мини-С- проинсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли бета-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК Полученную кДНК встроили в плазмиду pBR322 Е. coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
В 1978 г. сотрудниками Института биоорганической химии под руководством академика Ю. А. Овчинникова был осуществлен синтез двух структурных генов, кодирующих синтез нейропептидов: лейцин-энкефалина и брадикинина. Синтезированный ген лейцин-энкефалина имел два «липких» конца:
Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка бета-галактозидазы кишечной палочки Е. coli, в плазмиду-вектор pBR322 и обработан смесью рестриктаз — EcoRI и BamHI. Полученная рекомбинантная плазмида рЕк была трансформирована в клетки Е. coli. В результате экспрессии встроенного ген бактерия начала продуцировать гибридный (химерный) белок, cодержащий на N-конце участок бета-галактозидазы, а на С-конце последовательность нейропептида. С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетиче| кого гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.

СИНТЕЗ СОМАТОСТАТИНА
Аналогичным путем был синтезирован соматостатин — гормон гипоталамуса (рис. 5.13). Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем соединения тринуклеотидов. Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coli или к бета-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.

Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент бета-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от бета-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10000 молекул на одну клетку. Из 100 г биомассы Е.coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.

5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза. Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные — фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метионина на Н2N-конце молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, — с фен (—NH2) долей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку; Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.
бета-Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. Бета-эндорфин получен в клетках Е. coli в виде гибридного белка с бета-галактозидазой. Процедура синтеза бета-эндорфина включала: получение путем обратной транскрипции мРНК — кДНК, кодирующей белок- предшественник, содержащий помимо последовательности бета-эндорфина последовательность АКТГ и бета-липотропина (Р-ЛТГ), в дальнейшем удаляемые. Бета-эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против бета-эндорфина. От бета-эндорфина человека генно-инженерный бета-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
Источник