Кишечной палочки генная инженерия

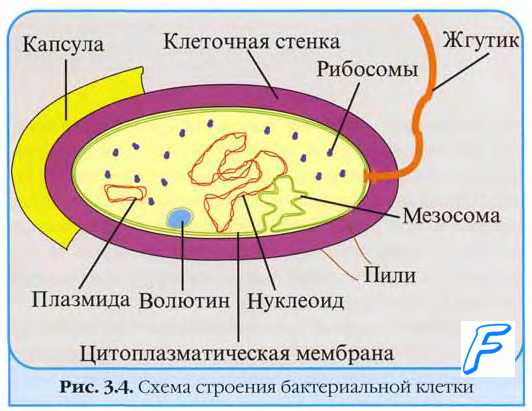
Кишечная палочка (лат. Escherichia coli, E. coli, по имени Теодора Эшериха) – грамотрицательная палочковидная бактерия, широко встречается в нижней части кишечника теплокровных организмов.E. coli – грамотрицательная бактерия, факультативный анаэроб, не образует эндоспор. Клетки палочковидные, со слегка закруглёнными концами, размером 0,4-0,8 х 1-3 мкм, объём клетки составляет около 0,6-0,7 мmі. Штаммы, имеющие жгутики, способны передвигаться. Жгутики расположены перитрихально. Протопласт E. coli одет в муреиновый мешок, прилегающий к внешней мембране. E. coli относится к микроорганизмам, не обладающим физиологической компетентностью к поглощению экзогенной ДНК.
Кишечная палочка может жить на разных субстратах. В анаэробных условиях E. coli образует в качестве продукта жизнедеятельности лактат, сукцинат, этанол, ацетат и углекислый газ. Часто при этом образуется молекулярный водород, который мешает образованию указанных выше метаболитов, поэтому E. coli часто сосуществует с микроорганизмами, потребляющими водород – например, с метаногенами или бактериями, восстанавливающими сульфат.
Оптимальный рост достигается культурами E. coli при температуре 37 °C, некоторые штаммы могут делиться при температурах до 49 °C. Рост может стимулироваться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей, в том числе, окислением пирувата, формиата, водорода, аминокислот, а также восстановлением кислорода, нитрата, диметилсульфоксида и триметиламин N-оксида.
E. coli играет важную роль в современной промышленной микробиологии и биологической инженерии. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli, с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК, находится у истоков современной биотехнологии. Усовершенствование методов получения сферопластов E. coli и их трансфекции позволили достичь достаточно высокой эффективности трансформации молекулами ДНК различных фагов.
Кишечную палочку считают универсальным организмом для синтеза чужеродных белков. В E. coli исследователи вводят гены при помощи плазмид, что позволяет осуществлять биосинтез белков для промышленной ферментации. Также разработаны системы для синтеза в E. coli рекомбинантных белков. Одним из первых примеров использования технологии рекомбинантных ДНК является синтез аналога инсулина человека. Модифицированные E. coli используют при разработке вакцин, синтеза иммобилизованных ферментов и решения других задач. Однако, в организмеE. coli невозможно получать некоторые крупные белковые комплексы, содержащие дисульфидные связи, в частности, белки, для проявления биологической активности которых требуется посттрансляционная модификация.
Чужеродные гены клонируют в так называемых челночных векторах. Эти вектора с одинаковым успехом реплицируются в клетках нескольких хозяев, в данном случае, в клетках E. coli. Векторы были получены комбинацией in vitro фрагментов этих плазмид.
Для конструирования рекомбинантной ДНК, содержащей в своем составе ген, который должен экспрессироваться, придерживаются следующей стратегии. Синтезируют к ДНК или из клонотеки выделяют клетки, несущие фрагмент генома с нужным геном, и клонируют их в соответствующем векторе. Фрагменты геномной ДНК подвергают модификации – удаляют из них некодирующие области и участки соседних генов. Часто для проведения этой операции необходимо секвенирование данного фрагмента ДНК. Затем конструируются промежуточные рекомбинантные ДНК, в которых ген помещается под контроль бактериальных регуляторных элементов (промотор, оператор, точка связывания с рибосомами). Эти регуляторные элементы выделяют из гибридных плазмид, сконструированных специально как источники регуляторных элементов. Полученная конструкция встраивается в подходящий вектор, например, pBR 322, и ген экспрессируется в бактериальной клетке.
Однако удобнее встраивать ген в специальный вектор для экспрессии, который уже содержит регуляторные элементы, обеспечивающие активную экспрессию после введения рекомбинантной плазмиды в бактериальную клетку. К таким эффективным регуляторным участкам относится, например, сильный промотор гена бэта-лактамазы (ген устойчивости к пенициллину, входящий в состав плазмиды pBR 322). Ряд генов, в том числе и ген инсулина, встраивали в сайт рестрикции Pst I, который расположен в структурной части гена. Промотор этого гена обеспечивает эффективную транскрипцию, которая продолжается до тех пор, пока РНК-полимераза не дойдет до сигнала терминации встроенного гена.
В качестве примера маркирования вектора могут служит первые эксперименты с E. coli, а точнее с одной из ее плазмид рBR322, проведенные Гилбертом для получения инсулина. Плазмида pBR322 содержит 2 гена, которые определяют устойчивость к ампициллину и тетрациклину. Рестриктаза PstI расщепляет плазмиду в средней части гена, кодирующего фермент устойчивости к ампициллину. После расщепления плазмиды на ее концы с помощью концевой трансферазы надстраивали последовательность из четырех нуклеотидов с остатками гуанина. Затем, как обычно, с помощью лигаз “вшивали” ген проинсулина, получая рекомбинантную ДНК. Встроенный в плазмиду фрагмент ДНК нарушал синтез фермента, разрушающего ампициллин, но ген, обеспечивающий устойчивость к тетрациклину, оставался активным. Трансформированные таким образом клетки E. coli синтезировали гибридный белок, содержащий последовательности пенициллазы и проинсулина, поэтому биологически активный инсулин получали путем отщепления пенициллазы и среднего сегмента проинсулина.
С другой стороны, если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику.
Источник
Создав при помощи генной инженерии штамм кишечной палочки (Escherichia coli), учёные заставили бактерию превращать сахар в горючее, которое по составу во многом напоминает обычное дизельное топливо. Если такой процесс поставить на поток, то подобное синтетическое горючее может стать хорошей альтернативой органическому топливу.
Исследование, результаты которого были опубликованы в журнале PNAS, проводил синтетический биолог Джон Лав (John Love) из университета Эксетера.
“Мы хотим сделать так, чтобы производители автомобилей, продавцы топлива и водители даже не заметили разницы между обычным бензином и нашим новым изобретением”, — говорит Лав.
Согласно планам Евросоюза, к 2050 году выбросы парниковых газов необходимо снизить на 80%. Как следствие, к 2020 году хотя бы 10% от общего числа используемого топлива должно будет составлять биотопливо. Однако на сегодняшний день большая часть биодизеля и биоэтанола несовместимы с современными двигателями. Чтобы двигатель функционировал исправно, необходим “коктейль” из 5-10% биотоплива и 90-95% бензина.
Команда Лава создала генно-модифицированную кишечную палочку, которая в отличие от других синтетических аналогов, производит биотопливо, которое можно заливать в бензобак, не смешивая ни с каким другим видом горючего. Плюс такого подхода к созданию биотоплива ещё и в том, что поставщикам топлива не надо будет менять существующую инфраструктуру (доставки и распространения).
Как правило, E. coli поглощают сахар и производят жиры для образования клеточной мембраны. Как сообщается в пресс-релизе, чтобы вместо жиров микроорганизмы производили синтетические молекулы топлива, учёные создали специальный штамм E. coli. В ход пошли технологии синтетической медицины.
Правда, несмотря на своё очевидное преимущество перед конкурентами, новый штамм, возможно, не будет иметь большого успеха у создателей заменителей топлива. Эффективность нового производства пока крайне низкая: сотня литров раствора из бактерий и сахара способна выдать всего одну чайную ложку нового биотоплива.
“Прежде чем мы перейдём к промышленному производству, нам необходимо будет увеличить эффективность работы бактерий. У нас есть в запасе от трёх до пяти лет, чтобы поставить необходимые эксперименты и понять, стоит ли игра свеч”, — рассказывает Лав. Его команда также пытается понять, могут ли кишечные палочки для эффективного производства потреблять вместо сахара животные или человеческие отходы.
Проект финансировали крупный производитель бензина и моторных масел компания Shell и британский Совет исследователей биологии и биотехнологий (BBSRC).
Добавим, что биотопливо считается безопасным для окружающей среды, поскольку производит именно такое количество углекислого газа, которое растения смогут переработать. Но существуют и альтернативные мнения: исследователь окружающей среды Роб Бейли (Rob Bailey) считает, что биотопливо наносит климату Земли даже больший ущерб, чем органические виды топлива, в число которых входит бензин (подробнее в этом PDF-документе).
Производство биологического топлива нельзя считать панацеей для современной экономики, политики и экологии. Необходимо учитывать, что бактерии, вроде кишечных палочек, также являются природным материалом и, соответственно, могут оказаться в дефиците. Исследователям ещё предстоит решить массу вопросов, связанных с производством топлива из кишечных палочек, прежде чем начать обсуждение практических испытаний и дальнейшей коммерциализации проекта.
Также по теме:
Учёные предложили добывать еду из древесины
Угольная котельная стала экспериментальной площадкой для альтернативного топлива
Пензенские предприятия в скором времени могут перейти на обогрев биотопливом
Автомобили можно будет заправлять водорослями
Знаменитый генетик приблизился к созданию синтетической жизни
Источник
Оглавление темы “Биотехнология. Генная инженерия. Генная терапия.”:
1. Биотехнология. Наука биотехнология. Этапы развития биотехнологии.
2. Области применения биотехнологии. Области использования биотехнологии. Оптимизация микробиологических процессов в биотехнологии.
3. Промышленное применение микроорганизмов. Производство продуктов микробного синтеза. Производство антибиотиков. Производство вакцин.
4. Генная инженерия. Биобезопасность. Актуальность генной инженерии. Теоретическая база генной инженерии.
5. Организация генетического материала в клетке. Генотип. Что такое генная инженерия? Этапы получения генной продукции.
6. Применение методов генной инженерии. Показания ( оправданность ) применения генной инженерии. Причины применения генной инженерии.
7. Биобезопасность в генной инженерии. Документы регламентирующие биобезопасность.
8. Группы опасности микроорганизмов. Оценка риска применения генетически модифицированных микроорганизмов.
9. Генная диагностика. Генная терапия. Что такое генная диагностика и генная терапия? Виды генной терапии.
10. Векторы. Векторы на основе РНК-содержащих вирусов. Векторы на основе ДНК-геномных вирусов. Невирусные векторы.
11. Перспективы генной терапии. Будущее генной терапии. Задачи генной терапии.
Организация генетического материала в клетке. Генотип. Что такое генная инженерия? Этапы получения генной продукции.
Организация генетического материала. Гены [от греч. genos, рождение] — единица наследственности, участок ДНК, занимающий специфическое место в хромосоме. С точки зрения генетики, ген — наследуемый фактор и неделимая единица генетического материала. Структурный ген (цистрон) — фрагмент ДНК, участвующий в образовании полипептидной цепи. В его состав входят лидерная последовательность, кодирующие фрагменты (экзоны), вставочные последовательности (нитроны) и концевая последовательность. Поскольку некоторые белки состоят более чем из одной субъединицы, формулировку «один ген — один фермент» применительно к гетеромультимерному (то есть состоящему из двух и более различных полипептидных субъединиц) белку следует трактовать как «один ген — одна полипептидная цепь».
Генотип — совокупность генов организма. Ещё в древности люди эмпирически использовали закономерности наследования. На основании этого опыта получила развитие селекция [от лат. selectio, выбирать] — наука о методах создания новых сортов растений и пород животных путём отбора и скрещивания. До недавнего времени генотип казался неприступным, не подвластным действиям человека. Открытие структуры генов позволило выделять их в изолированном виде, синтезировать биохимически и даже вводить в организм. Стало возможным воздействие на ген без его выделения из организма. Всё это создало предпосылки для манипулирования генотипом.
В 80-е годы XX века появилось новое понятие — генная инженерия — раздел молекулярной генетики, связанный с конструированием не существующих в природе сочетанин генов при помощи генетических и биохимических методов. Впервые введение чужеродного гена и изменение признаков организма осуществили английские микробиологи О. Эвери, К. Маклёод и М. Мак-Карти (1944). Из клеток пневмококка (серовар III) они выделили трансформирующий фактор (как выяснилось впоследствии, последовательность ДНК). После обработки этим фактором часть непатогенных бактерий серовара IIR превратилась в патогенные, причем именно серовара III. Это была первая демонстрация факта, что некие факторы могут передаваться от клетки к клетке, изменяя её наследственные свойства.
В 1972 г. Пол Берг с сотрудниками сообщили о получении in vitro рекомбинантной ДНК, состоящей из фрагментов разных молекул ДНК — вирусной (в том числе фаговой) и бактериальной. Иными словами, речь шла о получении энзимоло-гнческими методами (при помощи ферментов рестриктаз) синтетической генной конструкции. Позднее были предложены новые методы выявления ДНК: блот-гибридизация, увековечившая ими его создателя Э. Саузерна в английском названии метода southern blotting (1975); методы секвенирования ДНК (анализ первичной последовательности нуклеотидов в цепочке ДНК), основанные П. Сэнджером. В настоящее время для получения доступного для анализа и дальнейших манипуляций количества фрагмента ДНК применяют метод ПЦР, разработанный Нобелевским лауреатом (1994) американцем Кеем Мюллисом.
Этапы получения генной продукции
Процедура получения и использования синтетической генной продукции, состоит из нескольких этапов.
• Внедрение интересующего исследователей гена (выделенного, модифицированного либо синтезированного) в векторную молекулу ДНК in vitro с помощью рекомбинации. В роли вектора может выступать плазмидная ДНК, либо нуклеиновая кислота вируса или фага. Например, ген ИФН человека вводят в геном бактериофага X.
• Введение рекомбинантной (гибридной) векторной ДНК в клетку. В рассматриваемом примере этот этап заключается в заражении клеток кишечной палочки гибридными фагами.
• Отбор клеток, экспрессирующих введённый ген (молекулярное клонирование)
• Культивирование отобранных клонов.
• Введение чужеродного гена в организм приводит к изменению свойств и признаков последнего, то есть к созданию генно-инженерно модифицированного организма. Модифицированный генно-инженерно организм — клетка, группа клеток или вирус, содержащие генетический материал, полученный с применением методов генной инженерии. Известны три способа воздействия на генотип организма.
• Трансформация бактериальных клеток в результате включения экзогенной ДНК приводит к появлению нового генетического маркёра. Для эукариот аналогичный процесс — трансфекция эукариотических клеток (в связи с тем, что термин «трансформация» обозначает переход в состояние неконтролируемого роста и применяется по отношению к опухолевому перерождению клеток).
• Избирательная инактивация гена («адресное» разрушение гена, антисмысловая блокировка гена или производимой им РНК), позволяющая вывести из строя любой ген внутри клетки. Этот процесс известен также как «нокаутирование» [от англ. to knock out, сбивать с ног], а модифицированные организмы — как нокаутные. Направленное изменение гена (адресный мутагенез in vivo, генная инженерия in vitro — ex vivo) no желанию исследователя.
– Также рекомендуем “Применение методов генной инженерии. Показания ( оправданность ) применения генной инженерии. Причины применения генной инженерии.”
Источник
Оглавление темы “Биотехнология. Генная инженерия. Генная терапия.”: Применение методов генной инженерии. Показания ( оправданность ) применения генной инженерии. Причины применения генной инженерии.Применение методов генной инженерии особо оправдано в следующих случаях. • Невозможность культивировать микроорганизм-продуцент. В частности, возбудители сифилиса, проказы, малярии не растут на искусственных средах. Поэтому для получения вакцинных или диагностических препаратов гены, кодирующие синтез необходимых Аг, выделяют и встраивают в геном легко культивируемых микроорганизмов (например, кишечной палочки). • Высокая опасность заражения при работе с патогенными микроорганизмами. В таких случаях идентифицируют основные Аг возбудителя и встраивают кодирующие их гены в геномы безопасных микроорганизмов. В частности, выращиванием рекомбинантных штаммов кишечной палочки и дрожжей получены основные Аг ВИЧ (например, р24, gp41, gpl20).
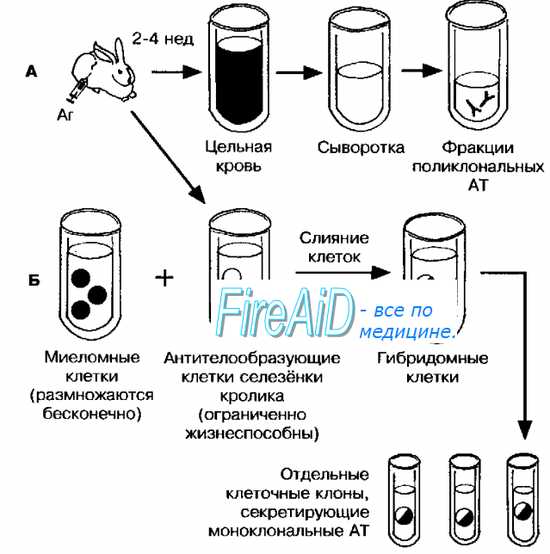
• Высокая стоимость продуктов, получаемых традиционными методами. В частности, методом генной инженерии получают многие цитокины (а-ИФН, ИЛ, миелопептиды) и гормоны (инсулин, соматотропный гормон). Особое значение имеет создание методами генной инженерии диагностических, лечебных и профилактических препаратов, ранее получаемых дорогостоящими методами. Чаще всего это продукты, выделяемые из крови иммунизированных доноров, — животных и людей. Технология получения гибридом основана на выделении от доноров клеток-продуцентов и их слияния с миеломными (опухолевыми) клетками. В результате образуется гибридная клетка — гибридома, способная быстро и бесконечно размножаться на искусственных питательных средах и синтезировать необходимые продукты.
Подобным способом часто получают AT. Предшественники гибридом —плазматические клетки, синтезирующие Ig определённого типа. Поэтому получаемые продукты получили название моноклональных AT (рис. 7-1). Наиболее часто применяют линии миеломных клеток мышей и крыс. Частота слияний в смешанной культуре клеток (миеломных и донорских клеток-продуцентов) невелика — одна гибридома на 104 клеток. Образовавшиеся гибридомы немедленно реклонируют, так как многие гибридные клетки склонны «выбрасывать» лишние хромосомы, пока их число не будет равным диплоидному набору (при этом гены, ответственные за антнтелообразование, могут быть утрачены). Гибридомы создают не только на основе В-клеток, но и Т-лимфоцитов и многих других, секретирующих лимфокины, факторы роста и т.д. Продукты, полученные технологией гибридом, применяют для лечения и профилактики различных болезней, а также для изучения строения и функций различных молекул (например, клеточных рецепторов). В частности, при помощи гибридом получают моноклональные AT, применяемые в иммуногистохимической диагностике опухолей. – Также рекомендуем “Биобезопасность в генной инженерии. Документы регламентирующие биобезопасность.” |
Источник