Кишечную палочку в качестве системы для экспрессии чужеродных генов
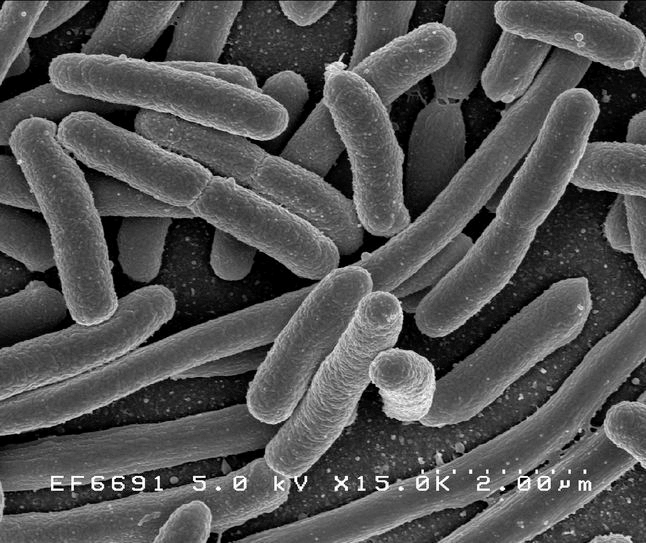
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
Кишечная палочка — один из первых мемов, с которым сталкиваются дети при знакомстве с биологией (рис. 1а). Запоминающееся, простое и забавное название. Помню, как узнал в детстве, что эта палочка может быть опасной — кто-то мучился животом, а родители сказали, что, наверное, кишечная палочка! Позже, уже в старшей школе, я узнал латинское название этой бактерии, и оно меня удивило, оказавшись каким-то не очень латинским. Оказывается, австрийский педиатр Теодор Эшерих (рис. 1б), который впервые выделил эту палочку из содержимого кишечника в 1885 году, вначале назвал ее благозвучно — Bacterium coli, что означает просто «кишечная бактерия». После ожидаемого пересмотра классификации бактерий род переименовали в честь первооткрывателя. По анекдотическому совпадению очень созвучно — Eschrichtius — называется одно из самых крупных существ на земле — серый кит (рис. 1в). Правда, этого гиганта так назвали в честь другого ученого — датского зоолога Даниэля Эшрихта, работавшего на полвека раньше (рис. 1г). В этом плане другой важной палочке — сенной — повезло больше, поскольку она до сих пор называется Bacillus subtilis, что в переводе — тонкая палочка.

Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Кишечная палочка живет… правильно, в кишечнике человека, составляя по численности не более 0,1% нормальной микрофлоры. Как и многие микроорганизмы, эта грамотрицательная палочка очень изменчива и из дружественного — комменсального — компонента микрофлоры кишечника зачастую превращается во вредный — патогенный. Практически каждый сталкивался с «колийной» инфекцией. Например, именно эшерихия вызывает большинство случаев диареи путешественников. В приморских районах местные жители иммунны к штаммам кишечной палочки, населяющим источники воды, поэтому от них страдают туристы. Одним из параметров качества питьевой воды считается косвенный показатель содержания в ней клеток кишечной палочки — так называемый коли-титр. Как и многие патогенные бактерии, кишечная палочка охотно приобретает свойства множественной устойчивости к антибиотикам . Так, в мире растет число случаев возвратного цистита [1] — воспаления мочевого пузыря — и других инфекций, вызванных мультирезистентными штаммами E. coli.
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Одновременно (или вскоре после этого) с помощью штаммов эшерихии были заложены основы современной молекулярной биологии. Французы Франсуа Жакоб и Жак Моно на примере лактозного оперона — серии генов E. coli, кодирующих каскад расщепления сахара лактозы, — раскрыли механизмы регуляции генной экспрессии — «самовыражения» генетического материала в виде работы белков, в данном случае — ферментов. На материале кишечной палочки описаны все процессы передачи информации в клетке: так называемые матричные процессы — репликация ДНК, транскрипция и трансляция. Я помню, как в университете на микробиологии нам раздали учебники Стента и Кэлиндара по молекулярной генетике, издания, кажется, 1981 года. Вначале было непонятно, почему это нужно для микробиологии, а потом оказалось, что материал учебника — кстати, очень непростой для восприятия второкурсника — на две трети описывает эксперименты, проведенные на кишечной палочке и ее вирусах.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Рисунок 2. Кишечная палочка Escherichia coli как герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, палочка уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
Благодарность
Автор благодарит своего друга — биоинформатика Анну Казнадзей (ИППИ РАН) за ее увлекательный рассказ о новом «лактозном опероне» кишечной палочки, в открытии которого она участвовала.
- Florian Hitzenbichler, Michaela Simon, Thomas Holzmann, Michael Iberer, Markus Zimmermann, et. al.. (2018). Antibiotic resistance in E. coli isolates from patients with urinary tract infections presenting to the emergency department. Infection. 46, 325-331;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Модельные организмы: фаг лямбда;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Молекулярная биология;
- У истоков генетического кода: родственные души;
- Биотехнология. Генная инженерия;
- Anna Kaznadzey, Pavel Shelyakin, Evgeniya Belousova, Aleksandra Eremina, Uliana Shvyreva, et. al.. (2018). The genes of the sulphoquinovose catabolism in Escherichia coli are also associated with a previously unknown pathway of lactose degradation. Sci Rep. 8;
- CRISPR-системы: иммунизация прокариот.
Источник
279. Моноклональные антитела получают в производстве:с помощью гибридом
280. Преимуществами генно-инженерного инсулина являются меньшая аллергенность
281. Преимущества получения видоспецифических для человека белков путем микробиологического синтеза:снятие этических проблем
282. Разработанная технология получения рекомбинантного эритропоэтина основана на экспрессии гена:в культуре животных клеток
283. Особенностью пептидных факторов роста тканей являются:образование вне желез внутренней секреции
284. Преимущество РИА инсулина перед определением инсулина по падению концентрации глюкозы в крови животных:в отсутствие влияния на результаты анализа др белков
285. При оценке качества генно-инженерного инсулина требуется уделять особенно большее внимание тесту на:пирогенность
286. Ослабление ограничений на использование в промышленности микроорганизмов-рекомбинантов, продуцирующих гормоны человека, стало возможным благодаря:экспериментальному подтверждению обязательной потери чужеродных генов
287. Прямой перенос чужеродной ДНК в протопласты возможен с помощью:упаковки в липосомы
288. Субстратами рестриктаз, используемых генным инженером, являются:НК
289. «Ген-маркер» необходим в генетической инженерии:для отбора колоний, образуемых клетками, в кот проник вектор
290. Понятие «липкие концы» применительно к генетической инженерии отражает:комплементарнсть нуклеотидных последовательностей
291. Поиск новых рестриктаз для использования в генетической инженерии объясняется:различным местам действия на субстрат
292. Успехи генетической инженерии в области создания рекомбинантных белков больше, чем в создании рекомбинантных антибиотиков Это объясняется: большим количеством структурных генов, вкл в биосинтез а/б
293. Ферменты лигазы используется в генетической инженерии поскольку:катализирует ковалентное связывание углеводно – фосфорной цепи ДНК гена с ДНК вектора
294. Биотехнологу «ген-маркер» необходим для:отбора рекомбинантов
295. Вектор на основе плазмиды предпочтительней вектора на основе фаговой ДНК благодаря:отсутствию лизиса клетки, возможной при работе с фагами
296. Для получения протопластов из клеток грибов используется:улиточный фермент
297. За образованием протопластов из микробных клеток можно следить с помощью методов:фазово-контрастной микроскопии
298. Для получения протопластов из бактериальных клеток используется:лизоцим
299. Высокая стабильность протопластов достигается при их хранении:в гипертонической среде
300. Полиэтиленгликоль, вносимый в суспензию протопластов: ПАВ который используется при слиянии протопластов
301. Для протопластирования наиболее подходят суспензионные культуры в:в логарифмической фазе
302. Гибридизация протопластов возможна, если клетки исходных растений обладают:совместимость не имеет существенного значения
303. Прямой перенос чужеродной ДНК в протопласты возможен с помощью:упаковки в липосомы
304. Изолированный протопласт растительной клетки не содержит:не содержит клеточной стенки
305. Создание неполовых гибридов путем слияния изолированных протопластов называется:соматическая гибридизация
306. Полиэтиленгликоль (ПЭГ) вносимый в суспензию протопластов вопрос 300
307. Для протопластирования наиболее подходят суспензионные культуры в следующей фазе роста: логарифмической
308. Зимолаза виноградной улитки обеспечивает получение протопластов:грибов
309. Генетическая инженерия получила практическое применение после:формулирования молекулярной концепции
310. Экзоны – это:несущие инфоучастки генов эукариот, которые сохраняются в транскрипте после удаления из него интронов. Последовательность экзонов составляет целую матричную мРНК
311. Интроны – это:участки генов эукариот, которые транскрибируются, но в отличие от экзонов в зрелую мРНК не входят.
312. Транспозоны выполняют следующие функции:
313. Рибосомы – это:крупный внутриклеточный макромолекулярный ансамбль, ответственный за синтез полипептидной цепи из ам-т. Состоит из молекул РНК и белков.
314. Транскрипция – это:первая стадия реализации(считывания) ген инфо, на которой нуклеотидная последовательность ДНК копируется в виде нуклеот последовательности РНК
315. Кишечную палочку в качестве системы для экспрессии чужеродных генов используют благодаря:
316. Bacillus subtilis в качестве системы для экспрессии чужеродных генов используют благодаря способности осуществлять:продуцирование внеклеточных метаболитов
317. Эукариотические продуценты в качестве систем для экспрессии чужеродных генов используют благодаря их способности осуществлять:
318. Причина невозможности непосредственной экспрессии гена человека в клетке прокариот:невозможность сплайсинга
319. Рестриктазы используются в технологии рекомбинантных ДНК, поскольку:они специфически расщепляют –цеп ДНК по сайтам узнавания
320. Природная роль рестриктаз:узнавание и атака определенной прследовательности нуклеотидов в молекуле ДНК
321. Природная роль лигаз:
1. Соединение мол ДНК бактерий и бактериофага
2. Воссоединение ДНК бактерий после расщепление
322. Небольшая кольцевидно замкнутая молекула ДНК, находящаяся вне хромосомы и автономно реплицирующаяся, называется:рекомбинантная
323. Последовательность нуклеотидов ДНК используется как исходный код для производства полимеров:РНК, а в дальнейшем белков
324. Плазмиды – это:кольцевая молекула ДНК, явл внехромосомным носителем ген инфо и используемая в качестве вектора
325. Трансгенный организм – это:живой организм, в геном которго искусственно введен ген др организма
326. Функцией мРНК является:несет инфо об ам-тной последовательности (о первичной структуре) синтезируемого белка
327. В технологии рекомбинантных ДНК эукаритические клетки имеют следующие преимущества перед прокариотическими клетками:
328. Полимеразная цепная реакция – это метод: амплификации специфического сегмента с помощью термостабильной ДНК-полимеразы с использованием олигопептидных ДНК-зондов комплементарных последовательных цепей ДНК.
с помощью которой м/б размножение ин витро фрагменты ДНК, в т ч отдельные гены
329. Перенос ядер соматических клеток это метод:
330. Структура белков закодирована в молекуле ДНК следующим образом:по типу комплементарности азотистых оснований
331. Для разделения молекул ДНК используют:рестриктазы
332. Сплайсинг – это: удаление после транскрипции из мРНКинтронов и связывание оставшихся экзонов за счет ковалентной связи
333. Вектор в технологии рекомбинантных ДНК – это:часть рекомбинантной ДНК, обеспечивающее ее проникновение в клетку и репликацию в этой клетке. Вектор контролируется на основе плазмид, фагов, космид
334. Биологический способ доставки генетической информации в клетку зависит от:
335. Выбор вектора зависит в первую очередь от свойств:клонируемого гена
336. Процесс использования записанной в молекулах ДНК информации для производства молекул РНК и последующего синтеза набора белков называется:транскрипцией
337. Аллели представляют собой:различные формы одного и того же гена, расположенные в участках гомологичных хромосом и опред альтернативные варианты развития одного и тоже признака
338. Особенностью использования генетического кода эукариот в процессе синтеза белка является то, что:
339. Нуклеотиды состоят из перечисленного ниже, кроме:
340. Прямой перенос чужеродной ДНК в протопласты возможен с помощью:
а) микроинъекции
б) трансформации
в) упаковки в липосомы +
г) культивирования протопластов на соответствующих питательных средах
д) Гибридом
Date: 2015-08-24; view: 3072; Нарушение авторских прав
Источник
Одним из наиболее значимых достижений генетической инженерии является клонирование эукариотических генов, что дает возможность осуществлять синтез микробными клетками важнейших для народного хозяйства белков — ферментов, гормонов, иммуномодуляторов и др. Эукариотические организмы-доноры генетического материала характеризуются гораздо менее высоким уровнем продукции природных белков, чем генноинженерные штаммы-продуценты. Поэтому получение практически ценных белков для изучения их структуры и свойств, а также для использования в хозяйственных целях осуществляют чаще с использованием гибридных микробных штаммов, а не культур клеток растений и животных или их органов и тканей. Названным способом получены такие ценные белки, как гормон роста человека и некоторых животных, инсулин, фактор роста эпидермиса человека, фактор некроза опухолей человека и мыши, a-, b- и g-интерфероны, медиатор нервной системы соматостатин, гормон кальцитонин, миоглобин, гормоноподобные сигнальные белки интерлейкины, фактор свертывания крови, отсутствующий у больных гемофилией, обратная транскриптаза вируса лейкоза мышей, урокиназа, трипсин, некоторые онкобелки, вакцины против некоторых вирусов и др.
Когда ген в составе векторной молекулы переносится из клеток одного организма в клетки другого, возникают проблемы с его экспрессией—транскрипция и трансляция мРНК могут не осуществляться вовсе либо происходить с низкой частотой. Это является следствием специфичности ферментов, катализирующих процессы транскрипции и трансляции, к определенным последовательностям ДНК (мРНК), структура которых бывает уникальной у различных таксономических групп организмов. Чаще всего проблемы экспрессии наблюдаются при клонировании эукариотических генов в клетках прокариот, в частности потому, что сигналы инициации транскрипции высших эукариот не распознаются РНК-полимеразами бактерий.
Для достижения эффективной экспрессии клонированных генов используют несколько подходов: 1) увеличение числа копий гена в клетке (амплификация гена); 2) подстановку перед структурной частью чужеродного гена сильного промотора, распознаваемого РНК-полимеразой клетки-хозяина; 3) подстановку перед геном чужеродного белка регуляторного элемента, обеспечивающего эффективную инициацию трансляции; 4) стабилизацию образующейся мРНК и белкового продукта. Перечисленные методы достижения высокого уровня экспрессии генов наилучшим образом разработаны для бактерий E.coli. Поскольку наличие такой методологии является определяющим условием конструирования новых продуцентов, кишечная палочка рассматривается как один из самых перспективных организмов, используемых для этой цели.
Амплификация генов. Для усиления экспрессии генов можно увеличить их количество в клетке. Осуществляют это двумя способами: увеличивая число копий рекомбинантных плазмид или увеличивая число копий гена в составе плазмиды.
Наиболее прост первый способ. Уже указывалось, что для конструирования векторов предпочтительнее использовать мультикопийные плазмиды, находящиеся под нестрогим контролем репликации. В этом случае число копий плазмид составляет 10—200. Данный показатель можно увеличить до нескольких тысяч, если подавить синтез белков бактериальной клетки или использовать мутантные плазмиды. Применение таких векторов позволяет значительно увеличить дозу целевого гена, а значит, и выход белкового продукта. Следует, однако, учитывать, что чрезмерная амплификация плазмид может приводить к снижению жизнеспособности штамма-продуцента из-за высокой токсичности некоторых чужеродных белков для бактерий, а также из-за увеличения времени генерации клеток.
Копийность генов в составе векторных молекул обеспечивают, создавая опероны с повторяющимися идентичными цистронами чужеродных генов. Сочетание перечисленных методов позволяет повысить дозу гена в клетке от нескольких десятков до тысяч копий на нуклеоид и увеличить уровень синтеза соответствующих белков (в ряде случаев на 1—2 порядка).
Достижение высокого уровня транскрипции чужеродных генов. Для того чтобы эукариотические гены транскрибировались в прокариотических клетках, их обычно подставляют под контроль сильных промоторов (обеспечивают высокую частоту событий инициации транскрипции) прокариот.
Наиболее часто для этих целей используют сильные промоторы кишечной палочки: лактозного оперона — PlacUV5, триптофанового — Ptrp; гибридные промоторы, например Ptrp-lacUV5 (Ptac), а также промоторы фага λ— PR, PL идругих фагов (Т5, Т7, jХ174). Выделение этих промоторов и включение их в состав векторов осуществляют в ходе генно-инженерных манипуляций.
Еще более совершенной является методология использования регулируемых промоторов, которые инициируют процесс эффективной транскрипции лишь в определенных условиях. Такими промоторами являются, например, PR и PL фага λ. Их используют в клетках, содержащих температурочувствительный сI-репрессор, ген которого может быть расположен на векторе или совместимой с ним плазмиде. В таких клетках экспрессия чужеродного гена под контролем PR или PL будет происходить лишь после инактивации репрессора повышением температуры ферментации.
Использование прокариотических регуляторных элементов, расположенных на многокопийных плазмидах, позволяет достигать уровня синтеза мРНК чужеродного гена до 25% от всей РНК бактериальной клетки.
Достижение высокого уровня трансляции чужеродных генов. Еще одним условием эффективной экспрессии клонированных генов является наличие перед геном чужеродного белка оптимального сайта инициации трансляции мРНК. На частоту событий трансляции первостепенное значение оказывает структура участков мРНК, обеспечивающих ее связывание с рибосомой и тРНК. Показано, что олигонуклеотидная последовательность, расположенная на 5’-конце и непосредственно примыкающая к стартовому кодону, обеспечивает комплементарное спаривание с нуклеотидами антикодоновой петли тРНК. В то же время среди нуклеотидов мРНК, участвующих во взаимодействии с рибосомой, достоверно установлена роль пуринбогатого участка на расстоянии 3— 15 нуклеотидов от стартового кодона (последовательность Шайн—Дальгарно, или SD-последовательность). Длина SD-последовательности, а также ее расположение относительно стартового кодона существенно сказываются на связывании рибосом с мРНК, а значит, и на частоте событий инициации трансляции.
Известно три основных подхода к конструированию векторов, обеспечивающих трансляцию чужеродной ДНК в бактериальных клетках. Одним из наиболее распространенных является метод конструирования «гибридных участков связывания рибосом». Суть его заключается в том, что структурная часть чужеродного гена (с собственным стартовым кодоном и несколькими нуклеотидами перед ним) включается между последовательностью SD и стартовым кодоном прокариотического гена. Такой метод имеет преимущество, состоящее в образовании полноразмерного чужеродного белка. Однако существенным недостатком метода является трудность достижения оптимального удаления стартового кодона от SD-последовательности, что, как указывалось, очень существенно для инициации трансляции. Поэтому применяют другой подход, в котором чужеродный структурный ген, лишенный собственных регуляторных областей, внедряют в состав хорошо экспрессируемого бактериального гена. Для этих целей чаще всего используют lac-промотор с соответствующей последовательностью Шайна—Дальгарно. Сайт внедрения должен быть достаточно удален от места инициации трансляции, чтобы новая нуклеотидная последовательность не мешала эффективной инициации транскрипции и трансляции бактериального гена. При экспрессии векторов такого типа образуется гибридный белок, в котором N-концевая часть представлена аминокислотами прокариотического пептида. Поэтому для выделения эукариотической полипептидной цепи требуется дополнительная химическая или ферментативная обработка.
Наконец, третий подход к конструированию векторов, обеспечивающих эффективную трансляцию, использует принцип «перекрывания» генов. В этом случае чужеродный ген встраивают в концевую часть прокариотического гена таким образом, что SD-последовательность второго гена расположена непосредственно в кодирующей области первого. При этом терминирующий трансляцию кодон первого гена является частью инициирующего кодона второго гена. Этот метод разработан в 1985 г. в СССР. Он позволяет достигать 100%-ной инициации трансляции второго гена, поскольку рибосомы, транслировавшие первую часть полицистронной мРНК, не отсоединяются от нее, а происходит реинициация трансляции второго гена. Таким образом, примене ние векторов с частично перекрывающимися генами в оперонах позволяет обеспечить эффективность инициации трансляции чужеродного гена не ниже, чем у исходного прокариотического цистрона.
Стабилизация мРНК и белкового продукта чужеродного гена. Стабильность мРНК в клетках бактерий можно повысить введением мутаций, инактивирующих РНКазы. Кроме этого, на стабильность мРНК влияет полинуклеотидфосфорилаза (pnp). Известны мутанты E.coli по генам pnp, в которых время полужизни мРНК, определяющей чужеродные белки, увеличивается в 1,5 раза.
Серьезным препятствием при получении штаммов-сверхпродуцентов может стать протеолиз чужеродных белков в клетке. Ведь набор клеточных пептидаз как раз и предназначен в основном для быстрой деградации полипептидов с «аномальной» структурой, которые возникают, например, в результате ошибок трансляции. Для стабилизации чужеродных белков можно использовать в качестве реципиентов штаммы, дефектные по системе деградации белков (lon-, htpR или deg-мутанты). Можно также вводить в бактериальную клетку ген pin бактериофага Т4, который контролирует синтез ингибиторов протеиназ, или другие гены с похожими функциями.
Источник