Кишечные анастомозы при перитоните

08.04.2019 Алёна Машева Здоровье

Рассмотрим, что такое перитонит кишечника. В брюшной полости находятся важные органы, особую роль среди которых играет кишечник. Внутренний покров брюшной полости образует стерильную замкнутую систему, которая способна негативно действовать на болезнетворные микроорганизмы, обезвреживая их. При нарушении целостности кишечника или стерильности брюшины создаются благоприятные условия для развития воспалительного процесса.
Это диффузный или локальный процесс воспаления серозного покрова брюшины (брюшной полости). Клиническими признаками перитонита кишечника выступают боль в животе, напряжение мышц брюшных стенок, тошнота и рвота, гипертермия, задержка газов и стула, тяжелое общее состояние. Диагностика патологии основывается на информации из анамнеза, определении положительной перитонеальной симптоматики, данных рентгенографии, УЗИ, ректального и вагинального исследований, лабораторных тестирований. Лечение гнойного перитонита кишечника, как правило, оперативное (лапаротомия, санация брюшной полости) с адекватной пред- и послеоперационной дезинтоксикационной и антибактериальной терапией.

Перитонит представляет собой тяжелое осложнение воспалительных и деструктивных заболеваний в системе органов брюшной полости, которое сопровождается выраженными общими и местными симптомами, возникновением полиорганной недостаточности. Общая летальность от гастроэнтерологических перитонитов составляет примерно 20-30 %, а при более тяжелых формах — 40-50%. Разберемся подробнее, что такое перитонит кишечника.
Особенности патологии
Специфические характеристики данного патологического процесса обусловлены строением брюшной полости. Брюшина образована двумя серозными листками, переходящими друг в друга — париетальным и висцеральным. Они покрывают стенки брюшной полости и внутренние органы. Брюшина представляет собой полупроницаемую, активно функционирующую мембрану, выполняющую множество важных функций:
- барьерную (противомикробная и механическая защита внутренних органов) ;
- резорбтивную (всасывание продуктов лизиса, экссудата, некротических тканей, бактерий) ;
- экссудативную (процессы выделения серозной жидкости) и др.
Важным защитным свойством брюшины выступает ее способность к отграничению воспалительного процесса в брюшине за счет фиброзных спаек и рубцов, а также клеточного и гуморального механизмов. При заболеваниях кишечника в этом органе развивается патогенная микрофлора, которая выходит за пределы его стенок и провоцирует заражение брюшины.
Перитонит асептического типа провоцируется раздражением тканей агрессивными веществами самого организма — мочой, кровью, желчью, соком желудка или поджелудочной железы. Он быстро приобретает бактериальный характер, так как уже через несколько часов ткани брюшины подвергаются воздействию патогенных бактерий. Разновидность асептического кишечного перитонита является бариевый перитонит, который развивается вследствие выхода за пределы кишечника бария.

Это становится возможным при проведении рентгенологических исследований с применением контрастного вещества, в составе которого присутствует барий. Такой вид заболевания встречается редко, но от него умирает каждый второй пациент. Известен также серозный перитонит кишечника, который появляется вследствие скопления серозной жидкости.
Причины развития
Чтобы понять, что такое перитонит кишечника, выясним, каковы его причины. Среди большинства случаев развития недуга возбудителем патологического процесса выступает бактериальная инфекция, которая состоит из неспецифической микрофлоры пищеварительного тракта: энтеробактер, кишечная палочка, стрептококк, стафилококк и др. В некоторых случаях указанная патология может быть вызвана специфической микрофлорой: гонококками, микобактериями туберкулеза и др.
Если перитонит тонкого кишечника или толстого изначально имеет бактериальную природу происхождения, к примеру, токсико-химическую, то спустя короткое время он обретает микробный характер вследствие присоединения инфекционных возбудителей из просвета пищеварительного тракта.
Наиболее распространенными причинами возникновения перитонита кишечника можно считать такие деструктивные и воспалительные заболевания:
- дивертикулит ободочной кишки;
- дивертикул Меккеля;
- деструктивный аппендицит острого характера;
- прободные язвы двенадцатиперстной кишки;
- разрыв кишки после хирургического вмешательства или травмы;
- кишечная непроходимость.
Перитонит кишечника иногда может возникать после операций в брюшной полости вследствие несостоятельности анастомозов, механических повреждений брюшины, дефектов наложения лигатур и т. д.
Для того, чтобы правильно оценить состояние пациента, поступившего в больницу с подозрением на данное заболевание, специалисту необходимо ознакомиться с имеющимися симптомами и определить стадию патологии. Причины перитонита кишечника также нужно обязательно выяснить.

Стадии заболевания
Недуг практически всегда протекает стремительно, в острой форме. Для данной патологии характерна быстрая и бурная динамика развития, крайне тяжелое состояние пациента и летальный исход в случае отсутствия эффективной хирургической терапии. Хроническая форма болезни выявляется в очень редких случаях.
Симптоматика перитонита кишечника отличается в зависимости от стадии течения. В медицине выделяется 3 стадии развития заболевания:
- Реактивная стадия, которая может длиться до 1 суток.
- Токсическая фаза, длительность которой составляет примерно до 2-3 дня.
- Терминальная стадия, которая развивается на 4-5 сутки с момент появления первых симптомов.
Чтобы наиболее полно понять динамику развития патологии, необходима подробная информация о всех его проявлениях, с самых первых дней.
Симптомы перитонита кишечника
На реактивной стадии наблюдается развитие следующих симптомов:
- внезапная сильная и острая боль с локализацией в зоне воспаления;
- потеря сознания;
- напряжение передней стенки брюшины;
- гипертермия;
- учащенный слабый пульс;
- налет на языке серого цвета;
- ложные позывы к мочеиспусканию или дефекации;
- тошнота и рвота, не приносящая облегчения.
На данной стадии заболевания можно заметить максимальное проявление местных симптомов, вызванных гиперергической реакцией на развивающееся раздражение брюшины. Симптомы перитонита кишечника могут быть и другие.
На следующей стадии, токсической, которая может продолжаться до 2-3 суток, происходит усиление общей интоксикации организма. При этом начинают ярко проявляться следующие патологические признаки:
- повышение температуры до высоких значений;
- судорожный синдром;
- снижение артериального давления;
- бледность кожных покровов;
- прерывистое дыхание;
- обезвоживание организма;
- заостренные черты лица;
- распространение болезненности по всему животу;
- неконтролируемая рвота с неприятным запахом.
Если в этот период пациенту не будет оказана срочная медицинская помощь, патологический процесс переходит в последнюю, терминальную фазу своего развития. Она характеризуется следующими симптомами перитонита кишечника у взрослых и детей:
- синеватый оттенок кожи;
- паралич нервных окончаний брюшной полости, что приводит к снижению напряжения живота и болевого синдрома;
- снижение температуры тела;
- лихорадочное состояние, озноб;
- запавшие глаза и щеки;
- спутанность сознания вследствие интоксикации организма;
- плохо определяемые пульс и давление;
- слабое дыхание.
Терминальная фаза перитонита кишечника в медицинской литературе считается необратимой, неминуемо приводящей к смерти пациента.

Первичная диагностика
При подозрении на перитонит кишечника необходимо проводить диагностические мероприятия одновременно с оказанием экстренной медицинской помощи. Во избежание опасных для жизни осложнений, точный диагноз больному должен быть поставлен не позже 2 часов от начала болезни.
В процессе диагностики перитонита кишечника необходимо принять во внимание следующую информацию:
- наличие перитонеальных симптомов;
- данные рентгена брюшной полости и УЗИ;
- данные пункции брюшины;
- результат диагностической лапароскопии;
- показатели лабораторных исследований.
Первоначальный диагноз может быть поставлен на основании общей клинической картины заболевания. Особое внимание специалисты уделяют болевому синдрому при первичном осмотре пациента. Для этого используется ряд современных методов (к примеру, методика Щеткина-Блюмберга), которые могут подтвердить развитие у больного перитонита кишечника. При самостоятельном купировании болевого синдрома с помощью различных обезболивающих медикаментов, достоверная клиническая картина может сильно искажаться.
Лабораторная диагностика
При осуществлении диагностических мероприятий при кишечном перитоните важное место занимают результаты биохимического исследования крови. Посредством данного анализа определяются патологические изменения состава крови: увеличение СОЭ, высокий лейкоцитоз, нейтрофилез, гнойно-токсическое смещение лейкоцитарной формулы влево. Данные изменения свидетельствует о развитии в организме гнойной интоксикации.
При проведении рентгеноскопии брюшины под куполом диафрагмы виден воздух, наличие жидкости в кишечнике, раздутые петли, что говорит о паралитической непроходимости. С помощью рентгеноскопического исследования с использованием контрастного вещества легко устанавливается несостоятельность швов анастомоза, что выступает наиболее частой причиной кишечного перитонита, возникшего после оперативного вмешательства. Свободная жидкость в полости брюшины хорошо определяется посредством ультразвукового исследования.
Выясним, проводят ли операцию при перитоните кишечника.

Хирургическая диагностика
В случае, если вышеуказанные диагностические мероприятия не дают полноценной картины заболевания и не позволяют поставить точный диагноз, специалисты прибегают к более сложным, но высокоэффективным методам диагностики, таким как лапароцентез и лапароскопия брюшной полости. С помощью указанных способов можно точно установить характер и причину возникновения патологического процесса.
Тяжелое состояние пациента часто требует осуществления экстренной диагностики. В определенных случаях диагноз ставится непосредственно в процессе вмешательства после вскрытия брюшины.
Лечение
При перитоните кишечника применяется только экстренное оперативное лечение в медучреждении. В домашних условиях лечить подобную патологию не представляется возможным. Своевременное обращение к врачу дает пациенту шанс на благоприятный прогноз хирургических мероприятий.
Перед операцией необходимо провести подготовительные процедуры:
- купировать болевой шок;
- стабилизировать водно-солевой баланс;
- нормализовать давление.
Оперативное лечение осуществляется под общей анестезией. Часто медики используют широкую срединную лапаротомию. В процессе вмешательства контролируется и поддерживается деятельность всех жизненно важных органов. Основными фазами операционного лечения считаются:
- устранение инфекционного очага;
- санация брюшной полости посредством специальных антибактериальных и антисептических растворов;
- дренирование брюшины в целях введения внутрь антибактериальных медикаментов и удаления скопившегося в ней экссудата;
- снятие воспалительного процесса;
- устранение паралитической непроходимости кишечника в целях восстановления нормальной перистальтики.
При тяжелых случаях осуществляют проточное промывание брюшины специальными растворами, что в медицине называется — «перитонеальный лаваж».

Послеоперационная терапия
После хирургического вмешательства обязательным является дальнейшее проведение консервативного лечения, основными направлениями которого служат:
- назначение пациенту сильнодействующих антибактериальных медикаментов и инфузий физиологического раствора для устранения интоксикации организма;
- восстановление работы поврежденных систем;
- стимуляция функционирования мускулатуры кишечника;
- поддержание работы дыхательной, сердечно-сосудистой, нервной систем;
- повышение иммунитета.
При лечении перитонита кишечника применяются также современные дополнительные методики: плазмаферез, УФО-облучение крови, гемосорбция и т. д.
В последнее время в послеоперационном лечении подобных патологий активно используется релапаротомия, суть которой заключается в тщательном промывании полости брюшины специальным составом. Данные процедуры могут проводить через 2-3 дня после операции, что напрямую зависит от самочувствия пациента.
Что такое перитонит кишечника, теперь понятно, но каков прогноз?

Прогноз
Прогноз на выздоровление зависит от своевременного проведения терапевтических мероприятий, а также от эффективности послеоперационных методов лечения. Немаловажную роль при этом играют причины возникновения патологии и тяжесть ее течения. Часты случаи перитонита при непроходимости кишечника. В запущенных ситуациях возможно возникновение тяжелых осложнений и летальный исход.
К мероприятиям по предупреждению такого опасного заболевания можно отнести здоровый образ жизни, правильное питание, своевременное прохождение медицинских осмотров.
Мы рассмотрели, что такое перитонит кишечника. Симптомы и лечение также были подробно описаны.
Источник: fb.ru
Источник
Оглавление темы “Перитонит.”:
1. Определение тяжести повреждения органов брюшной полости.
2. Перитонит. Классификация перитонита. Виды перитонита.
3. Ведение перитонита. Контроль за источником инфекции. Контроль за повреждениями в брюшной полости.
4. Агрессивные варианты ведения перетонита. Тактика при перетоните.
5. Интраабдоминальные абсцессы. Необходима ли перитонеальная бактериология?
6. Кишечные анастомозы. Идеальный анастомоз. За и против анастомоза.
7. Выбор техники анастомоза. Отечная кишка.
8. Техника наложения анастомоза. Контроль за анастомозом.
9. Когда не следует накладывать анастомоз? Противопоказания к наложению анастомоза.
10. Желудочно-кишечные кровотечения. Проблема желудочно-кишечных кровотечений.
Кишечные анастомозы. Идеальный анастомоз. За и против анастомоза.
Лучшее — враг хорошего, а первое впечатление наилучшее, зачем же его портить?
Идеальный анастомоз
Идеален тот кишечный анастомоз, который герметичен, а утечки (относительно редкие) представляют собой смертельно опасную беду. Кроме того, анастомоз не должен быть сужен, он обеспечивает нормальное функционирование ЖКТ даже в первые дни после его сформирования.
Каждый опытный хирург полагает, что именно его техника наложения анастомозов, которую он усвоил от своих учителей и закрепил собственным опытом, — «наилучшая». В практике применяют много методов: конец в конец, конец в бок или бок в бок; одно- или двухрядный шов, узловой или непрерывный, с применением плетеных или монофиламентных, рассасывающихся или нерассасывающихся нитей; а также мы даже знаем хирургов зараженных навязчивой идеей наложения анастомоза трехрядным узловым швом. Ко всему перечисленному добавим степлеры. Чему же отдать предпочтение?
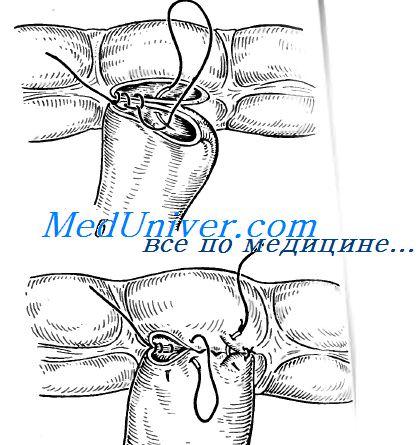
За и против анастомоза
Большое количество экспериментальных и клинических исследований позволяет сделать следующие заключения.
Утечки (несостоятельности) анастомоза. Расхождение анастомозов встречается независимо от методов их формирования, даже если они наложены без натяжения и при хорошем кровоснабжении анастомозируемой кишки.
Стриктуры (сужения) анастомоза. Однорядные анастомозы менее подвержены рубцовым сужениям, чем многорядные. Стриктуры чаще также осложняют анастомозы конец в конец, наложенные циркулярным степлером.
Неудачи наложения анастомоза. В целом степлеры более склонны к интраоперационным «осечкам»
Скорость наложения анастомоза. Механические анастомозы степлерами в среднем выполняются быстрее, чем ручным швом. Чем меньше слоев, тем быстрее накладывается анастомоз, а непрерывный шов занимает меньше времени, чем узловой. В целом на наложение двух кисетных швов для степлерного анастомоза нужно столько же времени, как для однорядного ручного непрерывного шва.
Шовный материал для анастомоза. Плетеные нити (шелк или викрил) пропиливают ткани и (по крайней мере в эксперименте) чаще вызывают воспаление и активацию коллагеназ, чем монофиламентный материал (полидеоксанон — ПДС или пролен). Хромированный кетгут слишком быстро рассасывается, чтобы обеспечить прочность анастомоза. Монофиламентная нить легче проскальзывает сквозь ткани и при непрерывном шве лучше распределяет натяжение вдоль всей окружности анастомоза.
Стоимость наложения анастомоза. Степлеры значительно дороже обычного шовного материала таким образом, материально более затратны. Вообще говоря, чем меньше используется шовного материала, тем дешевле обходится анастомоз, а наиболее экономичен однорядный непрерывный шов.
– Также рекомендуем “Выбор техники анастомоза. Отечная кишка.”
Источник
Несостоятельность анастомозов и риск ее развития являются краеугольным камнем резекционной хирургии полых органов брюшной полости, несмотря на многолетнюю историю изучения и широкую линейку как различных вариантов формирования соустий, так и девайсов (устройств, приспособлений, технических средств) для реализации этого процесса [1]. В настоящее время наиболее распространенной и широко применяемой является техника мануального одно- или двухрядного швов анастомоза, что позволяет использовать ее повсеместно, в том числе при условии перитонита [2]. Однако данные методики, к сожалению, имеют и ряд доказанных различными независимыми исследованиями недостатков. К последним следует отнести увеличение площади ишемии кишечной стенки в области формирования швов, что приводит к росту зоны некроза и риску несостоятельности. Иным вариантом течения процесса заживления следует считать формирование выраженного, избыточного воспалительного перифокального вала, что приводит к заживлению анастомоза по типу вторичного, особенно в условиях распространенного перитонита. К настоящему моменту, по данным литературы [3] имеется более 500 описаний различных способов кишечного шва, каждый из которых при анализе авторских публикаций следует считать оптимальным и повсеместно востребованным. Однако абсолютной надежности мануального традиционного шва за более чем столетнюю историю изучения (с момента внедрения принципов энтерального шва В.С. Холстедом и А. Ламбертом) не удалось достичь ни экспериментально, ни, тем более, на практике [3—5].
Как альтернативу традиционной мануальной техники можно рассмотреть аппаратные методики формирования различных соустий пищеварительного тракта, что, однако, ведет к увеличению стоимости проводимой операции, и, как следствие, данные методики экономически невыгодны и малоцелесообразны в условиях оплаты ОМС при ургентных вмешательствах, особенно на фоне неблагоприятных (распространенные формы перитонита) интраабдоминальных факторах [6, 7].
Основные требования к дигестивному соустью общеизвестны: достаточная ширина, биологическая и механическая прочность, первичная проходимость, соответствие принципам асептичности. Кроме того, наложение анастомоза должно быть легко воспроизводимым в любых условиях и доступно широкому кругу хирургов [8].
Последние десятилетия ознаменовались активным поиском и апробацией иных методик реализации вышеуказанных требований формирования соустий, что было реализовано внедрением в хирургическую практику различных вариантов компрессионных анастомозов полых органов. Для реализации компрессии используют никелид-титановые кольца с памятью формы, устройства по типу «пуговка Мерфи», биофрагментирующие кольца, магнитные анастомозы, компрессионные сшиватели кишечника (т.н. КСК) на основе титана ВТ-1 [9], а также возможность дополнительного укрепления линии шва клеевыми субстанциями на основе цианокрилатов и других адгезивов [10].
В последние годы проявляется интерес к использованию сплавов с эффектом памяти формы. Активно пропагандируемый рядом авторов способ бесшовного компрессионного анастомоза, выполненного имплантатами из никелида титана, надежен, герметичен, технически прост, а также функционален и легко воспроизводим, что может быть реализовано даже в условиях дефицита экспертного уровня хирургических кадров [11, 12]. Крайне важным аспектом следует считать способность никелид-титановых колец осуществлять дозированность давления в зависимости от толщины тканей кишечника или желудка, что, безусловно, значительно расширяет показания к их внедрению и использованию [12—14]. Одним из нюансов применения таких методов анастомозирования следует считать исключение возможности геморрагии из зоны соустья, отсутствие тяжелого анастомозита, а также риска формирования стриктур в отдаленном периоде. Фармакоэкономическая преференция использования никелид-титановых анастомозов очевидна ввиду сопоставимости их стоимости с затратами на современный шовный материал, что в сочетании с простотой использования и возможностью применения молодыми хирургами делает компрессионную методику формирования соустий кольцами на основе никелида титана крайне эффективной и легкодоступной [4, 12, 14, 15].
Таким образом, проблема профилактики послеоперационных осложнений после формирования межкишечных анастомозов является актуальной и требует дальнейшего изучения в сравнительном аспекте, тем более у лиц с высоким риском или на фоне распространенных форм перитонита.
Цель работы — внедрение компрессионного анастомоза с использованием никелид-титановых колец с памятью формы у пациентов с необходимостью выполнения резекционных вмешательств на кишечнике на фоне распространенных форм перитонита.
За период с 2011 по 2017 г. на базах кафедры нами выполнено 76 операций наложения межкишечного анастомоза никелид-титановым кольцом в условиях распространенного перитонита.
Используемый в нашей работе компрессионный имплантат Зиганьшина—Гюнтера представлял собой 3-витковую проволоку из никелид-титана овальной формы (рис. 1),  Рис. 1. Вид никелид-титановых колец (фотография). с диаметром проволоки до 2 мм. Подобные конструкции из никелид-титановой проволоки, закрученной многослойно и элипсообразно, следует рассматривать как своеобразный «золотой стандарт» в создании компрессионных анастомозов [12]. Данная конструкция соединила в себе простоту, надежность и эффективность, что удовлетворяет практически всем требованиям, предъявляемым к анастомозу. Эффект первичной проходимости при этом обеспечивается за счет рассечения ущемленных внутри устройства тканей с помощью специального инструментария, либо с помощью проведения тонкого зонда диаметром 3—4 мм. В ходе работы применялись импланты с температурой восстановления памяти формы в пределах +10—+250 °С. При применении гипотермии от 0 до +10 °С витки проволоки легко подвергались деформации с разведением последних на расстояние до 7—8 мм друг от друга, а после согревания in vivo при соприкосновении с тканями принимали исходную форму. Особенностью восстановления исходной формы является создание постоянной и равномерной компрессии соединяемых тканей с обеспечением этого эффекта на сроки до 7—10 сут. Окончательная компрессия и восстановление памяти формы реализуются при температуре тела в течение 30 с между витками спиралей, достигающей 900°. При этом создавали постоянную равномерную и длительную компрессию на все участки соединяемых тканей. Время восстановления первоначальной формы после извлечения из хладоагента и соприкосновения с тканями составляет 30 с, что значительно сокращает этап формирования соустья.
Рис. 1. Вид никелид-титановых колец (фотография). с диаметром проволоки до 2 мм. Подобные конструкции из никелид-титановой проволоки, закрученной многослойно и элипсообразно, следует рассматривать как своеобразный «золотой стандарт» в создании компрессионных анастомозов [12]. Данная конструкция соединила в себе простоту, надежность и эффективность, что удовлетворяет практически всем требованиям, предъявляемым к анастомозу. Эффект первичной проходимости при этом обеспечивается за счет рассечения ущемленных внутри устройства тканей с помощью специального инструментария, либо с помощью проведения тонкого зонда диаметром 3—4 мм. В ходе работы применялись импланты с температурой восстановления памяти формы в пределах +10—+250 °С. При применении гипотермии от 0 до +10 °С витки проволоки легко подвергались деформации с разведением последних на расстояние до 7—8 мм друг от друга, а после согревания in vivo при соприкосновении с тканями принимали исходную форму. Особенностью восстановления исходной формы является создание постоянной и равномерной компрессии соединяемых тканей с обеспечением этого эффекта на сроки до 7—10 сут. Окончательная компрессия и восстановление памяти формы реализуются при температуре тела в течение 30 с между витками спиралей, достигающей 900°. При этом создавали постоянную равномерную и длительную компрессию на все участки соединяемых тканей. Время восстановления первоначальной формы после извлечения из хладоагента и соприкосновения с тканями составляет 30 с, что значительно сокращает этап формирования соустья.
Во всех случаях нами была использована унифицированная техника формирования соустий путем наложения импланта в виде канцелярской скрепки. После выполнения резекционного этапа на противобрыжеечных участках определяли места формирования соустья, после чего проводили сближение участков двух петель кишечника с накладыванием швов-держалок. Фенестрацию кишечной стенки выполняли на расстоянии не более 4—6 мм с фиксацией углов узловыми швами для облегчения введения импланта (этот этап мы применяли на начальном этапе освоения методики, в последующем — его упразднили). В сформированные отверстия вводили предварительно охлажденное с параллельно разведенными витками компрессионное устройство с позиционированием в просвете кишечника. На фоне повышения окружающей температуры никелид-титановое кольцо приобретает исходную форму, тем самым формируя компрессию стенок кишки — будущие стенки анастомоза. Проходимость соустья обеспечивалась путем рассечения тканей специальными ножницами с выемкой для безопасной фенестрации (рис. 2).  Рис. 2. Ножницы для фенестрации просвета в анастомозе, сформированном никелид-титановым кольцом (фотография). Дефект стенок анастомозированных кишок герметизировали наложением нескольких серозно-подслизистых одиночных швов.
Рис. 2. Ножницы для фенестрации просвета в анастомозе, сформированном никелид-титановым кольцом (фотография). Дефект стенок анастомозированных кишок герметизировали наложением нескольких серозно-подслизистых одиночных швов.
Оперативные пособия, выполненные по поводу распространенного перитонита, сводились в 5 наблюдениях к резекции ранее сформированного гастроэнтероанастомоза при его несостоятельности, резекции участка тонкой кишки с межкишечным соустьем по поводу некроза кишечной стенки различного происхождения у 36 пациентов, а также илеотрансверзостомии или межкишечного анастомоза ободочной кишки у 35 больных. В трех наблюдениях подобные анастомозы выполняли по протоколу «damage control surgery» (программированного этапного лечения) ввиду крайней тяжести состояния оперируемых больных.
Гендерное распределение включенных в работу пациентов характеризовалось преобладанием лиц мужского пола (соотношение 4:1), преобладали больные старшей возрастной группы.
Особо следует обратить внимание на преобладание лиц старших возрастных групп (более 55%), что указывает на сопутствующие заболевания больных, тяжесть их общего состояния по шкалам органной дисфункции (APACHE-II), а также на снижение адаптивных резервов макроорганизма.
Тяжесть состояния по APACHE-II исходно определялась в диапазоне 16—20 баллов у 37 (49%) пациентов, при сумме баллов 21—25 — у 30 (39%) и более 26 отмечалась у 9 (12%) больных. Анализ исходного уровня органной дисфункции позволил выявить недостаточность одного органа у 35 (46%) пациентов, двух — у 25 (33%), а полиорганная дисфункция 3 и более органов и систем регистрировалась у 16 (21%) пациентов, что, безусловно, расценивалось как неблагоприятный прогностический критерий. Из 76 пациентов у 27 (35%) в течение первых суток прокальцитониновый тест был свыше 10, и отмечалось повышение концентрации С-реактивного пептида в сочетании с симптомами SIRS (синдрома системного ответа на воспаление).
Все операции выполнялись по неотложным показаниям, под эндотрахеальной анестезией и обязательным послеоперационным лечением в условиях отделения реанимации и интенсивной терапии.
Всем пациентам интраоперационно выполняли формирование от одного до двух компрессионных анастомозов (рис. 3).  Рис. 3. Имплантация никелид-титанового кольца в зону анастомозированных петель кишечника (интраоперационная фотография). Длительность формирования энтероэнтеростомы сокращалась пропорционально росту опыта проводимых вмешательств, согласно кривой обучения — с 8,5 мин при первых операциях, до 1 мин 27 с — при операциях по концепции damage control surgery. При этом среднее значение составило 2,6±0,98 мин. Во всех наблюдениях мы придерживались строго стандартизованной техники, описанной выше.
Рис. 3. Имплантация никелид-титанового кольца в зону анастомозированных петель кишечника (интраоперационная фотография). Длительность формирования энтероэнтеростомы сокращалась пропорционально росту опыта проводимых вмешательств, согласно кривой обучения — с 8,5 мин при первых операциях, до 1 мин 27 с — при операциях по концепции damage control surgery. При этом среднее значение составило 2,6±0,98 мин. Во всех наблюдениях мы придерживались строго стандартизованной техники, описанной выше.
Все оперативные пособия оканчивали страховочным дренированием брюшной полости, руководствуясь тяжестью и степенью распространенности перитонита. Также во всех наблюдениях выполняли раздельную назогастральную и назоеюнальную интубацию зондом Эббота—Миллера для декомпрессии проксимальных отделов желудочно-кишечного тракта, а также профилактики пареза в раннем послеоперационном периоде и нутритивной коррекции. При этом при планировании релапаромии по программе брюшную полость не ушивали, а формировали лапаростому с последующей санацией в сроки до 48 ч с момента первичного вмешательства.
Принимая во внимание характер экссудата, тяжесть перитонита, временную экспоненту до момента операции (как правило, длительность догоспитального этапа превышала 24 ч), у более чем половины больных (n=42; 55%) выполнялись программированные санации кратностью от 3 до 5 раз, Мср=3,23±0,79.
У оперированных нами 16 (21%) пациентов были релапаротомии «по требованию», решение о ее выполнении принимали, ориентируясь на тяжесть состояния, нарастание явлений SIRS и абдоминального сепсиса.
У 42 (55%) пациентов при оценке тяжести и органной дисфункции по шкале APACHE-II и сумме баллов выше 15 проводили сеансы экстракорпоральной детоксикации: высокообменный плазмаферез (18) и длительную от 24 до 48 ч гемофильтрацию (24). Наряду с экстракорпоральной детоксикацией через назоэнтеральный зонд у всех больных в сроки 48—72 ч проводили энтеральный лаваж с прокинетиками, энтеросорбцию и нутриционную поддержку, а также стимуляцию перистальтической активности медикаментозно. В тяжелых случаях резистентного к терапии пареза выполняли сеансы транскутанной резонансной стимуляции перистальтической активности на все «заинтересованные» отделы пищеварительного тракта последовательно с использованием специализированного оборудования [16, 17].
Оценку адекватности выполненных компрессионным способом соустий проводили как клинически, по характеру экссудата по страховочным дренажам, так и при реоперациях (по программе или по требованию). Также в послеоперационном периоде в первые 3—5 сут выполняли рентгенологическое обзорное исследование брюшной полости, при этом удавалось во всех наблюдениях визуализировать никелид-титановое кольцо (рис. 4).  Рис. 4. Обзорная рентгенограмма органов брюшной полости с визуализацией никелид-титанового кольца в области межкишечного соустья.
Рис. 4. Обзорная рентгенограмма органов брюшной полости с визуализацией никелид-титанового кольца в области межкишечного соустья.
В анализируемой группе больных несостоятельность анастомоза развилась у 2 (2,6%) пациентов, при этом причиной недостаточности соустья явились технические ошибки во время выполнения первичных операций из-за излишней мобилизации кишки с последующим развитием ее ишемии и некрозом. Справедливости ради, следует указать на наличие подобных технически-обусловленных осложнений на этапе освоения метода (первые 20 вмешательств), что в последующем удалось компенсировать прецизионностью техники, а также накоплением достаточного опыта с правильным позиционированием импланта. Анализируя частоту недостаточности анастомоза в 2,6%, следует учитывать исходную тяжесть состояния больных, а также тот факт, что ее величина при операциях на тонкой и ободочной кишках достигает по разным статистикам от 0,04 до 8,7% [4, 5], значительно возрастая в условиях перитонита.
Нами проводился анализ осложнений по классификации D. Dindo, P. Clavien [18] (см. таблицу),  Распределение хирургических осложнений по D. Dindo, N. Demartines, P. Clavien (2004) при этом, с учетом наличия лапаростомы у подавляющего количества больных, раневые осложнения не рассматривались. Из групп малых осложнений следует выделить успешно купированный консервативно паралитический илеус (в 2 случаях) как возможное проявление синдрома энтеральной недостаточности с применением всего спектра лекарственной и электростимулирующей терапии [16, 17], нутритивной коррекции и энтерального лаважа через установленный на операции назоэнтеральный зонд.
Распределение хирургических осложнений по D. Dindo, N. Demartines, P. Clavien (2004) при этом, с учетом наличия лапаростомы у подавляющего количества больных, раневые осложнения не рассматривались. Из групп малых осложнений следует выделить успешно купированный консервативно паралитический илеус (в 2 случаях) как возможное проявление синдрома энтеральной недостаточности с применением всего спектра лекарственной и электростимулирующей терапии [16, 17], нутритивной коррекции и энтерального лаважа через установленный на операции назоэнтеральный зонд.
В группе больших осложнений у исходно коморбидно-отягощенной группы пациентов следует обратить внимание на указанные ранее случаи несостоятельности, а также декомпенсацию органной недостаточности, что требует постоянной мультидисциплинарной курации и своевременного принятия решения.
В ходе наблюдения и лечения отмечено 11 летальных исходов, при этом 9 (12%) больных имели тяжесть перитонита и органной дисфункции по APACHE-II более 20 баллов, 2 больных с тяжестью состояния до 20 баллов. Непосредственными причинами летальных исходов у большинства оперированных нами больных явилась прогрессирующая полиорганная недостаточность (7 человек, 9,2%), в двух наблюдениях отмечены явления вялотекущего перитонита — как основная причина смерти (при состоятельности сформированного соустья), а также в двух случаях — острый инфаркт миокарда. Таким образом, общая летальность составила 14,5%, что, принимая во внимание исходную тяжесть исследуемой группы больных, не противоречит общепринятым значениям смертности (до 15—20% и выше) [19]. При этом не следует пренебрегать временным фактором оказания помощи, на что еще в 1926 г. указывал С.И. Спасокукоцкий: «При перитонитах операция в первые часы дает до 90% выздоровлений, в первый день — 50%, позже третьего дня — всего 10%» [19].
Дополнительно нами проводился макро- и микроскопический анализ ранее выполненных соустий при наступлении летального исхода, учитывая, что 8 из 11 смертей наступили в сроки более 3 сут с момента формирования энтероэнтеростомии. Визуально дефектов в анастомозе обнаружено не было, а микроскопически, помимо нейтрофильной лейкоцитарной инфильтрации, отмечалось увеличение фибробластов и фиброцитов как свидетельство активации регенераторных процессов. Сроки отторжения импланта в среднем составляли до 7,8±1,4 сут, при этом никелид-титановые кольца самостоятельно отторгались из организма.
Таким образом, проблема профилактики несостоятельности кишечного анастомоза, несмотря на более чем вековое изучение, остается актуальной и в настоящее время. Применение новых технологий, в том числе устройств из никелид-титана с эффектом памяти формы, при формировании межкишечных соустий при явлениях распространенного тяжелого перитонита позволяет снизить риск развития несостоятельности до уровня 3%, а также ускорить время операции. Это позволяет добиваться улучшения результатов лечения у коморбидных пациентов с прогностически неблагоприятным исходом по шкале APACHE-II.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: aliisaev79@mail.ru