Кишечный анастомоз по бондарю

Аннотация:
Изобретение относится к медицине, хирургии. После гастрэктомии по поводу рака желудка формируют пищеводно-кишечный анастомоз. На отключенной по Ру петле формируют впередиободочный арефлюксный муфтообразный эзофагоэнтероанастомоз по типу Бондаря. Отступя от эзофагоэнтероанастомоза формируют соустье бок в бок между слепым и отводящим концами петли. Способ упрощает технику и снижает травматичность реконстуктивной операции, повышает арефлюксные свойства пищеводно-кишечного соустья за счет снижения градиента давления в пределах эзофагоэнтероанастомоза. 1 пр., 1 ил.
Основные результаты:
Способ выполнения гастрэктомии, включающий формирование пищеводно-кишечного анастомоза между пищеводом и петлей тощей кишки, отличающийся тем, что на отключенной по Ру петле на расстоянии около 15 см от энтероэнтероанастомоза формируют впередиободочный арефлюксный муфтообразный эзофагоэнтероанастомоз по типу Бондаря, после чего на расстоянии около 12 сантиметров от пищеводно-кишечного анастомоза формируют анастомоз «бок в бок» между слепым и отводящим концами петли.
Изобретение относится к абдоминальной хирургии и может быть использовано при лечении рака желудка.
Термины, применяемые в описании изобретения.
Гастрэктомия – полное удаление желудка с наложением анастомоза.
Анастомоз – место соединения между чем-либо.
Энтероэнтероанастомоз – анастомоз между полыми органами или сосудами.
Эзофаго… – составная часть сложных слов, означающая «относящийся к пищеводу».
При выполнении гастрэктомии обычно формируют пищеводно-кишечный анастомоз между пищеводом и петлей тощей кишки с последующим формированием межкишечного анастомоза. Недостатками подобных способов являются:
– выключение из процесса пищеварения двенадцатиперстной кишки, что может привести к развитию тяжелых дискинезий желчевыводящих путей;
– утрата резервуарных функций удаленного желудка существенно ухудшает состояние больных, приводит к развитию демпинг-синдрома.
В качестве примера указанных выше способов можно привести «Способ формирования искусственного желудка», известный из патента RU 2445018 C2, МПК A61B 17/00, опубл. 20.03.2012 г., при котором после удаления желудка формируют пищеводно-кишечный анастомоз между пищеводом и отводящей петлей тощей кишки, а также резервуар из тонкой кишки.
За прототип заявляемого изобретения взят способ формирования пищеводно-тонкокишечного анастомоза, известный из патента RU 2437623 C2, МПК A61B 17/11, опубл. 27.12.2011 г. В способе-прототипе рассекают приводящий и отводящий отделы кишки прилежащей муфты длиной, равной двум ее диаметрам, сшивают конец пищевода с прилежащими краями вскрытых петель в верхнем отделе узловыми швами, после чего создают клапан, ушивая сверху края рассеченных отделов тонкой кишки на величину диаметра пищеводного отверстия, затем накладывают слизисто-серозный непрерывный шов тонкой кишки ниже сформированного пищеводно-кишечного анастомоза, формируют резервуар в виде кольцевидной приводящей петли тонкой кишки путем наложения межкишечного анастомоза бок в бок между перемещенным ушитым концом приводящего отдела тонкой кишки и просветом отводящей и приводящей петель тонкой кишки ниже сформированного клапана, а образованный резервуар анастомозируют в двенадцатиперстную кишку путем наложения дуоденоеюнального анастомоза конец в бок. Результатом операции, выполненной в соответствии с прототипом, является формирование двух резервуаров – продольного, замещающего удаленный желудок, и кольцевого, шунтирующего продольный резервуар.
Достоинствами прототипа являются арефлюксность и повышенная степень компенсации резервуарной функции удаленного желудка тощей кишкой, за счет чего значительно улучшается качество жизни больных после операции.
Недостатками прототипа являются повышенная сложность и повышенная травматичность исполнения. Повышенная сложность исполнения заключается в формировании большего количества анастомозов (дополнительный анастомоз между приводящей и отводящей петлями тонкой кишки и дуоденоеюнальный анастомоз). Кроме того, длинный межкишечный анастомоз, из которого формируется резервуар из тощей кишки между пищеводно-кишечным и тощекишечно-двенадцатиперстным анастомозами, менее надежен за счет увеличения количества налагаемых швов.
Задачей изобретения является создание простого, надежного способа выполнения гастрэктомии, характеризующегося арефлюксностью и повышенной степенью компенсации резервуарной функции удаленного желудка тощей кишкой при пониженной травматичности выполнения.
Технические результаты, на достижение которых направлено заявляемое изобретение, заключаются в снижении травматичности выполнения гастрэктомии и повышении степени компенсации резервуарной функции удаленного желудка тощей кишкой.
Указанные технические результаты могут быть получены в способе выполнения гастрэктомии, при котором после удаления желудка формируют пищеводно-кишечный анастомоз между пищеводом и петлей тощей кишки.
Технические результаты достигаются тем, что на отключенной по РУ петле на расстоянии около 15 см от энтероэнтероанастомоза формируют впередиободочный арефлюксный муфтообразный эзофагоэнтероанастомоз по типу Бондаря, после чего на расстоянии около 12 сантиметров от пищеводно-кишечного анастомоза формируют анастомоз «бок в бок» между слепым и отводящим концами петли.
Простота, надежность и пониженная травматичность предлагаемого способа обеспечиваются за счет уменьшения количества анастомозов и небольшой длины самих анастомозов.
Изобретение поясняется следующим чертежом.
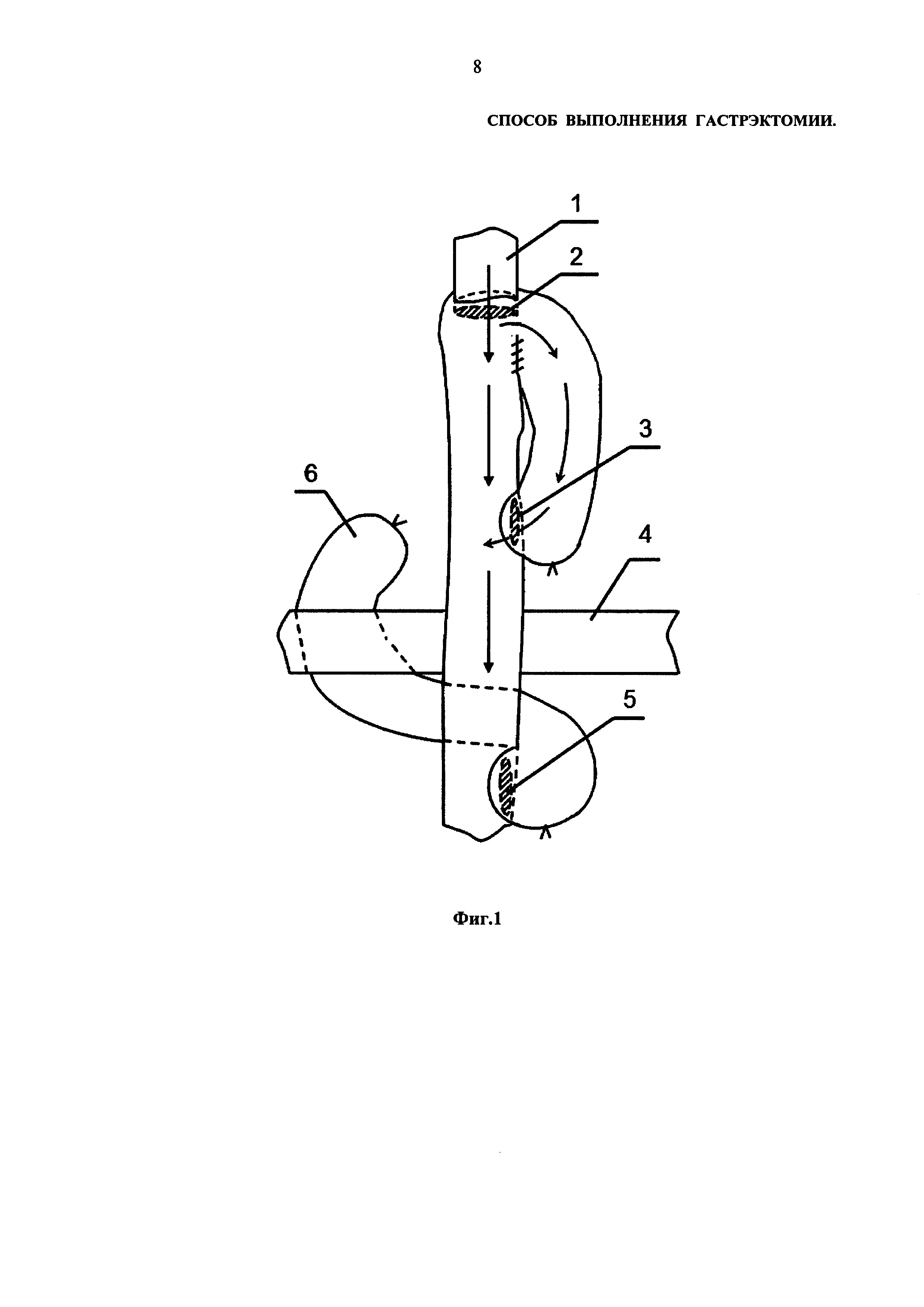
На Фиг.1 изображен результат выполнения гастрэктомии в соответствии с предлагаемым способом. Позициями на Фиг.1 обозначены:
1 – пищевод;
2 – эзофагоэнтероанастомоз;
3 – энтероэнтероанастомоз (дополнительный);
4 – поперечно-ободочная кишка;
5 – энтероэнтероанастомоз;
6 – культя двенадцатиперстной кишки.
Стрелками на Фиг.1 показаны направления движения пищи.
Для реализации изобретения выполняют следующую последовательность действий. Желудок мобилизуют по малой и большой кривизне (с обоими сальниками), перевязывают правые и левые желудочно-сальниковые артерии и вены. Мобилизуют начальный отдел двенадцатиперстной кишки, удаляют клетчатку с лимфоузлами из области печеночно-двенадцатиперстной связки, общей печеночной и селезеночной артерий. Двенадцатиперстную кишку прошивают механическим швом, пересекают, культю ее погружают двумя полукисетными швами. Отдельно перевязывают и пресекают левую желудочную вену и артерию. Продолжают мобилизовать желудок по большой и малой кривизне до абдоминального отдела пищевода. Выполняют ваготомию. Желудок отсекают от пищевода и удаляют. На расстоянии около тридцати сантиметров от связки Трейца пересекают тонкую кишку. Из дистальной петли тонкой кишки формируют муфту, которую подводят к пищеводу впередиободочно. Накладывают пищеводно-кишечный анастомоз по типу Бондаря. Затем накладывают энтероэнтероанастомоз бок в бок между проксимальной частью тонкой кишки и отводящей петлей тонкой кишки на расстоянии около 15 сантиметров от эзофагоэнтеоранастомоза (по Ру). В завершение способа формируют дополнительный энтероэнтероанстомоз бок в бок между отводящей и приводящей петлями тонкой кишки на расстоянии около 12 сантиметров от эзофагоэнтеоранастомоза.
Пример клинического выполнения.
Больной С., 59 лет, поступил в клинику 20.05.2013 г. с диагнозом рак желудка. При фиброгастродуоденоскопии выявлена опухоль тела желудка, инфильтративно-язвенная форма. 29.05.2013 г. выполнена верхнесрединная лапаротомия. При ревизии отдаленных метастазов не выявлено. В средней трети тела желудка по большой кривизне с переходом на переднюю и заднюю стенки определяется опухоль до 6 сантиметров, прорастающая серозу. Опухоль инфильтрирует желудочно-ободочную связку вплоть до селезенки. Решено выполнить гастрэктомию, спленэктомию. Мобилизация желудка по большой и малой кривизнам с обеими сальниками. Мобилизован начальный отдел двенадцатиперстной кишки. Удалена клетчатка с лимфоузлами из области общей печеночной, селезеночной, левой желудочной артерий чревного ствола двенадцатиперстная кишка прошита механическим швом, пересечена, культя ее погружена двумя полукисетными швами. Продолжена мобилизация желудка по большой и малой кривизнам до пищевода. Мобилизована селезенка. На пищевод наложен Г-зажим, пищевод пресечен. Произведена гастрэктомия единым блоком с селезенкой. На расстоянии 30 сантиметров от связки Трейца пересечена тонкая кишка. Из дистальной петли тонкой кишки сформирована муфта, которая подведена к пищеводу впередиободочно. Наложен пищеводно-кишечный анастомоз по типу Бондаря. Затем наложен энтероэнтероанастомоз бок в бок между проксимальной частью тонкой кишки и отводящей петлей тонкой кишки на расстоянии около 15 сантиметров от эзофагоэнтероанастомоза (по Ру). Сформирован дополнительный энтероэнтероанастомоз бок в бок между отводящей и приводящей петлями тонкой кишки на расстоянии 12 сантиметров от эзофагоэнтероанастомоза.
Способ выполнения гастрэктомии, включающий формирование пищеводно-кишечного анастомоза между пищеводом и петлей тощей кишки, отличающийся тем, что на отключенной по Ру петле на расстоянии около 15 см от энтероэнтероанастомоза формируют впередиободочный арефлюксный муфтообразный эзофагоэнтероанастомоз по типу Бондаря, после чего на расстоянии около 12 сантиметров от пищеводно-кишечного анастомоза формируют анастомоз «бок в бок» между слепым и отводящим концами петли.
Источник
Хирургические вмешательства при опухолях пищевода и кардии остаются одним из наиболее сложных разделов современной хирургии и онкологии. Возникающие при этом сложности обусловлены необходимостью манипуляции по обе стороны диафрагмы, высоким риском развития тяжелых интра- и послеоперационных осложнений, а также образованием в результате удаления опухоли протяженных дефектов пищеварительной трубки, требующих различных вариантов реконструкции с целью восстановления перорального питания.
К середине XX века были разработаны и опробованы в клинике разнообразные варианты эзофагопластики с использованием нескольких доступов (цервикоабдоминальный, право- или левосторонний трансторакальный), способов проведения трансплантата (предгрудинно, загрудинно или через заднее средостение), а также пластического замещения различными отделами желудочно-кишечного тракта (желудок, тонкая кишка, толстая кишка), однако ни одна из предложенных методик не стала универсальной [1, 2]. Последующее развитие хирургических технологий и реанимационного обеспечения позволило значительно сократить летальность после подобных вмешательств при выполнении их опытными хирургами в высокоспециализированных медицинских центрах.
В условиях стремительного развития хирургических технологий и повышения требований к качеству жизни многоэтапные операции практически утратили свою актуальность в плановой хирургии, в то время как вмешательства с одномоментным реконструктивно-пластическим этапом завоевывают все больше сторонников [1, 3—5].
Особую сложность представляет восстановление непрерывности верхних отделов желудочно-кишечного тракта в ситуациях, когда использование желудка в качестве пластического материала представляется невозможным в силу различных причин. К подобным клиническим ситуациям можно отнести первичный и рецидивный рак желудка с высоким распространением на пищевод; первично-множественные злокачественные новообразования желудка и пищевода, а также пластику пищевода на фоне органической патологии желудка (резецированный желудок, ранее сформированная гастростома, рубцовые деформации и т.д.).
В настоящее время отсутствует единый взгляд на различные хирургические аспекты данной проблемы, включая выбор объема вмешательства на желудке, уровня резекции пищевода, оптимального операционного доступа и варианта пластики, обеспечивающего приемлемые непосредственные и отдаленные результаты.
Наиболее часто сочетанное поражение пищевода и желудка наблюдается при кардиоэзофагеальном раке. При этом кардиоэзофагеальный рак не выделен в отдельную нозологическую группу, в связи с чем возникают проблемы при классификации и стадировании этих опухолей, часть из которых может быть отнесена к раку дистального отдела пищевода. В клинической онкохирургии широко используется классификация, предложенная J. Siewert (1996), основанная на гистологической структуре опухоли (аденокарцинома) и ее локализации в зоне пищеводно-желудочного перехода [10]. С учетом данной классификации выделяют следующие типы опухолей:
I тип — аденокарцинома дистального отдела пищевода, эпицентр которой расположен в пределах от 1 до 5 см выше зоны пищеводно-желудочного перехода (Z-линии) с возможностью распространения через последнюю в сторону желудка;
II тип — истинная аденокарцинома зоны пищеводно-желудочного перехода (истинный рак кардии), эпицентр расположен в пределах 1 см проксимально и 2 см дистально от Z-линии;
III тип —рак с локализацией основного массива опухоли в субкардиальном отделе желудка (от 2 до 5 см дистально от Z-линии) и возможным вовлечением дистальных отделов пищевода.
Сочетанное поражение желудка и пищевода, а также возможность поражения интраабдоминальных и медиастинальных лимфатических узлов обусловливает необходимость выполнения обширных операций, сопряженных с манипуляциями в брюшной и плевральной полостях. Адекватный выбор оперативного доступа и рациональное планирование этапов операции позволяет осуществить резекцию пищевода в пределах здоровых тканей, произвести двухзональную лимфаденэктомию и обеспечить оптимальные условия для формирования пищеводного анастомоза [6, 7].
Впервые гастрэктомию из единого левостороннего торакоабдоминального доступа выполнил в 1930 г. T. Osawa, а в 1946 г. J. Garlock из этого же доступа — проксимальную резекцию желудка с резекцией нижнегрудного отдела пищевода. I. Lewis в 1946 г. разработал доступ в раздельной лапаротомии и правосторонней торакотомии, позволяющий под визуальным контролем мобилизовать и резецировать грудной отдел пищевода на всем его протяжении, выполнить билатеральную мадиастинальную лимфаденэктомию и сформировать анастомоз в куполе плевральной полости.
Распространение опухоли желудка на пищевод, по мнению многих исследователей, является одним из неблагоприятных факторов прогноза, ухудшающих непосредственные и отдаленные результаты хирургического лечения [8—10]. Так, при поражении внутригрудного отдела пищевода частота развития послеоперационных осложнений, в том числе несостоятельности пищеводно-кишечного анастомоза, по некоторым данным, может достигать 30%. 5-летняя выживаемость больных, оперированных левосторонним комбинированным торакоабдоминальным доступом, не превышает 21,1%.
Дифференцированный подход к выбору оптимального оперативного доступа при раке желудка с распространением на пищевод, разработанный Л.А. Вашакмадзе (1991), позволил значительно снизить частоту несостоятельности швов и рецидивов в зоне анастомоза [8].
Основным критерием выбора оперативного доступа является уровень проксимальной границы опухоли в пищеводе и определение типа кардиоэзофагеального рака по Siewert [10]. Так, при опухолях III типа (поражение верхней трети желудка с минимальным распространением на пищевод) показан лапарофреноторакотомный доступ по Osawa—Garlock, при опухолях I и II типов оптимальным является правосторонний торакоабдоминальный доступ по Lewis с субтотальной резекцией пищевода [10, 11].
При выборе адекватного объема вмешательства на желудке необходимо учитывать гистологическую структуру, степень дифференцировки и форму роста опухоли. Кроме того, целесообразно проводить морфологический контроль состояния слизистой оболочки неизмененной части желудка (фон). Низкая степень дифференцировки опухоли, инфильтративная форма роста, наличие предраковых изменений слизистой оболочки дистальных отделов желудка являются показанием к гастрэктомии с резекцией пищевода даже при проксимальной локализации опухоли [8].
Одним из ключевых моментов одномоментной эзофагогастрэктомии является выбор варианта реконструкции, включая способ проведения трансплантата и методику формирования анастомоза. Особую актуальность этот вопрос приобретает у пожилых и соматически ослабленных пациентов с тяжелой сопутствующей патологией.
Оптимальным вариантом реконструкции после эзофагогастрэктомии принято считать пластику сегментом толстой кишки с проведением трансплантата в заднем средостении и формированием внутриплеврального двухрядного инвагинационного анастомоза по типу конец в бок [12].
Выбор сегмента толстой кишки в качестве трансплантата осуществляется с учетом анатомических особенностей ободочной кишки и ее ангиоархитектоники. Предпочтение отдается левой половине ободочной кишки на средних ободочных сосудах, что обусловлено возможностью формирования трансплантата достаточной длины и оптимальной длиной сосудистой ножки. Реже в качестве пластического материала используются поперечная ободочная кишка и правая половина ободочной кишки.
Вторым по значимости вариантом реконструкции после операции на пищеводе и желудке является пластика тонкокишечным трансплантатом. Данный вариант пластики может быть успешно реализован при наличии магистрального типа кровоснабжения, достаточной длины брыжейки, устойчивого кровоснабжения трансплантата. Следует отметить, что в некоторых ситуациях выбор этого варианта реконструкции продиктован необходимостью сокращения объема и длительности операции у соматически отягощенных больных. В целом пластика тонкой кишкой сопряжена с бóльшим риском недостаточности кровоснабжения трансплантата из-за особенностей ангиоархитектоники, низкой толерантности к гипоксии и венозной недостаточности. Наиболее часто при тонкокишечной пластике используется внутригрудной путь проведения трансплантата с формированием двухрядного инвагинационного эзофагоэнтероанастомоза по типу конец в конец. Возможности кишечной пластики могут быть расширены путем использования дополнительных микрососудистых анастомозов.
В доступной литературе встречаются единичные публикации, посвященные одномоментной эзофагогастрэктомии комбинированным правосторонним торакоабдоминальным доступом, которые описывают отдельные клинические наблюдения либо результаты лечения сравнительно небольших клинических групп (J. Rahamim, C. Cham и соавт., 1994; J. Belghiti, D. Cherqui и соавт., 1990) (табл. 1).
В нашей стране наиболее значительный опыт выполнения эзофагогастрэктомии имеют РОНЦ им. Н.Н. Блохина; МНИОИ им. П.А. Герцена и РНЦХ им. акад. Б.В. Петровского.
Нам не встретились сообщения о выполнении такого рода операций у больных, которые ранее перенесли оперативное вмешательство на желудке и пищеводе по поводу опухолевой или неопухолевой патологии или требующие отсроченной пластики пищевода.
Выбор варианта реконструкции пищевода у больных с рецидивом рака желудка в зоне пищеводного анастомоза определяется уровнем распространения опухолевой инфильтрации в проксимальном направлении на пищевод и в дистальном направлении на тонкую кишку. Оптимальным объемом хирургического вмешательства в этой ситуации является резекция пищеводно-кишечного анастомоза и грудного отдела пищевода из правостороннего торакоабдоминального доступа. Выбор способа кишечной пластики осуществляется индивидуально и определяется различными факторами, включая уровень поражения пищевода, анатомические особенности тонкой и толстой кишки, наличие спаечного процесса после ранее перенесенных вмешательств, а также соматический статус пациента.
В отделении торакоабдоминальной хирургии МНИОИ им. П.А. Герцена с 2006 по 2010 г. оперировано 17 пациентов, которым потребовалось выполнение резекции и пластики пищевода в условиях одномоментного или предшествующего вмешательства на желудке, что исключало пластику желудочным трансплантатом.
У 9 больных операции выполнены по поводу рака желудка с высоким распространением на пищевод, 6 больных оперированы по поводу рецидива рака желудка в зоне пищеводно-кишечного или пищеводно-желудочного анастомоза. У 1 больного имелся первично-множественный рак оперированного желудка и рак пищевода, одному больному произведена отсроченная эзофагопластика после экстирпации пищевода с резекцией желудка (табл. 2).
Во всех случаях доступ к пищеводу осуществлялся путем правосторонней торакотомии.
Среди 17 больных было 15 мужчин, 2 женщины. Возраст больных варьировал от 43 до 69 лет (средний возраст — 56,8 года).
Резекционные этапы операции включали гастрэктомию с резекцией пищевода (9 больных), резекцию пищеводно-кишечного анастомоза в плевральной полости (4), экстирпацию оперированного желудка с резекцией пищевода (3) (табл. 3).
Выбор варианта реконструкции осуществляли индивидуально, с предварительным обсуждением на дооперационном этапе и учетом разнообразных факторов: локализации, размера, формы роста опухоли, гистологической структуры, глубины инвазии и состояния регионарных лимфатических узлов, характера предшествующих вмешательств и способа реконструкции после них.
Всем пациентам выполняли комплексное ультразвуковое исследование органов брюшной полости, рентгенологическое и эндоскопическое исследование желудка и пищевода с биопсией опухоли и слизистой оболочки вне опухоли (фон). При наличии показаний выполняли компьютерную томографию органов грудной и брюшной полостей. Исследовали состояние ободочной кишки, выполняли ирригоскопию и/или колоноскопию. Кроме того, проводили комплексную оценку соматического статуса пациента, анестезиологического риска, коррекцию сопутствующей патологии и т.п.
Во всех наблюдениях в качестве предварительного плана реконструкции предполагалась толстокишечная пластика. Однако у ряда больных первоначальный план был пересмотрен интраоперационно с учетом индивидуальных особенностей анатомии и хода операции.
У 9 пациентов была выполнена гастрэктомия с резекцией грудного отдела пищевода комбинированным правосторонним торакоабдоминальным доступом. Реконструктивный этап операции был реализован путем формирования тонкокишечного трансплантата на брыжеечных сосудах с проведением его в плевральную полость и формированием инвагинационного пищеводно-кишечного анастомоза по типу конец в конец на уровне бифуркации трахеи или непарной вены (рис. 1, 2). Рисунок 1. Формирование тонкокишечного трансплантата (а); формирование внутриплеврального пищеводно-кишечного анастомоза (б).
Рисунок 1. Формирование тонкокишечного трансплантата (а); формирование внутриплеврального пищеводно-кишечного анастомоза (б). Рисунок 2. Схема операции. У 2 больных анастомозы были сформированы в куполе плевральной полости.
Рисунок 2. Схема операции. У 2 больных анастомозы были сформированы в куполе плевральной полости.
Трое больных, которым ранее в других медицинских учреждениях была выполнена гастрэктомия с реконструкцией на длинной петле с брауновским соустьем, поступили в отделение по поводу рецидива рака желудка в зоне пищеводно-кишечного анастомоза. Во всех 3 случаях была выполнена резекция пищеводно-кишечного анастомоза из правостороннего торакоабдоминального доступа с сохранением ранее наложенного межкишечного анастомоза по Брауну с пластикой тонкой кишкой и формированием внутриплеврального пищеводно-кишечного анастомоза (рис. 3, 4). Рисунок 3. Схема операции.
Рисунок 3. Схема операции. Рисунок 4. Формирование внутриплеврального пищеводно-кишечного анастомоза.
Рисунок 4. Формирование внутриплеврального пищеводно-кишечного анастомоза.
Одному больному по поводу рецидива опухоли была выполнена экстирпация оперированного желудка с резекцией пищевода после проксимальной субтотальной резекции желудка. Реконструктивный этап был осуществлен путем проведения тонкокишечного трансплантата в плевральную полость и формирования пищеводно-кишечного анастомоза.
Выбор варианта реконструкции с помощью тонкой кишки был обусловлен достаточной длиной и устойчивым кровоснабжением трансплантата, а также стремлением к сокращению объема оперативного вмешательства ввиду нестабильной гемодинамики во время наркоза.
Одному больному с рецидивом рака желудка после чрезбрюшинной гастрэктомии с реконструкцией по Бондарю выполнена резекция пищеводно-кишечного анастомоза с субтотальной резекцией пищевода и пластикой левой половиной ободочной кишки. Выбор варианта реконструкции был обусловлен распространением опухолевой инфильтрации до уровня бронхиального сегмента пищевода. Произведено формирование трансплантата из левой половины ободочной кишки, который был перемещен в средостение на средних ободочных сосудах с формированием эзофагоколоанастомоза в плевральной полости и энтероколоанастомоза в брюшной. Целостность ободочной кишки восстановлена путем формирования трансверзосигмоанастомоза (рис. 5, 6). Рисунок 5. Схема операции.
Рисунок 5. Схема операции. Рисунок 6. Формирование толстокишечного трансплантата (а); формирование энтероколоанастомоза (б).
Рисунок 6. Формирование толстокишечного трансплантата (а); формирование энтероколоанастомоза (б).
У 1 больной после одномоментной резекции и пластики пищевода желудочным стеблем развился частичный некроз желудочного трансплантата, что потребовало разобщения анастомоза с резекцией желудочного стебля и формированием эзофагостомы на шее и гастростомы предгрудинно. Сложность последующей реконструкции определялась невозможностью использовать оставшуюся часть желудка, массивным рубцово-спаечным процессом в плевральной полости и средостении после ранее перенесенного гнойно-воспалительного процесса, необходимостью формирования пищеводного анастомоза на шее. Через 4 мес после первой операции больной произведена отсроченная эзофагопластика толстой кишкой.
Реконструктивный этап заключался в выделении толстокишечного трансплантата из левой половины ободочной кишки на средних ободочных сосудах, проведением его ретростернально и формированием гастроколоанастомоза в брюшной полости и эзофагоколоанастомоза на шее.
Выбор варианта реконструкции был обусловлен необходимостью формирования пищеводного анастомоза на шее, а путь проведения трансплантата был избран с учетом невозможности манипуляции в плевральной полости, а также стремлением к достижению удовлетворительного косметического эффекта (рис. 7, 8). Рисунок 7. Схема операции.
Рисунок 7. Схема операции. Рисунок 8. Формирование толстокишечного трансплантата.
Рисунок 8. Формирование толстокишечного трансплантата.
Послеоперационные осложнения отмечены у 3 (17%) пациентов. У 1 больного выявлена перфорация стенки отводящей петли анастомозированной тонкой кишки, у другого — несостоятельность швов внутриплеврального пищеводно-кишечного анастомоза. У обоих пациентов осложнения удалось купировать консервативно путем стентирования и дренирования плевральной полости.
В одном наблюдении отмечен послеоперационный панкреонекроз, который стал причиной смерти больного. Летальность составила 6,5%.
Таким образом, реконструкция верхних отделов желудочно-кишечного тракта после одномоментных или последовательных операций на пищеводе и желудке является сложной и нестандартной ситуацией в онкохирургии.
Наиболее часто подобные ситуации возникают у больных кардиоэзофагеальным раком с высоким распространением на пищевод, когда наиболее обоснованной с онкологических позиций операцией является гастрэктомия с субтотальной резекцией пищевода правосторонним торакоабдоминальным доступом. Аналогичный объем вмешательства требуется у больных с рецидивами рака желудка в зоне пищеводно-кишечного либо пищеводно-желудочного анастомоза, а также при первично-множественном раке пищевода и желудка.
Выбор варианта реконструкции, включая тип трансплантата, путь проведения и способ формирования анастомоза, зависят от множества факторов, таких как распространенность опухолевого процесса, уровень поражения пищевода, индивидуальные анатомические особенности тонкой и толстой кишки, предшествующие операции, а также общее состояние и конституция пациента. Оптимальным вариантом реконструкции является пластика левой половиной ободочной кишки с внутриплевральным проведением трансплантата и формированием эзофагоколоанастомоза. При наличии благоприятных условий для тонкокишечной пластики выполняют реконструкцию сегментом тонкой кишки, что позволяет в ряде случаев использовать ранее наложенные соустья и, таким образом, сократить продолжительность и объем операции.
Все вышеописанные вмешательства отличаются технической сложностью, продолжительностью, высоким риском развития тяжелых интра- и послеоперационных осложнений и должны выполняться в высокоспециализированных центрах с хорошей материально-технической базой, а оперирующий хирург должен быть готов к изменению предварительного плана операции и владеть всеми вариантами пластики пищевода.
Источник