Корниенко актуальные вопросы коррекции кишечной микрофлоры у детей
За последние десятилетия благодаря появлению и широкому внедрению в исследовательскую практику новых, в первую очередь молекулярно-генетических методов, наши представления о кишечном микробиоценозе претерпели существенные изменения. Микроорганизмы кишечника человека представляют собой огромную популяцию, насчитывающую миллионы бактериальных клеток. Так, именно микроорганизмы составляют 90% совокупности клеток макроорганизма и микробов и 75% – суммы генетического материала (метагеном) [1]. В соответствии с современными представлениями в кишечном микробиоценозе насчитывается 395 филогенетических групп, из которых 244 (62%) – новые, выделенные за последние десятилетия, а по крайней мере 195 – некультивируемые, т. е. вырастить их существующими сегодня микробиологическими методами невозможно. Последнее обусловливает и значительные трудности в определении их функционального значения как на уровне ЖКТ, так и для организма человека в целом. На сегодня преобладающими в кишечнике микроорганизмами считаются представители филотипов Firmicutes, Bacteroidetes, Proteobacteria, Verrucomicrobia, Actinobacteria, Fusobacteria [2]. При этом на долю Firmicutes и Bacteroidetes приходится 70% [3], а разнообразие микробного населения толстой кишки превышает 70 тыс. видов.
Изменились представления и об организации микробного сообщества кишечника. Микроорганизмы, находящиеся на поверхности эпителиальных клеток, зафиксированы в матрице полимерных структур, продуцируемых самими микробами. При этом данная структура имеет вполне определенную организацию, а микроорганизмы взаимодействуют между собой, в значительно степени координируя свою активность. Данное наблюдение заложило основу для введения понятия Quorum Sensing (QS) («чувствительный кворум»), определяющего взаимодействие микробов в популяции. Распределенные в толще слизи и просвете кишечника микробы через QS обеспечивают координированное симбионтное пищеварение, колонизационную резистентность, функциональную активность, взаимодействие с клетками макроорганизма.
В связи с жизненно важными функциями, которые выполняет кишечная микрофлора, а также с учетом ее многочисленности и строгой организации данное сообщество должно рассматриваться как еще один орган человеческого организма. Именно поэтому в последние годы термин «кишечная микрофлора» (intestinal flora) заменяется термином «кишечная микробиота» (gut microbiota) [4].
Основными функциями кишечной микробиоты являются:
– антиинфекционная защита;
– питание толстой кишки;
– всасывание минералов, воды;
– синтез витаминов группы В и К;
– регуляция липидного обмена;
– регуляция азотистого обмена;
– регуляция кишечной моторики;
– иммунные функции.
Здоровье кишечной микрофлоры определяется факторами внутриутробного развития, условиями жизни ребенка в течение первых месяцев жизни, а также многочисленными факторами на протяжении всей жизни человека. Тем не менее именно первые годы жизни, особенно первые месяцы, являются в этом отношении наиболее критическими – в связи с процессом колонизации кишечника и становлением кишечного микробиоценоза.
Нарушение нормального состава кишечной микрофлоры (дисбиоз) наблюдается при многих заболеваниях и состояниях. Так, дисбиозу принадлежит ключевая роль в развитии функциональных нарушений моторики органов пищеварения, в первую очередь СРК. В частности, синдром избыточного бактериального роста (СИБР) в тонкой кишке выявляется у 75–80% детей с СРК. По данным B.S. Collins и H.C. Lin (2010), водородный дыхательный тест (ВДТ) с лактулозой выявил СИБР у 91% детей 8–18 лет с хроническими функциональными абдоминальными болями и лишь у 35% в контрольной группе (OR = 16,7, 95% доверительный интервал: 6,0–57,5, p<0,0001) [5]. По данным E. Scarpellini (2009), СИБР при проведении ВДТ был выявлен у 65% детей с СРК 4–18 лет (28/43) и у 7% в контрольной группе (4/56; OR 3,9, 95% ДИ 7,3–80,1, p<0,00001) [6].
По результатам работ Е.А. Корниенко и соавт., дисбактериоз наблюдается у 100% детей с СРК в возрасте от 5 до 17 лет и выражается в снижении количества бифидобактерий, лактобактерий, типичной кишечной палочки, а также превышении количества лактозонегативной кишечной палочки. Наличие условно-патогенной флоры (Staphylococcus aureus, Enterobacter cloacae, Pseudomonas aeruginosa, Candida albicans, Proteus mirabilis, Klebsiella pneumoniaе, Acinetobacter anitratus) также характерно для этого состояния. СИБР был выявлен у 88% детей. При этом у всех детей была повышена висцеральная чувствительность, что является характерным признаком СРК [7].
Кишечная микрофлора способна модулировать висцеральную рецепцию. Было установлено, что при приеме L. acidophilus увеличивается число опиоидных и каннабиноидных рецепторов у животных в эксперименте, что приводит к ингибированию висцеральной чувствительности эквивалентно приему 0,1 мг морфина на кг массы тела животного [8]. E. coli Nissle 1917 в эксперименте подавляет висцеральную гиперчувствительность при химически индуцированном колите [9]. L. paracasei снижает висцеральную гиперчувствительность при воспалении, связанном с нарушением микрофлоры после приема антибиотиков [10].
Таким образом, кишечная микрофлора играет важную роль в развитии функциональных расстройств органов пищеварения.
В то же время дисбиоз имеет большое значение для развития заболеваний, на первый взгляд не связанных напрямую с состоянием кишечника. К таким заболеваниям относятся, в частности, ожирение, СД 2-го типа, атеросклероз, ишемическая болезнь сердца, ревматоидный артрит, аутизм, рассеянный склероз.
Обсуждая вопросы профилактики и лечения кишечного дисбиоза, следует отметить, что в его профилактике имеет большое значение адекватное количество пребиотиков и пробиотиков в продуктах питания. В первую очередь речь идет о пищевых волокнах и кисломолочных продуктах. Что касается коррекции уже имеющихся дисбиотических нарушений, то начинать ее следует с устранения их причины. Дисбиоз всегда является вторичным нарушением, и поиск значимого в его развитии состояния или заболевания с последующей их коррекцией – задача первостепенной важности. Нужно отметить, что в связи с нашими ограниченными знаниями о кишечной микрофлоре говорить о целенаправленном воздействии на нее невозможно. В то же время коррекция ее состава и функционального состояния вполне возможна с помощью средств, изменяющих внутреннюю среду в кишке, создающих благоприятные условия для самовосстановления микробиоценоза. С этой целью назначаются пре- и пробиотики в составе лекарственных препаратов. Также перспективным методом коррекции является фекальная трансплантация, однако до ее внедрения в повседневную практику предстоит пройти еще длительный путь исследований и клинических испытаний.
Пребиотики – углеводы, неперевариваемые в верхних отделах ЖКТ, которые в толстой кишке избирательно стимулируют рост и/или метаболическую активность «полезной» микрофлоры. Пробиотики – это живые микроорганизмы, которые при назначении в адекватных количествах оказывают благотворное влияние на здоровье человека.
Пребиотики являются основным субстратом для энергетического метаболизма нормальной микрофлоры ЖКТ, в первую очередь толстой кишки. Через процессы брожения микроорганизмы получают энергию, выделяя в окружающую их среду летучие жирные кислоты, молочную кислоту, водород и ряд других метаболитов, которые необходимы для нормального течения многих жизненно важных для макроорганизма процессов как в толстой кишке, так и за ее пределами. В частности, бутират является основным источником энергии для толстой кишки, регулятором процессов пролиферации и дифференцировки колоноцитов. Таким образом, нормальное питание кишечной микрофлоры является важнейшим фактором здоровья организма человека в целом. В грудном молоке содержатся обладающие пребиотическим действием олигосахариды, а смеси для искусственного вскармливания должны обязательно включать их в свой состав. В дальнейшем фруктоолигосахариды, инулин, пищевые волокна должны присутствовать в рационе человека, однако в обычном рационе питания современного человека количества пребиотиков недостаточно.
К пробиотическим микроорганизмам относятся определенные штаммы бифидобактерий, лактобацилл, а также некоторые энтерококки (Lactobacillus acidophilus, Lactobacillus ramnosus GG, Lactobacillus fermentum, Strepto (Entero) coccus faecium SF68, S. Thermophiles, Bifidobacterium spp.) и грибы (в частности, Saccharomices boulardii).
Пробиотики применяются при таких заболеваниях, как острые диареи (кишечные инфекции), антибиотик-ассоциированная диарея, диарея путешественников, СРК, функциональные запоры, младенческие колики, хеликобактерная инфекция, некротизирующий энтероколит у недоношенных детей, аллергия и атопический дерматит [11]. Для используемых в качестве пробиотиков микроорганизмов доказана их безопасность, а минимальные побочные эффекты развиваются крайне редко [12, 13].
Однако далеко не всегда удается достичь хороших результатов лечения дисбиоза кишечника, применяя только пре- и пробиотики. Нередко используются препараты с антибактериальной активностью для санации кишечника согласно протоколу ведения больных с дисбактериозом кишечника (приказ Минздрава РФ от 09.06.2003 № 231) [14].
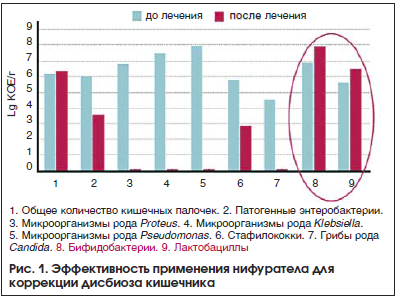
На фармацевтическом рынке РФ представлен оригинальный препарат европейского производства нифурател (Макмирор®), который относится к нитрофурановому ряду. Он может назначаться уже на начальном этапе коррекции дисбиоза наряду с адсорбентами, ферментными препаратами, про- и пребиотиками. Макмирор® хорошо всасывается в ЖКТ и обладает широким спектром действия в отношении бактерий, простейших, грибов (Enterococcus faecalis, Enterococcus faecium, Staphylococcus aureus, Bacillus subtilis, Escherichia coli, Shigella, Salmonella, Klebsiella spp., Enterobacter sph., Serratia spp., Citrobacter spp., Morganella spp., Rettgerella spp., Pragia fontium, Budvicia aquatica, Rachnella aquatilis и Acinetobacter spp., энтеробактерий, трихомонад, амеб, лямблий, Proteus, Pseudomonas, грибов рода Candida). При дисбактериозе кишечника часто отмечается избыточный рост грибов рода Candida. Макмирор®, обладая противогрибковой активностью, подавляет рост грибов рода Candida и предотвращает развитие кандидоза слизистых оболочек, в отличие от антибиотиков. Важно при этом, что Макмирор® снижает количество условно-патогенных микроорганизмов в кишечнике, способствуя одновременно росту бифидо- и лактобактерий (рис. 1) [14].
Биодоступность нифуратела составляет 95%. Нифурател вмешивается в метаболические процессы на уровне бактериальной клетки, блокирует ряд энзимных цепочек и тем самым препятствует размножению и росту микроорганизмов, обладая бактериостатическим действием. К нифурателу не формируется резистентность микроорганизмов, т. к. он препятствует появлению устойчивых штаммов (развитию устойчивости у микроорганизмов). Препятствует он и развитию перекрестной резистентности к антибиотикам (макролидам, аминогликозидам, линкозамидам, тетрациклинам, стрептопраминам, хлорамфениколу и т. д.).
Эффективность препарата Макмирор® доказана при лечении пациентов с СИБР, который сформировался на фоне СРК. По данным клинического исследования, у 30 пациентов с СРК показатели ВДТ с лактулозой превышали нормальные, что указывало на наличие СИБР. При построении общего (усредненного) графика результата тестов у пациентов с СРК-СИБР наблюдаются 2 пика повышения концентрации выдыхаемого водорода, что характерно для избыточной бактериальной контаминации тонкой кишки. У исследуемых контрольной группы наблюдается только 1 пик. Известно, что в норме лактулоза не метаболизируется в тонкой кишке, а в толстой кишке лактулоза метаболизируется нормальной анаэробной толстокишечной микрофлорой до короткоцепочечных жирных кислот с выделением молекулярного водорода. Этот водород регистрируется при его выдыхании из легких специальным прибором (Gastrolyzer). У пациентов с СИБР в тонкой кишке наблюдается избыточная контаминация толстокишечной анаэробной (нефизиологичной) микрофлорой, поэтому метаболизм лактулозы наблюдается значительно раньше, т. е. в тонкой кишке. Этот феномен регистрируется при ВДТ, делая его положительным. Макмирор® подавляет рост флоры в тонкой кишке, снижая количество водорода в выдыхаемом воздухе. Каждый пациент принимал нифурател (Макмирор®) по 400 мг 3 р./сут в течение 7 дней. Результаты исследования представлены на рисунках 2 и 3 [15].
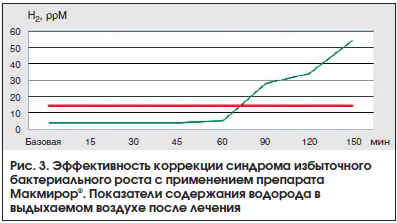
После деконтаминации тонкой кишки с применением препарата Макмирор® большинство пациентов (28 человек, 93,3%) отмечали значительное уменьшение или полное купирование метеоризма, нормализацию стула или уменьшение его частоты, полное или значительное купирование болевого синдрома.
Макмирор® показан в следующих случаях: дисбактериоз кишечника, СИБР, кишечные инфекции, амебиаз, лямблиоз, хронические заболевания верхних отделов ЖКТ, ассоциированные с H. рylori. Противопоказаниями являются гиперчувствительность, а также дефицит сахарозы/изомальтозы, непереносимость фруктозы, глюкозо-галактозная мальабсорбция. Побочные эффекты редки: диспепсические расстройства и аллергические реакции. Детям с массой тела менее 40 кг Макмирор® назначают в дозе 30 мг/кг/сут в 2–3 приема, а взрослым и детям с массой тела более 40 кг – по 2 таблетки 2–3 р./сут. Курс терапии – 7 дней.
В настоящее время очевидно, что нарушения состава и функции кишечной микрофлоры играют важную роль в патогенезе многих заболеваний у детей и взрослых, однако многие вопросы, связанные с коррекцией кишечного микробиоценоза, остаются недостаточно разработанными. Тем не менее эффективный путь решения данной проблемы существует – это своевременная и адекватная коррекция кишечной флоры.
Источник
Для цитирования: Коровина Н.А., Захарова И.Н. Коррекция дисбиоза кишечника у детей. РМЖ. 2005;27:1863.
Еще в начале прошлого века великий русский ученый И.И. Мечников писал о том, что кишечная микрофлора играет существенную роль в жизнедеятельности человека. В своей работе «Этюды оптимизма» 1908 г. он отмечал, что «наша преждевременная и несчастливая старость является следствием постоянного отравления вредными веществами, выделяемыми некоторыми микробами толстого кишечника. Совершенно очевидно, что уменьшение количества этих микробов отдаляет старость и смягчает ее проявления». По прошествии многих лет интерес к данной проблеме не угас.
Пищеварительный тракт представляет собой открытую систему, посредством которой осуществляется контакт макроорганизма с внешней средой и присутствующими в нем микробами. Нормальная микрофлора кишечника имеет большое значение для поддержания на оптимальном уровне метаболических процессов, протекающих в макроорганизме, а также для создания высокой колонизационной резистентности организма хозяина по отношению к патогенным микробам. Экологическая система, компонентами которой являются макроорганизм, его микрофлора и окружающая среда, характеризуется единством и способностью к саморегуляции. Но в результате разных неблагоприятных воздействий и патологических состояний происходят качественные и количественные изменения нормальной микрофлоры кишечника.
Дисбиоз – это состояние экосистемы, при котором нарушается функционирование ее составных частей и механизмов их взаимодействия, результатом чего является развитие заболевания человека. Дисбиоз характеризует состояние всех групп микроорганизмов, включая бактерии, грибы, вирусы, простейшие, а также гельминты. Дисбактериоз отражает состояние бактериальных форм представителей микрофлоры.
Дисбактериоз кишечника – это чисто бактериологическое понятие, характеризующее нарушения качественного состава бактерий и их количественного соотношения. Необходимо помнить, что дисбактериоз – это не диагноз, а тот неблагоприятный фон или состояние, на основе которого может развернуться целый ряд патологических процессов с четкой нозологической очерченностью. Развитие дисбактериоза кишечника приводит к отягощению течения основного заболевания, ухудшает его прогноз и исход. В ряде случаев дисбактериозы кишечника становятся доминирующими в формировании патологического состояния человека и могут явиться в последующем причиной самостоятельного заболевания человека.
При оценке нарушений микрофлоры кишечника рекомендуется учитывать следующие показатели:
– количественный показатель нарушений анаэробного компонента (отсутствие или снижение бифидобактерий);
– количественный показатель аэробного компонента: увеличение количества условно-патогенных возбудителей (протея, лактозонегативных энтеробактерий, гемолизирующего стафилококка и др. и/или появление и увеличение грибов);
– показатель изменения качества аэробной флоры;
– появление лактозонегативных и гемолизирующих кишечных палочек, патогенного стафилококка и др.;
– соотношение анаэробного и аэробного компонентов микрофлоры. (кишечные палочки, синегнойная палочка и др.).
Врач-педиатр, определяя программу коррекции дисбиоза кишечника, должен поставить перед собой цель:
• устранить избыточное бактериальное обсеменение кишечника;
• восстановить нормальную микрофлору кишечника;
• улучшить кишечное переваривание и всасывание;
• восстановить нарушенную моторику кишечника;
• нормализовать местный иммунитет ЖКТ.
Для коррекции дисбиоза кишечника наиболее физиологичным является применение биотерапии, так как:
• бактерийные препараты обладают выраженной антагонистической активностью в отношении патогенной и условно-патогенной микрофлоры, что способствует восстановлению нормального биоценоза кишечника;
• спектр терапевтической активности биопрепаратов многогранен и наряду с прямым воздействием на микрофлору они стимулируют репаративные процессы в слизистой оболочке кишечника;
• они способствуют повышению иммунологической реактивности и общей неспецифической резистентности организма больного.
В настоящее время для коррекции дисбиоза кишечника применяют пре- и пробиотики. Пребиотики – вещества немикробного происхождения, способные оказывать благоприятный эффект на организм через селективную стимуляцию роста и/или активности представителей нормальной микрофлоры кишечника. Пребиотиками являются: фруктоолигосахариды, галактоолигосахариды, инулин, лактулоза, лактитол. Источники пребиотиков представлены в таблице 1.
В грудном молоке содержатся олигосахариды, которые обладают естественным пребиотическим эффектом. Под воздействием бифидобактерий в кишечнике происходит ферментация пищевых волокон и олигосахаридов, конечными продуктами которой являются молочная кислота, создающая бактерицидную среду в кишечнике, и короткоцепочечные жирные кислоты, являющиеся дополнительным источником энергии и питания для эпителия толстой кишки.
Пробиотики – препараты, состоящие из живых микроорганизмов или продуктов микробного происхождения (табл. 2).
Пробиотики должны быть:
• полезными для организма хозяина;
• безопасными при длительном применении;
• устойчивыми к низким значениям рН, желчным кислотам, антимикробным субстанциям, обладать высокой адгезией к эпителию слизистой;
• обладать высокой скоростью роста.
Пробиотики оказывают существенное влияние на состояние желудочно-кишечного тракта человека, т.к. способствуют синтезу:
• иммуноглобулинов;
• эндогенного интерферона;
• аминокислот;
• витаминов группы В, фолиевой кислоты;
• продукции ферментов.
Наряду с этим пробиотики снижают рост патогенных микроорганизмов, обладают антитоксическим действием, увеличивают сорбцию и выведение тяжелых металлов.
Стимуляция роста нормальной микрофлоры пробиотиками осуществляется в результате роста патогенной микрофлоры, конкуренции с ними за рецепторы адгезии и питательные вещества; активации иммунокомпетентных клеток, стимуляции роста индигенной микрофлоры, стимуляции продукции витаминов и других ростостимулирующих факторов; нормализации рН; нейтрализации токсинов. Многочисленные исследования выявили многообразные аспекты влияния пробиотиков на организм человека (рис. 1)
Для производства препаратов, содержащих пробиотики, применяют cледующие штаммы микроорганизмов:
• лактобактерии (L. acidophilus, L. bulgaricus, L. casei, L. rhamnosus, L. brevis, L. celloblosus, L. fermentum, L. plantаrum);
• бифидобактерии (B. bifidum, B. infantis, B. breve, B. adolescentis, B. longum, B. animals, B. thermophilum);
• грам + кокки (Streptococcus salivarius, Str. Thermophilus, Str. Diacetylactis, Enterococcus faecium, Lactococcus lactis sp. Cremoris);
• дрожжи (Saccharomyces boulardii, S. Cerevisiae).
В настоящее время в России зарегистрировано большое количество пробиотиков, успешно использующихся в педиатрической практике, выбор которых определяется особенностями биоценоза кишечника у конкретных больных.
Коррекция нарушений аэробной микрофлоры может осуществляться направленными фагами (клебсиеллезный, стафилококковый, колипротейный, синегнойный, пиобактериофаг, интестибактериофаг и др.). В настоящее время отношение педиатров и микробиологов к фаготерапии неоднозначно. Тому есть ряд причин: слишком узкая специфичность, быстрое появление фагорезистентных штаммов патогенных бактерий, возможность сенсибилизации организма этим видом чужеродного белка. Кроме того, фаги плохо сорбируются в коллоидной среде, что может снижать их бактерицидность в толстой кишке. С другой стороны, накоплен богатый опыт успешного лечения фагами. Препараты бактериофагов не токсичны, не вызывают побочных реакций и с успехом могут применяться для лечения даже новорожденных детей. Однако следует помнить, что иногда на фоне применения бактериофага может быть ухудшение характера стула, связанное с массивным лизисом бактерий. Иногда могут быть кожные аллергические реакции. В этом случае необходимо отменить бактериофаг на несколько дней, либо уменьшить его дозу. При отсутствии побочных явлений фаг применяют в неразведенном виде.
Курс лечения фагами обычно составляет 7-10 дней, иногда требуется проведение 2 курсов с интервалом 3 дня. При ассоциативном дисбактериозе кишечника, обусловленном синегнойной палочкой, протеем и стафилококком, целесообразно сначала провести лечение соответствующим поливалентным фагом, действие которого специфично в отношении отдельных видов микроорганизмов, а затем назначать биологические препараты.
В последние годы показана целесоообразность коррекции нарушений местного иммунитета кишечника. У детей с дисбиозом кишечника используются иммуномодулирующие препараты (виферон, КИП, кипферон, бифилиз и другие).
Виферон – комплексный препарат, в состав которого входят человеческий рекомбинантный интерферон альфа-2b и мембрано-стабилизирующие компоненты (витамины Е и С). Препарат выпускается в двух лекарственных формах: мазь и ректальные суппозитории.
Виферон является эффективным средством для коррекции дисбиоза кишечника у детей. Применяется Виферон ректально, дважды в день, курс лечения составляет 10 дней. Проведенные нами контролируемые клинические и микробиологические исследования свидетельствуют о том, что на фоне лечения Вифероном в 3 раза снижается число детей с низким уровнем лактобактерий в фекалиях, в 3 раза сокращается число детей с высевом клебсиеллы, золотистого стафилококка, кишечной палочки с гемолизирующей активностью. Применение Виферона сопровождается уменьшением высева грибов рода кандида. С целью коррекции дисбиоза кишечника применяется Виферон-1, содержащий 150 тыс. ME ИФН в одной свече, и Виферон-2, содержащий 500 тыс. ME ИФН в одной свече.
КИП – комплексный иммуноглобулиновый препарат, содержит специфические антитела против герпес-вирусов, ротавирусов, хламидий, стафилококков, повышенные концентрации антител к энтеробактериям (шигеллы, сальмонеллы, эшерихии) и других патогенных микроорганизмов. Препарат обладает иммуномодулирующим действием. КИП выпускается в ампулах и флаконах (лиофилизированный КИП) для перорального и в виде свечей для ректального применения. Назначается по 200-400 мг сутки, курс лечения обычно составляет 5 дней.
Кипферон – содержит комплексный иммуноглобулиновый препарат – КИП (Ig А, М, G) и ИФН –a2. Иммуноглобулины выделены из крови человека, проверены на наличие антител к вирусу иммунодефицита 1 и 2 типа, вирусам гепатита В и С. Интерферон a2 – белок, синтезированный штаммом Pseudomonas putida или E. coli, в генетический аппарат которых встроен ген человеческого лейкоцитарного a2-ИФН. Применяются суппозитории ректально, преимущественно после акта дефекации. Разовая доза 50 тыс. МЕ/кг массы тела в 2 приема через 12 часов, но не более 1 млн. МЕ в сутки. Длительность курса 5-7 дней.
Бифилиз – препарат, состоящий из бифидумбактерина и лизоцима (фермента белковой природы). Благодаря наличию лизоцима препарат подавляет рост грамположительных микробов. Наряду с антибактериальными свойствами препарат обладает способностью стимулировать неспецифическую реактивность организма, оказывать противовоспалительное действие. Препарат обычно хорошо переносится. Курс лечения составляет от 1 до 3 недель.
Существенную роль в коррекции дисбиоза кишечника играет энтеросорбция. Применение энтеросорбентов хорошо переносится больными и не дает осложнений. Основными требованиями к энтеросорбентам являются:
• отсутствие токсичности;
• высокая сорбционная емкость по отношению к удаляемым компонентам химуса;
• минимизация потерь полезных микронутриентов;
• отсутствие влияния на процессы секреции и микробиоценоз кишечника.
Для коррекции дисбиоза кишечника у детей широко используются смекта, энтеросгель, лактофильтрум, фильтрум, и другие препараты. Однако их применение требует контроля за регулярностью опорожнения кишечника.
Таким образом, проблема коррекции дисбиоза кишечника у детей еще далека от своего окончательного решения. Учитывая важную роль, которую нормальная микрофлора играет в процессах пищеварения, иммуногенезе, нарушения микробиоценоза кишечника не должны оставаться без внимания. Поскольку дисбактериоз кишечника не является самостоятельным заболеванием, необходимо вовремя выявлять причины его возникновения и, по возможности, устранить их. Следует отметить, что препараты для коррекции выявленных нарушений биоценоза кишечника необходимо назначать индивидуально в каждом конкретном случае. Дифференцированный выбор препаратов будет способствовать нормализации кишечного микробиоценоза, коррекции функциональных расстройств желудочно-кишечного тракта и улучшению здоровья ребенка в целом.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Источник