Лабораторная диагностика острых кишечных заболеваний

, – ( , , – ), , – . 5 ( , 2 . ). «» : , , , (). , , . , . , , « ». , , . () (80-85%), 5¬-10%. , . , , ( ) (), . , , [1, 4]. , , 2010 , , , [5]. , , , . , , . , . , – , , , – . , , . , . , . , , . , , : , , .. , , , 650 [19]. , , , , , 5¬¬-7 , [24]. , -, , , . . , , , . , . , . () . , . , , , . , , , . « » , . . , . – ( , , 15 ), , . , , . . 1. -. 1 – , ; 2 – ; 3,4 – ( ); 5 – ; 6 – ; 7 – ; 8 – ; 9 – ; 10 – : ; 11 – : . – ( R-Biopharm () . 1. , . -, – , . «-» , ( ) , . , , . , , , , , . -, , , , , (. 2). . 2. – RIDA Quick Verotoxin / 157 Combi : – -, – -. 1 – . 2 – . 3 – ; – (); , (T2); , O157 (T1). 4 – ( ). . 40% , [27, 28]. , 5 ( , ), , 1 65 , 1 293 . , , , 500-600 [22, 27]. 20 , , , , . . , – , , . – -. ( ), , , . , ( ), . . . . ( NSP4) . , , , , . , , . : -. , , RIDA QUICK Rotavirus/Adenovirus (R-Biopharm) 75% ( ) , [32]. – , . – – F ( 40/41), . 4-15% . , , , . – ( – ). – RIDA QUICK Rotavirus/Adenovirus [32]. ( – , , ) – , [8], [2, 6]. , 80-90% [10, 13]. , , . , , . , , . : , , , , – , , .. ; . , , – . , . , , . , , , . , , -, -, [12, 21]. RIDASCREEN Norovirus (R-Biopharm) , , GI GII. 100%, 80%. , 2-3 , , , [11]. – RIDA QUICK Norovirus (R-Biopharm) – , , – . , , 20 . , 10% 15% 7 [23, 25]. – , (28-32 ) , . . . . , , . , , , . , Campylobacter, C.jejuni C.coli, . , . , – , . , . , , 5 14% . 7 . . – « ». ( – , , ) 39-40° , . – . . Campylobacter fetus : , , , -. , « ». . ; , . . – , . . , – RIDASCREEN Campylobacter (R-Biopharm), 100% (14 14) , – 99,6% (244 245). , , . Escherichia coli E.coli, – , – () , . , E.coli O157:H7. , , E.coli, 1983 ., 70 000 , 2 000 . , . () , 5-10% – () – , . , . O157:H7 , . – (, , , ) . , . ( ) , . , Acanthamoeba polyphaga. ( 50 ). , pH, . O157 , , ( D- β-). , , , , – . , ( ). , , , mTSB-, . . – RIDASCREEN Verotoxin (R-Biopharm) (96%) (99%) [9]. , . [3]. – RIDA QUICK Verotoxin/O157 Combi (R-Biopharm) O157, I II , . O157 , , [20, 26]. , , , [7, 29]. Clostridium difficile Clostridium difficile – , , . C.difficile – , , PaLoc, A () B (). , . , C.difficile, . , , . , . C.difficile – . – . – – . 5 . , C.difficile, . , (), NAP1/BI/027, [18]. C.difficile , – . « » , , A B, . – , , . , , 48 . -, A B , 2-3 . 90%, 100% [30]. : . Giardia lamblia – , 200 , . . . . ( 200 000 ), . , . , – . . . 6 , [15]. Cryptosporidium – , . 8 , C.hominis C.parvum. 3% 6% – . ( 7% 12%). (). , , . , . – . , , , .. [16, 17]. – . , 2 . , , , . , , . (, , ), . Entamoeba histolytica E.histolytica Entamoeba, ; E.dispar E.moshkovskii . E.histolytica , 1-4% . , , (70-90% ) . , 40 000 100 000 [14, 33]. , – . 10-20% . , , , (, « »). , . , . [31]. , , . , . , , , . , 60-80% () 35-50% (); 3 , 10 , 90-95%. – , . , . , , – RIDASCREEN () RIDA Quick (-), . (/) (//), . . «» ” ” ( ) . 1. .., .., .. . , // . 2008. .6. .61-64. 2. .., .., .. . . 2007 . // , 2008. 7. .81-83. 3. .., .. , Escherichia coli O157 // . 2009. 11. .23-25. 4. . ., . ., . . // . 2005, 9, . 54. 5. 2010 . , 7 13.05.2010 . 6. .., . ., .., .. // . 2009, 4, . 60-64. 7. Alpers K., Werber D., Frank C. et al. Sorbitol-fermenting enterohaemorrhagic Escherichia coli O157:H- causes another outbreak of haemolytic uraemic syndrome in children // Epidemiol Infect. 2009. Vol.137. P.389-395. 8. Atmar R.L., Estes M.K. The epidemiologic and clinical importance of norovirus infection // Gastroenterol Clin North Am. 2006. Vol.35. P.275-290. 9. Beutin L., Steinrück H., Krause G, et al. Comparative evaluation of the Ridascreen Verotoxin enzyme immunoassay for detection of Shiga-toxin producing strains of Escherichia coli (STEC) from food and other sources // J Appl Microbiol. 2007. Vol.102. P.630-639. 10. Blanton L.H., Adams S.M., Beard R.S. et al. Molecular and epidemiologic trends of caliciviruses associated with outbreaks of acute gastroenteritis in the United es, 2000-2004 // J Infect Dis. 2006. Vol.193. P.413-421. 11. Castriciano S., Luinstra K., Petrich A. et al. Comparison of the RIDASCREEN norovirus enzyme immunoassay to IDEIA NLV GI/GII by testing stools also assayed by RT-PCR and electron microscopy // J Virol Methods. 2007. Vol.141. P.216-219. 12. Duizer E., Pielaat A., Vennema H. et al. Probabilities in norovirus outbreak diagnosis // J Clin Virol. 2007, Vol.40. P.38-42. 13. Fankhauser R.L., Noel J.S., Monroe S.S. et al. Molecular epidemiology of “Norwalk-like viruses” in outbreaks of gastroenteritis in the United es // J Infect Dis. 1998. Vol.178. P.1571-1578. 14. Fotedar R., Stark D., Beebe N. et al. Laboratory diagnostic techniques for Entamoeba species // Clin Microbiol Rev. 2007. Vol.20. P.511-532. 15. Fraser D., Bilenko N., Deckelbaum R.J. et al. Giardia lamblia carriage in Israeli Bedouin infants: risk factors and consequences // Clin Infect Dis. 2000. Vol.30. P.419-424. 16. Garvey P., McKeown1 P. Epidemiology of human cryptosporidiosis in Ireland , 2004-2006: analysis of national notification data // Eurosurveillance. 2009. Vol .14. P.1-5. 17. Gradus M.S. Cryptosporidium and public health: from watershed to water glass // Clin Microbiol Newsletter. 2000. Vol.22. P.25-32. 18. Hookman P., Barkin J.S. Clostridium difficile associated infection, diarrhea and colitis // World J Gastroenterol. 2009. Vol.15. P.1554-1580. 19. Johnston C.P, Qiu H, Ticehurst J.R. et al. Outbreak management and implications of a nosocomial norovirus outbreak // Clin Infec Dis. 2007. Vol.45. P.534-540. 20. Karch H, Bielaszewska M. Sorbitol-fermenting Shiga toxin-producing Escherichia coli O157:H(-) strains: epidemiology, phenotypic and molecular characteristics, and microbiological diagnosis // J Clin Microbiol. 2001. Vol.39. P.2043-2049. 21. Khamrin P., Nguyen T.A., Phan T.G. et al. Evaluation of immunochromatography and commercial enzyme-ed immunosorbent assay for rapid detection of norovirus antigen in s samples // J Virol Methods. 2008. Vol.147. P.360-363. 22. Kim S.Y., Sweet S., Slichter D. et al. Health and economic impact of rotavirus vaccination in GAVI-eligible countries // BMC Public Health. 2010. Vol.10. P.253-257. 23. Klein E.J., Boster D.R., Stapp J.R. et al. Diarrhea etiology in a children’s hospital emergency department: a prospective cohort study // Clin Infect Dis. 2006. Vol.43. P.807-813. 24. Lopman B.A., Reacher M.H., Vipond I.B. et al. Epidemiology and cost of nosocomial gastroenteritis, Avon, England, 2002-2003 // Emerg Infec Dis. 2004. Vol.10. P.1827-1834. 25. Lyman W.H., Walsh J.F., Kotch J.B. et al. Prospective study of etiologic agents of acute gastroenteritis outbreaks in child care centers // J Pediatr. 2009. Vol.154. P.253-257. 26. Orth D., Grif K., Zimmerhackl L.B. et al. Sorbitol-fermenting Shiga toxin-producing Escherichia coli O157 in Austria // Wien Klin Wochenschr. 2009. Vol.121. P.108-112. 27. Parashar U.D., Gibson C.J., Bresse J.S., Glass R.I. Rotavirus and severe childhood diarrhea // Emerg Infect Dis. 2006. Vol.12. P.304-306. 28. Parashar U.D., Hummelman E.G., Bresee J.S. et al. Global illness and deaths caused by rotavirus disease in children // Emerg Infect Dis. 2003. Vol.9. P.565-572. 29. Rosser T., Dransfield T., Allison L. et al. Pathogenic potential of emergent sorbitol-fermenting Escherichia coli O157:NM // Infect Immun. 2008. Vol.76. P.5598-5607. 30. Rüssmann H., Panthel K., Bader R.C. et al. Evaluation of three rapid assays for detection of Clostridium difficile toxin A and toxin B in s specimens // Eur J Clin Microbiol Infect Dis. 2007. Vol.26/ P.115-119. 31. Salles J.M., Moraes L.A., Salles M.C. Hepatic amebiasis // Braz J Infect Dis. 2003. Vol.7. P.96-110. 32. Weitzel T., Reither K., Mockenhaupt F.P. et al. Field evaluation of a rota- and adenovirus immunochromatographic assay using s samples from children with acute diarrhea in Ghana // J Clin Microbiol. 2007. Vol.45. P.2695-2697. 33. WHO. Entamoeba taxonomy // Bull World Health Organ. 1997. Vol.75. P.291-294. |
Источник
[09-134] Острые кишечные инфекции, скрининг (Shigella spp., E. coli (EIEC), Salmonella spp., Campylobacter spp., Adenovirus F, Rotavirus A, Norovirus 2 генотип, Astrovirus)
2175 руб.
Комплексное молекулярно-генетическое исследование, которое позволяет выявить генетический материал наиболее вероятных возбудителей острых кишечных инфекций в кале и установить этиологию заболевания.
Синонимы русские
ОКИ, ПЦР (кал).
Синонимы английские
Acute intestinal infection screening; Bacterial and viral diarrhea screening, PCR, fecal samples.
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Кал.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.) и на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
Общая информация об исследовании
Острые кишечные инфекции (ОКИ) – группа заболеваний, обусловленных вирусами, бактериями или паразитами, для которых характерен фекально-оральный механизм передачи. Общими для данных инфекций являются факторы передачи: пищевые продукты, вода, инфицированные бытовые предметы и грязные руки. Первые симптомы возникают через несколько часов или дней после инфицирования, начало резкое, с появлением частого жидкого стула, рвоты, боли в животе, признаков интоксикации (лихорадки, озноба, тошноты). Заболевание может носить групповой характер и проявиться у нескольких человек, употреблявших инфицированную пищу или воду.
Согласно официальной статистике, в России до 65-67% заболеваний этой группы составляют ОКИ неуточненной этиологии. Если возбудитель инфекции неизвестен, эффективность противоэпидемических мероприятий ограничивается. Соотношение частоты выявления вирусных и бактериальных патогенов варьируется в разных возрастах: у детей до 3 лет на долю вирусных агентов приходится 80-90% заболеваний, на долю бактериальных – 10-20%; среди взрослых пациентов доля вирусных возбудителей снижается до 30%.
Shigella species и Esherichia coli – грамотрицательные палочковидные микроорганизмы из семейства энтеробактерий. К роду Shigella относятся патогенные бактерии S. dysenteriae, S. flexneri, S. boydii и S. sonnei, которые являются возбудителями шигеллеза (бактериальной дизентерии). Энтероинвазивные E. coli (EIEC) очень близки с шигеллами, синтезируют и выделяют шигеллоподобный токсин, способны проникать в клетки слизистой кишечника и разрушать энтероциты, что приводит к образованию язвенных дефектов в слизистой кишечника. За значительную часть случаев “бактериологически неподтвержденной дизентерии”, особенно у детей, ответственен энтероинвазивный эшерихиоз.
Бактерии рода Salmonella относятся к семейству энтеробактерий. S. typhi и S. parathyphi являются возбудителями брюшного тифа и паратифа. Существует множество серовариантов Salmonella species, способных вызвать у человека инфекцию по типу гастроэнтероколита, а также стать причиной внутрибольничных инфекций. Сальмонеллез может протекать в форме острой кишечной инфекции, тяжелой генерализированной инфекции или бессимптомного носительства. Окончательный диагноз ставится только после выделения возбудителя или обнаружения его ДНК.
Кампилобактерии являются одними из наиболее сложных для культивирования (которое требуется в ходе анализа) микроорганизмов. Это объясняется их микроаэрофильностью и возможностью подавления их роста сопутствующей флорой. Род кампилобактерий объединяет как возбудителей ОКИ (термофильные виды), так и сапрофитные и условно-патогенные виды, о чем необходимо помнить при выявлении этих микроорганизмов в клиническом материале. Применение наборов на основе ПЦР для определения термофильной группы кампилобактерий позволяет не только избежать трудоемкой и высокозатратной бактериологической работы, но и четко ограничить детекцию тех видов кампилобактерий, которые имеют этиологическую связь с острой кишечной инфекцией (С. jejuni, C. coli, C. lari, C. upsaliensis).
В соответствии с данными зарубежной литературы, норовирус – наиболее частый возбудитель вспышек ОКИ небактериальной этиологии. Эта особенность связана с низкой инфицирующей дозой и высокой устойчивостью в окружающей среде. ПЦР является “золотым стандартом” в клинической диагностике норовирусных инфекций.
Несмотря на несколько меньшую в сравнении с рота- и норовирусами распространенность, астровирусы составляют значительный пласт кишечных инфекций, у трети пациентов протекающий с явлениями колита. Ротавирусы группы А являются наиболее частой причиной спорадических заболеваний ОКИ у детей, а ДНКсодержащий аденовирус F (серотипы 40 и 41) нередко вызывает вспышки гастроэнтеритов у детей младшего возраста.
Для выявления и дифференциальной диагностики кишечных инфекций используются культуральные и молекулярно-генетические методы исследования генетического материала возбудителя в кале и определение концентрации специфических иммуноглобулинов в крови. ПЦР обладает преимуществом перед культуральными методами благодаря быстрому получению результатов, высокой специфичности и чувствительности исследования. Данный анализ позволяет со 100-процентной точностью определить возбудителя кишечного заболевания, а быстрая диагностика острых кишечных инфекций помогает избежать лишних процедур и оперативных вмешательств, своевременно начать лечение и ограничить очаг распространения инфекции.
Для чего используется исследование?
- Для установления этиологического фактора острой кишечной инфекции;
- для дифференциальной диагностики причин острого гастроэнтероколита (воспаления ЖКТ).
Когда назначается исследование?
- При симптомах острого гастроэнтерита, вероятно, инфекционной этиологии (жидкий частый стул, рвота, лихорадка, боли в животе);
- при одновременном или последовательном развитии ОКИ у нескольких членов семьи, у детей в детском учреждении или пациентов в стационаре;
- при подозрении на развитие внутрибольничной кишечной инфекции (при обострении симптомов энтероколита у пациента, находящегося на лечении по поводу ОКИ).
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
- присутствие ДНК или РНК возбудителя ОКИ; этиология в зависимости от выявленного вида возбудителя (Shigella spp., E. coli (EIEC), Salmonella spp., Campylobacter spp., Adenovirus F, Rotavirus A, Norovirus (2-й генотип), Astrovirus).
Причины отрицательного результата:
- отсутствие инфицирования Shigella spp., E. coli (EIEC), Salmonella spp., Campylobacter spp., Adenovirus F, Rotavirus A, Norovirus (2-й генотип), Astrovirus.
Важные замечания
- Рекомендуется проводить исследование в первые 3 суток с начала заболевания, у госпитализированных пациентов – в первый день госпитализации.
- Важно помнить, что острый энтероколит может быть обусловлен и другими инфекциями (например, амебами, лямблиями, иерсиниями, клостридиями, протеями и др.) или неинфекционными причинами (токсинами, ядовитыми веществами, острой непроходимостью кишечника, тромбозом сосудов брыжейки, воспалительными заболеваниями кишечника, острым панкреатитом, аппендицитом, целиакией, острым гепатитом, мальабсорбцией, дивертикулитом).
Также рекомендуется
- Yersinia pseudotuberculosis, ДНК [ПЦР]
- anti-Shigella flexneri 1-5, anti-Shigella flexneri 6, anti-Shigella sonnei
- Посев кала на патогенную флору (диз. группа и тифо-паратифозная группа)
- Посев кала на условно-патогенную флору с определением чувствительности к антибиотикам
- Анализ кала на цисты простейших
- Копрограмма
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Лейкоцитарная формула
- Скорость оседания эритроцитов (СОЭ)
Кто назначает исследование?
Инфекционист, гастроэнтеролог, терапевт, педиатр.
Литература
- Борисов Л. Б. Медицинская микробиология, вирусология, иммунология. М.: МИА, 2005. – 736 с.
- Gómez-Duarte O., Bai J., Newel E. Detection of E. coli, Salmonella spp., Shigella spp., Yersinia enterocolitica, Vibrio cholerae, and Campylobacter spp. enteropathogens by Three-reaction Multiplex PCR. Diagn Microbiol Infect Dis. 2009 January; 63(1): 1-9. PMCID: PMC2701628.
Источник
Роза Исмаиловна Ягудина, д. фарм. н., проф., зав. кафедрой организации лекарственного обеспечения и фармакоэкономики и зав. лабораторией фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
Евгения Евгеньевна Аринина, к. м. н., ведущий научный сотрудник лаборатории фармакоэкономических исследований Первого МГМУ им. И. М. Сеченова.
С наступившим летом тема нашей статьи приобрела особую актуальность. Кишечные инфекции – это целая группа инфекционных заболеваний, поражающих в основном желудочно-кишечный тракт. Острые кишечные инфекции по своей распространенности уступают только острым респираторным заболеваниям. Пик заболеваемости обычно приходится на лето, но и в холодное время года часто встречаются кишечные инфекции, вызываемые преимущественно вирусами. Однако наиболее частая причина возникновения этих заболеваний – попадание возбудителей инфекции с загрязненными продуктами и водой в желудочно-кишечный тракт.
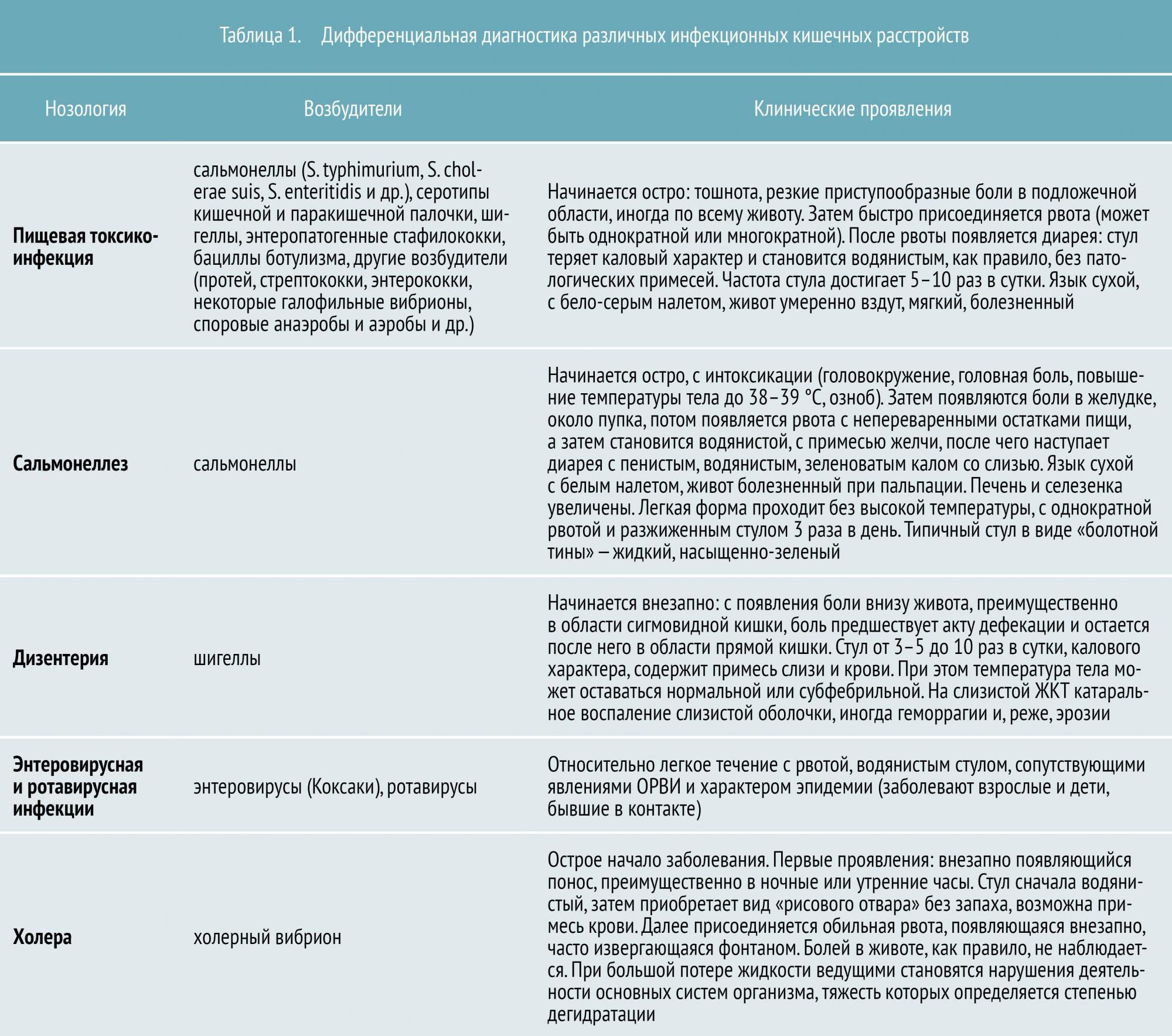
Всего в настоящее время известно около 30 инфекционных кишечных заболеваний. К наиболее распространенным относятся:
- пищевая токсикоинфекция (в основном стафилококковой этиологии)
- сальмонеллез
- дизентерия
- энтеровирусная и ротавирусная инфекция
- холера
По степени опасности их можно условно разделить на неопасные, опасные и особо опасные. Так, к неопасным относят пищевую токсикоинфекцию (ПТИ), а к особо опасным – холеру, брюшной тиф и т. д. Но это не значит, что так называемая «неопасная» ПТИ не наносит серьезного ущерба организму и не приводит к осложнениям.
Осложнения кишечных инфекций:
- бактериальные инфекции органов дыхания и среднего уха
- дисбактериоз кишечника
- кишечное кровотечение
- перфорация стенки кишки
- инвагинация кишечника
- бактериально-токсический шок
Возбудители кишечной инфекции
Помимо инфекционных агентов из естественной среды источником заражения может стать уже заболевший человек. Выделяя большое количество патогенных микроорганизмов (микробы выделяются с испражнениями, рвотными массами, иногда с мочой), больной заражает предметы, находящиеся вокруг, и, если не соблюдать меры предосторожности, может возникнуть цепная реакция в распространении инфекции.
Практически все возбудители кишечных инфекций чрезвычайно живучи. Они способы подолгу существовать в почве, воде и на различных предметах (ложках, тарелках, дверных ручках и мебели). Инфекционные микроорганизмы во внешней среде не только не погибают, но и сохраняют способность к размножению, а размножаются они наиболее активно в теплых и влажных условиях. Однако самая благоприятная среда для развития бактерий – это кисломолочные и мясные продукты.
Установлена связь отдельных форм острых кишечных инфекций с видами пищи. Так, дизентерия чаще возникает при употреблении молока и молочных продуктов, а кишечные инфекции, вызванные стафилококком, – при употреблении молочных продуктов и кондитерских изделий с кремом. Иерсиниозы обычно развиваются при употреблении сырых овощей, салатов и другой растительной пищи.
Возбудителями кишечных инфекций могут быть как бактерии (сальмонеллы, шигеллы, иерсинии, энтеропатогенные кишечные палочки, стафилококки), так и их токсины (пищевые токсикоинфекции). Вирусы (ротавирусы, энтеровирусы, астровирусы, парвовирусы) пока на втором месте по частоте встречаемости, однако в последнее время вирусные инфекции получают всё более широкое распространение. И на последнем месте – простейшие (лямблии, амебы, бластоцисты).
После попадания патогенов в организм человека, как правило, проходит бессимптомный инкубационный период, который продолжается от 6 до 48 часов – от попадания микроорганизмов в ротовую полость до момента поступления их в кишечник, где происходит их бурное размножение. После того как патогенные микроорганизмы размножились, начинается стадия клинических проявлений.
N. B.! При появлении симптомов, напоминающих острую кишечную инфекцию, необходимо срочно обратиться к инфекционисту для правильного подбора терапии и профилактики осложнений.
Наступает острый период – от 1 до 14 дней, в это время клинические проявления со стороны ЖКТ выражены максимально. Как правило, период заканчивается, когда нормализуется температура и прекращается ведущий симптом (понос или рвота).
Период реконвалесценции – не менее 2 недель, а в некоторых случаях при отсутствии лечения до нескольких лет. В этот период функция желудочно-кишечного тракта, как правило, восстанавливается не полностью – может быть неустойчивый стул.
В основном все кишечные инфекции протекают с достаточно похожими симптомами. Они всегда начинаются внезапно. В самом начале заболевания появляется резкая слабость, вялость, снижение аппетита, головная боль, повышение температуры – неспецифические симптомы, которые могут напоминать симптомы респираторных вирусных инфекций. Однако вскоре возникают тошнота, рвота, схваткообразные боли в животе, понос с примесью слизи, гноя или крови (например, при дизентерии), также могут беспокоить жажда и озноб. Среди клинических проявлений со стороны желудочно-кишечного тракта, как правило, сильнее всего выражены симптомы, связанные с пораженным органом:
- тошнота, рвота и боли в эпигастральной области (при гастрите);
- понос (при энтерите);
- рвота и понос (при гастроэнтерите);
- кровь в стуле и его нарушения (при колите);
- поражения всего кишечника (при энтероколите).
Одно из самых неблагоприятных последствий кишечной инфекции – это дегидратация организма из‑за рвоты и/или поноса и, как следствие, нарушение водно-электролитного обмена. Результатом резкой дегидратации может стать даже шок.
Однако иногда кишечные инфекции могут не иметь видимых симптомов, но сопровождаются выделением возбудителей. В плане распространения инфекции такое носительство наиболее опасно: ничего не подозревающий человек становится постоянным источником инфекции, заражая окружающих.
Врачу важно провести дифференциальную диагностику между кишечной инфекцией и соматическими заболеваниями со сходными симптомами: диареей, связанной с приемом лекарственных препаратов, острым аппендицитом, инфарктом миокарда, пневмонией, внематочной беременностью и т. д.
Диагностика и лечение кишечной инфекции
Существуют различные взаимодополняющие методы лабораторной диагностики кишечных инфекций:
- Выделение из крови возбудителя и его антигенов (токсинов)
- Бактериологическое исследование: выделение и типирование возбудителя в посевах кала, других биологических секретов и экскретов организма больного
- Вирусологическое исследование: выделение вируса из кала в посевах на культуре клеток или при электронной микроскопии
- Микроскопическое исследование: обнаружение паразитов в мазках нативного кала после обработки специальными красителями
- Выявление сывороточных антител к антигенам возбудителя и роста их титра: серологическое обследование с использованием специальных диагностикумов в реакциях (РПГА, РИГА, ИФА и т. п.); прирост титра в 4 раза.
Основные принципы терапии кишечных инфекций:
- борьба с возбудителем (антибактериальная терапия);
- борьба с обезвоживанием (как правило, для устранения недостатка жидкости пациентам назначают солевые растворы);
- устранение диареи (энтеросорбенты);
- соблюдение щадящей диеты (исключение свежих овощей и фруктов, молочных продуктов, сладкого).
Во время болезни необходимо соблюдать диету, помогающую замедлить перистальтику кишечника. Рекомендуются продукты с высоким содержанием танина (черника, черемуха, крепкий чай); вещества вязкой консистенции (слизистые супы, протертые каши, кисели); сухари; индифферентные вещества – паровые блюда из нежирного мяса и рыбы. Важный этап в лечении кишечных инфекций – исключение из рациона жареных и жирных блюд, сырых овощей и фруктов.
Главное направление лечебной тактики – нейтрализация экзотоксинов в кишечнике (энтеросорбенты) и регидратация – компенсация патологических потерь жидкости и электролитов специально разработанными глюкозо-солевыми растворами. Объем вводимых растворов зависит от степени обезвоживания и массы тела больного, а скорость введения составляет 1-1,5 л/ч. Дезинтоксикационная и регидратационная терапия в 85-95 % случаев может осуществляться перорально.
Антибиотики может назначить только инфекционист с учетом проведенных лабораторных тестов и выявленного возбудителя инфекции. Однако при выраженной диарее для ускоренной санации обоснованным является назначение антибактериальных ЛС, которые не всасываются или плохо всасываются из кишечника и обладают широким спектром действия (например, энтерофурил или ко-тримоксазол). Эффективными средствами альтернативной этиотропной терапии, в качестве препаратов от острой кишечной инфекции, являются энтеросорбенты и пробиотики. Этиотропное действие пробиотиков связано с выраженной антагонистической активностью в отношении всех возбудителей острых кишечных инфекций (ОКИ) бактериальной этиологии и опосредованным иммуномодулирующим действием на местное звено иммунитета.
Обзор лекарств для лечения кишечных инфекций
Нифуроксазид (энтерофурил)
Безрецептурное противомикробное средство широкого спектра действия, производное 5‑нитрофурана. Антимикробная активность нифуроксазида вызвана наличием в его составе NO2‑группы, которая угнетает активность дегидрогеназы и нарушает синтез белков в патогенных бактериях.
Нифуроксазид не оказывает действия на сапрофитную флору, не нарушает равновесия нормальной кишечной флоры. При острой бактериальной диарее восстанавливает эубиоз кишечника. При инфицировании энтеротропными вирусами препятствует развитию бактериальной суперинфекции. Этот препарат для лечения кишечной инфекции можно назначать беременным и кормящим женщинам, детям начиная с одного месяца. Терапия нифуроксазидом не должна превышать 7 дней, при этом запрещено употреблять алкоголь.
Кипферон
Безрецептурный препарат в форме вагинальных и ректальных суппозиториев. Обладает иммуномодулирующим, противовирусным, антихламидийным действием. Кипферон – комплексная лекарственная форма, содержащая человеческий рекомбинантный интерферон-α2 и комплексный иммуноглобулиновый препарат (КИП). Разрешен к применению у детей на первом году жизни.
Ко-тримоксазол (сульфаметоксазол + триметоприм)
Механизм действия ко-тримоксазола обусловлен двойным блокированием метаболизма микроорганизмов. Триметоприм обратимо ингибирует дигидрофолатредуктазу микроорганизмов, нарушает образование из дигидрофолиевой кислоты тетрагидрофолиевой, продукцию нуклеиновых кислот, пиримидиновых и пуриновых оснований; подавляет размножение и рост бактерий. Сульфаметоксазол, который по строению схож с парааминобензойной кислотой, захватывается бактерией и препятствует включению парааминобензойной кислоты в дигидрофолиевую кислоту. В связи с тем что ко-тримоксазол угнетает жизнедеятельность кишечной палочки, снижается образование в кишечнике никотиновой кислоты, рибофлавина, тиамина и прочих витаминов B-комплекса. Это лекарство, помогающее от кишечной инфекции, отпускается по рецепту, применяется с 2‑месячного возраста.
Бактисубтил – споры бактерий Bacillus cereus IP. Рецептурный препарат от кишечной инфекции бактисубтил сохраняет и корригирует физиологическое равновесие кишечной флоры. Споры бактерий, содержащиеся в препарате, устойчивы к действию желудочного сока. Прорастание бактерий в вегетативные формы происходит в кишечнике, затем они высвобождают энзимы, которые расщепляют углеводы, жиры, белки. В результате образуется кислая среда, предотвращающая процессы гниения. Препарат препятствует нарушению синтеза витаминов группы В и Р в кишечнике, его нельзя запивать горячим, а также сочетать с алкоголем. Детям его назначают с семилетнего возраста. Бактисубтил резистентен к действию различных антибиотиков и сульфаниламидных препаратов, поэтому может быть назначен одновременно с ними.
Декстроза + калия хлорид + натрия хлорид + натрия цитрат (регидрон)
Регидратирующее средство для перорального приема восстанавливает водно-электролитное равновесие, нарушенное при обезвоживании организма; корректирует ацидоз. Содержимое одного пакетика растворяют в литре свежепрокипяченной охлажденной питьевой воды. Приготовленный раствор нужно хранить в холодильнике и использовать в течение 24 часов. В раствор нельзя добавлять никакие другие компоненты, чтобы не нарушить действие препарата. Отпускается без рецепта.
Смектит диоктаэдрический
Безрецептурное лекарственное средство природного происхождения, обладающее протективным действием в отношении слизистой оболочки кишечника и выраженными адсорбирующими свойствами. Являясь стабилизатором слизистого барьера, образует поливалентные связи с гликопротеинами слизи и увеличивает продолжительность ее жизни, образуя физический барьер, который защищает слизистую оболочку пищеварительного тракта от отрицательного действия ионов Н+, соляной кислоты, желчных солей, микроорганизмов, их токсинов и других раздражителей. Обладает селективными сорбционными свойствами, защищает слизистую оболочку пищеварительного тракта от отрицательного воздействия. В терапевтических дозах не влияет на моторику кишечника.
Профилактика кишечных инфекций, в том числе и острых
Для профилактики кишечных инфекций важно регулярно мыть руки и проводить влажную уборку в квартире. Лучше сразу же выкидывать продукты с истекшим сроком годности, не покупать их в местах с непонятными условиями хранения – как бы ни были привлекательны, скажем, грибочки у бабушки возле метро – а фрукты и овощи есть только тщательно вымытыми.
Избежать распространения болезни поможет ранняя диагностика и изоляция больного с кишечной инфекцией. В очаге инфекции нужно обработать поверхности дезинфицирующими растворами, прокипятить посуду. Выписку пациентов проводят только после отрицательного результата контрольного обследования кала. Всем, кто перенес кишечную инфекцию, в течение месяца необходимо регулярно проходить диспансерное наблюдение в поликлинике.
Простые меры профилактики кишечных инфекций:
- пить воду и молоко только в кипяченом виде
- мыть овощи и фрукты горячей водой с мылом
- соблюдать правила и сроки хранения пищевых продуктов
- мыть руки перед едой
Источник