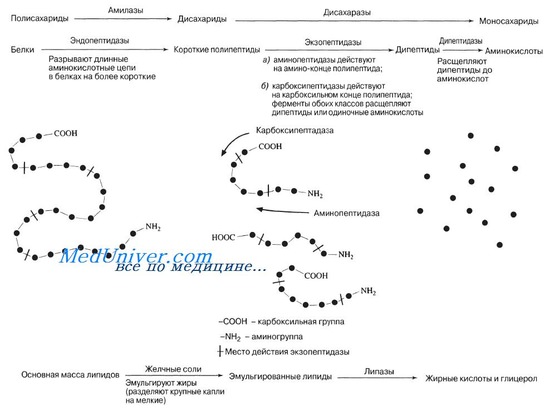
Механизм переваривания белков в желудочно кишечном тракте
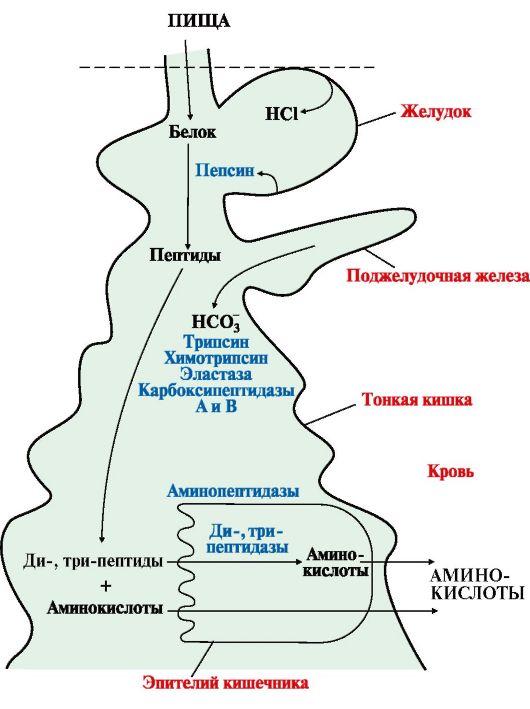
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0–4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5–8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Данный текст является ознакомительным фрагментом.
Похожие главы из других книг:
Изменения белков[43]
Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет
Глава 2. Строение и функции белков
Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Уровни структурной организации белков
Первичная структура – строго определенная линейная последовательность аминокислот в полипептидной цепочке.Стратегические принципы изучения первичной структуры белка претерпевали значительные изменения по мере развития и
Функционирование белков
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
Посттрансляционные изменения белков
Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили
Переваривание углеводов
В слюне содержится фермент ?-амилаза, расщепляющая ?-1,4-гликозидные связи внутри молекул полисахаридов.Переваривание основной массы углеводов происходит в двенадцатиперстной кишке под действием ферментов панкреатического сока – ?-амилазы,
Глава 19. Липиды тканей, переваривание и транспорт липидов
Липиды – неоднородная в химическом отношении группа веществ биологического происхождения, общим свойством которых является гидрофобность и способность растворяться в неполярных органических растворителях.
Липиды пищи, их переваривание и всасывание.
Взрослому человеку требуется от 70 до 145 г липидов в сутки в зависимости от трудовой деятельности, пола, возраста и климатических условий. При рациональном питании жиры должны обеспечивать не более 30% от общей калорийности
Расщепление белков в тканях
Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
Нуклеиновые кислоты поступают в организм с пищей главным образом в составе нуклеопротеинов и высвобождаются в результате действия протеолитических ферментов желудочно-кишечного тракта. Далее под
Характеристика белков сыворотки крови
Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью.
Глава 4. Нарушения нормальных функций желудочно-кишечного тракта
Различные нарушения в работе желудочно-кишечного тракта могут быть как временными, так и длительными, возникшими в результате болезни. В обоих случаях владельцу собаки трудно самому установить причину
5
Болезни желудочно-кишечного тракта
Собаки – животные плотоядные. Тем не менее, их организм приспособился к потреблению и усвоению питательных веществ рациона, состоящего из смеси различных кормов.
В процессе пищеварения белки, жиры и углеводы пищи подвергаются
Желудочно-кишечный тракт
Строение пищевода и однокамерного желудка собаки – стандартное для хищников. 12-перстная кишка висит на короткой брыжейке. От пилорической части желудка она отходит в правое подреберье, направляется вдоль печени по правой стенке брюшной полости
3.8. Защитные системы желудочно-кишечного тракта
Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
3.8. Защитные системы желудочно-кишечного тракта
Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
Источник
Переваривание белков. Этапы и последовательность переваривания белковПищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в главе 64, железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться. Пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы. Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
единица | 9.1. Роль 9.2. Переваривание 9.3. Трансаминирование |
Модульная | 9.4. Обмен 9.5. Орнитиновый 9.6. Гипераммониемия 9.7. Пути 9.8. Биосинтез |
Модульная | 9.9. Обмен 9.10. Обмен 9.11. Обмен 9.12. Заболевания, 9.13. Биогенные |
ЕМА 9.1. РОЛЬ
БЕЛКОВ В ПИТАНИИ. АЗОТИСТЫЙ БАЛАНС
В организме
человека содержится примерно 15 кг
белков. Количество свободных аминокислот
составляет около 35 г. Ежесуточно в
организме распадается до аминокислот
почти 400 г белков и столько же синтезируется.
1. Основным
источником аминокислот для человека
являются пищевые белки. Суточная норма
потребления белков составляет в среднем
около 100 г.
20 α-аминокислот,
которые встречаются в белках организма,
можно разделить на четыре группы:
• заменимые
аминокислоты – Ала, Асп, Асн, Глу, Глн,
Про, Гли, Сер –
синтезируются в необходимых количествах
в организме;
• незаменимые
аминокислоты – Вал, Лей, Иле, Мет, Фен,
Три, Лиз, Тре –
не могут синтезироваться в организме
и должны поступать с пищей;
• частично
заменимые аминокислоты – Гис, Арг –
синтезируются очень медленно, в
количествах, не покрывающих потребности
организма, особенно в детском возрасте;
• условно
заменимые аминокислоты – Цис, Тир –
синтезируются из незаменимых аминокислот
Мет и Фен соответственно.
2. Полноценность
белкового питания зависит
от аминокислотного состава белков и
определяется наличием незаменимых
аминокислот.Отсутствие
в пищевых белках незаменимых аминокислот
(даже одной) нарушает их синтез в
организме. Обновление белков в различных
тканях происходит с разной скоростью.
Так, белок соединительной ткани коллаген
обновляется полностью за 300 дней, а
белки системы свертывания крови – от
нескольких минут до нескольких дней.
3. Большая
часть свободных аминокислот используется
для синтеза собственных белков организма.
Кроме того, из аминокислот синтезируется
большое количество биологически
активных молекул:
• биогенные
амины (медиаторы); некоторые аминокислоты
сами являются нейромедиаторами –
например, глицин и глутамат;
• гормоны
белковой природы;
• гем,
креатин, карнитин и другие азотсодержащие
соединения.
Аминокислоты
подвергаются реакции дезаминирования;
образовавшиеся безазотистые остатки
используются для синтеза глюкозы,
кетоновых тел или окисляются до СО2 и
Н2О.
Азот аминокислот
выводится из организма почками в виде
мочевины или аммонийных солей.
Аминокислоты и белки содержат до 95%
всего азота организма.
4. Азотистый
баланс –
разница между количеством азота,
поступающего с пищей, и количеством
азота, выделяемого почками в виде
мочевины и азотистых солей. Он является
показателем состояния белкового и
аминокислотного обмена.
Азотистый
баланс может
быть:
• положительным –
у детей, беременных женщин, при увеличении
мышечной массы у спортсменов и больных,
выздоравливающих после тяжелой болезни,
что свидетельствует о преобладании
синтеза белков и роста тканей над их
распадом;
• отрицательным –
при тяжелых заболеваниях, голодании,
старении, что свидетельствует об
усилении процессов распада белков;
• равным
нулю (азотистое равновесие) – у
здоровых взрослых людей при нормальном
питании.
1. При
переваривании происходит гидролиз
пищевых белков до свободных аминокислот.
Процесс переваривания начинается в
желудке и продолжается в тонком кишечнике
под действием ферментов пептидгидролаз
(пептидаз). Основные
пептидазы синтезируются в клетках
желудка, поджелудочной железы и кишечника
(рис. 9.1). В желудке белки
пищи денатурируются и гидролизуются
с образованием олигопептидов.
Вкишечнике панкреатические
пептидазы продолжают гидролиз
олигопептидов до ди- и трипептидов и
свободных аминокислот. Короткие пептиды
расщепляются до свободных аминокислот
в пристеночном
слое или
в клетках кишечного эпителия. Затем
происходит их всасывание.
Все пептидазы, в
зависимости от места расположения в
пептиде гидролизуемой связи, делятся
на
эндопептидазы и экзопептидазы:
• эндопептидазы –
расщепляют пептидные связи, удаленные
от концов пептидной цепи (пепсин,
трипсин, химотрипсин, эластаза);
• экзопептидазы
– гидролизуют
пептидные связи, образованные N- и
С-концевыми аминокислотами (аминопептидаза,
карбоксипептидазы А и В),
а также расщепляют ди- и трипептиды.
 Рис.
Рис.
9.1. Переваривание белков в желудочно-кишечном
тракте
Ферменты,
участвующие в переваривании белков,
обладают относительной субстратной
специфичностью и гидролизуют пептидные
связи; при этом каждая пептидаза
преимущественно расщепляет связи,
образованные определенными аминокислотами
(табл. 9.1).
2. Желудочные
и панкреатические пептидазы вырабатываются
в неактивной форме (проферменты), секретируются
к месту действия, где активируются путем
частичного протеолиза (отщепление
пептида различной длины, чаще с N-конца
молекулы профермента). Место
синтеза проферментов (клетки
слизистой оболочки желудка, поджелудочная
железа) и место
их активации (полость
желудка, тонкого кишечника)пространственно
разделены. Такой
механизм образования активных ферментов
необходим для защиты секреторных клеток
желудка и поджелудочной железы от
самопереваривания.
Таблица
9.1. Характеристика протеолитических
ферментов желудочно-кишечного тракта
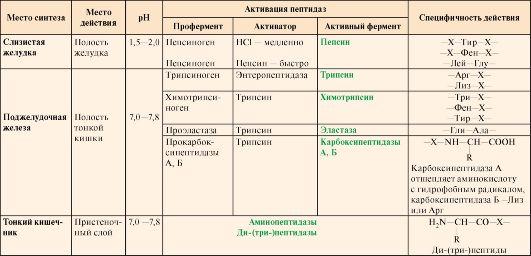 Примечание: X
Примечание: X
– любая аминокислота
Преждевременная
активация проферментов в секреторных
клетках происходит при:
• язвенной
болезни желудка –
пепсиноген превращается в пепсин в
клетках слизистой желудка;
• остром
панкреатите –
трипсиноген превращается в трипсин в
клетках поджелудочной железы и активирует
остальные панкреатические пептидазы.
3. Слизистая
оболочка желудка вырабатывает следующие
факторы, необходимые для переваривания
белков:
• пепсиноген –
синтезируется в главных клетках;
• соляную
кислоту –
вырабатывается обкладочными клетками.
Гидролиз белков в
желудке происходит
под действием пепсина.
Профермент
пепсиноген при поступлении пищи
секретируется в полость желудка, где
в два этапа происходит его активация:
• с помощью
НС! – медленно;
• аутокаталитически
– быстро, уже имеющимся пепсином. Соляная
кислота желудочного
сока выполняет следующие функции:
• .участвует
в активации пепсиногена;
• создает
оптимум рН для пепсина;
• оказывает
бактерицидное действие;
• денатурирует
белки пищи.
Значение рН
желудочного сока в норме составляет
1,5-2,0. Определение
кислотности желудочного сока используется
для диагностики различных заболеваний
желудка (табл. 9.2).
Таблица
9.2. Компоненты желудочного сока в норме
и при патологических состояниях
• 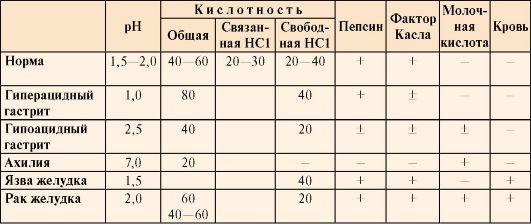 Общая
Общая
кислотность желудочного сока –
это совокупность всех кислотореагирующих
веществ желудочного сока, представляющая
собой секрет желудка, собираемый в
течение 1 часа (предварительно отбирают
секрет, ранее содержащийся в желудке).
• Связанная
соляная кислота –
это соляная кислота, связанная с белками
и продуктами их переваривания.
• Свободная
соляная кислота –
это соляная кислота, не связанная с
другими молекулами.
• Общая
кислотность желудочного сока выражается
в титрационных единицах (ТЕ) и
измеряется количеством 0,1 М NaOH в
миллилитрах, затраченным на титрование
100 мл желудочного сока в присутствии
определенных индикаторов.
• Кислотность
желудочного сока в
норме составляет:
общая 40-60 ТЕ;
связанная
HCl 20-30 ТЕ;
свободная
HCl 20-40 ТЕ.
При диагностике
заболеваний желудка помимо биохимических
анализов обязательно проводят
рентгенологические и эндоскопические
исследования, иногда биопсию.
В слизистой
оболочке желудка вырабатывается
также внутренний
фактор (фактор Касла), который
представляет собой белок, способствующий
всасыванию витамина В12 в
тонкой кишке. Отсутствие этого витамина
часто приводит к развитию анемии.
Молочная
кислота в
норме в желудочном соке отсутствует.
Образуется при уменьшении содержания
или отсутствии свободной соляной
кислоты в результате усиленного
размножения молочнокислых бактерий
или при злокачественных опухолях
желудка.
НС1 и пепсин
способны разрушать клетки эпителия
желудка. В норме это не происходит
благодаря наличию защитных факторов
слизистой оболочки, таких, как:
• образование
на поверхности слизи, содержащей
гетерополисахариды, которые не являются
субстратами пептидгидролаз;
• секреция
эпителиальными клетками ионов НСО3-,
создающих в пристеночном слое менее
агрессивную среду с рН 5,0-6,0, в которой
пепсин неактивен. Кроме того, клетки
поврежденного эпителия обладают
способностью к быстрой регенерации.
Пепсин
гидролизует пептидные
связи, образованные аминогруппой или
карбоксильной группой ароматических
аминокислот (см. табл. 9.1):
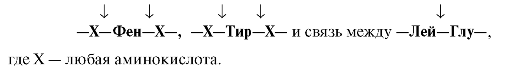 4.
4.
Переваривание белков в кишечнике происходит
под действием:
• ферментов
поджелудочной железы-трипсина,
химотрипсина, эластазы, карбоксипептидаз
А и Б;
• ферментов
эпителия тонкой кишки – аминопептидазы,
дипептидаз, трипептидаз.
Активная
форма трипсина образуется
в кишечнике при участии фермента
энтеропептидазы, выделяемого клетками
кишечника. Энтеропептидазаотщепляет
от N-конца трипсиногена гексапептид
(рис. 9.2), что приводит к изменению
конформации молекулы и формированию
активного центра трипсина.
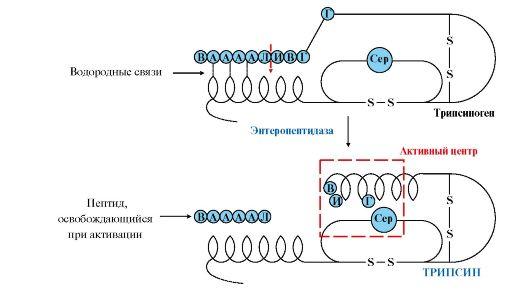 Рис.
Рис.
9.2. Механизм активации трипсиногена.
Пунктирная
стрелка – место гидролиза. Буквами
обозначены аминокислоты (А – асп, Г –
глу, В – вал, Л – лиз, И – иле)
Остальные проферменты
панкреатического сока (химотрипсиноген,
прокарбоксипептидазы А и В, проэластаза)
активируются трипсином.Активация
панкреатических пептидаз в кишечнике
происходит в виде каскада реакций.
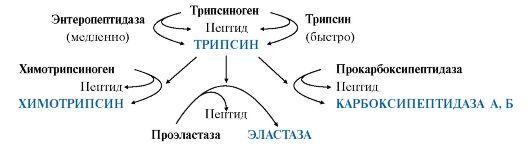 Ферменты
Ферменты
эпителия тонкой кишки синтезируются
в энтероцитах сразу в
активной форме.
• Ферменты,
участвующие в переваривании белков в
кишечнике, обладают
субстратной специфичностью к
определенным аминокислотам в
белке: Трипсин гидролизует
преимущественно пептидные связи,
образованные карбоксильными группами
катионогенных аминокислот:
• 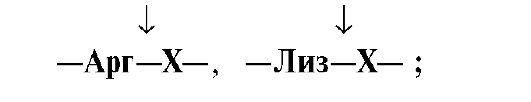 Химотрипсин –
Химотрипсин –
пептидные связи, образованные
карбоксильными группами ароматических
аминокислот:
•  Эластаза –
Эластаза –
связь между -Гли-Ала-
• Карбоксипептидазы отщепляют
С-концевые аминокислоты:
карбоксипептидаза А –
гидрофобные аминокислоты, карбоксипептидаза В
– Лиз и Арг;
• Аминопептидаза –
отщепляет N-концевые аминокислоты;
• Дипептидаза –
гидролизует дипептиды;
• Трипептидаза –
расщепляет трипептиды на отдельные
аминокислоты.
5. Конечным
результатом переваривания белков
является образование свободных
аминокислот, поступающих в клетки
слизистой оболочки кишечника,
путем вторично-активного
транспорта за
счет градиента концентрации натрия
(симпорт). Всасывание L-аминокислот
является активным, требующим затраты
энергии процессом. Транспорт их
осуществляется двумя путями:
• через
воротную систему печени;
• по
лимфатическим сосудам, сообщающимся
с кровью через грудной лимфатический
проток.
Аминокислоты
конкурируют друг с другом за специфические
участки связывания белков-переносчиков.
Так, всасывание лейцина в больших
количествах уменьшает всасывание
изолейцина и валина. В крови максимальная
концентрация аминокислот достигается
через 30-50 минут после приема белковой
пищи. Свободные аминокислоты, в отличие
от белков пищи, лишены видовой
специфичности и не обладают антигенными
свойствами.
Скорость
проникновения аминокислот через
мембраны клеток различается, что
указывает на существование транспортных
систем, обеспечивающих перенос
аминокислот через мембраны. Известно
пять специфических транспортных систем
для переноса определенной группы
близких по строению аминокислот:
• нейтральных
с короткой боковой цепью (аланин,
серин, треонин);
• нейтральных
с длинной или разветвленной боковой
цепью (валин,
лейцин, изолейцин);
• с
катионными радикалами (лизин,
аргинин);
• с
анионными радикалами (глутаминовая
и аспарагиновая кислоты);
• иминокислот (пролин,
оксипролин).
Переносчики
аминокислот первой и пятой групп, а
также переносчик метионина относятся
к числу Na+-зависимых. Независимые от
Na+ переносчики специфичны для некоторых
нейтральных аминокислот (фенилаланин,
лейцин) и аминокислот с катионными
радикалами (лизин).
Одной из
основных транспортных систем для
нейтральных аминокислот
является γ-глутамильный
цикл, который
функционирует в почках, поджелудочной
железе, печени и селезенке, в мозге и
других тканях он содержится в очень
небольших количествах (рис. 9.3).
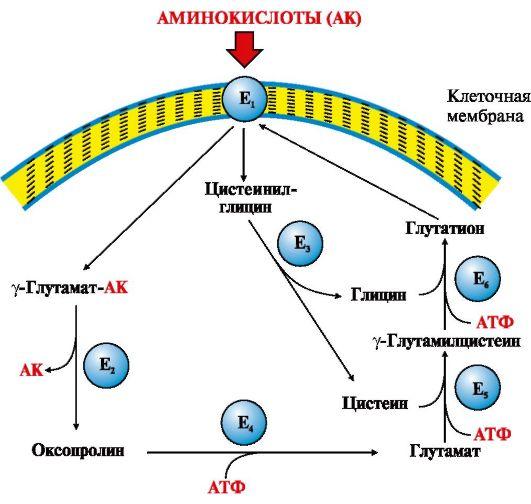 Рис.
Рис.
9.3. γ-Глутамильный цикл:
Е1 –
γ-глутамилтранспептидаза (γ-ГТ); Е2 –
γ-глутамилциклотрансфераза; Е3 –
пептидаза; Е4 –
оксопролиназа; Е5 –
γ-глутамилцистеинсинтетаза; Е6 –
глутатионсинтетаза.
Система
состоит из одного мембранного и пяти
цитоплазматических ферментов. Перенос
аминокислоты внутрь клетки осуществляется
в комплексе с глутамильным остатком
глутатиона под действием фермента
γ-ГТ. Затем аминокислота освобождается,
а γ-глутамильный остаток в несколько
стадий превращается в глутатион, который
способен присоединять следующую
молекулу аминокислоты
Ключевую
роль в работе системы играет мембранный
фермент γ-глутамилтранспептидаза
(γ-ГТ). Этот
гликопротеин катализирует перенос
γ-глутамильной группы с
глутатиона (γ-глутамилцистеинилглицин)
или другого γ-глутамильного пептида
на транспортируемую аминокислоту и
последующий перенос комплекса в клетку.
Глутатион содержится во всех тканях
животных. Для транспорта в клетку одной
молекулы аминокислоты с участием
γ-глутамильного цикла затрачивается
три молекулы АТР.
γ-ГТ в больших
количествах содержится в почках,
поджелудочной железе, печени и других
тканях. Активность фермента в сыворотке
крови в норме составляет 30-50 МЕ/л
(мкмоль/мин-мг) для мужчин и 25-35 МЕ/л для
женщин. Определение активности γ-ГТ в
сыворотке крови используется для
диагностики заболеваний печени и
сердца. γ-ГТ-тест используется также в
качестве маркера рака поджелудочной
железы, печени, предстательной железы
и для обнаружения людей из группы
раннего риска алкоголизма, для контроля
за лечением хронического алкоголизма.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник