Механизм развития кишечной формы лучевой болезни
Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? | Кишечная форма развивается при воздействии радиации в дозе 10-20 Гр (прогноз абсолютно неблагоприятный, критической системой выступает эпителий тонкой кишки.) Картина развивается в течение недели. Повреждение и гибель клеток эпителия тонкой кишки. Основная из-за прямого радиационного поражения стволовых клеток эпителия. Изменения в кишечнике приводят к смерти в течение нескольких дней (обычно на 10-14-е сутки), до развития глубоких нарушений в органах кроветворения. Прекращение резорбции из просвета воды и электролитов. Дегидратация. Нарушение барьерной функции кишечной стенки, во внутреннюю среду поступают токсичные вещества, микрофлора. Гибель в течении недели. Исчезновение эпителиальной выстилки тонкой кишки происходит при у-облучении в дозе 10 Гр,и дальнейшее увеличение дозы не изменяет танатогенеза. Начальный период отличается большей тяжестью проявлений и большей длительностью. 1)Неукротимая рвота. 2)Резко снижается АД, коллапс. 3)Диарея. 4)Эритема кожи и слизистых. 5)Боль в животе, мышцах, суставах, голове. Продолжительность первичной реакции составляет 2-3 суток. Продолжительность скрытого периода не превышают 3 суток. Периода разгара кишечной формы ОЛБ – профузная диарея, температура тела – до 39-40°С. Присоединение аутоинфекции. Обезвоживание. Сознание угнетается до уровня оглушения-сопора. «орофарингеальный синдром». Характеризуется развитием острого радиационного гастроэнтерита. Поражение желудка и кишечника проявляется диареей и неукротимой рвотой, вследствие чего наступает эксикоз. Слизистая оболочка желудка и кишечника изъязвляется. Язвы нередко глубокие, осложняются кровотечением, перфорацией и перитонитом. Это проявлялось деструктивными изменениями и атрофией кроветворной ткани, множественными кровоизлияниями в желудочно-кишечный тракт, во внутренние органы, полиорганная недостаточность. некротическими очагами и язвами Церебральная форма острой лучевой болезни: патогенез. Синдром ранней преходящей недееспособности. Средства купирования синдрома ранней приходящей недееспособности. Облучение головы или всего тела в дозах 50 Гр и выше Основа – Острая церебральная недостаточность в результате дисфункции и гибели нейронов из-за прямого действия радиации и также резкого снижения уровня макроергов в клетках. Повреждения ядерного хроматина столь многочисленны, что вызывают гиперактивацию системы ферментов репарации ДНК, которая сопровождается гидролизом АТФ и глубоким истощением внутриклеточного пула НАД. Продолжительный дефицит АТФ глубоко и необратимо влияет на клетки коры головного мозга, отличающиеся крайне высокой потребностью в энергии. Проявления церебрального лучевого синдрома зависят от мощности дозы облучения: если она превышает 10-15 Гр/мин., то в течение нескольких минут после облучения могут развиться коллаптоидное состояние, резчайшая слабость, атаксия, судороги. Данный симптомокомплекс получил название синдрома ранней преходящей недееспособности (РПН-синдрома). Через 10-45 мин. основные проявления РПН проходят, сменяясь временным улучшением состояния. Если облучение происходит с небольшой мощностью дозы, то РПН не развивается. Нарастают признаки отёка мозга, атаксия, дезориентация, гиперкинезы, судороги, расстройства дыхания и сосудистого тонуса, угнетение сознания до уровня комы в терминальной стадии. Смерть наступает в течение не более чем 48 часов после облучения. Препараты, предназначенные для купирования проявлений РПН- синдрома: Биаи; Никотинамид. Инкорпорация радиоактивных веществ. Кинетика радионуклидов в организме. Классификация радионуклидов по органотропности. Определение инкорпорированных радиоактивных веществ. Принципы лечения и профилактики. Инкорпорация радиоактивных веществ – проникновение радиоактивных веществ в животный или растительный организм и фиксация их в его органах и тканях; такие вещества создают непрерывное радиоактивное облучение органов и тканей. От расщепления радиоактивных веществ в организме, скорости их выведения и распада зависит поражение тех или иных орунов и тканей и всего организма. Ингаляционное поступление радиоактивных веществ Около 25 % попавших в органы дыхания частиц выдыхается. Если оставшиеся после выдоха РВ принять за 100%, то 50% из них подвергаются ретроградному выносу со слизью Около 25% резорбируются в кровь через альвеолярные мембраны. Приблизительно 25% частиц фагоцитируются макрофагами. Таким путем удаляется около 15% РВ. Фагоциты, захватившие оставшиеся 10 % РВ, перемещаются через альвеолярную мембрану. Небольшая часть РВ задерживается в паренхи_ме легких, эпителиальных клетках с периодом полувыведения из них около 600 суток. Еще прочнее фиксация РВ в бронхолегочных лимфатических узлах, куда они попадают с фагоцитамиПоступление радиоактивных веществ через желудочно-кишечный тракт Поражающее действие свя_зано в этом варианте заражения как с лучевой нагрузкой на стен_ку пищеварительного тракта, так и с всасыванием РВ в кровь и лимфу. Всасывание хорошо растворимых радионуклидов происходит, в основном, в тонкой кишке. Значительно меньше РВ всасывается в желудке. Всасывание в толстой кишке практического значения не имеет. Поступление радиоактивных веществ через неповрежденную кожу, раневые и ожоговые поверхности Большинство радиоактивных веществ практически не проникают через неповрежденную кожу. Исключение составляют окись трития, йод, нитрат и фторид уранила а также полоний. Проникновение РВ через кожные покровы зависит от плотности загрязнения, от площади загрязненного участка, от физико-химических свойств самого элемента или соединения, в состав ко_торого он входит, растворимости в воде и липидах, рН среды, от физиологического состояния кожи. Всасывание радионуклидов повы_шается при повышении температуры среды вследствие расширения кровеносных и лимфатических сосудов, раскрытия сальных и потовых желез.,. Резорбция плохо растворимых соединений РВ происходит, в основном по лимфатическим путям, в результате чего радионукли_ды накапливаются в лимфатических узлах. Некоторая часть радио_нуклидов из лимфатических узлов поступает с фагоцитами в орга_ны ретикуло-эндотелиальной системы. В месте нахождения радионуклида в плохо растворимой фор_ме могут возникнуть опухоли (чаще остеогенные саркомы). По способности преимущественно накапливаться в тех или иных органах выделяют следующие основные группы радиоактивных элементов: – радионуклиды, избирательно откладывающиеся в костях (“остеотропные”). Это щелочноземельные элементы: радий, стронций, барий, кальций. Остеотропность проявляют некоторые соединения плутония и тория. – радионуклиды, избирательно накапливающиеся в органах, богатых элементами ретикулоэндотелиальной системы (“гепатотропные”). Это изотопы редкоземельных элементов (лантан, церий, прометий, празеодим), а также актиний, торий и некоторые соединения плутония. При их поступлении наблюдаются поражения печени, проксимальных отделов кишки – радионуклиды, равномерно распределяющиеся по организму. Это изотопы щелочных металлов (цезия, калия, натрия, рубидия), водорода, углерода, азота, а также изотопы некоторых других элементов, в частности, полония. При их поступлении поражения носят диффузный характер: развивается атрофия лимфоидной ткани, в том числе селезенки, атрофия семенников, нарушения функции мышц (при поступлении радиоактивного цезия). На поздние сроки наблюдаются опухоли мягких тканей: молочных желез, кишечника, почек и т.п.; в отдельную группу выделяют радиоактивные изотопы йода, избирательно накапливающиеся в щитовидной железе. При их поступлении в большом количестве вначале наблюдается стимуляция, а позже угнетение функции щитовидной железы. На поздние сроки развиваются опухоли этого органа; Радионуклиды, попавшие в организм человека, называют инкорпорированными При инкорпорации высокотоксичных радионуклидов, таких как плутоний, полоний, америций, радий и др. требуется срочная эвакуация в специализированное учреждение, где могут быть проведены эффективные мероприятия по выведению РВ из организма (бронхопульмональный лаваж, форсированный диурез, повторные введения комплексонов и т.п.) |
Источник
Его наступление при типичной форме ОЛБ обусловлено падением числа функциональных клеток крови ниже критического уровня. Гранулоцитопения и тромбоцитопения представляют собою ведущие причины развития аутоинфекционных осложнений и геморрагического синдрома – потенциально смертельных клинических проявлений ОЛБ в период разгара.
Глубина и продолжительность цитопении и, соответственно, тяжесть клинических проявлений ОЛБ, зависят, прежде всего, от дозы облучения. Существенное значение имеют и различия в индивидуальной радиочувствительности организма. Продолжительность аутоинфекционных и геморрагических проявлений приблизительно соответствует времени, в течение которого в периферической крови регистрируются субкритические значения содержания лейкоцитов и тромбоцитов.
Непосредственной причиной смерти при ОЛБ чаще всего служат тяжёлые инфекционные процессы и кровоизлияния в жизненно важные органы.
Период восстановления
Если в период разгара не наступит смерть, регенераторные процессы в кроветворной системе обеспечивают через определённый срок увеличение числа зрелых клеток крови, а с ним и ликвидацию симптоматики периода разгара. Начинается период восстановления, в течение которого происходит полная или частичная нормализация функций критических систем организма.
Прогноз для жизни.
Прогноз для жизни при ОЛБ лёгкой степени – благоприятный. При ОЛБ средней степени – благоприятный при проведении надлежащего лечения. При ОЛБ тяжёлой степени прогноз сомнительный: даже интенсивная комплексная терапия не всегда оказывается успешной. Без лечения среднесмертельная дозаγ- или рентгеновского излучения для человека составляет, ориентировочно, 3,5 – 4,0 Гр. Продолжительность жизни в случаях, заканчивающихся летально, составляет при типичной форме ОЛБ 3-5 недель.
Кишечная форма острой лучевой болезни
После общего облучения в дозах 10-20 Гр развивается кишечная форма ОЛБ, основу проявлений которой составляет кишечный синдром. Этот симптомокомплекс развивается в течение недели после облучения. Он связан с повреждением и гибелью клеток эпителия тонкой кишки. Основная роль в механизмах оголения подслизистого слоя отводится прямому радиационному поражению стволовых клеток эпителия.
Наиболее важным следствием оголения подслизистого слоя тонкой кишки является прекращение резорбции из её просвета воды и электролитов. Развивается дегидратация, которая сама по себе угрожает жизни больного. Из-за нарушения барьерной функции кишечной стенки во внутреннюю среду поступают токсичные вещества – в частности, токсины кишечной палочки. Их количество также может оказаться несовместимым с жизнью. По этой же причине в кровь и лимфу проникает кишечная микрофлора. Её размножению способствует развивающаяся одновременно гранулоцитопения. При достаточной выраженности перечисленные процессы приводят к гибели, если не предпринимаются попытки лечения, в течение недели.
Поскольку исчезновение эпителиальной выстилки тонкой кишки происходит уже при γ-облучении в дозе 10 Гр, дальнейшее увеличение дозы не может что-либо добавить к этому достаточному условию смертельного исхода, и сроки гибели не меняются с изменением дозы в диапазоне 10-20 Гр.
В течении кишечной формы ОЛБ часто можно выделить отдельные периоды, подобные тем, которые описывались при костномозговой форме. Начальный период отличается большей тяжестью проявлений и большей длительностью. Кроме того, нередко уже с первых дней отмечается диарея. Глубже снижается артериальное давление (иногда развивается коллаптоидное состояние). Весьма выражена и длительно сохраняется ранняя эритема кожи и слизистых. Температура тела повышается до фебрильных значений. Больные жалуются на боль в животе, мышцах, суставах, голове.
Продолжительность первичной реакции при кишечной форме ОЛБ составляет 2-3 суток. Затем может наступить кратковременное улучшение общего состояния (эквивалент скрытого периода костномозговой формы ОЛБ), однако проявления заболевания полностью не исчезают. Продолжительность скрытого периода не превышают 3 суток.
Наступление периода разгара кишечной формы ОЛБ знаменуется резким ухудшением самочувствия, развитием диареи, повышением температуры тела до 39-400С, развитием проявлений орофарингеального синдрома, обезвоживания, интоксикации и эндогенной инфекции, которой способствует раннее наступление агранулоцитоза. Смертельному исходу обычно предшествует развитие сопора и комы.
При условии лечения поражённые с кишечной формой ОЛБ могут прожить до двух и даже двух с половиной недель. В этом случае есть время для развития панцитопенического синдрома, вторичной инфекции и кровоточивости, которые и служат причиной смерти.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
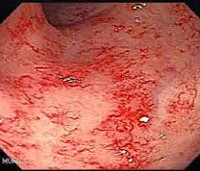
Лучевой энтероколит – это воспалительное поражение кишечника, связанное с радиационными воздействиями. Проявляется диареей, запорами, другими диспепсическими явлениями, патологическими примесями в кале, болями в животе, снижением веса, астенией. Диагностируется с помощью рентгеноконтрастного исследования тонкой, толстой кишки, колоноскопии, копрограммы, дыхательных тестов. Для лечения используют кортикостероиды, препараты 5-АМК, прокинетики, ингибиторы опиатных рецепторов, анионообменные смолы, антибиотики, пробиотики, ферментные средства, регенеранты в сочетании с диетотерапией. Оперативное лечение проводится при возникновении хирургических осложнений.
Общие сведения
Впервые характерные изменения кишечника после проведенной радиотерапии злокачественного новообразования были описаны в 1917 г. К.Францем и Дж.Ортом. По мере расширения показаний к проведению лучевой терапии, как радикального и паллиативного метода лечения онкологических заболеваний, совершенствования применяемых методик, число пациентов, получающих радиотерапию, увеличилось до 60% всех онкобольных. По результатам наблюдений специалистов в сфере практической проктологии, гастроэнтерологии и онкологии, у 3-17% больных, получивших радиационную нагрузку, развиваются ранние (острые) и поздние (хронические) формы лучевого энтероколита. Неятрогенное повреждение кишечника ионизирующими излучениями в настоящее время фиксируется крайне редко.

Лучевой энтероколит
Причины лучевого энтероколита
Пострадиационное воспаление кишечника обычно развивается у пациентов, принимающих радиотерапию по поводу злокачественных новообразований брюшной полости, забрюшинного пространства, малого таза. Прямое повреждающее воздействие на различные участки тонкой и толстой кишки возникает вследствие лучевого лечения рака желудка, поджелудочной железы, шейки матки, яичников, предстательной железы, яичек, мочевого пузыря, прямой кишки, почечных карцином, опухолей надпочечников, ретроперитонеальных лимфом и пораженных метастазами лимфоузлов. Радиационная толерантность тонкого кишечника достигает 35 Гр, толстого – 40 Гр. При более высокой лучевой нагрузке наступают отсроченные патологические изменения. Острая обратимая реакция в процессе терапии ионизирующим излучением может развиться и при меньших дозах.
Вероятность возникновения радиационного энтероколита повышается при наличии воспалительных заболеваний кишечника, послеоперационных спаек, ограничивающих подвижность петель тонкой кишки, у лиц пожилого возраста, пациентов, которым назначена химиотерапия. Дополнительными факторами риска являются сопутствующие заболевания (артериальная гипертензия, сахарный диабет), астеническое телосложение, использование устаревшей радиационной техники, неправильный расчет лучевой нагрузки, несоблюдение техники облучения. Развитие клиники радиационного энтероколита возможно в рамках острой лучевой болезни при равномерном внешнем облучении дозой более 20 Гр во время ядерных катастроф, при халатном отношении к технике безопасности во время работы с источниками ионизирующих излучений.
Патогенез
Механизм развития лучевого энтероколита зависит от времени возникновения заболевания. Раннее радиационное поражение, возникающее непосредственно в процессе радиотерапии или в течение первых трех месяцев после курса лечения, основано на цитотоксическом действии ионизирующего излучения. Десквамация, преходящая атрофия, гибель энтероцитов и колоноцитов сочетаются с неспецифической воспалительной реакцией. Укорочение ворсинок, отек, гиперемия, выраженная нейтрофильная инфильтрация собственной пластинки кишки нарушают пристеночное пищеварение, процессы расщепления нутриентов, всасывания воды, усиливают или угнетают перистальтику кишечника. Благодаря быстрому делению оставшихся эпителиальных клеток слизистая кишки полностью восстанавливается, явления энтероколита купируются.
При сверхвысоких дозах лучевой нагрузки развиваются стойкие поздние поражения, обусловленные патоморфологическими изменениями мелких подслизистых сосудов. Нарушение кровообращения в кишечной стенке, вызванное микротромбированием и гиалинозом артериол, приводит к развитию хронической ишемии и связанной с ней гипорегенераторной атрофии кишечных эпителиоцитов. При значительном истончении слизистой уплощается ее рельеф, повышается кишечная проницаемость, замедляется моторика, нарушается абсорбция основных питательных веществ, желчных кислот, возникают участки язв и эрозий, в тяжелых случаях происходит некротическая деструкция. Ситуацию усугубляет гипоксический реактивный фиброз мышечного слоя, осложняющийся рубцовым стенозированием просвета кишечника.
Классификация
Систематизация форм лучевого энтероколита учитывает время возникновения расстройства, выраженность и локализацию патоморфологических изменений кишечной стенки. Такой подход позволяет более точно спрогнозировать исход и подобрать адекватное лечение. Выделяют следующие варианты лучевого повреждения кишечника:
- По времени возникновения: ранние и поздние поражения кишечника. Острые формы лучевого воспаления возникают во время курса радиотерапии или на протяжении 3 месяцев после завершения лечения. В большинстве случаев они полностью обратимы. Для позднего лучевого повреждения, развивающегося спустя 4 и более месяцев после облучения, характерны хроническое течение, выраженные деструктивные изменения кишечника, менее благоприятный прогноз.
- По характеру патологических изменений: при оценке варианта энтероколита учитывается глубина повреждения кишечной стенки. Наиболее легкой формой является поверхностное катаральное воспаление. Для эрозивно-десквамативного и инфильтративно-язвенного лучевого воспалительного процесса, часто осложняющегося кишечными кровотечениями, характерен дефект слизистой вследствие полной атрофии эпителиоцитов. Самым тяжелым считается некротическое воспаление.
- По локализации воспаления: радиационный энтерит, колит. Хотя тонкая кишка более чувствительна к лучевой нагрузке, благодаря высокой мобильности она реже подвергается повреждению. Однако энтериты протекают тяжелее, чем колиты, и соответственно имеют более серьезный прогноз. При воспалении толстой кишки чаще возникают осложнения, требующие хирургического лечения. Заболевание протекает более тяжело при поражении обоих отделов кишечника.
Симптомы лучевого энтероколита
Клиническая картина острой формы заболевания сходна с признаками кишечного воспаления инфекционной этиологии. У пациентов наблюдается тошнота и рвота, потеря аппетита, учащенный стул с примесями слизи, боли в животе различной локализации. Значительное нарушение всасывания жиров проявляется выделением зловонных каловых масс светлого цвета с жирным блеском. При прогрессировании лучевой воспалительной реакции боли усиливаются, могут присоединяться ложные болезненные позывы к дефекации, в кале появляется кровь. Поздние радиационные энтероколиты характеризуются дискомфортом и умеренными болями в левой подвздошной области, других участках живота, чередованием запоров и диареи, потерей массы тела. Отмечаются нарушения общего состояния – головные боли, головокружения, слабость, снижение трудоспособности.
Осложнения
При язвенно-некротическом варианте лучевого энтероколита возникают потери крови с калом, которые со временем провоцируют формирование тяжелой железодефицитной анемии. Иногда развиваются профузные кровотечения, представляющие опасность для жизни больного. При лучевом энтероколите может происходить некроз всех слоев кишечной стенки, что приводит к перфорации и развитию местного или разлитого перитонита.
В случае хронического течения заболевания формируются рубцовые стриктуры, которые могут осложняться динамической или механической кишечной непроходимостью. Нарушение всасывания витаминов группы В сопровождается возникновением В12-дефицитной анемии, периферической полинейропатии. Ретиноловая недостаточность проявляется нарушением сумеречного зрения, слепотой, сухостью кожи и слизистых. При значительном недостатке эргокальциферола возможны остеопороз, кариес.
Диагностика
Постановка диагноза лучевого энтероколита не представляет затруднений при наличии в анамнезе сведений о радиационных воздействиях. Диагностический поиск направлен на тщательное обследование органов пищеварения с целью исключения других причин поражения кишечника. Наиболее информативными являются следующие инструментальные и лабораторные исследования:
- Рентгенологические методы. Рентгенография тонкого кишечника и ирригоскопия визуализируют признаки, характерные для лучевого поражения. Выявляются отсутствие гаустраций, сглаженность крипт слизистой, наличие язв или свищей, рубцовое сужение кишки. В сложных случаях выполняется МСКТ, МРТ брюшной полости.
- Колоноскопия. Введение эндоскопа через прямую кишку позволяет врачу осмотреть весь толстый кишечник. При энтероколите обнаруживаются очаги катарального воспаления слизистой, язвенные дефекты, точечные кровоизлияния, участки атрофии. Дополнительно выполняет биопсия кишечной стенки для гистологического анализа.
- Копрограмма. При анализе кала определяются типичные признаки лучевого воспаления: слизь, большое количество эритроцитов и лейкоцитов, примеси нейтральных жиров, непереваренных частиц пищи. Диагностика может дополняться бактериологическим посевом, который используется для выявления патогенной микрофлоры.
При хроническом воспалении с помощью мезентериальной ангиографии определяется поражение артериол, приводящее к ишемии. Для исключения других возможных причин энтероколита (непереносимости лактозы, СИБР) применяют функциональные Н2-дыхательные тесты. Для лучевого энтероколитического синдрома типично снижение количества гемоглобина и эритроцитов, микроцитоз, уменьшение содержания ретикулоцитов в клиническом анализе крови.
Дифференциальная диагностика проводится с воспалительными заболеваниями кишечника (терминальным илеитом, неспецифическим язвенным колитом), энтероколитами вирусной или бактериальной этиологии, амебиазом, целиакией, спру, первичной лактазной недостаточностью, синдромом избыточного бактериального роста (СИБР), злокачественными новообразованиями пищеварительного тракта. Кроме наблюдения у врача-проктолога или гастроэнтеролога, пациенту может потребоваться консультация онколога, радиолога, инфекциониста, гематолога, общего хирурга.
Лечение лучевого энтероколита
Терапевтическая тактика в целом напоминает схему ведения пациентов с болезнью Крона, язвенным колитом. Независимо от варианта энтероколитического лучевого синдрома, проводится коррекция питания. Больным рекомендован рацион с высоким содержанием белка (100-120 г/сут.), достаточным количеством углеводов, жиров, макро- и микроэлементов, витаминов. При тяжело протекающих поздних энтероколитах возможен перевод пациента на энтерально-зондовое и парентеральное питание. При умеренно выраженной симптоматике достаточным оказывается симптоматическое лечение. Пострадиационную диарею эффективно купируют анионообменные смолы и блокаторы опиоидных рецепторов.
Для стимуляции моторики применяют прокинетики, которые для редукции возросшего количества микроорганизмов комбинируют с нитроимидазолами и тетрациклинами. Слабительные могут назначаться при отсутствии кишечной обструкции. Чтобы стимулировать восстановление эпителия, используют нестероидные анаболики, регенеранты и репаранты. Назначение антагонистов H2-рецепторов или ингибиторов протонной помпы позволяет ускорить заживление участков с эрозиями и язвами. При нарушении процессов пищеварения показаны ферментные препараты. Для профилактика возможного дисбиоза используются пробиотики. При среднетяжелом и тяжелом течении оправдано проведение патогенетической медикаментозной терапии, включающей:
- Кортикостероиды. Противовоспалительная терапия глюкокортикоидами позволяет блокировать образование арахидоновой кислоты и некоторых других медиаторов воспаления, затормозить пролиферацию Т-хелперов, уменьшить содержание в крови моноцитов и за счет этого сократить количество тканевых макрофагов. Пациентам с энтероколитом обычно назначают прием преднизолона или метилпреднизолона.
- Производные 5-аминосалициловой кислоты. Их эффект основан на блокировании циклооксигеназного и липооксигеназного механизмов образования медиаторов воспаления – простагландинов, тромбоксанов, лейкотриенов. Лекарственные средства с 5-АСК угнетают продукции миофибробластами белка, тормозящего разрушение рубцовой ткани, что позволяет замедлить или предотвратить возникновение фиброза.
Терапевтическую резистентность тяжелого энтероколита позволяет снизить проведение гипербарической оксигенации. До 20-30% пациентов с поздним радиационным воспалением, выраженными стриктурами и стенозом нуждаются в оперативном лечении. В зависимости от ситуации проводятся сегментарная резекция тонкой кишки, энтероэнтеростомия, энтероколостомия, энтеростомия (еюностомия или илеостомия), резекции ободочной кишки, стомирование толстого кишечника, наложение различных типов толстокишечных анастомозов.
Прогноз и профилактика
У большинства больных с острым воспалением наблюдается полное выздоровление с восстановлением целостности слизистой оболочки. У 70-80% пациентов с хроническим процессом удается добиться стойкой клинической ремиссии консервативными методами. Прогностически неблагоприятной является язвенно-некротическая форма лучевого энтероколита, которая может приводить к серьезным осложнениям и ограничению трудоспособности пациентов. Профилактика радиационных поражений кишечника заключается в индивидуальном подборе курсовой и разовой дозы облучения, соблюдении перерывов между сеансами лучевой терапии, применении радиопротекторов.
Источник