Накопление биомассы культуры кишечной палочки проводят

1)гидролиз природного белковосодержащего сырья;
2)химический синтез с разделением рацематов на иммобилизованной аминоацилазе
3)химико-ферментативный синтез
4)микробиологический синтез
300.МЕХАНИЗМ КОНТРОЛЯ СКОРОСТИ БИОСИНТЕЗА АМИНОКИСЛОТЫ У ПРИРОДНОГО ПРОДУЦЕНТА – КИШЕЧНОЙ ПАЛОЧКИ, ПРЕПЯТСТВУЮЩИЙ ИЗБЫТОЧНОМУ НАКОПЛЕНИЮ АМИНОКИСЛОТЫ
1)не согласованная репрессия
2)согласованная репрессия
3)совместное ингибиторование
4)репрессия
301.У ТИПИЧНЫХ ПРИРОДНЫХ НЕ МУТАНТНЫХ ПРОДУЦЕНТОВ
ЛИЗИНА Согуnebacterium glutamicum И, Brevibacterium flavum ФЕРМЕНТ АСПАРТАТКИНАЗА ЯВЛЯЕТСЯ АЛЛОСТЕРИЧЕСКИМ БЕЛКОМ, ЧУВСТВИТЕЛЬНЫМ ПО ПРИНЦИПУ ОБРАТНОЙ СВЯЗИ ПРИ СОВМЕСТНОМ ДЕЙСТВИИ
1)только лизина
2)только треонина
3)L- лизина и L- треонина
4)D- лизина и L- лизина
302.КАКОЙ ИЗ ПРИМЕНЯЕМЫХ МЕТОДОВ ПРОМЫШЛЕННОГО
ПОЛУЧЕНИЯ АМИНОКИСЛОТ ЯВЛЯЕТСЯ ПОЛНОСТЬЮ БИОТЕХНОЛОГИЧЕСКИМ (БАЗИРУЕТСЯ ЦЕЛИКОМ НА ПРИМЕНЕНИИ БИООБЪЕКТОВ)
1)гидролиз природного белковосодержащего сырья;
2)химический синтез с разделением рацематов на иммобилизованной аминоацилазе
3)химико-ферментативный синтез
4)микробиологический синтез
303.Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ СЛЕДУЮЩИЕЙ АМИНОКИСЛОТЫ
1)треонин
2)триптофан
3)фенилаланин
4)лейцин
304.Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ СЛЕДУЮЩИЕЙ АМИНОКИСЛОТЫ
1)лейцин
51
2)гистидин
3)изолейцин
4)валин
305.Corinebacterium glutamicum ЯВЛЯЕТСЯ ПРОДУЦЕНТОМ ДЛЯ СЛЕДУЮЩИЕЙ АМИНОКИСЛОТЫ
1)серин
2)Фенилаланин
3)изолейцин
4)триптофан
306.ДЛЯ РЕГУЛЯЦИИ БИОСИНТЕЗА АМИНОКИСЛОТ У КОРИНЕБАКТЕРИЙ ХАРАКТЕРНО
1)ретроингибирование
2)согласованная репрессия
3)совместное ингибирование
4)ауксотрофен
307.СИНТЕЗ ЛИЗИНА ОСУЩЕСТВЛЯЮТ КОРИНЕБАКТЕРИИ, АУКСОТРОФНЫЕ ПО
1)изолейцину
2)треонину
3)лизину
4)валину
308.СИНТЕЗ ЛИЗИНА ОСУЩЕСТВЛЯЮТ КОРИНЕБАКТЕРИИ, АУКСОТРОФНЫЕ ПО
1)изолейцину
2)лизину
3)гомосерину
4)валину
309.АМИНОКИСЛОТУ ТРЕОНИН ПРОДУЦИРУЮТ МУТАНТНОИНЖЕНЕРНЫЕ ШТАММЫ
1)стрептококков
2)кишечной палочки
3)коринебактерий
4)пекарских дрожжей
310.МУТАНТНО-ИНЖЕНЕРНЫЙ ШТАММ КИШЕЧНОЙ ПАЛОЧКИ – ПРОДУЦЕНТ ТРЕОНИНА
1)ауксотрофен по тренину и гомосерину
2)синтезирует продукт после накопления биомассы
3)не нуждается в аминокислотах для своего роста
4)синтезирует продукт до накопления биомассы
52
311.ДЛЯ РЕГУЛЯЦИИ БИОСИНТЕЗА АМИНОКИСЛОТ КИШЕЧНОЙ ПАЛОЧКОЙ ХАРАКТЕРНО
1)репрессия
2)ретроингибирование
3)совместное ингибирование лизином и треонином
4)согласованная репрессия треонином и изолейцином
312.АМИНОКИСЛОТУ ЛИЗИН ПРОДУЦИРУЮТ МУТАНТНЫЕ
ШТАММЫ
1)кишечной палочки
2)коринебактерий
3)пекарских дрожжей
4)стрептококков
313.РЕЗИДЕНТНОЙ НАЗЫВАЮТ
1)условно-патогенную микрофлору ЖКТ
2)патогенную микрофлору ЖКТ
3)постоянную микрофлору ЖКТ
4)транзиторную микрофлору ЖКТ
314.КУЛЬТИВИРОВАНИЕ КИШЕЧНОЙ ПАЛОЧКИ ОСУЩЕСТВЛЯЮТ, ПРИ РН
1)рН = 5,5-6,0
2)рН = 8,0-8,2
3)рН = 6,0-7,0
4)рН = 7,2-8,0
315.К ПРЕПАРАТАМ ПРОБИОТИКОВ, НЕ СОДЕРЖАЩИМ БИФИДОБАКТЕРИИ, ОТНОСЯТ
1)пробифор
2)нормофлор
3)бификол
4)бифилиз
316.К ПРЕПАРАТАМ ПРОБИОТИКОВ, НЕ СОДЕРЖАЩИЕ ЛАКТОБАКТЕРИИ, ОТНОСЯТ
1)гастрофарм
2)бифилиз
3)линекс
4)лактобактерин сухой
317.ЕСЛИ ОБА ШТАММА В СМЕШАННОЙ КУЛЬТУРЕ РАСТУТ БЫСТРЕЕ, ЧЕМ В СООТВЕТСТВУЮЩИХ ЧИСТЫХ КУЛЬТУРАХ, ЯВЛЕНИЕ НОСИТ НАЗВАНИЕ
53
1)нейтрализм
2)мутуализм
3)аменсализм
4)комменсализм
318.РОСТ ОДНОГО МИКРООРГАНИЗМА ПОДАВЛЯЕТСЯ В ПРИСУТСТВИИ ДРУГОГО — ЭТО
1)нейтрализм
2)аменсализм
3)комменсализм
4)симбиоз
319.КУЛЬТИВИРОВАНИЕ МОЛОЧНО-КИСЛЫХ БАКТЕРИЙ ОСУЩЕСТВЛЯЮТ, ПРИ РН
1)рН = 5,5-6,0
2)рН = 8,0-8,2
3)рН = 6,0-7,0
4)рН = 7,2-8,0
320.МЕХАНИЗМЫ МУТУАЛИЗМА
1)обмен питательными веществами
2)синтез токсических веществ
3)поглощение незаменимых питательных веществ
4)секреция ферментов, разрушающих полимеры клеточной стенки
321.СОСТОЯНИЕ СИСТЕМЫ, КОГДА НИ ОДИН ИЗ ОРГАНИЗМОВ НЕ ОКАЗЫВАЕТ ВЛИЯНИЯ НА СКОРОСТЬ РОСТА ДРУГОГО МИКРООРГАНИЗМА, НАЗЫВАЕТСЯ
1)нейтрализм
2)мутуализм
3)комменсализм
4)аменсализм
322.РОСТ ОДНОГО МИКРООРГАНИЗМА ПОДАВЛЯЕТСЯ В ПРИСУТСТВИИ ДРУГОГО – ЭТО
1)нейтрализм
2)аменсализм
3)комменсализм
4)симбиоз
323.ЕСЛИ В СМЕШАННОЙ КУЛЬТУРЕ ПРЕИМУЩЕСТВА ПОЛУЧАЕТ ВТОРОЙ ВИД МИКРООРГАНИЗМОВ, ТО ЯВЛЕНИЕ НАЗЫВАЮТ
1)аменсализм
54
2)мутуализм
3)комменсализм
4)симбиоз
324.ПАРАЗИТИЗМОМ НАЗЫВАЮТ ВАРИАНТ
1)мутуализма
2)аменсализма
3)комменсализма
4)симбиоз
325.МЕТАБОЛИЗМ ХОЛЕСТЕРИНА ОСУЩЕСТВЛЯЮТ
1)бифидобактерии
2)лактобактерии
3)непатогенные штаммы кишечной палочки
4)грибы рода Кандида
326.СИМБИОЗОМ НАЗЫВАЮТ
1)тесные мутуалистические связи
2)тесные аменсалитические связи
3)тесные комменсалитические связи
4)аменсализм
327.ДИАРЕЯ ПУТЕШЕСТВЕННИКОВ ОБУСЛОВЛЕНА
1)снижением количества бифидо- и лактобактерий
2)развитием кишечных палочек с патогенными свойствами
3)развитием дрожжеподобных грибов рода Кандида
4)постоянной микрофлорой ЖКТ
328.НАКОПЛЕНИЕ БИОМАССЫ КУЛЬТУРЫ КИШЕЧНОЙ ПАЛОЧКИ ПРОВОДЯТ НА ПИТАТЕЛЬНЫХ СРЕДАХ НА ОСНОВЕ
1)казеина и желатина
2)печеночного бульона, пептона и лактозы
3)гидролизата молока, солодового экстракта, глюкозы
4)мелассы и хлорида натрия
329.В КАЧЕСТВЕ ЗАЩИТНОЙ СРЕДЫ ПРИ ЛИОФИЛЬНОЙ СУШКЕ СУСПЕНЗИИ КИШЕЧНОЙ ПАЛОЧКИ В ПРОИЗВОДСТВЕ КОЛИБАКТЕРИНА ИСПОЛЬЗУЮТ
1)сахарозу
2)глюкозу
3)пептон
4)обрат молока
330.СИМБИОНТАМИ МАКРООРГАНИЗМА С ПЕРВЫХ ДНЕЙ ЖИЗНИ ЯВЛЯЮТСЯ
55
1)бифидобактерии
2)кишечная палочка
3)бактероиды
4)грибы рода Кандида
331.Bacillus ВХОДИТ В СОСТАВ ПРЕПАРАТА
1)Флонивин БС
2)Нормофлор
3)Энтерол
4)Бификол
332.В КАЧЕСТВЕ ЗАЩИТНОЙ СРЕДЫ ПРИ ЛИОФИЛЬНОЙ СУШКЕ СУСПЕНЗИИ БИФИДОБАКТЕРИЙ В ПРОИЗВОДСТВЕ БИФИДОБАКТЕРИНА ИСПОЛЬЗУЮТ
1)сахарозу
2)глюкозу
3)пептон
4)обезжиренное молоко
333.ПРЕПАРАТ НОРМОФЛОР СОДЕРЖИТ ЛИОФИЛИЗИРОВАННЫЕ
КЛЕТКИ
1)Bacillus subtilis
2)Lactobaccillus acidophilus
3)Lactobaccillus bulgaricus
4)Kefir greins
334.НАКОПЛЕНИЕ БИОМАССЫ КУЛЬТУР LACTOBACILLUS ПРОВОДЯТ НА ПИТАТЕЛЬНЫХ СРЕДАХ НА ОСНОВЕ
1)казеина и желатина
2)печеночного бульона, пептона и лактозы
3)гидролизата молока, солодового экстракта, глюкозы
4)мелассы и хлорида натрия
335.ВЫВОДЯТСЯ ИЗ ОРГАНИЗМА ПОСЛЕ КУРСА ЛЕЧЕНИЯ ПРОБИОТИКИ, ВХОДЯЩИЕ В СОСТАВ ПРЕПАРАТОВ
1)Бифилиз
2)Энтерол
3)Бификол
4)Колибактерин
336.ПРЕПАРАТЫ ПРОБИОТИКОВ, СОДЕРЖАЩИЕ НЕСКОЛЬКО ШТАММОВ МИКРООРГАНИЗМОВ
1)Гастрофарм
2)Линекс
3)Энтерол
56
4)Бифилиз
337.ЛИЗОЦИМ ВХОДИТ В СОСТАВ ПРЕПАРАТА
1)Флонивин БС
2)Бактисубтил
3)Бифилиз
4)Бификол
338.ОСНОВНОЕ ПРЕИМУЩЕСТВО ФЕРМЕНТАТИВНОЙ БИОКОНВЕРСИИ СТЕРОИДОВ ПЕРЕД ХИМИЧЕСКОЙ ТРАНСФОРМАЦИЕЙ СОСТОИТ
1)в доступности реагентов
2)в избирательности воздействия на определенные функциональные группы стероида
3)в сокращении времени процесса
4)в получении принципиально новых соединений
339.ПРЕИМУЩЕСТВОМ МЕТОДА БИОКОНВЕРСИИ СТЕРОИДОВ ПЕРЕД ХИМИЧЕСКОЙ ТРАНСФОРМАЦИЕЙ ЯВЛЯЕТСЯ
1)высокая скорость реакции окисления
2)окисление только по боковой цепи
3)окисление по системе сконденсированных колец
4)окисление как по системе колец, так и по боковой цепи
340.ВЕЩЕСТВО S РАЙХШТЕЙНА МОЖЕТ БЫТЬ ПОЛУЧЕНО ИЗ
1)аланина
2)соласодина
3)преднизолона
4)целлюлозы
341.КОРТИКОСТЕРОИДЫ СОДЕРЖАТ ПРИ С-17
1)аминогруппу
2)гидроксизамещенную ацетильную группу
3)кольцо ароматическое
4)карбонильную или гидроксильную группы, а их модифицированные аналоги — алкильную или этинильную группу
342.УВЕЛИЧЕНИЕ ВЫХОДА ЦЕЛЕВОГО ПРОДУКТА ПРИ БИОТРАНСФОРМАЦИИ СТЕРОИДА ДОСТИГАЕТСЯ
1)При увеличении интенсивности перемешивания
2)при увеличении интенсивности аэрации
3)при повышении температуры ферментации
4)при увеличении концентрации стероидного субстрата в ферментационной среде
57
343.ВЕЩЕСТВО S РАЙХШТЕЙНА МОЖЕТ БЫТЬ ПОЛУЧЕНО ИЗ
1)диосгенина
2)аланина
3)преднизолона
4)целлюлозы
344.МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПОЛУЧАЮТ В ПРОИЗВОДСТВЕ
1)при фракционировании антител организмов
2)фракционированием лимфоцитов
3)с помощью гибридом
4)химическим синтезом
345.ПО ПРОИСХОЖДЕНИЮ ИММУНОСТИМУЛЯТОРЫ ПОДРАЗДЕЛЯЮТ НА
1)экзогенные
2)химические
3)биосинтетические
4)экстракционные
346.ЭНДОГЕННЫЕ ИММУНОСТИМУЛЯТОРЫ СИНТЕЗИРУЮТСЯ 1)клетками микроорганизмов
2)с помощью химических реакций
3)клетками макроорганизма
4)половыми клетками
347.ELISA — ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ ЯВЛЯЕТСЯ
1)иммунометрическим
2)конкурентным
3)быстрым
4)гетерогенным
348.«СЕНДВИЧ» – АНАЛИЗ ЯВЛЯЕТСЯ
1)иммунометрическим
2)конкурентным
3)гомогенным
4)гетерогенным
349.ВАРИАНТЫ ПОСТАНОВКИ ИФА
1)онкурентный, иммунометрический
2)юминисцентным
3)адиоиммунный
4)люоресцертный
58
350.ВАКЦИНЫ ФОРМИРУЮТ ИММУНИТЕТ
1)пассивный
2)активный
3)быстрый
4)медленный
351.ПРЕИМУЩЕСТВА ИФА ПЕРЕД МЕТОДОМ РИА
1)меньшая стоимость анализа
2)легкость освоения персоналом
3)отсутствие радиоактивных изотопов
4)возможность визуальной оценки результата
352.«СЕНДВИЧ» – АНАЛИЗ ПРИМЕНИМ
1)к поликлональным иммуноглобулинам
2)к ионоклональным антителам
3)как к поли так и к моноклональным антителам
4)к аминокислотам
353.ТОЧНОСТЬ ОПРЕДЕЛЕНИЯ ВЫШЕ В МЕТОДЕ
1)ELISA
2)«СЕНДВИЧ»
3)EMIT
4)РИА
354.В КАЧЕСТВЕ МАРКЕРА В ТЕСТЕ ИФА УСТАНОВЛЕНИЯ ФАКТА БЕРЕМЕННОСТИ ИСПОЛЬЗУЮТ
1)йод-125
2)тритий
3)пероксидазу
4)галактозидазу
355.ГОМОГЕННЫЙ ИФА ОСНОВАН
1)на разделении компонентов после проведения реакции
2)на изменении активности фермента в процессе реакции
3)на адсорбции фермента на носителе
4)на подавление фермента
356.ПО ПРОИСХОЖДЕНИЮ ИММУНОСТИМУЛЯТОРЫ ПОДРАЗДЕЛЯЮТ НА
1)эндогенные
2)экзогенные
3)химические
4)биосинтетические
59
357.ПО ПРОИСХОЖДЕНИЮ ИММУНОСТИМУЛЯТОРЫ ПОДРАЗДЕЛЯЮТ НА
1)эндогенные
2)экстракционные
3)химические
4)биосинтетические
358.ELISA — ТВЕРДОФАЗНЫЙ ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ ЯВЛЯЕТСЯ
1)иммунометрическим
2)конкурентным
3)гомогенным
4)быстрым
359.АКТИВНОСТЬ АЛЬФА-ИНТЕРФЕРОНА ОПРЕДЕЛЯЕТСЯ ПО ЗАЩИТНОМУ ПРОТИВОВИРУСНОМУ ДЕЙСТВИЮ НА КУЛЬТУРУ КЛЕТОК
1)яичников китайского хомячка
2)эмбрионов человека
3)печени обезьяны
4)куринной эмбриональной ткани
360.В ПРОИЗВОДСТВЕ РЕКОМБИНАНТНЫХ В- И У- ИНТЕРФЕРОНОВ ИСПОЛЬЗУЮТ ЭУКАРИОТНЫЕ ПРОДУЦЕНТЫ БЛАГОДАРЯ ИХ СПОСОБНОСТИ ОСУЩЕСТВЛЯТЬ
1)сплайсинг
2)процессинг
3)продуцирование внеклеточных метаболитов
4)гликозилирование белков
361.ВЫДЕЛЕНИЕ И ОЧИСТКУ ИНТЕРФЕРОНОВ ПРОВОДЯТ МЕТОДОМ
1)гель-хроматографии
2)аффинной хроматографии
3)ионнообменной хроматографии
4)адсорбционной хроматографии
362.ПРЕПАРАТЫ РЕКОМБИНАНТНОГО АЛЬФА-ИНТЕРФЕРОНА
1)виферон
2)эгиферон
3)циклоферон
4)линекс
363.РАЗРАБОТАННЫЕ ТЕХНОЛОГИИ РЕКОМБИНАНТНОГО Α- ИНТЕРФЕРОНА ОСНОВАНЫ НА ЭКСПРЕССИИ ГЕНА
60
Источник

Израильские ученые получили штамм кишечной палочки (Escherichia coli), способный к автотрофному питанию, сообщается в Cell. Бактерии, полученные в лаборатории с помощью генной инженерии и селекции, способны создавать органические вещества из углекислого газа в ходе реакций цикла Кальвина. Ожидается, что такая кишечная палочка будет способствовать биосинтезу нужных человеку веществ в промышленных масштабах без отходов в виде диоксида углерода.
Биотехнология давно позволяет внедрять в ДНК бактерий гены других организмов и делать так, чтобы эти гены экспрессировались, а в результате их экспрессии образовывались нужные вещества. Так в промышленных масштабах получают ряд гормонов (инсулин, гормон роста соматотропин), аминокислоты и другие вещества. Большая часть бактерий, которые для этой цели используют, — гетеротрофы. Это означает, что для производства органических веществ им нужны другие органические вещества. Этим они отличаются от автотрофов, которым для создания органики подходит неорганическое сырье — углекислый газ (CO2). Автотрофы поглощают его из воздуха и включают в состав более крупных молекул, такой процесс называется фиксацией углерода.
Учитывая, что содержание CO2 в атмосфере планеты растет, и вместе с этим меняется климат, было бы неплохо перевести биопроизводство на безотходный режим, «научить» бактерии синтезировать органические вещества из углекислого газа, который они же сами (или еще и кто-то другой) и произвели при дыхании. Попытки это сделать уже предпринимали различные группы ученых, но полученным в ходе их экспериментов бактериям для фиксации углерода все же требовались некоторые органические вещества. В лучшем случае такие организмы формировали из диоксида углерода лишь треть биомассы.
Исследователи из Института Вейцмана под руководством Рона Майло (Ron Milo) вывели кишечную палочку, которая может использовать для производства органики только углекислый газ без добавления каких-либо органических веществ. Для этого они добавили в ДНК Escherichia coli гены ферментов, необходимых для реакций цикла Кальвина (в ходе них CO2 превращается в органические вещества), инактивировали часть ферментов, необходимых для нормального обмена веществ гетеротрофам, и поместили полученные бактерии в биореакторы, где атмосфера содержит 10 процентов углекислого газа, а не 0,4 процента, как земная.
Несколько поколений бактерий держали в биореакторах, добавляя в среду некоторое количество сахара ксилозы, чтобы микроорганизмы-гетеротрофы могли выжить. Ксилоза не самый удобный источник углерода, поэтому бактерии, способные получать углерод из углекислого газа, получали в такой среде преимущество. Впервые их выделили из биореакторов через 203 дня после запуска эксперимента, а к 340 дню все бактерии были способны использовать CO2 как материал для построения органических веществ.
Источником энергии для фиксации углерода служила реакция окисления муравьиной кислоты. Хотя это вещество относится к органическим, его атомы E. coli не включали в состав органических молекул, а значит, муравьиная кислота здесь по определению не поддерживала гетеротрофный метаболизм.

A — лабораторная эволюция модифицированных кишечных палочек от бактерий, которым для производства органических веществ нужна ксилоза, до автотрофов, которые получают энергию для синтеза органических веществ за счет окисления муравьиной кислоты (и синтез этот идет только из углекислого газа). B — ход лабораторной эволюции кишечной палочки. Зеленые точки показывают, как менялась доля зависимых от ксилозы бактерий с течением дней
Gleizer et al. / Cell, 2019
Эксперимент показал, что известные бактерии можно в обозримые сроки «настроить» так, чтобы они производили органические вещества только из углекислого газа. Правда, пока полученные кишечные палочки производят больше CO2 при окислении муравьиной кислоты, чем поглощают его для цикла Кальвина. К тому же, нет стопроцентной уверенности, что автотрофных Escherichia coli так же легко получится выращивать в промышленных масштабах, для изучения этого вопроса нужны новые исследования.

Кишечная палочка с измененным метаболизмом: в ней из углекислого газа образуются органические вещества (зеленый цикл), а энергию для этого получают окислением муравьиной кислоты (HCOOH, коричневые стрелки) под действием формиатдегидрогеназы (FDH)
Gleizer et al. / Cell, 2019
Обмен веществ у бактерий очень пластичен, и их геномы легко меняются, благодаря чему возможностями и потребностями этих организмов можно управлять в широких пределах. А E. coli — еще и наиболее изученный микроорганизм. Поэтому неудивительно, что именно на базе ее штаммов создали бактерии с лишними «буквами» в ДНК и, наоборот, клетки с недостающими «словами» генетического кода. Также кишечной палочкой пробовали заменять митохондрии в клетках дрожжей и даже превращали ее в источник жесткого рентгеновского излучения.
Светлана Ястребова
Источник
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
Кишечная палочка — один из первых мемов, с которым сталкиваются дети при знакомстве с биологией (рис. 1а). Запоминающееся, простое и забавное название. Помню, как узнал в детстве, что эта палочка может быть опасной — кто-то мучился животом, а родители сказали, что, наверное, кишечная палочка! Позже, уже в старшей школе, я узнал латинское название этой бактерии, и оно меня удивило, оказавшись каким-то не очень латинским. Оказывается, австрийский педиатр Теодор Эшерих (рис. 1б), который впервые выделил эту палочку из содержимого кишечника в 1885 году, вначале назвал ее благозвучно — Bacterium coli, что означает просто «кишечная бактерия». После ожидаемого пересмотра классификации бактерий род переименовали в честь первооткрывателя. По анекдотическому совпадению очень созвучно — Eschrichtius — называется одно из самых крупных существ на земле — серый кит (рис. 1в). Правда, этого гиганта так назвали в честь другого ученого — датского зоолога Даниэля Эшрихта, работавшего на полвека раньше (рис. 1г). В этом плане другой важной палочке — сенной — повезло больше, поскольку она до сих пор называется Bacillus subtilis, что в переводе — тонкая палочка.
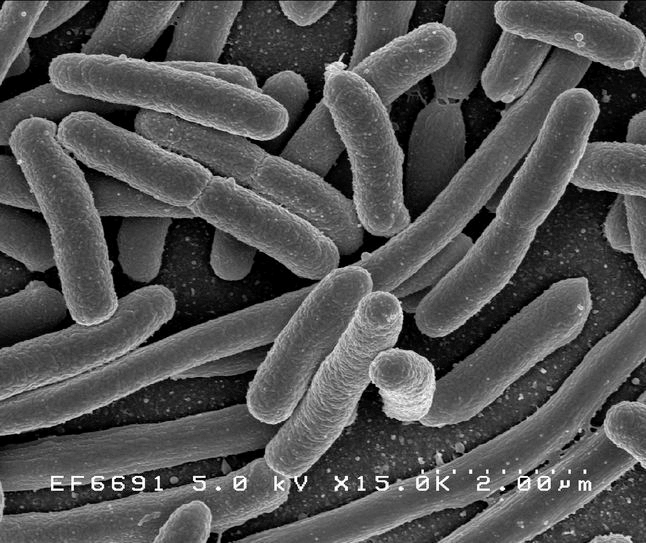
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Кишечная палочка живет… правильно, в кишечнике человека, составляя по численности не более 0,1% нормальной микрофлоры. Как и многие микроорганизмы, эта грамотрицательная палочка очень изменчива и из дружественного — комменсального — компонента микрофлоры кишечника зачастую превращается во вредный — патогенный. Практически каждый сталкивался с «колийной» инфекцией. Например, именно эшерихия вызывает большинство случаев диареи путешественников. В приморских районах местные жители иммунны к штаммам кишечной палочки, населяющим источники воды, поэтому от них страдают туристы. Одним из параметров качества питьевой воды считается косвенный показатель содержания в ней клеток кишечной палочки — так называемый коли-титр. Как и многие патогенные бактерии, кишечная палочка охотно приобретает свойства множественной устойчивости к антибиотикам . Так, в мире растет число случаев возвратного цистита [1] — воспаления мочевого пузыря — и других инфекций, вызванных мультирезистентными штаммами E. coli.
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Одновременно (или вскоре после этого) с помощью штаммов эшерихии были заложены основы современной молекулярной биологии. Французы Франсуа Жакоб и Жак Моно на примере лактозного оперона — серии генов E. coli, кодирующих каскад расщепления сахара лактозы, — раскрыли механизмы регуляции генной экспрессии — «самовыражения» генетического материала в виде работы белков, в данном случае — ферментов. На материале кишечной палочки описаны все процессы передачи информации в клетке: так называемые матричные процессы — репликация ДНК, транскрипция и трансляция. Я помню, как в университете на микробиологии нам раздали учебники Стента и Кэлиндара по молекулярной генетике, издания, кажется, 1981 года. Вначале было непонятно, почему это нужно для микробиологии, а потом оказалось, что материал учебника — кстати, очень непростой для восприятия второкурсника — на две трети описывает эксперименты, проведенные на кишечной палочке и ее вирусах.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
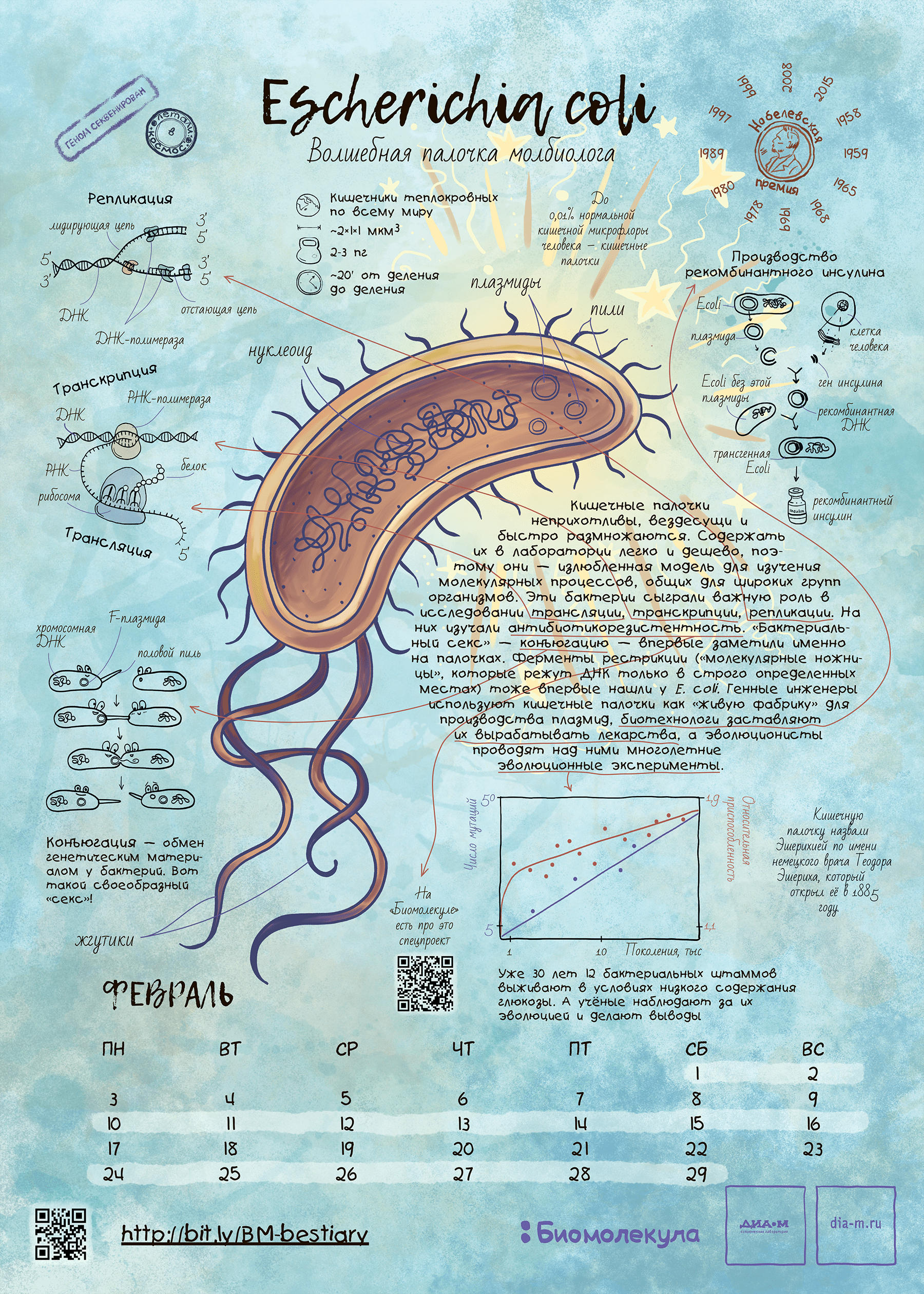
Рисунок 2. Кишечная палочка Escherichia coli как герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, палочка уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
Благодарность
Автор благодарит своего друга — биоинформатика Анну Казнадзей (ИППИ РАН) за ее увлекательный рассказ о новом «лактозном опероне» кишечной палочки, в открытии которого она участвовала.
- Florian Hitzenbichler, Michaela Simon, Thomas Holzmann, Michael Iberer, Markus Zimmermann, et. al.. (2018). Antibiotic resistance in E. coli isolates from patients with urinary tract infections presenting to the emergency department. Infection. 46, 325-331;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Модельные организмы: фаг лямбда;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Молекулярная биология;
- У истоков генетического кода: родственные души;
- Биотехнология. Генная инженерия;
- Anna Kaznadzey, Pavel Shelyakin, Evgeniya Belousova, Aleksandra Eremina, Uliana Shvyreva, et. al.. (2018). The genes of the sulphoquinovose catabolism in Escherichia coli are also associated with a previously unknown pathway of lactose degradation. Sci Rep. 8;
- CRISPR-системы: иммунизация прокариот.
Источник