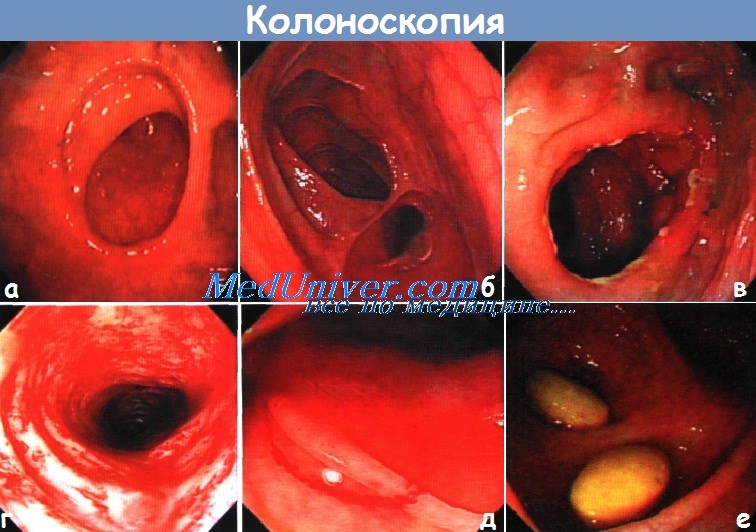
Несостоятельность кишечных швов причина

Несостоятельность анастамоза кишечника – причины, диагностика, лечениеПослеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы). Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%). а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита). б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение. в) Обследование несостоятельности анастамоза кишечника Необходимый минимальный стандарт: Сопутствующие факторы, влияющие на принятие решения:
г) Ведение пациента с несостоятельностью анастамоза кишечника Консервативное ведение: Хирургический подход: • Ранняя симптоматическая несостоятельность (< 7—10 дней) => релапаротомия для поиска дефекта: • Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии: Видео промывания желудка через назогастральный зонд у взрослого |
Источник
За последние десятилетия, несмотря на усовершенствование техники соединения тканей, применение многочисленных методов прогнозирования, профилактики и ранней диагностики, в решении проблемы несостоятельности швов кишечных анастомозов (НШКА) радикальных изменений не наблюдается. Проблема приобретает особую актуальность при экстренной и неотложной резекции кишки на фоне острой кишечной непроходимости (ОКН), распространенного перитонита (РП), раковой и гнойной интоксикации, сочетанной травмы органов брюшной полости, у больных пожилого и старческого возраста.
Не менее сложно определить причины возникновения данного осложнения, среди которых имеют особое значение технические погрешности при формировании анастомоза [8], нарушение кровоснабжения сшиваемых тканей [9], вовлечение в воспалительный процесс стенки кишки, прилегающей к анастомозу, снижение ее защитно-барьерной функции для флоры, вегетирующей в просвете кишечника [10], анемия [13], повышение внутрикишечного давления [3, 14], наличие злокачественного новообразования и его распространенность [11, 17], проведение предоперационной лучевой терапии [11, 18].
Для профилактики данного осложнения используют различные методы и средства, такие как укрепление кишечных швов фибрин-коллагеновой субстанцией ТахоКомб [16], применение аутофибринового клея [5], биоклея ЛАБ [7], укрепление зоны анастомоза демукозированным сегментом подвздошной кишки [15], парамезентериальное введение иммуномодулятора [12], введение препарата энтеросана [6], интубационная декомпрессия, санация и гастроэнтеросорбция с полифепаном [4], перманентная внутрибрыжеечная блокада и лимфотропная терапия [1], лазермагнитотерапия зоны анастомоза [2], санация области анастомоза [10].
Цель работы – профилактика НШКА у больных после экстренной и неотложной резекции кишки при ОКН и РП различной этиологии.
Проанализированы результаты лечения 576 больных, оперированных в экстренном и неотложном порядке в период с 1990 по 2008 г. Из 576 больных 332 составили основную группу (ОГ) и 244 – группу сравнения (ГС).
Из 332 больных ОГ 143 (43,07%) произведена резекция различных сегментов тонкой и толстой кишки по поводу осложненных форм раковой опухоли, 189 (56,93%) – по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 143 больных, оперированных в экстренном и неотложном порядке по поводу осложненных раковых опухолей, 112 (78,32%) проведены радикальные, 31 (21,68%) – паллиативные вмешательства. При радикальных операциях у 73 (65,18%) больных вмешательство завершилось наложением первичных анастомозов, у 39 (34,82%) – формирование энтеро- и колостомы.
Из 189 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 43 (22,75%) диагностирована ущемленная грыжа различной локализации, у 6 (3,18%) – тонко-тонкокишечная (1) и тонко-толстокишечная (5) инвагинация; у 49 (25,93%) – заворот кишки, у 6 (3,18%) – тромбоз и тромбоэмболия мезентеральных сосудов, у 34 (17,99%) – спаечная ОКН, у 15 (7,94%) – перфорация кишки различной этиологии, у 8 (4,23%) – колото-резаные раны, у 10 (5,29%) – огнестрельные ранения, у 17 (8,99%) – закрытые повреждения, у 1 (0,53%) – стеноз анастомоза. Из них у 162 (85,71%) операция завершилась наложением первичных анастомозов, у 27 (14,29%) – формированием энтеро- и колостомы. У 6 больных с первичными анастомозами в левой половине толстой кишки была сформирована разгрузочная цекостома.
Больным ОГ первичных анастомозов было наложено 235 (70,78%): тонко-тонкокишечных – 110 (46,81%), тонко-толстокишечных – 33 (14,04%), толсто-толстокишечных – 92 (39,15%). Проксимальные тонкокишечные анастомозы наложены 24 (10,2%) больным, дистальные тонкокишечные – 65 (27,7%), терминальные тонкокишечные анастомозы – 21 (8,9%), илеоцекоанастомозы – 5 (2,1%), илеоасцендоанастомозы – 6 (2,6%), илеотрансверзоанастомозы – 22 (9,4%), поперечно-поперечноободочные – 3 (1,3%), поперечно-нисходящеободочные – 8 (3,4%), поперечно-сигмовидноободочные – 10 (4,3%), поперечно-прямокишечные – 23 (9,8%), нисходящеободочно-прямокишечные – 48 (20,4%) больным.
Из 244 больных ГС 118 (48,36%) произведены операции по поводу осложненных раковых опухолей тонкой и толстой кишки, 126 (51,64%) – по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 118 больных, оперированных по поводу осложненных раковых опухолей, 71 (60,17%) произведены радикальные и 47 (39,83%) – паллиативные вмешательства. Радикальная операция у 21 (29,58%) больного завершилась наложением 24 первичных анастомозов, у 1 из них с анастомозом на левой половине толстой кишки дополнительно сформирована вспомогательная цекостома. У 50 (70,42%) больных были сформированы энтеро- и колостомы. Из 47 паллиативных операций в 6 (12,77%) были наложены обходные тонко-толстокишечные анастомозы, в 41 (87,23%) – энтеро- и колостомы.
Из 126 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 34 (26,98%) диагностирована ущемленная грыжа различной локализации, у 28 (22,22%) – заворот кишки, у 4 (3,18%) – тромбоз и тромбоэмболия мезентеральных сосудов, у 33 (26,19%) – спаечная ОКН, у 6 (4,76%) – перфорация кишечника различной этиологии, у 5 (3,97%) – колото-резаные раны, у 7 (5,56%) – огнестрельные ранения и у 9 (7,14%) – закрытые повреждения. Из 126 у 80 (63,49%) больных операция завершилась наложением первичного анастомоза, у 46 (36,51%) – формированием энтеро- и колостомы. У 3 больных с первичным анастомозом в левой половине ободочной кишки была сформирована дополнительная разгрузочная цекостома.
Больным ГС произведена резекция тонкой кишки с наложением первичных тонко-тонкокишечных анастомозов в 59 (56,7%) наблюдениях, резекция терминальной части тонкой кишки и правосторонняя гемиколэктомия с наложением илеоколоанастомоза – в 15 (14,4%), резекция толстой кишки с наложением коло-колоанастомоза – в 30 (28,9%). Проксимальные тонкокишечные анастомозы наложены 10 (9,6%) больным, дистальные – 42 (40,4%), терминальные – 7 (6,7%), илеоцекоанастомозы – 1 (0,96%), илеоасцендоанастомозы – 2 (1,9%), илеотрансверзоанастомозы – 12 (11,5%), поперечно-поперечноободочные – 3 (2,9%), поперечно-нисходящеободочные – 2 (1,9%), поперечно-прямокишечные – 14 (13,5%), нисходяще-прямокишечные – 11 (10,6%) больным. В 6 наблюдениях, в которых произведена паллиативная операция, были сформированы обходные илеотрансверзоанастомозы.
Таким образом, у 244 больных ГС было сформировано 110 (45,08%) первичных анастомозов и 141 (57,38%) – энтеро- и колостома. Из 110 первичных анастомозов 80 были наложены больным с неопухолевыми заболеваниями, 30 анастомозов наложены 27 больным со злокачественными опухолями. Среди последних 27 больных 21 произведены радикальные операции (наложено 24 первичных анастомоза, причем в 3 наблюдениях одномоментно сформированы тонко-тонкокишечные и толсто-толстокишечные анастомозы с резекцией тонкой и толстой кишки по поводу инвазии раковой опухоли толстой кишки в тонкую) и 6 больным наложены обходные илеотрансверзоанастомозы.
Из 141 кишечной стомы 49 были сформированы больным с неопухолевыми заболеваниями, причем 3 из них с первичными анастомозами в левой половине ободочной кишки была наложена вспомогательная цекостома. 92 наружных свища были сформированы у больных с осложненной формой рака тонкой и толстой кишки. У 51 больного кишечные стомы были сформированы после радикальных операций и у 41 – после паллиативных.
При соединении концов кишки нами в основном были использованы анастомозы по типу бок в бок. Из 235 анастомозов 175 (74,47%) были наложены по типу бок в бок, 60 (25,53%) – по типу конец в конец. У больных ГС из 110 анастомозов 37 (33,64%) были наложены по типу бок в бок, 68 (61,82%) – по типу конец в конец и 5 (4,55%) – по типу конец в бок.
Для прогнозирования НШКА и определения жизнеспособности резецируемых сегментов кишечника нами были использованы трансиллюминационная ангиотензиометрия и пульсомоторография по М.З. Сигалу и З.М. Сигалу. Для профилактики данного осложнения проводили назоинтестинальную и трансанальную интубацию тонкой и толстой кишки с интра- и послеоперационной декомпрессией, санацию, гастроэнтеросорбцию с полифепаном, перманентную внутрибрыжеечную блокаду и лимфотропную терапию и лазермагнитное облучение области швов анастомоза как во время операции, так и в послеоперационном периоде чрескожно с помощью приборов Орион и двухканального Мустанг-2000.
В ОГ НШКА наблюдалась у 8 (3,40%) из 235 больных, в ГС – у 17 (15,46%) из 110 (см. таблицу), что связано с внедрением комплексных мероприятий по прогнозированию и профилактике ранних послеоперационных осложнений у больных, которым выполнена неотложная резекция кишечника.
что связано с внедрением комплексных мероприятий по прогнозированию и профилактике ранних послеоперационных осложнений у больных, которым выполнена неотложная резекция кишечника.
Методы трансиллюминационной ангиотензиометрии и пульсомоторографии позволили с высокой точностью определить состояние интрамуральной гемодинамики анастомозируемых приводящего и отводящего концов кишки и перистальтической активности кишечника. Первичные анастомозы были наложены больным с максимальным интрамуральным артериальным давлением не ниже 8 кПа (60 мм рт.ст.) с пульсовым кровотоком и амплитудой пульсовой волны более 3 мм.
Для профилактики ранних послеоперационных осложнений больным ОГ проводили комплексные мероприятия. С целью интраоперационной и послеоперационной декомпрессии, санации и гастроэнтеросорбции выполняли назоинтестинальную и трансанальную интубацию желудочно-кишечного тракта. Для назоинтестинальной интубации были использованы зонды: желудочно-кишечный одноканальный и двухканальный силиконовый №25 с наружным диаметром 8,2 мм, длиной 2,5 м, для трансанальной интубации – №33 с наружным диаметром 11,2 мм, длиной 1,4 м. Для гастроэнтеросорбции использовали полифепан. Он положительно влияет на перистальтику кишечника, оказывает адсорбирующее, детоксикационное, антиоксидантное действие, повышает фагоцитарную активность ретикулоэндотелиальной системы, снижает протромбиновый индекс, повышает концентрацию IgA, ускоряет репаративные процессы, стимулирует регенерацию. Препарат не травмирует слизистую желудочно-кишечного тракта, что дает возможность его длительного применения. Сеансы гастроэнтеросорбции проводили 3-4 раза в день. В емкость помещали 300 мл изотонического раствора натрия хлорида, добавляли 20-30 г полифепана (из расчета 0,5-1 г на 1 кг массы тела больного в сутки) и перемешивали жидкость. С помощью шприца Жане вводили раствор с полифепаном фракционно в назоинтестинальный зонд 3-4 раза в день по 200-300 мл с последующим пассивным, а при необходимости активным выведением через 20-30 мин. Больным с тяжелым эндотоксикозом дополнительно проводили сеансы толстокишечного сорбционного диализа.
В послеоперационном периоде выполняли перманентную внутрибрыжеечную блокаду и лимфотропную терапию через катетер, введенный и фиксированный в корне брыжейки тонкой кишки, лекарственным составом, включающим местный анестетик новокаин 0,5% (по 7 мл/кг в сутки), антикоагулянт гепарин (по 150 ЕД/кг в сутки), антихолинэстеразный препарат прозерин (по 0,03 мг/кг в сутки) и антибиотик цефтриаксон (по 15 мг/кг в сутки). Это позволяет блокировать патологическую симпатическую и болевую импульсацию в стенке кишечника, ликвидировать спазм баугиниевой заслонки, быстрее восстановить перистальтику кишечника, что приводит к раннему уменьшению внутрикишечного давления, улучшает крово- и лимфообращение в области швов анастомоза, способствует его заживлению и тем самым предотвращает НШКА.
Для профилактики НШКА проводили также лазермагнитное облучение области швов анастомоза во время операции и в послеоперационном периоде, что способствует улучшению микроциркуляции, ликвидации отека в тканевом шовном валике и первичному заживлению кишечных анастомозов.
Таким образом, экстренная и неотложная резекция кишки должна проводиться с обязательным определением состояния интрамуральной гемодинамики анастомозируемых сегментов объективными методами исследования.
Для профилактики несостоятельности швов у больных с первичными анастомозами на фоне острой кишечной непроходимости и распространенного перитонита целесообразно проведение перманентной внутрибрыжеечной блокады, лимфотропной терапии и местной лазермагнитотерапии.
Проведение назоинтестинальной и трансанальной интубационной декомпрессии, санация и гастроэнтеросорбция полифепаном положительно влияют на процесс заживления анастомозов на фоне перитонита.
Внедрение разработанного комплекса мероприятий по профилактике несостоятельности швов кишечных анастомозов после экстренной и неотложной резекции кишки позволило уменьшить частоту осложнения на 12,06% у больных основной группы по сравнению с контрольной.
Источник
Признаками несостоятельности швов являются: вновь возникшие боли в животе, ухудшение состояния пострадавшего, нарастающая тахикардия и сухость языка, вздутие живота.
Диагностике перитонита помогает УЗИ брюшной полости (наличие свободной жидкости), рентгенологический метод. Появление клиники перитонита является показанием к срочной релапаротомии, которая производится под эндотрахеальным наркозом. После санации брюшной полости оба конца кишки с несостоятельым анастомозом выводят на брюшную стенку в виде стом. Если выведение невозможно, место несостоятельности изолируют от кишки тампонами, к дефекту органа подводят дренаж и накладывают проксимальную стому. При несостоятельности швов желудка и двенадцатиперстной кишки стома накладывается дистальнее, методом выбора является еюностомия по Майдлю.
При наличии дренажа в брюшной полости, диагноз несостоятельности легко устанавливается по поступлению кишечного содержимого по дренажу, если общее состояние больного при этом не страдает, и не появляются признаки перитонита, то это говорит об отграничении процесса и срочная релапаротомия не показана.
При диагностике абсцессов брюшной полости при обзорной рентгенографии выявляются как прямые признаки, (полость содержащая газ, наличие мелких газовых пузырьков), так и косвенные – функциональные нарушения ЖКТ, затемнение участка брюшной полости, смещение и деформация желудка и других отделов кишечника), изменения в грудной клетке. Диагноз подтверждают при УЗИ, КТ брюшной полости.
Для лечения внутрибрюшных абсцессов используют опорожнение и адекватное дренирование с использованием двухпросветных трубок, что обеспечивает закрытый аспирационный метод лечения. В случае развития забрюшинной флегмоны операционный доступ производят в зависимости от распространённости флегмоны одним из люмботомических разрезов. По ходу вскрытой, очищенной гнойной полости укладывают двухпросветные трубки диаметром 8мм и осуществляют дренаж по Каншину.
При атипичной клинике гнойно-воспалительных процессов мягких тканей местные проявления выражаются в незначительных симптомах и в тяжёлой интоксикации, не соответствующей этим симптомам.
Так неклостридиальная анаэробная раневая инфекция проявляется в виде своеобразно протекающего нагноения ран и флегмон брюшной стенки. Выделяют 3 формы заболевания: неклостридиальный целлюлит, миозит и смешанную формы. Неклостридиальный целлюлит – самый частый при анаэробной раневой инфекции, может проявляться в двух вариантах: отёчно- токсическая и отёчно- некротическая. Отёчно – токсический целлюлит проявляется, главным образом, отёчностью тканей, умеренно выраженной гипертермией и слабовыраженной гиперемией. Кожные покровы в зоне инфильтрации нередко бледноваты, флюктуация не определяется, истинные границы поражения пальпаторно определить при этом невозможно. Иногда наблюдается умеренное количество газа в тканях, вовлечённых в воспалительный процесс.
При ревизии раны, которая должна быть произведена как можно раньше, выявляются следующие изменения: подкожная клетчатка имеет сероватый или темносерый цвет, отёчная, местами бесструктурная, пропитана коричневатым или серозно-геморрагическим экссудатом.
В позднем периоде клетчатка приобретает грязно-серый цвет с зонами распада. Необходимо раннее снятие швов, удаление некротически изменённых тканей, ведение вначале открытым способом, активная антибактериальная терапия с применением цефалоспоринов, метронидазола.
Летальность при неклостридиальной инфекции достигает 48-60%.
Сочетанные травмы
Проблема лечения сочетанной травмы в последнюю четверть 20 века заняла одно из ведущих мест, что объясняется её большой социальной значимостью.
Сочетанные повреждения являются одной из трёх основных причин смертности населения, причём у пострадавших в возрасте до 40 лет эта причина выходит на первое место. Ежегодно в мире от травм страдают 20млн человек, на лечение и реабилитацию тратится 200млрд долларов. В России от травм страдает ежегодно более 200тыс человек, затраты составляют – 2 млрд. долларов, погибает 40 тыс. человек. Ежегодно количество пострадавших увеличивается на 8-10%.
Сочетанная травма является специфической категорией повреждений, при которой тяжесть состояния пострадавшего обуславливается не простой суммой повреждений, а рядом взаимно влияющих друг на друга патофизиологических процессов.
Несмотря на то, что эта проблема разрабатывается много лет, летальность и инвалидность остаются высокими. Летальность достигает 23,5-85% , инвалидность 25-80%, и превышает в 10 раз таковую при изолированных повреждениях.
Неудовлетворительные результаты лечения пострадавших связаны с отсутствием единой тактики оказания помощи при тяжёлой сочетанной травме, лечением большой части пострадавших в общехирургических стационарах и недостаточным представлением хирургов об особенностях хирургической тактики при сочетанных повреждениях.
Сочетанной травмой считается повреждение внутренних органов в двух полостях и более или внутренних органов и элементов опорно-двигательной системы, например, органов брюшной полости и переломы костей конечностей, черепномозговая травма и повреждение тазовых органов и т.д.
Согласно клинико-анатомической классификации НИИ скорой помощи им. Н.В.Склифосовского (1990г), все виды сочетанной травмы можно разделить на 7 групп:
I группа – сочетанная черепномозговая травма
II группа – сочетанная травма спинного мозга
III – сочетанная травма груди
IV- сочетанная травма живота и органов забрюшинного пространства
V – сочетанная травма опорно-двигательного аппарата
VI –сочетанная травма с двумя и более тяжёлыми (доминирующими) повреждениями, VII- сочетанная травма без ведущих повреждений, то есть относительно лёгких с благоприятным ближайшим и отдалённым прогнозом.
Множественная сочетанная травма отличается особой тяжестью клинических проявлений, сопровождающихся значительным расстройством жизненно важных функций организма, трудностью диагностики, сложностью лечения. Сочетанная травма часто сопровождается травматическим шоком, расстройством кровообращения и дыхания, иногда терминальным состоянием.
Для сочетанной травмы характерны следующие особенности:
1) Наблюдается так называемый синдром взаимного отягощения (кровопотеря способствует развитию шока и его усугублению, в свою очередь это ухудшает течение травмы и прогноз)
2) Нередко сочетание повреждений создаёт особые трудности при лечении больных ( несовместимость терапии)
3) Учащается развитие таких тяжёлых осложнений, приводящих больного к критическому состоянию, как массивная кровопотеря, шок, токсемия, острая почечная недостаточность, тромбоэмболия, жировая эмболия
4) Наблюдается стёртость и извращение клинических симптомов при сочетании черепномозговой и травмы живота, также как и при другой сочетанной травме, что приводит к диагностическим ошибкам
При оказании медицинской помощи и лечении больных с сочетанной травмой должна быть определённая последовательность действий врача:
v определение тяжести состояния
v выявление кровотечения- наружного, внутреннего
v выявление как наиболее опасных для жизни повреждений, так и менее опасных повреждений (костных)
v одновременно производится реанимационные мероприятия вкупе с диагностикой повреждений. Если по ходу диагностического поиска выясняется, что больному показано оперативное вмешательство, то оно может быть неотложным, экстренным по жизненным показаниям ( наружное или внутреннее кровотечение)
Экстренная лапаротомия выполняется при геморрагическом шоке и достоверном прогрессирующем гемоперитонеуме, при этом часто возникает необходимость выполнения симультанных операций для спасения жизни больного: сочетание дренирования плевральной полости и лапаротомии.
К срочным относят операции у пострадавших с разрывом полых органов, повреждением сосудов, травматическими ампутациями, требующие кратковременной подготовки в течение 3-6 часов в условиях реанимационного отделения или операционной.
Отсроченные операции выполняются в сроки от 2 суток и более после травмы (остеосинтез перелома, наложение аппарата Илизарова и т.д.).
Диагностический алгоритм при тяжёлой механической сочетанной и травме включает:
– первичное определение характера повреждений анатомических областей
– выявление доминирующих повреждений с выделением угрожающих жизни последствий
– определение их роли в тяжести состояния пострадавшего и установлении показаний к реанимации
– диагностика повреждений отягощающих (не отягощающих) течение ведущей травмы
– традиционные рентгенологические исследования живота, груди, черепа, конечностей
– в течении последних лет ведущее место в диагностике повреждений живота и груди принадлежит УЗИ
– лапароцентез (« перитонеальный лаваж») торакоцентез
– по показаниям КТ исследование, особенно при сочетании с тяжёлой черепномозговой травмой
КТ обладает высокой диагностической точностью, большой разрешающей способностью и специфичностью, однако её применение резко ограничено при нестабильной гемодинамике, нетранспортабельности, проведении реанимационных мероприятий. Отсутствие или извращение клинических симптомов повреждения органов брюшной полости у пострадавших с сочетанной травмой диктует необходимость применения инструментальных методов обследования.
При тяжёлых сочетанных повреждениях от скорости выполнения методов исследования и их информативности напрямую зависит быстрота, объём и характер медицинской помощи и, в конечном итоге, исход травмы.
Простым, быстрым, неинвазивным методом диагностики повреждения органов брюшной полости является УЗИ, но информативность его ограничена при повреждении полых органов. Щадящим методом является лапароцентез, наиболее достоверную информацию даёт промывание брюшной полости – «перитонеальный лаваж».
Хирургическая тактика при множественных повреждениях органов брюшной полости. Если при лапаротомии обнаруживается кровь, то, прежде всего, следует быстро найти источник кровотечения и временно остановить его. Дальнейшая ревизия органов брюшной полости начинается с обследования печени, селезёнки, поджелудочной железы, почек, тонкой и толстой, прямой кишки и мочевого пузыря. Поскольку при ранениях паренхиматозных органов чаще всего повреждается печень, затем селезёнка, обследование следует производить в той же последовательности.
Источник