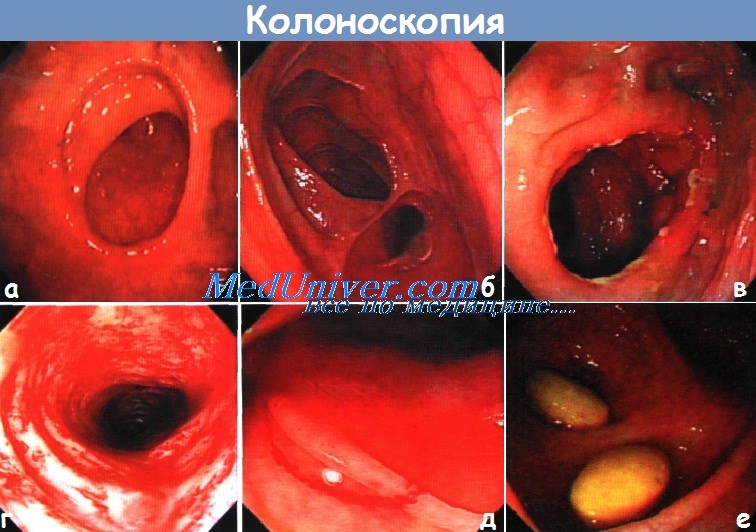
Несостоятельность пищеводно кишечного анастомоза

Несостоятельность анастамоза кишечника – причины, диагностика, лечениеПослеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы). Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%). а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита). б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение. в) Обследование несостоятельности анастамоза кишечника Необходимый минимальный стандарт: Сопутствующие факторы, влияющие на принятие решения:
г) Ведение пациента с несостоятельностью анастамоза кишечника Консервативное ведение: Хирургический подход: • Ранняя симптоматическая несостоятельность (< 7—10 дней) => релапаротомия для поиска дефекта: • Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии: Видео промывания желудка через назогастральный зонд у взрослого |
Источник
В структуре заболеваемости злокачественными новообразованиями в России рак желудка и пищевода занимает ведущие позиции [1]. Сегодня наиболее эффективным методом лечения этих заболеваний является хирургический. Однако, несмотря на все возможности современной хирургии, сложность и травматичность проводимых операций влекут за собой ряд осложнений. Одним из самых тяжелых осложнений таких операций является несостоятельность швов эзофагогастроанастомоза и эзофагоеюноанастомоза, что может стать причиной эмпиемы плевры, медиастинита, пищеводно-трахеального свища, сепсиса и летального исхода. По данным последних исследований [2], частота несостоятельности пищеводного соустья составляет от 3 до 25%, а летальность в данной группе пациентов достигает 60%.
Основными задачами лечения несостоятельности шов анастомоза являются закрытие свищевого отверстия, санация полости затека, обеспечение нутритивной поддержки, а также профилактика и лечение гнойных осложнений. В прошедшие годы с развитием эндоскопических технологий для лечения несостоятельности анастомозов применяли различные методики, такие как клипирование, фибриновый клей, ушивание отверстия с использованием эндоскопических устройств, стентирование самораскрывающимися металлическими и пластиковыми стентами [3, 4]. Методом выбора в течение долгого времени служило стентирование с хорошим клиническим результатом до 80% [5]. Однако процедура стентирования имеет ряд осложнений, таких как миграция стента, врастание в окружающие ткани с образованием стриктуры после его удаления [6—8].
С 2006 г. стал доступным новый метод лечения данного осложнения — эндоскопическая вакуумно-аспирационная терапия (ВАТ) [9]. В хирургической практике вакуумная терапия используется с 1950 г. [10] для лечения раневых инфекций. Принцип ВАТ основан на продолжительном локальном воздействии отрицательного давления на рану, что уменьшает локальный отек, способствует усилению местного кровообращения, снижает уровень микробной обсемененности раны, уменьшает раневую полость и приводит тем самым к ускорению заживления раны [11].
Внутрипросветная вакуумная терапия с использованием губки впервые применена для лечения несостоятельности колоректальных анастомозов [12, 13]. В дальнейшем методика получила свое развитие в лечении несостоятельности анастомозов верхних отделов желудочно-кишечного тракта [14, 15] и стала активно применяться отдельными авторами как альтернативный метод лечения [16, 17].
В 2015—2018 гг. на базе хирургического эндоскопического отделения НМИЦ хирургии им. А.В. Вишневского пролечены 10 пациентов с использованием вакуумно-аспирационной системы (ВАС) при несостоятельности анастомозов верхних отделов желудочно-кишечного тракта. Средний возраст пациентов составил 55,7 года (48—70 лет). По поводу злокачественных новообразований пищевода или желудка оперированы 9 пациентов, из них у 2 выполнена расширенная гастрэктомия с еюногастропластикой, у 4 — субтотальная эзофагэктомия с пластикой изоперистальтической желудочной трубкой, у 1 — проксимальная резекция желудка и нижней трети пищевода с еюногастропластикой, у 2 — резекция пищевода с пластикой желудочной трубкой. Еще у 1 пациента с многочисленными оперативными вмешательствами в анамнезе по поводу рецидивной грыжи пищеводного отверстия диафрагмы выполнены ререзекция желудка с резекцией эзофагогастроанастомоза и еюногастропластика (реконструкция по типу операции Merendino—Dillard).
Несостоятельность эзофагогастро-, эзофагоэнтероанастомоза у данных пациентов диагностирована на 6±2-е сутки после проведенных операций. Всем пациентам предприняли попытку консервативной терапии (с целью самостоятельного закрытия дефекта), однако ввиду ее неэффективности на 14±5-е сутки начали лечение с использованием ВАС.
Все манипуляции проводили после тщательного обследования пациента с целью уточнения расположения, размера дефекта анастомоза, а также выявления затеков в средостение, плевральную или брюшную полости. Несостоятельность анастомоза диагностировали при рентгенологическом исследовании верхних отделов желудочно-кишечного тракта с использованием водорастворимого контрастного препарата (рис. 1).  Рис. 1. Рентгенограмма верхних отделов желудочно-кишечного тракта с водорастворимым контрастом у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
Рис. 1. Рентгенограмма верхних отделов желудочно-кишечного тракта с водорастворимым контрастом у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
Для определения размера и локализации затеков в средостении, плевральных или брюшной полостях и динамики их уменьшения пациентам выполнена КТ с пероральным контрастированием (рис. 2).  Рис. 2. Компьютерная томограмма пациента после низведения желудка, проксимальной резекции желудка с резекцией эзофагогастроанастомоза и еюногастропластики. Желтой стрелкой указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
Рис. 2. Компьютерная томограмма пациента после низведения желудка, проксимальной резекции желудка с резекцией эзофагогастроанастомоза и еюногастропластики. Желтой стрелкой указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
Помимо этого, для предварительной оценки зоны несостоятельности анастомоза, ее размеров и расположения всем пациентам выполнена ЭГДС (рис. 3).  Рис. 3. Эндоскопическая картина у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указан просвет желудочной трубки, черными — зона несостоятельности анастомоза.
Рис. 3. Эндоскопическая картина у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указан просвет желудочной трубки, черными — зона несостоятельности анастомоза.
Эндоскопическую установку ВАС проводили под общей анестезией с интубацией трахеи в положении пациента лежа на спине. При первичном осмотре определяли уровень пищеводного анастомоза (в см) от резцов и размеры дефекта соустья. При наличии затека по возможности проводили эндоскопическую ревизию полости с оценкой ее размеров.
При создании эндоскопической ВАС использовали губчатую систему с открытыми сообщающимися ячейками для лечения осложненных и хронических раневых инфекций размером 10×7,5 см и толщиной 3,3 см (рис. 4, А).  Рис. 4. Пошаговое моделирование вакуумно-аспирационной системы. А — губчатая система с открытыми сообщающимися ячейками размером 10×7,5 см и толщиной 3,3 см; Б — моделирование губки в форме цилиндра; В — назогастральный зонд, на котором моделировали систему; Г — фиксация губки на дистальном конце зонда; Д — фиксация губки проксимально; Е — окончательный вид системы. Такие размеры губки позволяли сделать 2 ВАС с использованием стандартного зонда для аспирации содержимого желудка.
Рис. 4. Пошаговое моделирование вакуумно-аспирационной системы. А — губчатая система с открытыми сообщающимися ячейками размером 10×7,5 см и толщиной 3,3 см; Б — моделирование губки в форме цилиндра; В — назогастральный зонд, на котором моделировали систему; Г — фиксация губки на дистальном конце зонда; Д — фиксация губки проксимально; Е — окончательный вид системы. Такие размеры губки позволяли сделать 2 ВАС с использованием стандартного зонда для аспирации содержимого желудка.
Губку моделировали в форме цилиндра диаметром, не превышающим диаметр пищевода, и длиной, перекрывающей минимум на 2 см дистальную и проксимальную границы зоны несостоятельности (см. рис. 4, Б). В губку проводили «желудочный» зонд и фиксировали его 2 швами — на дистальном конце зонда и проксимально (см. рис. 4, В, Д). Здесь же из лигатур формировали 2 петли для позиционирования губки. На рис. 4. Е представлен окончательный вид ВАС.
Для установки ВАС применяли собственную разработанную методику. С этой целью использовали overtube с внутренним полым стилетом, через который можно провести эндоскоп (рис. 5, А—В).  Рис. 5. Overtube с внутренним полым стилетом — А и Б; В — внешний вид эндоскопа с надетым на него overtube.
Рис. 5. Overtube с внутренним полым стилетом — А и Б; В — внешний вид эндоскопа с надетым на него overtube.
Это приспособление (overtube) под эндоскопическим контролем устанавливали в просвет пищевода до зоны несостоятельности анастомоза. В дальнейшем по нему с помощью внутреннего стилета проводили ВАС (рис. 6, А;  Рис. 6. Эндоскопическая картина установки и позиционирования вакуумно-аспирационной системы. А — система проведена в просвет пищевода; Б — вдоль системы проведен зонд для питания; В, Г — эндоскопически ассистированное позиционирование системы. рис. 7, А).
Рис. 6. Эндоскопическая картина установки и позиционирования вакуумно-аспирационной системы. А — система проведена в просвет пищевода; Б — вдоль системы проведен зонд для питания; В, Г — эндоскопически ассистированное позиционирование системы. рис. 7, А).  Рис. 7. Схема установки и позиционирования вакуумно-аспирационной системы. А — система проведена через overtube в просвет пищевода к зоне анастомоза; Б — overtube извлечен, вдоль системы проведен зонд для питания на противоположной стороне от зоны несостоятельности; В, Г — эндоскопически ассистированное позиционирование системы.
Рис. 7. Схема установки и позиционирования вакуумно-аспирационной системы. А — система проведена через overtube в просвет пищевода к зоне анастомоза; Б — overtube извлечен, вдоль системы проведен зонд для питания на противоположной стороне от зоны несостоятельности; В, Г — эндоскопически ассистированное позиционирование системы.
После этого overtube извлекали из просвета пищевода и следующим этапом мимо ВАС через инструментальный канал в просвет тонкой кишки устанавливали зонд для питания, позиционируемый вдоль ВАС с противоположной стороны от зоны несостоятельности (см. рис. 6, Б; 7, Б). Окончательным этапом выполняли эндоскопически ассистированное позиционирование ВАС в область несостоятельности анастомоза таким образом, чтобы зона дефекта располагалась непосредственно посередине губки (рис. 8).  Рис. 8. Эндоскопическая картина соотношения вакуумно-аспирационной системы (желтые стрелки) и зоны несостоятельности анастомоза (красные стрелки).
Рис. 8. Эндоскопическая картина соотношения вакуумно-аспирационной системы (желтые стрелки) и зоны несостоятельности анастомоза (красные стрелки).
Это достигалось путем захватывания ранее сформированных лигатурных петель на проксимальном и дистальном концах губки с помощью эндоскопической цапки, проведенной через инструментальный канал (см. рис. 6, В, Г; 7, В, Г).
После установки и позиционирования губки проксимальный конец ВАС и несущий ее зонд выводили через нос и подключали к активной аспирации с разрежением 100—110 мм рт.ст.
После установки ВАС пациентов переводили в палаты общего профиля на самостоятельном дыхании. Лечение дополняли антибактериальной и инфузионной терапией, а также энтеральным зондовым питанием.
На 3—5-е сутки удаляли аспирационную систему и эндоскопически контролировали динамику размеров дефекта. При визуальном отсутствии несостоятельности (рис. 9)  Рис. 9. Эндоскопическая картина у пациента после резекции желудка, нижней трети пищевода, интерпозиции сегмента тощей кишки по типу еюногастропластики, несостоятельности эзофагоеюноанастомоза и 3 сеансов лечения с помощью вакуумно-аспирационной системы. Полное закрытие дефекта в зоне пищеводного соустья. ВАС удаляли и выполняли контрольное рентгенологическое исследование с водорастворимым контрастом. При сохранении дефекта ВАС устанавливали повторно.
Рис. 9. Эндоскопическая картина у пациента после резекции желудка, нижней трети пищевода, интерпозиции сегмента тощей кишки по типу еюногастропластики, несостоятельности эзофагоеюноанастомоза и 3 сеансов лечения с помощью вакуумно-аспирационной системы. Полное закрытие дефекта в зоне пищеводного соустья. ВАС удаляли и выполняли контрольное рентгенологическое исследование с водорастворимым контрастом. При сохранении дефекта ВАС устанавливали повторно.
В таблице  Основные данные о лечении пациентов с помощью вакуумно-аспирационной системы суммированы основные данные о лечении пациентов с помощью ВАС. Средняя продолжительность первичной манипуляции составила 78 мин. Замену ВАС проводили каждые 3—5 дней, длилась она в среднем около 50 мин.
Основные данные о лечении пациентов с помощью вакуумно-аспирационной системы суммированы основные данные о лечении пациентов с помощью ВАС. Средняя продолжительность первичной манипуляции составила 78 мин. Замену ВАС проводили каждые 3—5 дней, длилась она в среднем около 50 мин.
У 9 пациентов систему удалили после 2—5 сеансов (в среднем на 11-е сутки) с полным закрытием дефекта. У 1 пациента после 5 сеансов в области несостоятельности образовалась отграниченная полость, заполненная грануляциями, ВАС удалена. Эффект лечения у всех пациентов подтвержден рентгеноскопией с пероральным приемом контрастного препарата с визуализацией зоны эзофагоанастомоза. Несостоятельность швов пищеводного соустья ликвидирована у всех больных.
Таким образом, эндоскопическая ВАТ — новый, минимально инвазивный способ лечения несостоятельности пищеводных анастомозов различной локализации. Более того, данная методика может успешно применяться как в гастроинтестинальной, так и в колоректальной, а также в бариатрической хирургии. ВАТ также является экономически выгодной манипуляцией по сравнению не только с повторной операцией, но и с другими минимально инвазивными методами лечения несостоятельности анастомоза.
В целом эндоскопическую ВАТ можно рассматривать как инновационный и перспективный метод выбора в лечении несостоятельности различных анастомозов верхних отделов желудочно-кишечного тракта. Важно отметить, что ВАТ требует большого опыта и навыка команды эндоскопических хирургов, а также анестезиологов-реаниматологов для обеспечения анестезиологического пособия и оказания интенсивной терапии в периоперационном периоде.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Старков Ю.Г. — e-mail: ygstarkov@gmail.com
Выборный М.И. — e-mail: m.vyborniy@hospital.ru
Ручкин Д.В. — e-mail: ruchkindmitry@gmail.com
Джантуханова С.В. — e-mail: sedana.dz@gmail.com
Замолодчиков Р.Д. — e-mail: rzamolod@yandex.ru
Воробьева Е.А. — e-mail: vlizaveta1993@gmail.com
Автор, ответственный за переписку: Выборный М.И. — e-mail: m.vyborniy@hospital.ru
Старков Ю.Г., Выборный М.И., Ручкин Д.В., Джантуханова С.В., Замолодчиков Р.Д., Воробьева Е.А. Эндоскопическое лечение несостоятельности пищеводных анастомозов с использованием вакуумно-аспирационной системы. Хирургия. Журнал им. Н.И. Пирогова. 2019;10:13-20. https://doi.org/10.17116/hirurgia2019101
Источник
Оглавление темы “Лапароскопия.”:
1. Лечение ранних послеоперационных кишечных свищей.
2. Кишечный свищ. Классификация кишечных свищей.
3. Скрытая несостоятельность кишечного анастомоза.
4. Хирургическая рана. Классификация ран.
5. Профилактика инфецирования хирургических ран.
6. Ведение неосложненных ран. Лечение нагноений ран.
7. Лапароскопия. Значение лапароскопии.
8. Показания к лапароскопии. Лапароскопия при травме живота.
9. Лапароскопия при ранениях живота.
10. Клинико-анатомическая конференция. Формат клинико-анатомической конференции.
Скрытая несостоятельность кишечного анастомоза.
Прошла неделя после экстренной гемиколэктомии по поводу обтурирующей карциномы слепой кишки у вашей пациентки. Она уже находится дома, чувствует себя неплохо и самостоятельно ест, но вдруг у нее вновь возникает приступ болей в правой половине живота, сопровождающийся рвотой.
Пациентку снова доставляют в приемное отделение. У нее лихорадка, в правой половине живота пальпируется болезненный инфильтрат, на обзорной рентгенограмме брюшной полости — картина, заставляющая заподозрить кишечную непроходимость. Лейкоцитоз повышен. Вы подозреваете несостоятельность анастомоза.
С клинической точки зрения, существуют 3 типа несостоятельности кишечного шва, которые можно идентифицировать.
• Свободная утечка. Анастомоз негерметичен, а утечка не отграничена прилежащими структурами. Состояние пациента обычно ухудшается, появляются симптомы диффузного перитонита. Показана экстренная релапаротомия, как уже указывалось выше.
• Отграниченная утечка. В этом случае вытекающее кишечное содержимое частично отграничивается сальником и прилежащими органами. Клинически симптомы раздражения брюшины локализованы. Последствием этого является формирование околокишечного абсцесса.
• Мини-утечка. Подобное незначительное проникновение кишечного содержимого возникает в поздние сроки после операции, когда анастомоз уже в основном сформирован. Абдоминальные симптомы строго локализованы, и у пациента нет каких-либо проявлений интоксикации. Это действительно перианастомозит — воспалительная инфильтрация вокруг анастомоза. Обычно при этом не происходит формирования какого-либо гнойника.
При отсутствии диффузного перитонита вы должны документировать несостоятельность анастомоза и определить лечебную тактику. Толстокишечый анастомоз лучше всего визуализировать с помощью контрастной клизмы с гастрогра-фином. А для исследования анастомозов верхних отделов ЖКТ гастрографин необходимо давать перорально. Мы обычно сочетаем подобные контрастные исследования с КТ, пытаясь выявить проникновение контрастного вещества в свободную брюшную полость либо зафиксировать формирование гнойника в зоне анастомоза.
При этом также возможно несколько вариантов:
• Свободное проникновение контрастного вещества в брюшную полость; большое его количество и жидкость в животе на КТ. Больного необходимо срочно оперировать. Предварительно мы обсудили, что делать во время операции, — лучше всего резецировать участок кишки с анастомозом.
• Отграниченное скопление контрастного препарата — абсцесс на КТ. Остальные отделы брюшной полости интактны.
• Утечки контрастного вещества не отмечено, выявлена лишь перианастомотическая инфильтрация. Такой перианастомозит обычно разрешается после нескольких дней лечения антибиотиками.
Учтите, что заметная локальная утечка контрастного вещества или его мини-утечка связаны с обструкцией анастомоза воспалительным отеком. Такая обструкция обычно разрешается самостоятельно — примерно за 1 нед, после дренирования гноя и уменьшения отека.
Мы показали вам, что несостоятельность анастомоза не является «одной болезнью». Это спектр состояний, требующих дифференцированного подхода. Чтобы не допускать осложнений, соотносите проводимое лечение с конкретными условиями несостоятельности анастомоза, величиной дефекта и состоянием пациента. Но прежде всего помните, что недренированные скопления в брюшной полости кишечного содержимого или гноя — это убийцы, часто «молчаливые».
Мы склонны лучше помнить тех больных, которых едва не погубили; и мы никогда не забываем тех из них, которых мы действительно довели до гибели.
– Также рекомендуем “Хирургическая рана. Классификация ран.”
Источник