Переваривание белков в желудочно кишечном тракте
Переваривание белков в желудочно-кишечном тракте
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
1. денатурирует белки;
2. стерилизует пищу;
3. вызывает набухание труднорастворимых белков;
4. активирует пепсиноген;
5. создает рН-оптимум для действия пепсина;
6. способствует всасыванию железа;
7. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5–2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0–4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5–8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Данный текст является ознакомительным фрагментом.
Читайте также
Изменения белков[43]
Изменения белков[43]
Те участки генома, которые кодируют белки, изменились на удивление мало. Различия в аминокислотных последовательностях белков у человека и шимпанзе составляют значительно менее 1 %, да и из этих немногочисленных различий большая часть либо не имеет
Глава 2. Строение и функции белков
Глава 2. Строение и функции белков
Белки – высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных в полипептидные цепи с помощью пептидных связей, и имеющие сложную структурную организацию.История изучения белковВ 1728 г.
Уровни структурной организации белков
Уровни структурной организации белков
Первичная структура – строго определенная линейная последовательность аминокислот в полипептидной цепочке.Стратегические принципы изучения первичной структуры белка претерпевали значительные изменения по мере развития и
Функционирование белков
Функционирование белков
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных
Посттрансляционные изменения белков
Посттрансляционные изменения белков
Многие белки синтезируются в неактивном виде (предшественники) и после схождения с рибосом подвергаются постсинтетическим структурным модификациям. Эти конформационные и структурные изменения полипептидных цепей получили
Переваривание углеводов
Переваривание углеводов
В слюне содержится фермент ?-амилаза, расщепляющая ?-1,4-гликозидные связи внутри молекул полисахаридов.Переваривание основной массы углеводов происходит в двенадцатиперстной кишке под действием ферментов панкреатического сока – ?-амилазы,
Глава 19. Липиды тканей, переваривание и транспорт липидов
Глава 19. Липиды тканей, переваривание и транспорт липидов
Липиды – неоднородная в химическом отношении группа веществ биологического происхождения, общим свойством которых является гидрофобность и способность растворяться в неполярных органических растворителях.
Липиды пищи, их переваривание и всасывание.
Липиды пищи, их переваривание и всасывание.
Взрослому человеку требуется от 70 до 145 г липидов в сутки в зависимости от трудовой деятельности, пола, возраста и климатических условий. При рациональном питании жиры должны обеспечивать не более 30% от общей калорийности
Расщепление белков в тканях
Расщепление белков в тканях
Осуществляется с помощью протеолитических лизосомальных ферментов катепсинов. По строению активного центра выделяют цистеиновые, сериновые, карбоксильные и металлопротеиновые катепсины. Роль катепсинов:1. создание биологически активных
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
Нуклеиновые кислоты поступают в организм с пищей главным образом в составе нуклеопротеинов и высвобождаются в результате действия протеолитических ферментов желудочно-кишечного тракта. Далее под
Характеристика белков сыворотки крови
Характеристика белков сыворотки крови
Белки системы комплемента – к этой системе относятся 20 белков, циркулирующих в крови в форме неактивных предшественников. Их активация происходит под действием специфических веществ, обладающих протеолитической активностью.
Глава 4. Нарушения нормальных функций желудочно-кишечного тракта
Глава 4. Нарушения нормальных функций желудочно-кишечного тракта
Различные нарушения в работе желудочно-кишечного тракта могут быть как временными, так и длительными, возникшими в результате болезни. В обоих случаях владельцу собаки трудно самому установить причину
5 Болезни желудочно-кишечного тракта
5
Болезни желудочно-кишечного тракта
Собаки – животные плотоядные. Тем не менее, их организм приспособился к потреблению и усвоению питательных веществ рациона, состоящего из смеси различных кормов.
В процессе пищеварения белки, жиры и углеводы пищи подвергаются
Желудочно-кишечный тракт
Желудочно-кишечный тракт
Строение пищевода и однокамерного желудка собаки – стандартное для хищников. 12-перстная кишка висит на короткой брыжейке. От пилорической части желудка она отходит в правое подреберье, направляется вдоль печени по правой стенке брюшной полости
3.8. Защитные системы желудочно-кишечного тракта
3.8. Защитные системы желудочно-кишечного тракта
Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
3.8. Защитные системы желудочно-кишечного тракта
3.8. Защитные системы желудочно-кишечного тракта
Теория адекватного питания придает большое значение системам защиты организма от проникновения различных вредных веществ в его внутреннюю среду. Поступление пищевых веществ в желудочно-кишечный тракт следует
Источник
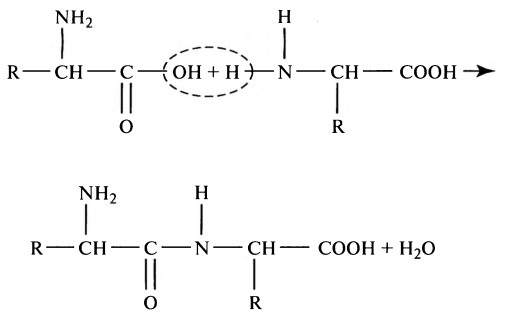
Переваривание белков. Этапы и последовательность переваривания белкова) Пищевые белки. Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Далее представлена типичная связь:
Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот. Физические и химические характеристики различных белков, важных для человека, изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). б) Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в отдельной статье на сайте (просим вас пользоваться формой поиска выше), железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.
Как показано на рисунке выше, пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами. в) Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы (для облегчения понимания просим вас изучить рисунок выше). Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. г) Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
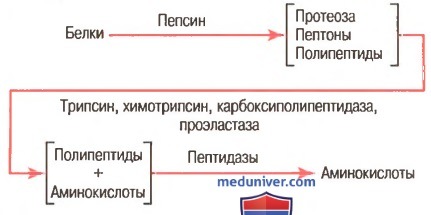
Переваривание белков происходит в 3 этапа:в желудке;в тонком кишечнике;в клетках слизистой оболочки тонкого кишечника.
Расщепление белков происходит при участии нескольких групп ферментов:
Эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи.
Экзопептидазы – катализирует разрыв концевой пептидной связи с образованием одной какой-либо аминокислоты.
К эндопептидазам относятся следующие ферменты: пепсин, гастрин, трипсин, химотрипсин, эластаза.
К экзопептидазам относятся: карбоксипептидазы, аминопептидазы, дипептидазы.
1.Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Железы желудка секретируют большое количество соляной кислоты. Когда кислота смешивается с желудочным содержимым, рН составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина.
Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. Пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы (крупные полипептиды), пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
2.Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы.
Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов.
3.Переваривание белков пептидазами энтероцитов. Заключительный этап переваривания белков обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью.
Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дипептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита, где перевариваются до конечной стадии в форме отдельных аминокислот, а отсюда в кровь.
28. Катаболизм аминокислот: образование и обезвреживание аммиака. Токсичность аммиака. Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы. Основными источниками аммиака являются следующие реакции:
неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
Так как аммиак является чрезвычайно токсичным соединением, то в тканях существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата.
1.Синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратнареакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
реакция синтеза глутаминовой кислоты.
2.Синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачиваниеплазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин –является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ- аминомасляной кислоты(ГАМК), тормозного медиатора нервной системы.
В клетки печени и почек аммиак попадает в составе глутаминаи аспарагина, глутаминовой кислоты, аланинаи в свободномвиде и идет на синтез мочевины.
Источник