Переваривание и всасывание липидов в желудочно кишечном тракте
В полости рта липиды подвергаются лишь механической обработке. В желудке имеется небольшое количество липазы, которая гидролизует жиры. Малая активность липазы желудочного сока связана с кислой реакцией содержимого желудка. Кроме того, липаза может влиять только на эмульгированные жиры, в желудке отсутствуют условия для образования эмульсии жира. Только у детей и у моногастричных животных липаза желудочного сока играет важную роль в переваривании липидов.
Кишечник является основным местом переваривания липидов. В двенадцатиперстной кишке на липиды воздействует желчь печени и сок поджелудочной железы, одновременно происходит нейтрализация кишечного содержимого (химуса). Происходит эмульгирование жиров под действием желчных кислот. В состав желчи входят: холевая кислота, дезоксихолевая (3,12 дигидроксихолановая), хенодезоксихолевая (3,7 дигидроксихолановая) кислоты, натриевые соли парных желчных кислот: гликохолевая, гликодезоксихолевая, таурохолевая, тауродезоксихолевая. Они состоят из двух компонентов: холевой и дезоксихолевой кислот, а также глицина и таурина.
дезоксихолевая кислота хенодезоксихолевая кислота
гликохолевая кислота
таурохолевая кислота
Соли желчных кислот хорошо эмульгируют жиры. При этом увеличивается площадь соприкосновения ферментов с жирами и увеличивается действие фермента. Недостаточность синтеза желчных кислот или задержка поступления нарушает эффективность действия ферментов. Жиры, как правило, всасываются после гидролиза, но часть тонко эмульгированных жиров всасывается через стенку кишечника и переходит в лимфу без гидролиза.
Эстеразы разрывают в жирах эфирную связь между, спиртовой группой и карбоксильной группой карбоновых кислот и неорганических кислот (липаза, фосфатазы).
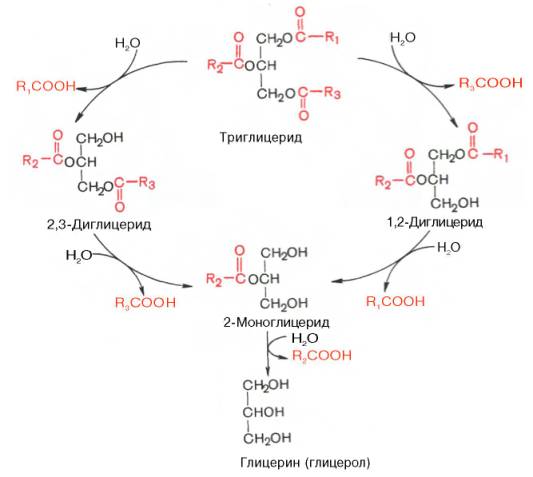
Под действием липазы жиры гидролизуются на глицерин и высшие жирные кислоты. Активность липазы возрастает под действием желчи, т.е. желчь непосредственно активирует липазу. Кроме того, активность липазы увеличивают ионы Са++ вследствие того, что ионы Са++ образуют нерастворимые соли (мыла) с освободившимися жирными кислотами и предотвращают их подавляющее влияние на активность липазы.
Под действием липазы в начале гидролизуются эфирные связи у α и α1 (боковых) углеродных атомов глицерина, затем у β-углеродного атома:
Под действием липазы до 40% триацилглицеридов расщепляются до глицерина и жирных кислот, 50-55% гидролизуется до 2-моноацилглицеринов и 3-10% не гидролизуется и всасываются в виде триацилглицеринов.
Стериды корма расщепляются ферментом холестеролэстеразой до холестерина и высших жирных кислот. Фосфатиды гидролизуются под влиянием фосфолипаз А, A2, С и D. Каждый фермент действует на определенную сложноэфирную связь липида. Точки приложения фосфолипаз представлены на схеме:
Фосфолипазы поджелудочной железы, тканевые фосфолипазы вырабатываются в виде проферментов и активируются трипсином. Фосфолипаза A2 змеиных ядов катализирует отщепление ненасыщенной жирной кислоты в положении 2 фосфоглицеридов. При этом образуются лизолецитины с гемолитическим действием.
фосфотидилхолин лизолецитин
Поэтому при попадании этого яда в кровь происходит сильный гемолиз.. В кишечнике эта опасность устраняется действием фосфолипазы A1, быстро инактивирующей лизофосфатид в результате отщепления от него остатка насыщенной жирной кислоты с превращением его в неактивный глицерофосфохолин.
Лизолецитины в малых концентрациях стимулируют дифференцировку лимфоидных клеток, активность протеинкиназы С, усиливают клеточную пролиферацию.
Коламинфосфатиды и серинфосфатиды расщепляются фосфолипазой А до лизоколаминфосфатидов, лизосеринфосфатидов, которые далее расщепляются фосфолипазой A2. Фосфолипазы С и D гидролизуют связи холина; коламина и серина с фосфорной кислотой и остатка фосфорной кислоты с глицерином.
Всасывание липидов происходит в тонком отделе кишечника. Жирные кислоты с длиной цепи менее 10 углеродных атомов всасываются в неэтерифицированной форме. Для всасывания необходимо присутствие эмульгирующих веществ – желчных кислот и желчи.
Ресинтез жира, характерного для данного организма, происходит в кишечной стенке. Концентрация липидов в крови в течение 3-5 часов после приема корма высокая. Хиломикроны – мелкие частицы жира, образующиеся после всасывания в кишечной стенке, представляют собой липопротеиды, окруженные фосфолипидами и белковой оболочкой, внутри содержат молекулы жира и желчных кислот. Они поступают в печень, где липиды подвергаются промежуточному обмену, а желчные кислоты проходят в желчный пузырь и далее обратно в кишечник (см. рис.9.3 на стр.192). В результате такого кругооборота теряется малое количество желчных кислот. Считают, что молекула желчной кислоты в сутки совершает 4 кругооборота.
Источник
Расщепление триглицеридов в пищеварительном тракте. Слюна не содержит расщепляющих жиры
ферментов. Следовательно, в полости рта жиры не подвергаются никаким
изменениям. У взрослых людей жиры проходят через желудок также без особых
изменений. В желудочном соке содержится липаза, получившая название желудочной,
однако роль ее в гидролизе пищевых
триглицеридов у взрослых людей невелика. Во-первых, в желудочном соке взрослого
человека и других млекопитающих содержание липазы крайне низкое. Во-вторых, рН
желудочного сока далек от оптимума действия этого фермента (оптимальное
значение рН для желудочной липазы 5,5–7,5). Напомним, что значение рН
желудочного сока около 1,5. В-третьих, в желудке отсутствуют условия для
эмульгирования тригли-церидов, а липаза может активно действовать только на
триглицериды, находящиеся в форме эмульсии. Поэтому у взрослых
неэмульгированные триглицериды, составляющие основную массу пищевого жира,
проходят через желудок без особых изменений. Вместе с тем расщепление
три-глицеридов в желудке играет важную роль в пищеварении у детей, особенно
грудного возраста. Слизистая оболочка корня языка и примыкающей к нему области
глотки ребенка грудного возраста секретирует собственную липазу в ответ на
сосательные и глотательные движения (при кормлении грудью). Эта липаза получила
название лингвальной. Активность линг-вальной липазы не успевает «проявиться» в
полости рта, и основным местом ее воздействия является желудок. Оптимум рН лингвальной
липазы в пределах 4,0–4,5; он близок к величине рН желудочного сока у таких
детей. Лингвальная липаза наиболее активно действует на триглицериды,
содержащие жирные кислоты с короткой и средней длиной цепи, что характерно для
триглицеридов молока. Иными словами, жир молока – самый подходящий субстрат для
этого энзима. У взрослых активность лингвальной липазы крайне низкая.
Расщепление
триглицеридов в желудке взрослого человека невелико, но оно в определенной
степени облегчает последующее переваривание их в кишечнике. Даже незначительное
по объему расщепление триглицеридов в желудке приводит к появлению свободных
жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в
кишечник и способствуют там эмульгированию жиров, облегчая таким образом
воздействие на них липазы панкреатического сока.
После того
как химус попадает в двенадцатиперстную кишку, прежде всего происходит
нейтрализация попавшей в кишечник с пищей соляной кислоты желудочного сока
бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся
при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему
перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается
эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры оказывают
соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде
натриевых солей. Большая часть желчных кислот конъюгирована с глицином или
таурином. По химической природе желчные кислоты являются производными холановой
кислоты:
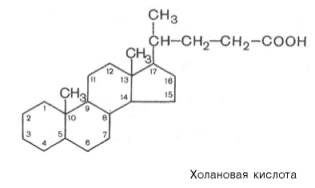
Желчные
кислоты представляют собой основной конечный продукт метаболизма холестерина.
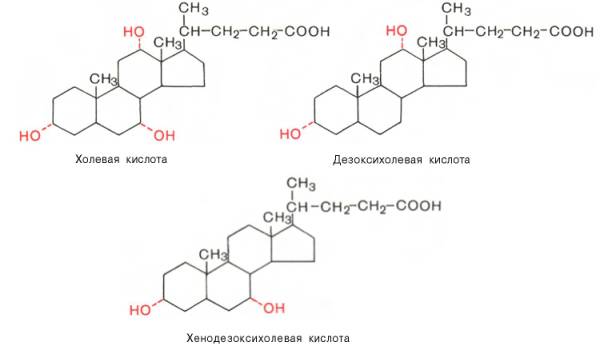
В желчи
человека в основном содержатся холевая (3,7,12-триоксихола-новая),
дезоксихолевая (3,12-диоксихолановая) и хенодезоксихолевая
(3,7-диоксихолановая) кислоты (все гидроксильные группы имеют
α-конфи-гурацию и поэтому обозначены пунктирной линией):
Кроме того, в
желчи человека в малых количествах содержатся лито-холевая
(3α-оксихолановая) кислота, а также аллохолевая и уреодезокси-холевая
кислоты – стереоизомеры холевой и хенодезоксихолевой кислот.
Как
отмечалось, желчные кислоты присутствуют в желчи в конъюги-рованной форме, т.е.
в виде гликохолевой, гликодезоксихолевой, гли-кохенодезоксихолевой (около 2/3
– 4/5 всех желчных кислот) или таурохо-левой,
тауродезоксихолевой и таурохенодезоксихолевой (около 1/5
– 1/3 всех желчных кислот) кислот. Эти соединения иногда
называют парными желчными кислотами, так как они состоят из двух компонентов –
желчной кислоты и глицина или таурина. Соотношения между конъюгатами обоих
видов могут меняться в зависимости от характера пищи: в случае преобладания в
ней углеводов увеличивается относительное содержание глициновых конъюгатов, а
при высокобелковой диете – тауриновых конъюгатов. Строение парных желчных
кислот может быть представлено в следующем виде:
Считают, что
только комбинация соль желчной кислоты + ненасыщенная жирная кислота +
моноглицерид придает необходимую степень эмульгирования жира. Соли желчных
кислот резко уменьшают поверхностное натяжение на поверхности раздела жир/вода,
благодаря чему они не только облегчают эмульгирование, но и стабилизируют уже
образовавшуюся эмульсию.
Известно, что
основная масса пищевых глицеридов подвергается расщеплению в верхних отделах
тонкой кишки при действии липазы панкреатического сока. Этот фермент был
впервые обнаружен известным французским физиологом С. Bernard
в середине прошлого века.
Панкреатическая
липаза (КФ 3.1.1.3) является гликопротеидом, имеющим мол. массу 48000 (у
человека) и оптимум рН 8–9. Данный фермент расщепляет триглицериды, находящиеся
в эмульгированном состоянии (действие фермента на растворенные субстраты
значительно слабее). Как и другие пищеварительные ферменты (пепсин, трипсин,
химотрипсин), панкреатическая липаза поступает в верхний отдел тонкой кишки в
виде неактивной пролипазы.
Превращение
пролипазы в активную липазу происходит при участии желчных кислот и еще одного
белка панкреатического сока – колипазы (мол. масса 10000). Последняя
присоединяется к пролипазе в молекулярном соотношении 2:1. Это приводит к тому,
что липаза становится активной и устойчивой к действию трипсина.
Установлено,
что основными продуктами расщепления триглицеридов при действии панкреатической
липазы являются β(2)-моноглицерид и жирные кислоты. Фермент катализирует
гидролиз эфирных связей в α(1), α'(3)-положениях, в
результате чего и образуются β(2)-моноглицерид и две частицы (молекулы)
жирной кислоты. На скорость катализируемого липазой гидролиза триглицеридов не
оказывает существенного влияния ни степень ненасыщенности жирных кислот, ни
длина ее цепи (от С12 до С18).
Гидролиз
триглицеридов при участии панкреатической липазы можно изобразить в виде
следующей схемы:

В
панкреатическом соке наряду с липазой содержится моноглицеридная изомераза –
фермент, катализирующий внутримолекулярный перенос ацила из β(2)-положения
моноглицерида в α(1)-положение. В процессе переваривания пищевых жиров при
участии этого фермента примерно треть β-моноглицерида превращается в
α-моноглицерид. Поскольку эфирная связь в α-положении чувствительна к
действию панкреатической липазы, последняя расщепляет большую часть
α-моноглицеридов до конечных продуктов – глицерина и жирной кислоты.
Меньшая часть α-моноглице-ридов успевает всосаться в стенку тонкой кишки,
минуя воздействие липазы.
Всасывание триглицеридов и продуктов их расщепления. Всасывание происходит в проксимальной
части тонкой кишки. Тонкоэмульгированные жиры (величина жировых капель эмульсии
не должна превышать 0,5 мкм) частично могут всасываться через стенки кишечника
без предварительного гидролиза. Основная часть жира всасывается лишь после
расщепления его панкреатической липазой на жирные кислоты, моноглицериды и
глицерин. Жирные кислоты с короткой углеродной цепью (менее 10 атомов углерода)
и глицерин, будучи хорошо растворимыми в воде, свободно всасываются в кишечнике
и поступают в кровь воротной вены, оттуда в печень, минуя какие-либо
превращения в кишечной стенке.
Более сложно
происходит всасывание жирных кислот с длинной углеродной цепью и
моноглицеридов. Этот процесс осуществляется при участии желчи и главным образом
желчных кислот, входящих в ее состав. В желчи соли желчных кислот, фосфолипиды
и холестерин содержатся в соотношении 12,5:2,5:1,0. Жирные кислоты с длинной
цепью и моноглицериды в просвете кишечника образуют с этими соединениями
устойчивые в водной среде мицеллы. Структура мицелл такова, что их гидрофобное
ядро (жирные кислоты, моноглицериды и др.) оказывается окруженным снаружи
гидрофильной оболочкой из желчных кислот и фосфолипидов. Мицеллы примерно в 100
раз меньше самых мелких эмульгированных жировых капель. В составе мицелл высшие
жирные кислоты и моноглицериды переносятся от места гидролиза жиров к
всасывающей поверхности кишечного эпителия. Относительно механизма всасывания
жировых мицелл единого мнения нет. Одни исследователи считают, что в результате
так называемой мицеллярной диффузии, а возможно, и пиноцитоза мицеллы целиком
проникают в эпителиальные клетки ворсинок, где происходит распад жировых
мицелл. При этом желчные кислоты сразу поступают в ток крови и через систему
воротной вены попадают сначала в печень, а оттуда вновь в желчь. Другие
исследователи допускают возможность перехода в клетки ворсинок только липидного
компонента жировых мицелл. Соли желчных кислот, выполнив свою физиологическую
роль, остаются в просвете кишечника; позже основная масса их всасывается в
кровь (в подвздошной кишке), попадает в печень и затем выделяется с желчью.
Таким образом, все исследователи признают, что происходит постоянная циркуляция
желчных кислот между печенью и кишечником. Этот процесс получил название
печеночно-кишечной (гепатоэнтеральной) циркуляции.
С помощью
метода меченых атомов было показано, что в желчи содержится лишь небольшая
часть желчных кислот (10–15% от общего количества), вновь синтезированных
печенью. Таким образом, основная масса желчных кислот (85–90%) – это желчные
кислоты, реабсорбирован-ные в кишечнике и повторно секретируемые в составе
желчи. Установлено, что у человека общий пул желчных кислот составляет примерно
2,8–3,5 г, при этом они совершают 6–8 оборотов в сутки.
Расщепление и всасывание фосфолипидов и холестерина. Подавляющая часть фосфолипидов
содержимого тонкой кишки приходится на фосфати-дилхолин (лецитин), основная
масса которого поступает в кишечник с желчью (11–12 г/сут) и меньшая часть (1–2
г/сут) – с пищей.
Существует
две точки зрения относительно судьбы поступивших в тонкую кишку экзогенных и
эндогенных фосфолипидов. Согласно одной из них, и те, и другие фосфолипиды
подвергаются в кишечнике атаке со стороны фосфолипазы А2,
катализирующей гидролиз сложноэфирной связи в β-положении. В результате
катализируемой фосфолипазой А2реакции глицерофосфолипиды
расщепляются с образованием лизофосфолипида и жирной кислоты. Лизофосфолипид
может подвергаться расщеплению при действии другого фермента панкреатического
сока – лизофосфолипазы. В результате из лизолецитина освобождается последняя
частица жирной кислоты и образуется глицерофосфохолин, который хорошо
растворяется в водной среде и всасывается из кишечника в кровь.
Сторонники
другой точки зрения считают, что фосфолипиды «желчного» (более точно
печеночного) происхождения в отличие от пищевых фосфолипидов не подвергаются
воздействию фосфолипазы А2. Следовательно, функция «желчных»
фосфолипидов исключительно связана с гепатоэнтеральной циркуляцией желчи: с
желчью они поступают в кишечник, с желчными кислотами участвуют в мицеллярной
солюбили-зации липидов и вместе с ними возвращаются в печень. Таким образом,
существует как бы два пула фосфолипидов в кишечнике: «желчный», защищенный от
действия фосфолипазы А2, и «пищевой», подверженный ее действию. Пока
трудно объяснить причину существования двух пулов фосфолипидов и их различное
отношение к действию фосфоли-пазы А2.
В зависимости
от пищи организм взрослого человека получает ежедневно 300–500 мг холестерина,
содержащегося в пищевых продуктах частично в свободном (неэстерицифицированном)
виде, частично в виде эфиров с жирными кислотами. Эфиры холестерина
расщепляются на холестерин и жирные кислоты особым ферментом панкреатического и
кишечного соков – гидролазой эфиров холестерина, или холестеролэстеразой (КФ
3.1.1.13). В тонкой кишке происходит всасывание холестерина, источником
которого являются:
В общей
сложности в кишечник поступает 1,8–2,5 г эндогенного и экзогенного холестерина.
Из этого количества около 0,5 г холестерина выделяется с фекалиями в виде
восстановленного продукта – копростерина и очень небольшая часть в виде
окисленных продуктов – холестенона и др. И восстановление, и окисление
холестерина происходят в толстой кишке под воздействием ферментов микробной
флоры. Основная часть холестерина в неэстерифицированной форме подвергается
всасыванию в тонкой кишке в составе смешанных жировых мицелл, состоящих из
желчных кислот, жирных кислот, моноглицеридов, фосфолипидов и
лизофосфо-липидов.
Ресинтез липидов в кишечной стенке. Триглицериды. По современным представлениям, ресинтез
триглицеридов происходит в
эпителиальных
клетках
(энтероцитах слизистой оболочки ворсинок тонкой кишки) двумя путями. Первый
путь – β-моноглицеридный. Долгое время этот путь считался единственным.
Суть его состоит в том, что β-моноглицериды и жирные кислоты, проникающие
в процессе всасывания в эпителиальные клетки кишечной стенки, задерживаются в
гладком эндоплазматическом рети-кулуме клеток. Здесь из жирных кислот образуется
их активная форма – ацил-КоА и затем происходит ацилирование
β-моноглицеридов с образованием сначала диглицеридов, а затем
триглицеридов:
β-Моноглицерид
+ R—СО—S-KoA –> Диглицерид + HS-KoA ;
Диглицерид + R1—СО—S-KoA –> Триглицерид + HS-KoA.
Все реакции
катализируются ферментным комплексом – триглицерид-синтетазой, включающим в
себя ацил-КоА-синтетазу, моноглицеридацил-трансферазу и
диглицеридацилтрансферазу.
Второй путь
ресинтеза триглицеридов протекает в шероховатом эндо-плазматическом ретикулуме
эпителиальных клеток и включает следующие реакции:
1) образование активной формы жирной кислоты –
ацил-КоА при участии ацил-КоА-синтетазы;
2) образование α-глицерофосфата при
участии глицеролкиназы;
3) превращение α-глицерофосфата в
фосфатидную кислоту при участии глицерофосфат-ацилтрансферазы;
4) превращение фосфатидной кислоты в диглицерид
при участии фос-фатидат-фосфогидролазы;
5)
ацилирование диглицерида с образованием триглицерида при участии
диглицеридацилтрансферазы.
Как видно,
первая и последняя реакции повторяют аналогичные реакции
β-моноглицеридного пути. Установлено, что α-глицерофосфатный путь
ресинтеза жиров (триглицеридов) приобретает значение, если в эпителиальные
клетки слизистой оболочки тонкой кишки поступили преимущественно жирные кислоты.
В случае, если в стенку кишки поступили жирные кислоты вместе с
β-моноглицеридами, запускается β-моногли-церидный путь. Как правило,
наличие в эпителиальных клетках избытка β-моноглицеридов тормозит
протекание α-глицерофосфатного пути.
Ресинтез фосфолипидов в кишечной стенке. В энтероцитах наряду с ре-синтезом
триглицеридов происходит также и ресинтез фосфолипидов. В образовании
фосфатидилхолинов и фосфатидилэтаноламинов участвует ресинтезированный
диглицерид, а в образовании фосфатидилинозитолов – ресинтезированная
фосфатидная кислота. Участие этих субстратов в образовании фосфолипидов в
стенке кишечника происходит по тем же закономерностям, что и в других тканях
(см. с. 396, 397).
Необходимо
подчеркнуть, что в стенке кишечника синтезируются жиры, в значительной степени
специфичные для данного вида животного и отличающиеся по своему строению от
пищевого жира. В известной мере это обеспечивается тем, что в синтезе
триглицеридов (а также фосфолипидов) в кишечной стенке принимают участие наряду
с экзогенными и эндогенные жирные кислоты. Однако способность к осуществлению в
стенке кишечника синтеза жира, специфичного для данного вида животного, все же
ограничена. Показано, что при скармливании животному (например, собаке),
особенно предварительно голодавшему, больших количеств чужеродного жира
(например, льняного масла или верблюжьего жира) часть его обнаруживается в
жировых тканях животного в неизмененном виде. Жировая ткань скорее всего
является единственной тканью, где могут откладываться чужеродные жиры. Липиды,
входящие в состав протоплазмы клеток других органов и тканей, отличаются
высокой специфичностью, их состав и свойства мало зависят от пищевых жиров.
Образование хиломикронов и транспорт липидов. Ресинтезированные в эпителиальных
клетках кишечника триглицериды и фосфолипиды, а также поступивший в эти клетки
из полости кишечника холестерин (здесь он может частично эстерифицироваться)
соединяются с небольшим количеством белка и образуют относительно стабильные
комплексные частицы – хиломикроны (ХМ). Последние содержат около 2% белка, 7%
фосфолипидов, 8% холестерина и его эфиров и более 80% триглицеридов. Диаметр ХМ
колеблется от 0,1 до 5 мкм. Благодаря большим размерам частиц ХМ не способны
проникать из эндотелиальных клеток кишечника в кровеносные капилляры и
диффундируют в лимфатическую систему кишечника, а из нее – в грудной
лимфатический проток. Затем из грудного лимфатического протока ХМ попадают в
кровяное русло, т.е. с их помощью осуществляется транспорт экзогенных
триглицеридов, холестерина и частично фосфолипидов из кишечника через
лимфатическую систему в кровь. Уже через 1–2 ч после приема пищи, содержащей
жиры, наблюдается алиментарная гиперлипемия. Это физиологическое явление,
характеризующееся в первую очередь повышением концентрации триглицеридов в
крови и появлением в ней ХМ. Пик алиментарной гиперлипемии наблюдается через
4–6 ч после приема жирной пищи. Обычно через 10–12 ч после приема пищи
содержание триглицеридов возвращается к нормальным величинам, а ХМ полностью
исчезают из кровяного русла.
Известно, что
печень и жировая ткань играют наиболее существенную роль в дальнейшей судьбе
ХМ. Последние свободно диффундируют из плазмы крови в межклеточные пространства
печени (синусоиды). Допускается, что гидролиз триглицеридов ХМ происходит как
внутри печеночных клеток, так и на поверхности. ХМ не способны (из-за своих
размеров) проникать в клетки жировой ткани. В связи с этим триглицериды ХМ
подвергаются гидролизу на поверхности эндотелия капилляров жировой ткани при
участии фермента липопротеидлипазы.
Источник