Переваривание нуклеиновых кислот в желудочно кишечном тракте
РАЗДЕЛ 10. ОБМЕН НУКЛЕОТИДОВ
Рибонуклеозид- и дезоксирибонуклеозидфосфаты — существеннейшие компоненты клеток.
• Нуклеозидтрифосфаты (НТФ) используются в качестве субстратов синтеза ДНК и РНК, без которых невозможны образование белков и клеточная пролиферация.
• Природа выбрала цикл АДФ-АТФ в качестве универсального механизма трансформации энергии окисления в энергию биосинтетических процессов. В некоторых биологических процессах и другие НТФ используются в качестве источника энергии.
• Производные нуклеотидов служат донорами активных субстратов в синтезе гомо- и гетерополисахаридов, липидов и белков. Например, УДФ-глюкоза, УДФ-галактоза, ГДФ-манноза, УДФ- N-ацетилглюкозамин или ЦМФ-ацетилнейраминовая кислота принимают участие в синтезе гликогена и гликозаминогликанов; ЦЦФ-холин — в синтезе фосфолипидов.
• УДФ-глюкуроновая кислота, ФАФС, S-аденозилметионин — наиболее частые участники универсальной системы детоксикации, обеспечивающей последующее выведение ксенобиотиков (чужеродных веществ) и некоторых собственных метаболитов из организма.
• АМФ входит в состав коферментов дегидрогеназ (NAD+, NADP+, FAD, FMN) и ацилирования (КоА).
• С помощью циклических форм нуклеотидов (цАМФ, цГМФ) осуществляется передача в клетку сигналов гормонов, факторов роста, нейромедиаторов и некоторых других регуляторных молекул.
Практически все клетки организма способны к синтезу нуклеотидов (исключение составляют некоторые клетки крови). Другим источником этих молекул могут быть нуклеиновые кислоты собственных тканей и пищи, однако эти источники имеют лишь второстепенное, вспомогательное значение.
Со строением нуклеотидов и номенклатурой мы знакомились в разделе 4, в данном разделе предстоит рассмотреть метаболизм этих молекул в организме.
I. Переваривание нуклеиновых кислот пищи в желудочно-кишечном тракте
Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием НСl желудочного сока (рис. 10-1). Далее полинуклеотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов.
Рис. 10-1. Переваривание нуклеиновых кислот пищи.

В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов. Последние под действием фосфодиэстераз панкреатической железы расщепляются до смеси 3′- и 5′-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезоксирибозо-1-фосфата, пуриновых и пиримидиновых оснований.
Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы — фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, СО2, β-аланина и β-аминоизобутирата.
В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям.
Источник
Пищевые нуклеопротеины,
попадая в организм человека, в желудке
отщепляют белковый компонент и
денатурируют под действием НС1 желудочного
сок. Далее полинуклеотидная часть этих
молекул гидролизуется в кишечнике до
мононуклеотидов.
В расщеплении нуклеиновых
кислот принимают участие ДНК-азы
и РНК-азы панкреатического
сока, которые, будучи эндонуклеазами,
гидролизуют макромолекулы до
олигонуклеотидов. Последние под действием
фосфодиэстераз панкреатической железы
расщепляются до смеси 3′- и 5′-мононуклеотидов.
Нуклеотидазы и
неспецифические фосфатазы
гидролитически отщепляют фосфатный
остаток нуклеотидов и превращают их в
нуклеозиды, которые либо всасываются
клетками тонкого кишечника, либо
расщепляются нуклеозидфосфорилазами
кишечника с образованием рибозо- или
дезоксирибозо-1-фосфата, пуриновых и
пиримидиновых оснований.
Пищевые пурины и пиримидины
не являются незаменимыми пищевыми
факторами и очень мало используются
для синтеза нуклеиновых кислот тканей.
В энтероцитах обнаружена высокая
активность ксантиноксидазы – фермента,
который большую часть пуринов, поступающих
в клетки, превращает в мочевую кислоту,
удаляющуюся с мочой. Пиримидиновые
основания, не успевшие поступить в
энтероциты, под действием микрофлоры
кишечника расщепляются до NH3,
CO2,
β-аланина и β-аминоизобутирата.
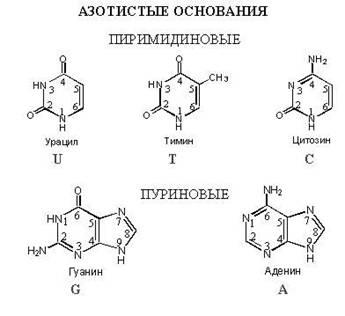
Вопрос № 2.Структура нуклеотида
В
каждом нуклеотиде можно выделить 3
части:
1.
Углевод – это пятичленный сахар-пентоза
(рибоза или дезоксирибоза).
2.
Фосфорный остаток (фосфат) – это остаток
фосфорной кислоты.
3.
Азотистое основание – это соединение, в
котором много атомов азота. В нуклеиновых
кислотах используется всего 5 видов
азотистых оснований : Аденин, Тимин,
Гуанин, Цитозин, Урацил. В ДНК – 4 вида:
Аденин, Тимин, Гуанин, Цитозин. В РНК
– тоже 4 вида: Аденин, Урацил, Гуанин,
Цитозин, Легко заметить, что в РНК
происходит замещение Тимина на Урацил
по сравнению с ДНК.
Общая
структурная формула пентозы (рибозы
или дезоксирибозы), молекулы которой
образуют “скелет” нуклеиновых
кислот:
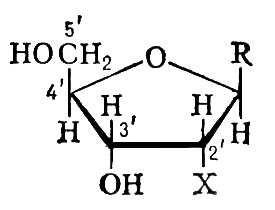
Если
Х заменить на Н (Х = Н) – то получаются
дезоксирибонуклеозиды; если Х заменить
на ОН (Х = ОН) – то получаются рибонуклеозиды.
Если вместо R подставить азотистое
основание (пуриновое или пиримидиновое)
– то получится конкретный нуклеотид.
Важно обратить внимание на
те положения атомов углерода в
пентозе, которые обозначены как 3′ и
5′. Нумерация атомов углерода начинается
от атома кислорода вверху и идёт по
часовой стрелке. Последним получается
атом углерода (5′), который располагается
за пределами пентозного кольца и
образует, можно сказать, “хвостик”
у пентозы. Так вот, при наращивании
цепочки из нуклеотидов фермент может
присоединить новый нуклеотид только к
углероду 3′ и ни к какому другому. Поэтому
5′-конец нуклеотидной цепочки никогда
не сможет иметь продолжения, удлинняться
может только 3′-конец.
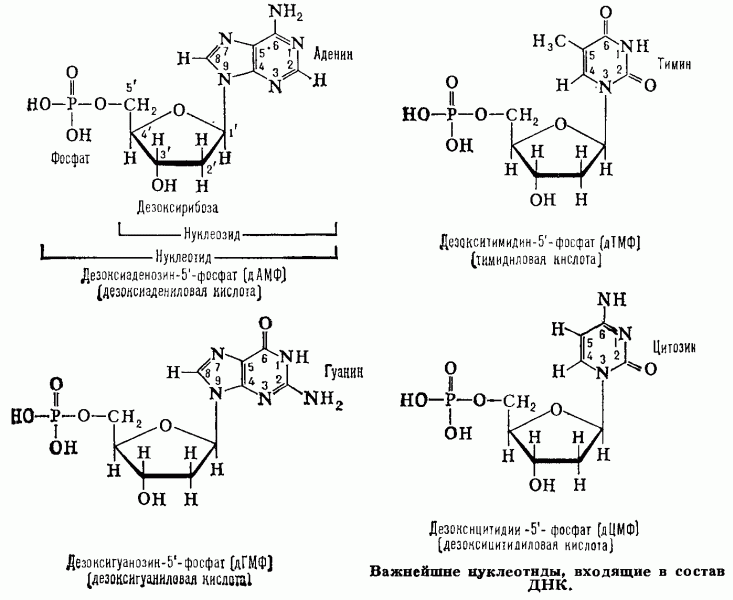
Азотистые основания

Нуклеотиды
Наращивание нуклеотидной цепочки днк
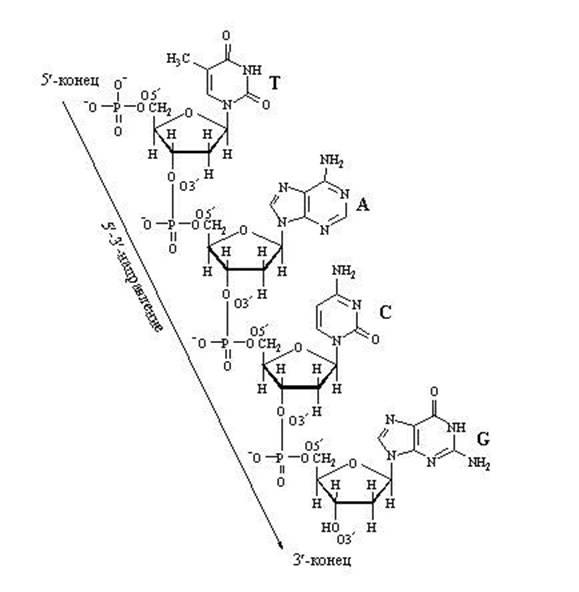
Наращивание цепочки за
счёт “продольных” связей между
нуклеотидами может идти только в одном
направлении: от 5′ ⇒
к 3′, т.к. новый нуклеотид можно присоединить
только к 3′-концу цепочки, но не к
5′-концу.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Оглавление по разделу: «Ответы на вопросы по биохимии»
Навигация
- Переваривание нуклеопротеинов и нуклеиновых кислот в ЖКТ: ферменты, химизм, конечные продукты и их всасывание
- Пути использования в организме продуктов гидролиза нуклеиновых кислот экзо — и эндогенного происхождения
- Основной путь синтеза пиримидиновых нуклеотидов: химизм, ферменты
- Основной путь синтеза пуриновых нуклеотидов: начальные стадии биосинтеза (от рибозо-5- фосфата до 5-фосфорибозиламина). Инозиновая кислота и ее роль. Происхождение атомов пуринового ядра
- Дополнительные пути синтеза нуклеотидов
- Биосинтез дезоксирибонуклеотидов
- Распад пиримидиновых нуклеотидов, конечные продукты и их судьба
- Распад пуриновых нуклеотидов, конечные продукты их судьба
- Нарушение обмена пуринов: подагра, мочекаменная болезнь, гиперурикемия, ксантинурия
- Количественное определение мочевой кислоты в сыворотке крови: принцип метода, показатели нормы, диагностическое значение
- Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания экзогенного железа
- Синтез железосодержащих хромопротеинов в тканях. Глицино-янтарный цикл Шемина
- Распад гемоглобина в тканях. Прямой и непрямой билирубин. Химизм образования прямого билирубина
- Нарушение пигментного обмена. Желтухи, механизм их возникновения
Переваривание нуклеопротеинов и нуклеиновых кислот в ЖКТ: ферменты, химизм, конечные продукты и их всасывание
Нуклеотиды поступают в организм с пищей в составе нуклеопротеинов. После воздействия протеолитических ферментов желудка и кишечника из них освобождаются нуклеиновые кислоты и белковая часть.
Белки перевариваются обычным порядком, нуклеиновые кислоты с помощью дополнительных ферментов.
Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы, гидролизующие нуклеиновые кислоты до полинуклеотидов.
После действия панкреатических нуклеаз полинуклеотидазы (или фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований.
Пути использования в организме продуктов гидролиза нуклеиновых кислот экзо- и эндогенного происхождения
В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой.
Большая часть тех пуринов, что всосались, в энтероцитах также превращается в мочевую кислоту, при этом не происходит их включения во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот. Как и пурины, свободные пиримидины в основном катаболизируют и выделяются без их использования в организме.
Таким образом, нуклеиновые кислоты пищи не поступают из кишечника в кровоток и не выступают в роли поставщика непосредственных предшественников ДНК и РНК клеток организма. И хотя млекопитающие потребляют значительные количества нуклеиновых кислот и нуклеотидов, их жизнедеятельность не зависит от всасывания этих веществ или соответствующих продуктов распада.
Основной путь синтеза пиримидиновых нуклеотидов: химизм, ферменты
Синтез пиримидиновых оснований происходит во всех клетках организма. В реакциях синтеза участвует глутамин, СО2, аспартат, затрачивается 2 молекулы АТФ.
Условно можно выделить этапы синтеза:
- Образование карбамоилфосфата, но в отличие от синтеза мочевины эта реакция идет в цитозоле.
- Образование пиримидинового кольца после присоединения аспарагиновой кислоты и реакции дегидратации. Первым пиримидиновым основанием является оротовая кислота.
- Синтез оротидилмонофосфата и уридинмонофосфорной кислоты (УМФ). В реакции с фосфорибозилдифосфатом (ФРДФ) к оротовой кислоте присоединяется рибозо-5-фосфат и образуется оротидилмонофосфат, непосредственный предшественник УМФ.
- Синтез УТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ.
- Синтез ЦТФ происходит из УТФ с затратой энергии АТФ при участии глутамина, являющегося источником NH2-группы.
Основной путь синтеза пуриновых нуклеотидов: начальные стадии биосинтеза. Инозиновая кислота и ее роль. Происхождение атомов пуринового ядра
Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени.
Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа. Но будет рассмотрен только первый этап — начальные стадии биосинтеза пуриновых нуклеотидов.
Первый этап: синтез 5′-фосфорибозиламина.
Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл.
Первая реакция синтеза пуринов заключается в активации углерода в первом положении рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ).
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5-фосфорибозиламина. Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
Инозиновая кислота и его роль
Инозиновая кислота или инозин монофосфат (ИМФ) — нуклеотид, являющийся монофосфатом соответствующего рибонуклеозида гипоксантина. Инозиновая кислота играет важную роль в метаболизме.
Биологически важными производными инозиновой кислоты являются пуриновые нуклеотиды, входящие в состав нуклеиновых кислот, а также АТФ, который служит для сохранения химической энергии в клетках.
Происхождение атомов пуринового ядра
Дополнительные пути синтеза нуклеотидов (реутилизация оснований)
Реутилизация пуриновых оснований
Реутилизация пуриновых оснований – это процесс повторного их использования. Он особенно актуален в быстрорастущих тканях (эмбриональная, регенерирующая, опухолевая), когда активно идет процесс синтеза нуклеиновых кислот и недопустима потеря их предшественников.
Сущность реутилизации заключается в присоединении к аденину, гуанину или гипоксантину рибозо-5-фосфата и образовании АМФ, ГМФ или ИМФ. Эту реакцию осуществляют соответствующие трансферазы.
Наиболее характерным примером является реутилизация гипоксантина и гуанина под влиянием фермента гипоксантин-гуанин-фосфорибозилтрансферазы. В качестве источника рибозo-5-фосфата используется фосфорибозилдифосфат.
Реутилизация пиримидиновых оснований
Реутилизация пиримидиновых оснований сводится к повторному использованию пиримидиновых нуклеозидов. Свободные основания реутилизироваться не способны. Источником фосфатной группы является АТФ.
Биосинтез дезоксирибонуклеотидов
Особенностью обмена пуринов и пиримидинов является то, что они могут образовывать не только рибонуклеотиды, но и дезоксирибонуклеотиды.
Дезоксирибонуклеотидтрифосфаты необходимы клетке для синтеза ДНК.
Их образование протекает в три реакции:
- В начале процесса происходит дефосфорилирование рибонуклеозидтрифосфатов с образованием АДФ, ГДФ, ЦДФ, УДФ.
- Далее фермент рибонуклеозид-редуктаза восстанавливает АДФ, ГДФ, ЦДФ, УДФ до дезоксирибонуклеозиддифосфатов dАДФ, dГДФ, dЦДФ, dУДФ. Донором водорода для восстановления рибозы является белок тиоредоксин, его SH-группы окисляются кислородом рибозы и образуется вода. Последующее восстановление тиоредоксина в рабочее состояние обеспечивается за счет НАДФН.
- После образования dАДФ, dГДФ, dЦДФ фосфорилируются, а dУДФ используется для синтеза тимидилового нуклеотида.
Синтез тимидилтрифосфата
Три дезоксинуклеотида – dАТФ, dГТФ, dЦТФ сразу после синтеза используются для синтеза ДНК. Однако известно, что в составе ДНК нет уридиловых нуклеотидов, поэтому dУДФ не превращается в dУТФ, а идет на образование тимидилового нуклеотида.
Участие в этом принимает фермент тимидилатсинтаза.
Донором метильной группы является N5N10-метилен-ТГФК.
Восстановление дигидрофолиевой кислоты до N5N10-метилен-ТГФК происходит при участии двух ферментов – дигидрофолатредуктазы и сериноксиметилтрансферазы.
Распад пиримидиновых нуклеотидов, продукты распада, их судьба
Конечными продуктами реакции являются СО2, NH3, мочевина, β-аланин и β-аминоизомасляная кислота.
β-аланин может служить источником для синтеза ансерина и карнозина, а также для образования КоА. В тканях животных открыта специфическая аминотрансфераза, катализирующая трансаминирование между β-аланином и пировиноградной кислотой. В процессе этой обратимой реакции синтезируются α-аланин и формилацетат (полуальдегид малоновой кислоты):
Образовавшийся формилацетат далее подвергается окислительному декарбоксилированию с образованием углекислоты и ацетил-КоА,который используется для энергетических целей.
Распад пуриновых нуклеотидов, продукты распада, их судьба
Конечный продукт — мочевая кислота, которая выводится из организма вместе с мочой.
Нарушения обмена пуринов
Гиперурикемия
Самым частым нарушением обмена пуринов является повышенное образование мочевой кислоты с развитием гиперурикемии.
Особенностью является то, что растворимость солей мочевой кислоты (уратов) в плазме крови невелика и при превышении порога растворимости в плазме (около 0,7 ммоль/л) они кристаллизуются в периферических зонах с пониженной температурой.
В зависимости от длительности и тяжести гиперурикемия проявляется:
- Появление тофусов (греч. tophus – пористый камень, туф) – отложение уратных кристаллов в коже и подкожных слоях, в мелких суставах ног и рук, в сухожилиях, хрящах, костях и мышцах.
- Нефропатии в результате кристаллизации мочевой кислоты с поражением почечных канальцев и мочекаменная болезнь.
- Подагра – поражение мелких суставов.
Подагра
Подагра — хроническое заболевание,связанное с нарушением мочекислого обмена веществ: повышенным содержанием в крови мочевой кислоты и отложением в тканях ее солей-уратов. Клинически заболевание проявляется рецивирующим острым артритом и образованием тофусов (уплотнение подкожной клетчатки).
Мочекаменная болезнь
Мочекаменная болезнь заключается в образовании солевых кристаллов (камней) разной природы в мочевыводящих путях. Непосредственно образование мочекислых камней составляет около 15% от всех случаев этой болезни. Мочекислые камни в мочевыводящих путях откладываются примерно у половины больных подагрой. Причиной отложения кристаллов мочевой кислоты является гиперурикемия и повышенное выведение уратов натрия с мочой.
Главным провоцирующим фактором кристаллизации является увеличение кислотности мочи. При понижении рН мочи ниже 5,75 ураты (енольная форма) переходят в менее растворимую кетоформу и кристаллизуются в почечных канальцах.
Ксантинурия
Наследственная болезнь, обусловленная недостаточностью фермента ксантиноксидазы и характеризующаяся нарушением пуринового обмена; проявляется рецидивирующей гематурией и болями в поясничной области, повышением содержания ксантина в плазме крови и моче.
В плазме крови и моче может наблюдаться 10-ти кратное снижение уровня мочевой кислоты, но увеличивается в 10 и более раз экскреция ксантина и гипоксантина.
Основное клиническое проявление – образование ксантиновых конкрементов, величиной до нескольких миллиметров, коричневого цвета, сравнительно мягкой консистенции. Постепенно может развиться патология почек.
Почечная недостаточность — одно из наиболее грозных осложнений у этой категории больных. Это связано с нефролитиазом.
Определение содержания мочевины в сыворотке крови
Принцип метода
Метод основан на образовании мочевины с диацетилмонооксимом продукта красного цвета в присутствии тиосемикарбазида и солей железа. Интенсивность окраски образовавшегося соединения пропорциональна содержанию мочевины и определяется колориметрически при длине волны 540-560 нм (зеленый светофильтр).
Клинико-диагностическое значение
У здорового человека содержание мочевины составляет в сыворотке крови 3,0-8,3 ммоль/л, в слюне – 2,3-2,8 ммоль/л.
Повышение мочевины в крови отмечается при заболеваниях почек (нарушении выделительной функции), при избыточном белковом питании, при интенсивном распаде белка, при обезвоживании (диарея, лихорадка).
Концентрация мочевины в слюне тесно связана с ее содержанием в крови. Основная часть мочевины секретируется в слюну околоушной железой, с увеличением скорости слюноотделения содержание мочевины в смешанной слюне снижается.
Переваривание и всасывание железосодержащих хромопротеинов. Особенности всасывания экзогенного железа
Fе соединяется со специфическим белком и связывается с рецепторами мембраны энтероцита. Поступившее внутрь клетки железо переносится к противоположной стороне мембраны специфическим белком, который отдаёт железо в кровь, а сам разрушается в лизосомах.
При дефиците железа в организме происходит расширение зон всасывания на слизистой оболочке верхнего отдела подвздошной кишки, сопровождающееся усилением синтеза железосвязывающего белка.
Всасывается лишь 5-10% железа, поступившего в организм (около 1 мг в сутки).
Всасыванию способствуют витамин Е, фолиевая кислота, НСl. Тормозят абсорбцию железа ионы Са и Р (поэтому препараты железа нельзя запивать молоком), а также фитиновая кислота (её много в крупах).
Поступление железа из энтероцитов в кровь регулируется синтезом особого белка энтероцитов – апоферритина, который способен связывать абсорбированное железо, что снижает возможность всасывания последнего в капилляры крови из клеток кишечника. При этом из апоферритина образуется ферритин. При дефиците железа в организме последний отдаёт железо в кровь, а если такой необходимости нет, то через несколько дней внутриклеточный ферритин выделяется с калом при десквамации эпителиальных клеток.
Синтез железосодержащих хромопротеинов в тканях
Исходными веществами в этом метаболическом пути являются аминокислота глицин и метаболит цикла Кребса сукцинил-КоА.
Синтез происходит в ретикулоцитах (незрелых эритроцитах, содержащих клеточное ядро). Реакции идут в митохондриях и цитоплазме клеток.
Первая стадия в последовательности реакций, ведущих к синтезу гема, катализируется δ-аминолевулинат-синтазой. Фермент абсолютно специфичен к субстратам; кофакторами фермента являются пиридоксаль-5-фосфат и ионы Mg2+.
Имеются данные о том, что некоторые лекарственные препараты, а также стероидные гормоны, напротив, индуцируют синтез печёночной δ-аминолевулинат-синтазы.
Во второй реакции, катализируемой δ -аминолевулинат-дегидратазой, при конденсации двух молекул δ-аминолевулината образуется порфобилиноген.
В дальнейшем из четырёх молекул порфобилиногена в результате ряда сложных ферментативных реакций образуется протопорфирин IX – непосредственный предшественник гема.
При участии митохондриального фермента феррохелатазы двухвалентное железо включается в уже готовую структуру протопорфирина. Для протекания этой реакции необходимы аскорбиновая кислота и цистеин в качестве восстановителей. Ингибитором феррохелатазы является свинец.
На заключительном этапе происходит соединение гема с белковыми цепями, характерными для синтезируемого хромопротеина. Конечные продукты этого биосинтеза (гем, гемоглобин) подавляют начальные реакции по механизму отрицательной обратной связи.
Распад гемоглобина в тканях. Прямой и непрямой билирубин. Химизм образования прямого билирубина.
Эритроциты имеют время жизни примерно 120 дней. При физиологических условиях в организме взрослого человека разрушается около 1 — 2×1011 эритроцитов в сутки. Их катаболизм происходит главным образом в ретикулоэндотелиальных клетках селезёнки, лимфатических узлах, костного мозга и печени.
Этапы образования желчных пигментов:
- в РЭС (ретикуло-эндотелиальная система);
- в гепатоцитах;
- в кишечнике.
Первый этап образования желчных пигментов — в клетках РЭС. Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Фермент катализирует расщепление α-метинового мостика между двумя пиррольными кольцами. При этом выделяется эндогенный угарный газ — СО (поступает в эритроциты, где образуется карбоксигемоглобин, норма — до 1,5%). В результате реакции образуется вердоглобин:
Затем от него спонтанно отщепляется белковая часть (глобин) и атом железа. В результате реакции образуется линейный тетрапиррол — биливердин (первый желчный пигмент, имеет зеленый цвет, хорошо растворяется в воде и не проявляющий токсичности). Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных:
Ионы железа, освободившиеся при распаде гема, могут быть использованы для синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков. Транспортной формой железа в плазме крови является белок трансферрин; резервная форма железа в тканях – ферритин.
Нарушения пигментного обмена. Виды желтух
- Гемолитическая желтуха — ускоренное образование билирубина в результате усиления внутрисосудистого гемолиза любого происхождения — сепсис, лучевое поражение, несовместимость крови по системе АВ0 или резус-фактору, дефект глюкозо-6-фосфатдегидрогеназы, отравление гемолитическими ядами, малярия и т.д.
- Механическая желтуха развивается вследствие снижения оттока желчи при непроходимости желчного протока. Прямой билирубин поступает в кровь, развивается гипербилирубинемия.
- Паренхиматозная желтуха. Причиной может быть нарушение на всех трех стадиях превращения билирубина в печени:
- извлечение билирубина из крови печеночными клетками,
- конъюгирование билирубина,
- АТФ-зависимая секреция в желчь.
Источник