Превращение белков в желудочно кишечном тракте
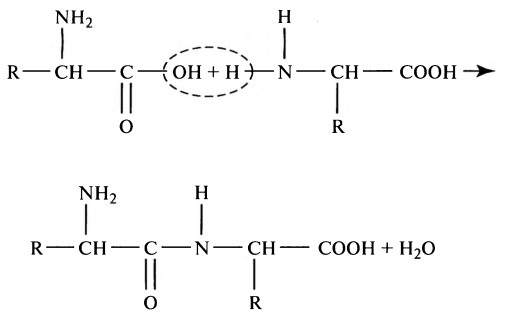
Переваривание белков. Этапы и последовательность переваривания белкова) Пищевые белки. Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Далее представлена типичная связь:
Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот. Физические и химические характеристики различных белков, важных для человека, изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). б) Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в отдельной статье на сайте (просим вас пользоваться формой поиска выше), железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.
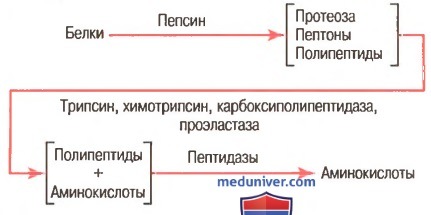
Как показано на рисунке выше, пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами. в) Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы (для облегчения понимания просим вас изучить рисунок выше). Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. г) Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
âÅÌËÉ, ÐÏÓÔÕÐÁÀÝÉÅ Ó ÐÉÝÅÊ, ÐÏÄ×ÅÒÇÁÀÔÓÑ × ÖÅÌÕÄÏÞÎÏ-ËÉÛÅÞÎÏÍ ÔÒÁËÔÅ ÒÁÓÐÁÄÕ ÐÒÉ ÕÞÁÓÔÉÉ ÐÒÏÔÅÏÌÉÔÉÞÅÓËÉÈ ÆÅÒÍÅÎÔÏ× ÉÌÉ ÐÅÐÔÉÄÇÉÄÒÏÌÁÚ, ËÏÔÏÒÙÅ ÕÓËÏÒÑÀÔ ÇÉÄÒÏÌÉÔÉÞÅÓËÏÅ ÒÁÓÝÅÐÌÅÎÉÅ ÐÅÐÔÉÄÎÙÈ Ó×ÑÚÅÊ ÍÅÖÄÕ ÁÍÉÎÏËÉÓÌÏÔÁÍÉ. òÁÚÌÉÞÎÙÅ ÐÅÐÔÉÄÇÉÄÒÏÌÁÚÙ ÏÂÌÁÄÁÀÔ ÏÔÎÏÓÉÔÅÌØÎÏÊ ÓÐÅÃÉÆÉÞÎÏÓÔØÀ, ÏÎÉ ÓÐÏÓÏÂÎÙ ËÁÔÁÌÉÚÉÒÏ×ÁÔØ ÒÁÓÝÅÐÌÅÎÉÅ ÐÅÐÔÉÄÎÙÈ Ó×ÑÚÅÊ ÍÅÖÄÕ ÏÐÒÅÄÅÌÅÎÎÙÍÉ ÁÍÉÎÏËÉÓÌÏÔÁÍÉ. ðÅÐÔÉÄÇÉÄÒÏÌÁÚÙ ×ÙÄÅÌÑÀÔÓÑ × ÎÅÁËÔÉ×ÎÏÊ ÆÏÒÍÅ ( ÜÔÏ ÐÒÅÄÏÈÒÁÎÑÅÔ ÓÔÅÎËÉ ÐÉÝÅ×ÁÒÉÔÅÌØÎÏÊ ÓÉÓÔÅÍÙ ÏÔ ÓÁÍÏÐÅÒÅ×ÁÒÉ×ÁÎÉÑ). áËÔÉ×ÉÒÕÀÔÓÑ ÏÎÉ ÐÒÉ ÐÏÓÔÕÐÌÅÎÉÉ ÐÉÝÉ × ÓÏÏÔ×ÅÔÓÔ×ÕÀÝÉÊ ÏÔÄÅÌ ÖÅÌÕÄÏÞÎÏ-ËÉÛÅÞÎÏÇÏ ÔÒÁËÔÁ ÉÌÉ ÐÒÉ ×ÉÄÅ É ÚÁÐÁÈÅ ÐÉÝÉ ÐÏ ÍÅÈÁÎÉÚÍÕ ÕÓÌÏ×ÎÏÇÏ ÒÅÆÌÅËÓÁ. áËÔÉ×ÁÃÉÑ ÐÅÐÓÉÎÁ É ÔÒÉÐÓÉÎÁ ÐÒÏÉÓÈÏÄÉÔ ÐÏ ÍÅÈÁÎÉÚÍÕ Á×ÔÏËÁÔÁÌÉÚÁ, ÄÒÕÇÉÅ ÐÅÐÔÉÄÇÉÄÒÏÌÁÚÙ ÁËÔÉ×ÉÒÕÀÔÓÑ ÔÒÉÐÓÉÎÏÍ.
÷Ï ÒÔÕ ÂÅÌËÉ ÐÉÝÉ ÔÏÌØËÏ ÍÅÈÁÎÉÞÅÓËÉ ÉÚÍÅÌØÞÁÀÔÓÑ, ÎÏ ÎÅ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÈÉÍÉÞÅÓËÉÍ ÉÚÍÅÎÅÎÉÑÍ, ÔÁË ËÁË × ÓÌÀÎÅ ÎÅÔ ÐÅÐÔÉÄÇÉÄÒÏÌÁÚ. èÉÍÉÞÅÓËÏÅ ÉÚÍÅÎÅÎÉÅ ÂÅÌËÏ× ÎÁÞÉÎÁÅÔÓÑ × ÖÅÌÕÄËÅ ÐÒÉ ÕÞÁÓÔÉÉ ÐÅÐÓÉÎÁ É ÓÏÌÑÎÏÊ ËÉÓÌÏÔÙ. ðÏÄ ÄÅÊÓÔ×ÉÅÍ ÓÏÌÑÎÏÊ ËÉÓÌÏÔÙ ÂÅÌËÉ ÎÁÂÕÈÁÀÔ, É ÆÅÒÍÅÎÔ ÐÏÌÕÞÁÅÔ ÄÏÓÔÕÐ ×Ï ×ÎÕÔÒÅÎÎÉÅ ÚÏÎÙ ÉÈ ÍÏÌÅËÕÌ. ðÅÐÓÉÎ ÕÓËÏÒÑÅÔ ÇÉÄÒÏÌÉÚ ×ÎÕÔÒÅÎÎÉÈ (ÒÁÓÐÏÌÏÖÅÎÎÙÈ ÄÁÌÅËÏ ÏÔ ËÏÎÃÏ× ÍÏÌÅËÕÌ) ÐÅÐÔÉÄÎÙÈ Ó×ÑÚÅÊ. ÷ ÒÅÚÕÌØÔÁÔÅ ÉÚ ÂÅÌËÏ×ÏÊ ÍÏÌÅËÕÌÙ ÏÂÒÁÚÕÀÔÓÑ ×ÙÓÏËÏÍÏÌÅËÕÌÑÒÎÙÅ ÐÅÐÔÉÄÙ. åÓÌÉ × ÖÅÌÕÄÏË ÐÏÓÔÕÐÁÀÔ ÓÌÏÖÎÙÅ ÂÅÌËÉ, ÐÅÐÓÉÎ É ÓÏÌÑÎÁÑ ËÉÓÌÏÔÁ ÓÐÏÓÏÂÎÙ ËÁÔÁÌÉÚÉÒÏ×ÁÔØ ÏÔÄÅÌÅÎÉÅ ÉÈ ÐÒÏÓÔÅÔÉÞÅÓËÏÊ (ÎÅÂÅÌËÏ×ÏÊ) ÇÒÕÐÐÙ.
÷ÙÓÏËÏÍÏÌÅËÕÌÑÒÎÙÅ ÐÅÐÔÉÄÙ × ËÉÛÅÞÎÉËÅ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÄÁÌØÎÅÊÛÉÍ ÐÒÅ×ÒÁÝÅÎÉÑÍ × ÓÌÁÂÏÝÅÌÏÞÎÏÊ ÓÒÅÄÅ ÐÏÄ ÄÅÊÓÔ×ÉÅÍ ÔÒÉÐÓÉÎÁ, ÈÉÍÏÔÒÉÐÓÉÎÁ É ÐÅÐÔÉÄÁÚ. ôÒÉÐÓÉÎ ÕÓËÏÒÑÅÔ ÇÉÄÒÏÌÉÚ ÐÅÐÔÉÄÎÙÈ Ó×ÑÚÅÊ, × ÏÂÒÁÚÏ×ÁÎÉÉ ËÏÔÏÒÙÈ ÐÒÉÎÉÍÁÀÔ ÕÞÁÓÔÉÅ ËÁÒÂÏËÓÉÌØÎÙÅ ÇÒÕÐÐÙ ÁÒÇÉÎÉÎÁ É ÌÉÚÉÎÁ; ÈÉÍÏÔÒÉÐÓÉÎ ÒÁÓÝÅÐÌÑÅÔ ÐÅÐÔÉÄÎÙÅ Ó×ÑÚÉ, ÏÂÒÁÚÏ×ÁÎÎÙÅ Ó ÕÞÁÓÔÉÅÍ ËÁÒÂÏËÓÉÌØÎÙÈ ÇÒÕÐÐ ÔÒÉÐÔÏÆÁÎÁ, ÔÉÒÏÚÉÎÁ É ÆÅÎÉÌÁÌÁÎÉÎÁ. ÷ ÒÅÚÕÌØÔÁÔÅ ÄÅÊÓÔ×ÉÑ ÜÔÉÈ ÆÅÒÍÅÎÔÏ× ×ÙÓÏËÏÍÏÌÅËÕÌÑÒÎÙÅ ÐÅÐÔÉÄÙ ÐÒÅ×ÒÁÝÁÀÔÓÑ × ÎÉÚËÏÍÏÌÅËÕÌÑÒÎÙÅ É ÎÅËÏÔÏÒÏÅ ËÏÌÉÞÅÓÔ×Ï Ó×ÏÂÏÄÎÙÈ ÁÍÉÎÏËÉÓÌÏÔ. îÉÚËÏÍÏÌÅËÕÌÑÒÎÙÅ ÐÅÐÔÉÄÙ × ÔÏÎËÏÍ ËÉÛÅÞÎÉËÅ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÄÅÊÓÔ×ÉÀ ËÁÒÂÏËÓÉÐÅÐÔÉÄÁÚ á É ÷, ÏÔÝÅÐÌÑÀÝÉÈ ËÏÎÃÅ×ÙÅ ÁÍÉÎÏËÉÓÌÏÔÙ ÓÏ ÓÔÏÒÏÎÙ Ó×ÏÂÏÄÎÏÊ ÁÍÉÎÏÇÒÕÐÐÙ, É ÁÍÉÎÏÐÅÐÔÉÄÁÚ, ÄÅÌÁÀÝÉÈ ÔÏ ÖÅ ÓÁÍÏÅ ÓÏ ÓÔÏÒÏÎÙ Ó×ÏÂÏÄÎÏÊ ÁÍÉÎÏÇÒÕÐÐÙ. ÷ ÒÅÚÕÌØÔÁÔÅ ÏÂÒÁÚÕÀÔÓÑ ÄÉÐÅÐÔÉÄÙ, ËÏÔÏÒÙÅ ÇÉÄÒÏÌÉÚÕÀÔÓÑ ÄÏ Ó×ÏÂÏÄÎÙÈ ÁÍÉÎÏËÉÓÌÏÔ ÐÏÄ ÄÅÊÓÔ×ÉÅÍ ÄÉÐÅÐÔÉÄÁÚ. áÍÉÎÏËÉÓÌÏÔÙ É ÎÅËÏÔÏÒÏÅ ËÏÌÉÞÅÓÔ×Ï ÎÉÚËÏÍÏÌÅËÕÌÑÒÎÙÈ ÐÅÐÔÉÄÏ× ×ÓÁÓÙ×ÁÀÔÓÑ ËÉÛÅÞÎÙÍÉ ×ÏÒÓÉÎËÁÍÉ. üÔÏÔ ÐÒÏÃÅÓÓ ÔÒÅÂÕÅÔ ÚÁÔÒÁÔ ÜÎÅÒÇÉÉ. þÁÓÔØ ÁÍÉÎÏËÉÓÌÏÔ ÕÖÅ × ÓÔÅÎËÁÈ ËÉÛÅÞÎÉËÁ ×ËÌÀÞÁÀÔÓÑ × ÓÉÎÔÅÚ ÓÐÅÃÉÆÉÞÅÓËÉÈ ÂÅÌËÏ×, ÂÏÌØÛÁÑ ÖÅ ÞÁÓÔØ ÐÒÏÄÕËÔÏ× ÐÉÝÅ×ÁÒÅÎÉÑ ÐÏÓÔÕÐÁÅÔ × ËÒÏ×Ø (95%) É × ÌÉÍÆÕ.
þÁÓÔØ ÁÍÉÎÏËÉÓÌÏÔ, ÏÂÒÁÚÏ×Á×ÛÁÑÓÑ × ÐÒÏÃÅÓÓÅ ÐÉÝÅ×ÁÒÅÎÉÑ, É ÎÅÐÅÒÅ×ÁÒÅÎÎÙÅ ÂÅÌËÉ ÎÉÖÎÉÈ ÏÔÄÅÌÏ× ËÉÛÅÞÎÉËÁ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÇÎÉÅÎÉÀ ÐÏÄ ÄÅÊÓÔ×ÉÅÍ ËÉÛÅÞÎÙÈ ÂÁËÔÅÒÉÊ. éÚ ÎÅËÏÔÏÒÙÈ ÁÍÉÎÏËÉÓÌÏÔ ÏÂÒÁÚÕÀÔÓÑ ÑÄÏ×ÉÔÙÅ ÐÒÏÄÕËÔÙ: ÆÅÎÏÌÙ, ÁÍÉÎÙ, ÍÅÒËÁÐÔÁÎÙ. ïÎÉ ÞÁÓÔÉÞÎÏ ×Ù×ÏÄÑÔÓÑ ÉÚ ÏÒÇÁÎÉÚÍÁ Ó ËÁÌÏÍ, ÞÁÓÔÉÞÎÏ ×ÓÁÓÙ×ÁÀÔÓÑ × ËÒÏ×Ø, ÐÅÒÅÎÏÓÑÔÓÑ ÅÀ × ÐÅÞÅÎØ, ÇÄÅ ÐÒÏÉÓÈÏÄÉÔ ÉÈ ÏÂÅÚ×ÒÅÖÉ×ÁÎÉÅ. üÔÏÔ ÐÒÏÃÅÓÓ ÔÒÅÂÕÅÔ ÚÎÁÞÉÔÅÌØÎÙÈ ÚÁÔÒÁÔ ÜÎÅÒÇÉÉ.
óÌÏÖÎÙÊ ÂÅÌÏË × ÐÉÝÅ×ÁÒÉÔÅÌØÎÏÊ ÓÉÓÔÅÍÅ ÒÁÓÐÁÄÁÅÔÓÑ ÎÁ ÂÅÌÏË É ÐÒÏÓÔÅÔÉÞÅÓËÕÀ ÇÒÕÐÐÕ. ðÒÏÓÔÙÅ ÂÅÌËÉ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÇÉÄÒÏÌÉÚÕ ÄÏ ÁÍÉÎÏËÉÓÌÏÔ. ðÒÅ×ÒÁÝÅÎÉÑ ÐÒÏÓÔÅÔÉÞÅÓËÉÈ ÇÒÕÐÐ ÐÒÏÉÓÈÏÄÑÔ × ÓÏÏÔ×ÅÔÓÔ×ÉÉ Ó ÉÈ ÈÉÍÉÞÅÓËÏÊ ÐÒÉÒÏÄÏÊ. çÅÍ ÈÒÏÍÏÐÒÏÔÅÉÄÏ× ÏËÉÓÌÑÅÔÓÑ × ÇÅÍÁÔÉÎ, ËÏÔÏÒÙÊ ÐÏÞÔÉ ÎÅ ×ÓÁÓÙ×ÁÅÔÓÑ × ËÒÏ×Ø, Á ×ÙÄÅÌÑÅÔÓÑ Ó ËÁÌÏÍ. îÕËÌÅÉÎÏ×ÙÅ ËÉÓÌÏÔÙ × ËÉÛÅÞÎÉËÅ ÇÉÄÒÏÌÉÚÕÀÔÓÑ ÐÒÉ ÕÞÁÓÔÉÉ ÜÎÄÏÎÕËÌÅÁÚ, ÜËÚÏÎÕËÌÅÁÚ É ÎÕËÌÅÏÔÉÄÁÚ. ðÏÄ ÄÅÊÓÔ×ÉÅÍ ÜÎÄÏÎÕËÌÅÁÚ ÉÚ ÍÏÌÅËÕÌ ÎÕËÌÅÉÎÏ×ÙÈ ËÉÓÌÏÔ ÏÂÒÁÚÕÀÔÓÑ ËÒÕÐÎÙÅ ÏÓËÏÌËÉ – ÏÌÉÇÏÎÕËÌÅÏÔÉÄÙ. üËÚÏÎÕËÌÅÁÚÙ ÏÔ ËÏÎÃÏ× ÍÏÌÅËÕÌ ÎÕËÌÅÉÎÏ×ÙÈ ËÉÓÌÏÔ É ÏÌÉÇÏÎÕËÌÅÏÔÉÄÏ× ÏÔÝÅÐÌÑÀÔ ÍÏÎÏÍÅÒÙ – ÏÔÄÅÌØÎÙÅ ÍÏÎÏÎÕËÌÅÏÔÉÄÙ, ËÏÔÏÒÙÅ ÐÏÄ ÄÅÊÓÔ×ÉÅÍ ÎÕËÌÅÏÔÉÄÁÚ ÍÏÇÕÔ ÒÁÓÐÁÄÁÔØÓÑ ÎÁ ÆÏÓÆÏÒÎÕÀ ËÉÓÌÏÔÕ É ÎÕËÌÅÏÚÉÄ. íÏÎÏÎÕËÌÅÏÔÉÄÙ É ÎÕËÌÅÏÚÉÄÙ ×ÓÁÓÙ×ÁÀÔÓÑ × ËÒÏ×Ø É ÐÅÒÅÎÏÓÑÔÓÑ Ë ÔËÁÎÑÍ., ÇÄÅ ÍÏÎÏÎÕËÌÅÏÔÉÄÙ ÉÓÐÏÌØÚÕÀÔÓÑ ÄÌÑ ÓÉÎÔÅÚÁ ÓÐÅÃÉÆÉÞÅÓËÉÈ ÎÕËÌÅÉÎÏ×ÙÈ ËÉÓÌÏÔ, Á ÎÕËÌÅÏÚÉÄÙ ÐÏÄ×ÅÒÇÁÀÔÓÑ ÄÁÌØÎÅÊÛÅÍÕ ÒÁÓÐÁÄÕ.
òÉÓ.6 ðÅÒÅ×ÁÒÉ×ÁÎÉÅ ÂÅÌËÏ× × ÖÅÌÕÄÏÞÎÏ-ËÉÛÅÞÎÏÍ ÔÒÁËÔÅ.
íÅÔÁÂÏÌÉÞÅÓËÉÊ ÆÏÎÄ ÁÍÉÎÏËÉÓÌÏÔ ËÒÏ×É ÐÏÐÏÌÎÑÅÔÓÑ ÎÅ ÔÏÌØËÏ ÚÁ ÓÞÅÔ ÁÍÉÎÏËÉÓÌÏÔ, ÐÏÓÔÕÐÁÀÝÉÈ Ó ÐÉÝÅÊ, ÎÏ É ÚÁ ÓÞÅÔ ÁÍÉÎÏËÉÓÌÏÔ, ÏÂÒÁÚÕÀÝÉÈÓÑ ÐÒÉ ÇÉÄÒÏÌÉÚÅ ÔËÁÎÅ×ÙÈ ÂÅÌËÏ×, ÁÍÉÎÏËÉÓÌÏÔ, ÓÉÎÔÅÚÉÒÕÅÍÙÈ ÉÚ ×ÅÝÅÓÔ× ÎÅÂÅÌËÏ×ÏÊ ÐÒÉÒÏÄÙ, É ÐÒÉ ÐÒÅ×ÒÁÝÅÎÉÑÈ ÏÄÎÉÈ ÁÍÉÎÏËÉÓÌÏÔ × ÄÒÕÇÉÅ. éÚ ÍÅÔÁÂÏÌÉÞÅÓËÏÇÏ ÆÏÎÄÁ ËÒÏ×É ËÁÖÄÁÑ ËÌÅÔËÁ ÔÅÌÁ ÐÏÌÕÞÁÅÔ ÁÍÉÎÏËÉÓÌÏÔÙ, ÎÅÏÂÈÏÄÉÍÙÅ ÅÊ ÄÌÑ ÓÉÎÔÅÚÁ ÅÅ ÓÐÅÃÉÆÉÞÅÓËÉÈ ÂÅÌËÏ×, Á ÏÓÔÁ×ÛÉÅÓÑ ÁÍÉÎÏËÉÓÌÏÔÙ ÐÒÅÏÂÒÁÚÕÀÔÓÑ × ÄÒÕÇÉÅ ËÌÁÓÓÙ ÓÏÅÄÉÎÅÎÉÊ ÉÌÉ ÒÁÓÐÁÄÁÀÔÓÑ ÄÏ ËÏÎÅÞÎÙÈ ÐÒÏÄÕËÔÏ× ÏÂÍÅÎÁ É ×ÙÄÅÌÑÀÔ ÐÒÉ ÜÔÏÍ ÜÎÅÒÇÉÀ.
Источник
Глава 23. Обмен аминокислот. Динамическое состояние белков организма
Значение аминокислот для организма в первую очередь заключается в том, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Аминокислоты непосредственно участвуют в биосинтезе большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклеотидов, гема, креатина, холина и др.
Рис. 23.1. Общая схема метаболизма аминокислот в организме
Катаболизм аминокислот является источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет). Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме.
Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека составляет примерно 15 кг.
Какой-либо специальной формы депонирования аминокислот и белков, подобно глюкозе или жирным кислотам не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Период полураспада белков различен – от нескольких минут до нескольких суток. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируется только углеродная часть молекулы, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи.
Показателем, отражающим интенсивность аминокислотного обмена, является азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей).
Переваривание белков начинается в желудке под действием ферментов желудочного сока. За сутки его выделяется до 2,5 литров и он отличается от других пищеварительных соков сильно кислой реакцией, благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка.
Секреция соляной кислоты представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ.
Роль соляной кислоты:
· денатурирует белки;
· стерилизует пищу;
· вызывает набухание труднорастворимых белков;
· активирует пепсиноген;
· создает рН-оптимум для действия пепсина;
· способствует всасыванию железа;
· вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты пепсин, гастриксин и реннин. Главным из них является пепсин. Он вырабатывается главными клетками слизистой желудка в виде профермента пепсиногена. Активация его осуществляется соляной кислотой (медленная) и аутокаталитически пепсином (быстрая) путем отщепления фрагмента полипептидной цепи с N-конца (частичный протеолиз). При этом происходит изменение конформации молекулы и формирование активного центра. Пепсин действует при значениях рН 1,5-2,5 и является эндопептидазой с относительной специфичностью действия, расщепляющей пептидные связи внутри белковой молекулы.
Кроме пепсина в желудочном соке содержится фермент гастриксин, проявляющий протеолитическую активность при рН 3,0-4,0. По-видимому, именно он начинает переваривание белков.
В желудочном соке грудных детей содержится фермент реннин, который имеет большое значение для переваривания белков у грудных детей, т.к. катализирует створаживание молока (превращение растворимого казеиногена в нерастворимый казеин), в результате чего замедляется продвижение нерастворимого казеина в двенадцатиперстную кишку и он дольше подвергается действию протеаз.
Образовавшиеся в результате действия пепсина в желудке полипептиды поступают в двенадцатиперстную кишку, куда выделяется сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию (рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. Кислое содержимое, поступающее из желудка нейтрализуется, и пепсин теряет свою активность.
В панкреатическом соке содержатся протеолитические ферменты трипсин, химотрипсин, карбоксипептидаза и эластаза, которые вырабатываются также в виде проферментов. Трипсиноген активируется энтерокиназой (вырабатывается клетками слизистой двенадцатиперстной кишки), переходит в активный трипсин, который активирует все остальные ферменты поджелудочного и кишечного сока. Клетки поджелудочной железы защищены от действия протеаз тем, что ферменты желудочного сока образуются в виде неактивных предшественников, а в панкреас синтезируется особый белок-ингибитор трипсина. В полости ЖКТ протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами. Разрушение клеточных белков ферментами желудочного или кишечного сока происходит при язвенной болезни.
Переваривание продуктов протеолиза пищевых белков в тонком кишечнике осуществляется с помощью амино-, ди-, и трипептидаз, которые функционируют преимущественно пристеночно.
Таким образом, конечными продуктами переваривания белков в ЖКТ являются свободные аминокислоты, которые всасываются.
Всасывание аминокислот.
Происходит путем активного транспорта с участием переносчиков. Максимальная концентрация аминокислот в крови достигается через 30-50 мин после приема белковой пищи. Перенос через щеточную каемку осуществляется целым рядом переносчиков, многие из которых действую при участии Na+-зависимых механизмов симпорта. Причем аминокислоты конкурируют друг с другом за специфические участки связывания. Выяснено, что существуют транспортные системы, переносящие аминокислоты определенного строения: нейтральные с небольшим радикалом, нейтральные с объемным радикалом, кислые, основные и иминокислоты.
В настоящее время, расшифрован механизм транспорта аминокислот в клетки кишечника, мозга, почек, получивший название g-глутамильного цикла Майстера, ключевым ферментом которого является g-глутамилтрансфераза.
Всосавшиеся аминокислоты попадают в портальный кровоток и, следовательно, в печень, а затем в общий кровоток. Освобождается кровь от свободных аминокислот очень быстро – уже через 5 мин 85-100% их оказывается в тканях. Особенно интенсивно аминокислоты поглощаются печенью и почками.
Источник
Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Регуляция желудочного пищеварения
Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин.
Гастрин секретируется специфичными G-клетками пилорического отдела:
- в ответ на раздражение механорецепторов,
- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков),
- под влиянием n.vagus.
Далее гастрин через системный кровоток достигает и стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он обеспечивает секрецию гистамина, влияя на ECL-клетки (enterochromaffin-like cells, англ. энтерохромаффиноподобные клетки).
Гистамин, образующийся в энтерохромаффиноподобных клетках слизистой оболочки желудка (фундальные железы), выходит в кровоток, взаимодействует с Н2-рецепторами на обкладочных клетках и увеличивает в них синтез и секрецию соляной кислоты.
Закисление желудочного содержимого (pH 1,0) по механизму обратной отрицательной связи подавляет активность G-клеток, снижает секрецию гастрина и желудочного сока.
Соляная кислота
Одним из важнейших компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, секретирующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии.
Н+,К+-АТФаза (протонная помпа) является мишенью действия лекарственных препаратов “ингибиторов протонной помпы” – омепразол, пантопразол и др., используемых для лечения заболеваний желудочно-кишечного тракта, связанных с повышенной кислотностью (гастриты, язвы желудка и 12-перстной кишки, дуоденит).
При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения.
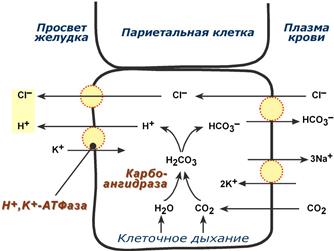
Синтез соляной кислоты
Функции соляной кислоты
- Денатурация белков пищи.
- Бактерицидное действие.
- Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы.
- Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты – тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться.
- Превращение неактивного пепсиногена в активный пепсин.
- Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина.
- После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи.
Кислая реакция желудочного сока обусловлена, главным образом, присутствием HCl, гораздо в меньшей степени иона H2PO4-, при патологиях (гипо- и анацидное состояние, онкология) свой вклад может вносить молочная кислота.
Совокупность всех веществ желудочного сока, способных быть донорами протонов, составляет общую кислотность. Соляную кислоту, находящуюся в комплексе с белками, мукополисахаридами слизистой оболочки и продуктами переваривания, называют связанной соляной кислотой, оставшуюся часть – свободной соляной кислотой. Содержание свободной HCl подвержено изменениям, в то же время количество связанной HCl относительно постоянно.
Влияние гастрина и гистамина на обкладочные клетки сводится к усилению работы Н+,К+-АТФазы. Действие гастрина заключается в активации кальций-фосфолипидного механизма передачи сигнала, гистамин действует по аденилатциклазному механизму.
Изменение кислотности в желудке
Гипоацидное состояние развивается при снижении активности и/или количества обкладочных клеток, синтезирующих HCl. В результате могут развиваться самые разнообразные последствия, прямо или косвенно связанные с невыполнением соляной кислотой ее функций:
- снижение переваривания белков как в желудке, так и в кишечнике,
- активация процессов брожения в желудке, запах изо рта,
- активация процесса гниения белков в толстой кишке, бурление в кишечнике и метеоризм,
- проникновение недопереваренных продуктов в кровь и, как следствие, аллергические реакции,
- уменьшение высвобождения от белков и возникновение дефицита минеральных веществ (железо, медь, магний, цинк, йод и др),
- снижение высвобождения от белков и всасывания ряда водорастворимых витаминов – развитие гиповитаминозов (B1, B2, B6, B12, H),
- снижение синтеза обкладочными клетками внутреннего фактора Касла и снижение всасывания витамина B12,
- снижение секреции кишечных гормонов и, как следствие, уменьшение выделения желчи и панкреатического сока,
- нарушение переваривания и всасывания липидов и, как следствие, развитие гиповитаминозов по жирорастворимым витаминам.
Гиперацидное состояние развивается при повышенной активности обкладочных клеток. Может приводить к клиническим проявлениям в виде воспаления стенки желудка, эрозии и язвенной болезни желудка и двенадцатипеперстной кишки.
Пепсин
Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр “прикрыт” N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что “раскрывается” активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
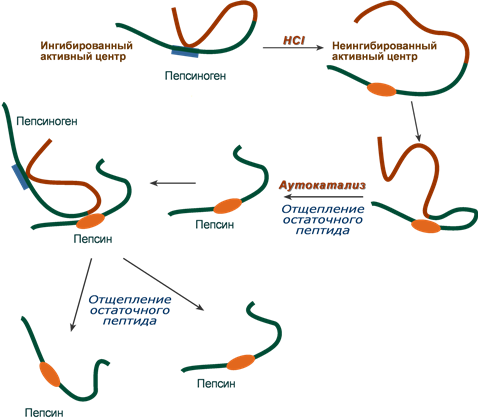
Превращение пепсиногена в пепсин
Пепсин обладает невысокой специфичностью, в основном он гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д. Оптимум рН для работы пепсина 1,5-2,0.
Связи, расщепляемые пепсином
Гастриксин
Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде прогастриксина (профермент) и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3,2-3,5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
В течение суток синтезируется около 2 г пепсина. Объем работы пепсина составляет примерно 10% от всех пептидных связей белков, попадающих в желудок.
Наличие в желудке двух протеаз, действующих при различных pH, позволяет организму пепсином переваривать белки мясной пищи, стимулирующей секрецию HCL, а гастриксином – белки растительно-молочной пищи.
Источник