Применение кишечной палочки в биотехнологии

Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
Кишечная палочка — один из первых мемов, с которым сталкиваются дети при знакомстве с биологией (рис. 1а). Запоминающееся, простое и забавное название. Помню, как узнал в детстве, что эта палочка может быть опасной — кто-то мучился животом, а родители сказали, что, наверное, кишечная палочка! Позже, уже в старшей школе, я узнал латинское название этой бактерии, и оно меня удивило, оказавшись каким-то не очень латинским. Оказывается, австрийский педиатр Теодор Эшерих (рис. 1б), который впервые выделил эту палочку из содержимого кишечника в 1885 году, вначале назвал ее благозвучно — Bacterium coli, что означает просто «кишечная бактерия». После ожидаемого пересмотра классификации бактерий род переименовали в честь первооткрывателя. По анекдотическому совпадению очень созвучно — Eschrichtius — называется одно из самых крупных существ на земле — серый кит (рис. 1в). Правда, этого гиганта так назвали в честь другого ученого — датского зоолога Даниэля Эшрихта, работавшего на полвека раньше (рис. 1г). В этом плане другой важной палочке — сенной — повезло больше, поскольку она до сих пор называется Bacillus subtilis, что в переводе — тонкая палочка.
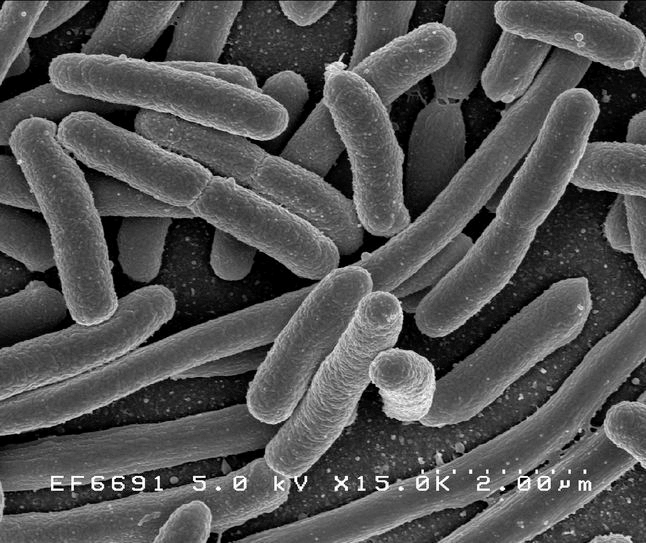
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Кишечная палочка живет… правильно, в кишечнике человека, составляя по численности не более 0,1% нормальной микрофлоры. Как и многие микроорганизмы, эта грамотрицательная палочка очень изменчива и из дружественного — комменсального — компонента микрофлоры кишечника зачастую превращается во вредный — патогенный. Практически каждый сталкивался с «колийной» инфекцией. Например, именно эшерихия вызывает большинство случаев диареи путешественников. В приморских районах местные жители иммунны к штаммам кишечной палочки, населяющим источники воды, поэтому от них страдают туристы. Одним из параметров качества питьевой воды считается косвенный показатель содержания в ней клеток кишечной палочки — так называемый коли-титр. Как и многие патогенные бактерии, кишечная палочка охотно приобретает свойства множественной устойчивости к антибиотикам . Так, в мире растет число случаев возвратного цистита [1] — воспаления мочевого пузыря — и других инфекций, вызванных мультирезистентными штаммами E. coli.
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Одновременно (или вскоре после этого) с помощью штаммов эшерихии были заложены основы современной молекулярной биологии. Французы Франсуа Жакоб и Жак Моно на примере лактозного оперона — серии генов E. coli, кодирующих каскад расщепления сахара лактозы, — раскрыли механизмы регуляции генной экспрессии — «самовыражения» генетического материала в виде работы белков, в данном случае — ферментов. На материале кишечной палочки описаны все процессы передачи информации в клетке: так называемые матричные процессы — репликация ДНК, транскрипция и трансляция. Я помню, как в университете на микробиологии нам раздали учебники Стента и Кэлиндара по молекулярной генетике, издания, кажется, 1981 года. Вначале было непонятно, почему это нужно для микробиологии, а потом оказалось, что материал учебника — кстати, очень непростой для восприятия второкурсника — на две трети описывает эксперименты, проведенные на кишечной палочке и ее вирусах.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
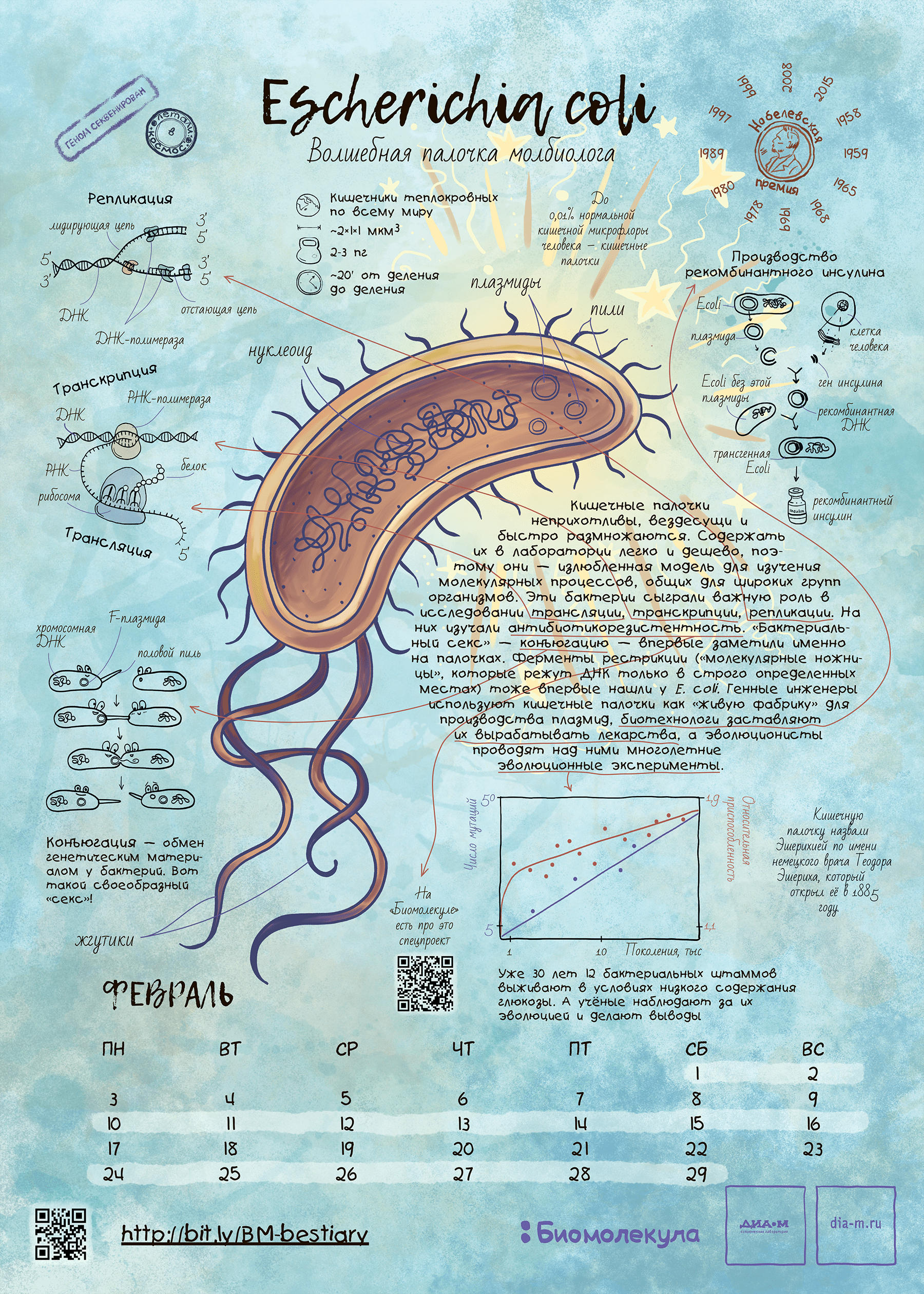
Рисунок 2. Кишечная палочка Escherichia coli как герой календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, палочка уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
Благодарность
Автор благодарит своего друга — биоинформатика Анну Казнадзей (ИППИ РАН) за ее увлекательный рассказ о новом «лактозном опероне» кишечной палочки, в открытии которого она участвовала.
- Florian Hitzenbichler, Michaela Simon, Thomas Holzmann, Michael Iberer, Markus Zimmermann, et. al.. (2018). Antibiotic resistance in E. coli isolates from patients with urinary tract infections presenting to the emergency department. Infection. 46, 325-331;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Модельные организмы: фаг лямбда;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Молекулярная биология;
- У истоков генетического кода: родственные души;
- Биотехнология. Генная инженерия;
- Anna Kaznadzey, Pavel Shelyakin, Evgeniya Belousova, Aleksandra Eremina, Uliana Shvyreva, et. al.. (2018). The genes of the sulphoquinovose catabolism in Escherichia coli are also associated with a previously unknown pathway of lactose degradation. Sci Rep. 8;
- CRISPR-системы: иммунизация прокариот.
Источник
Кишечная палочка (лат. Escherichia coli, E. coli, по имени Теодора Эшериха) – грамотрицательная палочковидная бактерия, широко встречается в нижней части кишечника теплокровных организмов.E. coli – грамотрицательная бактерия, факультативный анаэроб, не образует эндоспор. Клетки палочковидные, со слегка закруглёнными концами, размером 0,4-0,8 х 1-3 мкм, объём клетки составляет около 0,6-0,7 мmі. Штаммы, имеющие жгутики, способны передвигаться. Жгутики расположены перитрихально. Протопласт E. coli одет в муреиновый мешок, прилегающий к внешней мембране. E. coli относится к микроорганизмам, не обладающим физиологической компетентностью к поглощению экзогенной ДНК.

Кишечная палочка может жить на разных субстратах. В анаэробных условиях E. coli образует в качестве продукта жизнедеятельности лактат, сукцинат, этанол, ацетат и углекислый газ. Часто при этом образуется молекулярный водород, который мешает образованию указанных выше метаболитов, поэтому E. coli часто сосуществует с микроорганизмами, потребляющими водород – например, с метаногенами или бактериями, восстанавливающими сульфат.

Оптимальный рост достигается культурами E. coli при температуре 37 °C, некоторые штаммы могут делиться при температурах до 49 °C. Рост может стимулироваться аэробным или анаэробным дыханием, различными парами окислителей и восстановителей, в том числе, окислением пирувата, формиата, водорода, аминокислот, а также восстановлением кислорода, нитрата, диметилсульфоксида и триметиламин N-оксида.
E. coli играет важную роль в современной промышленной микробиологии и биологической инженерии. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli, с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК, находится у истоков современной биотехнологии. Усовершенствование методов получения сферопластов E. coli и их трансфекции позволили достичь достаточно высокой эффективности трансформации молекулами ДНК различных фагов.
Кишечную палочку считают универсальным организмом для синтеза чужеродных белков. В E. coli исследователи вводят гены при помощи плазмид, что позволяет осуществлять биосинтез белков для промышленной ферментации. Также разработаны системы для синтеза в E. coli рекомбинантных белков. Одним из первых примеров использования технологии рекомбинантных ДНК является синтез аналога инсулина человека. Модифицированные E. coli используют при разработке вакцин, синтеза иммобилизованных ферментов и решения других задач. Однако, в организмеE. coli невозможно получать некоторые крупные белковые комплексы, содержащие дисульфидные связи, в частности, белки, для проявления биологической активности которых требуется посттрансляционная модификация.
Чужеродные гены клонируют в так называемых челночных векторах. Эти вектора с одинаковым успехом реплицируются в клетках нескольких хозяев, в данном случае, в клетках E. coli. Векторы были получены комбинацией in vitro фрагментов этих плазмид.
Для конструирования рекомбинантной ДНК, содержащей в своем составе ген, который должен экспрессироваться, придерживаются следующей стратегии. Синтезируют к ДНК или из клонотеки выделяют клетки, несущие фрагмент генома с нужным геном, и клонируют их в соответствующем векторе. Фрагменты геномной ДНК подвергают модификации – удаляют из них некодирующие области и участки соседних генов. Часто для проведения этой операции необходимо секвенирование данного фрагмента ДНК. Затем конструируются промежуточные рекомбинантные ДНК, в которых ген помещается под контроль бактериальных регуляторных элементов (промотор, оператор, точка связывания с рибосомами). Эти регуляторные элементы выделяют из гибридных плазмид, сконструированных специально как источники регуляторных элементов. Полученная конструкция встраивается в подходящий вектор, например, pBR 322, и ген экспрессируется в бактериальной клетке.
Однако удобнее встраивать ген в специальный вектор для экспрессии, который уже содержит регуляторные элементы, обеспечивающие активную экспрессию после введения рекомбинантной плазмиды в бактериальную клетку. К таким эффективным регуляторным участкам относится, например, сильный промотор гена бэта-лактамазы (ген устойчивости к пенициллину, входящий в состав плазмиды pBR 322). Ряд генов, в том числе и ген инсулина, встраивали в сайт рестрикции Pst I, который расположен в структурной части гена. Промотор этого гена обеспечивает эффективную транскрипцию, которая продолжается до тех пор, пока РНК-полимераза не дойдет до сигнала терминации встроенного гена.
В качестве примера маркирования вектора могут служит первые эксперименты с E. coli, а точнее с одной из ее плазмид рBR322, проведенные Гилбертом для получения инсулина. Плазмида pBR322 содержит 2 гена, которые определяют устойчивость к ампициллину и тетрациклину. Рестриктаза PstI расщепляет плазмиду в средней части гена, кодирующего фермент устойчивости к ампициллину. После расщепления плазмиды на ее концы с помощью концевой трансферазы надстраивали последовательность из четырех нуклеотидов с остатками гуанина. Затем, как обычно, с помощью лигаз “вшивали” ген проинсулина, получая рекомбинантную ДНК. Встроенный в плазмиду фрагмент ДНК нарушал синтез фермента, разрушающего ампициллин, но ген, обеспечивающий устойчивость к тетрациклину, оставался активным. Трансформированные таким образом клетки E. coli синтезировали гибридный белок, содержащий последовательности пенициллазы и проинсулина, поэтому биологически активный инсулин получали путем отщепления пенициллазы и среднего сегмента проинсулина.
С другой стороны, если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику.
Источник
ESCHERICHIA COLI КАК МОДЕЛЬНЫЙ ОБЪЕКТ В БИОЛОГИИ И ЭКСПЕРИМЕНТАЛЬНОЙ МЕДИЦИНЕ
- Авторы
- Файлы работы
- Сертификаты
Кайсаров И.Д. 1, Борейко А.С. 1, Николаев В.А. 1, Казакова М.С. 1, Поляков Н.К. 1
1Волгоградский государственный медицинский университет
Комментарии
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Кишечная палочка (лат. Escherichia coli) — вид грамотрицательных факультативно-анаэробных подвижных палочковидных бактерий. E. coli является обитателем нормальной микрофлоры желудочно-кишечного тракта человека.
Вид кишечная палочка (лат. E. coli) включён в род эшерихии (лат. Escherichia), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ-proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии. (Гусев М.В., Минеева Л.А., “Микробиология” 2003)
Развитие методов молекулярной биологии и генетики, направленных на изучение механизмов наследственности и изменчивости живых организмов, вызвало потребность в подходящих для решения таких задач модельных объектах. Все объекты генетических исследований, служащие моделями для изучения основных закономерностей наследственности и изменчивости, должны отвечать определённым требованиям: доступность; простота культивирования; высокая интенсивность роста клеточной культуры; короткий репродуктивный период. Среди прокариотов всем этим требованиям лучше всех отвечает кишечная палочка, что делает данный вид бактерий классическим объектом для молекулярно-генетических исследований. (Коничев А.С., Севастьянова Г.А. “Молекулярная биология” 2005)
Изучение E. coli также сыграло важную роль в развитии современной промышленной микробиологии и биоинженерии. Работа Стенли Нормана Коэна и Герберта Бойера на E. coli, с использованием плазмид и эндонуклеаз рестрикции для создания рекомбинантной ДНК, стала одной из фундаментальных для современной биотехнологии. Впервые технология рекомбинантных ДНК была успешно применена с целью синтеза аналога инсулина человека колонией кишечной палочки. (Тимощенко Л.В., Чубик М.В., “Основы микробиологии и биотехнологии” 2009)
Большой интерес к E. coli как к модельному объекту возник в конце XX столетия и поддерживается в настоящее время по причине незаменимости данного вида бактерий в широком спектре исследований. На сегодняшний день E. coli является одним из наиболее часто использующихся биообъектов научных и клинических исследований. Модифицированные штаммы E. coli используются при разработке вакцин, синтеза биологически активных веществ, и решения других задач. (Бирюков В.В. “Основы промышленной биотехнологии” 2004)
Список литературы:
Гусев М.В., Минеева Л.А., Микробиология, 4-е изд., стер. – М.: Академия, 2003. — 464 с.
Коничев А.С., Севастьянова Г.А., Молекулярная биология, М.: Издательский центр “Академия”, 2-е изд., 2005. – 400 с.
Тимощенко Л.В., Чубик М.В., Основы микробиологии и биотехнологии: учебное пособие Томск: Изд-во Томского политехнического университета, 2009. – 194 с.
Бирюков В.В., Основы промышленной биотехнологии, Издательство: «КолосС», 2004.- 296 с.
Просмотров работы: 687
Код для цитирования:
Источник
Кишечной палочки ( ; обычно сокращенно кишечной палочки ) представляет собойграмотрицательные гамма-протеобактерииобычно находится в нижнемкишечникенатеплокровныхорганизмов (эндотермических). Потомки двух изолятов, штамм К-12 и В, обычно используются в молекулярной биологии как инструмент и как модельный организм.
Разнообразие
Escherichia coli – один из самых разнообразных видов бактерий с несколькими патогенными штаммами с разными симптомами и только 20% генома, общего для всех штаммов. Кроме того, с эволюционной точки зрения, члены рода Shigella ( дизентерии , Флекснер , boydii , Зонне ) на самом деле являются E. Coli штаммов «в маскировке» (т.е. кишечной палочка является парафилетической к роду).
История
В 1885 году немецкий педиатр Теодор Эшерих впервые обнаружил этот вид в кале здоровых людей и назвал его Bacterium coli commune, потому что он обнаружен в толстой кишке, и ранние классификации прокариот поместили их в несколько родов в зависимости от их формы и формы. подвижность (в то время существовала классификация бактерий в королевстве Монера, разработанная Эрнстом Геккелем ).
После пересмотра Bacteria он был реклассифицирован как Bacillus coli компанией Migula в 1895 году, а затем реклассифицирован как Escherichia coli .
Из-за простоты культивирования и быстрого удвоения его использовали в первых микробиологических экспериментах; однако бактерии считались примитивными и доклеточными и не привлекали к себе особого внимания до 1944 года, когда Эйвери, Маклауд и Маккарти продемонстрировали, что ДНК является генетическим материалом с использованием Salmonella typhimurium , после чего Escherichia coli была использована для исследований картирования сцепления.
Штаммы
Четыре из множества штаммов E. coli (K-12, B, C и W) считаются модельными штаммами организмов. Они отнесены к группе риска 1 в руководствах по биобезопасности.
Изолят Эшериха
Первый изолят Escherich был депонирован в NCTC в 1920 году Институтом Листера в Лондоне ( NCTC 86 [1] ).
К-12
Штамм был выделен из образца стула пациента, выздоравливающего от дифтерии, и в 1922 году в Стэнфордском университете был обозначен как K-12 (не антиген). Этот изолят был использован в 1940-х годах Чарльзом Клифтоном для изучения метаболизма азота, который депонировал его в АТСС (штамм АТСС 10798 ) и одолжил Эдварду Татуму для его экспериментов по биосинтезу триптофана, несмотря на его идиосинкразии из-за фенотипа F + λ +. В ходе пассажей он потерял свой O-антиген и в 1953 г. был излечен сначала от своего лямбда-фага ( штамм W1485 , разработанного Джошуа Ледербергом и его коллегами), а затем в 1985 г. от плазмиды F путем отверждения акридиновым апельсином. Штаммы, полученные из MG1655, включают DH1, родительский элемент DH5α и, в свою очередь, DH10B (переименованный в TOP10 компанией Invitrogen). Альтернативная линия от W1485 – это линия W2637 (которая содержит инверсию rrnD-rrnE), которая, в свою очередь, привела к W3110. Из-за отсутствия конкретных записей, «родословная» штаммов не была доступна, и ее нужно было определить, изучив лабораторную книгу и записи, чтобы создать Барбарой Бахманн Центр генетического запаса E. coli в Йельском университете . Различные штаммы были получены путем обработки E. coli K-12 такими агентами, как азотистый иприт, ультрафиолетовое излучение, рентгеновское излучение и т. Д. Обширный список производных штамма Escherichia coli K-12 и их индивидуальная конструкция, генотипы, фенотипы , информацию о плазмидах и фагах можно найти на сайте Ecoliwiki .
Штамм B
Второй распространенный лабораторный штамм – это штамм B, история которого менее очевидна, и первое название штамма E. coli B было дано Дельбрюком и Лурией в 1942 году в их исследовании бактериофагов T1 и T7. Первоначальный штамм E. coli B, известный тогда как Bacillus coli , произошел от Феликса д’Эрелля из Института Пастера в Париже около 1918 года, который изучал бактериофаги и утверждал, что он произошел из Коллекции Института Пастера, но не штаммы того периода. существовать. Штамм d’Herelle был передан Жюлю Борде, директору Института Пастера дю Брабанта в Брюсселе, и его ученику Андре Грациа. Первый передал штамм Анне Каттнер («Бактериальная палочка, полученная от доктора Бордет») и, в свою очередь, Эжену Вольману (B. coli Bordet), сын которого депонировал его в 1963 году (CIP 63.70) как «штамм БАМ» ( B American), в то время как Андре Грация передал штамм Марте Воллштейн, исследователю из Рокфеллера, которая в 1921 году назвала штамм «брюссельским штаммом Bacillus coli », который, в свою очередь, передал его Жаку Бронфенбреннеру (B. coli PC), который передал его Дельбрюку и Лурии. Этот штамм дал начало нескольким другим штаммам, таким как REL606 и BL21.
Штамм C
E. coli C морфологически отличается от других штаммов E. coli ; он более сферический по форме и имеет отчетливое распределение нуклеоида.
Деформация W
Штамм W был выделен из почвы недалеко от Университета Рутгерса Селманом Ваксманом .
Роль в биотехнологии
Из-за своей долгой истории лабораторного культивирования и простоты манипуляции E. coli также играет важную роль в современной биологической инженерии и промышленной микробиологии . Работа Stanley Norman Cohen и Герберт Бойер в E.coli , с использованием плазмид и ферментов рестрикции , чтобы создать рекомбинантную ДНК , стала основой биотехнологии.
Считаясь очень универсальным хозяином для производства гетерологичных белков , исследователи могут вводить гены в микробы с помощью плазмид, что позволяет массовое производство белков в промышленных процессах ферментации . Также были разработаны генетические системы, позволяющие производить рекомбинантные белки с использованием E. coli . Одним из первых полезных применений технологии рекомбинантной ДНК было манипулирование E. coli для производства человеческого инсулина . Модифицированная E. coli использовалась при разработке вакцин , биоремедиации и производстве иммобилизованных ферментов .
E. coli успешно использовались для получения белков, которые ранее считались трудными или невозможными для E. coli , например белков, содержащих множественные дисульфидные связи, или белков, требующих посттрансляционной модификации для стабильности или функции. Клеточная среда E. coli обычно слишком восстановительна для образования дисульфидных связей, поэтому белки с дисульфидными связями могут секретироваться в ее периплазматическое пространство , однако мутанты, у которых нарушено восстановление как тиоредоксинов, так и глутатиона, также позволяют белкам с дисульфидными связями образовываться. вырабатываться в цитоплазме кишечной палочки . Он также использовался для производства белков с различными посттрансляционными модификациями, включая гликопротеины, с использованием системы N-связанного гликозилирования Campylobacter jejuni, сконструированной в E. coli . В настоящее время предпринимаются попытки расширить эту технологию для получения сложных гликозилирований.
Также проводятся исследования по программированию E. coli для решения сложных математических задач, таких как проблема гамильтонова пути .
Модельный организм
E. coli часто используется в качестве модельного организма в микробиологических исследованиях. Культурные штаммы (например, E. coli K-12) хорошо адаптированы к лабораторным условиям и, в отличие от штаммов дикого типа , утратили способность расти в кишечнике. Многие лабораторные штаммы теряют способность образовывать биопленки . Эти свойства защищают штаммы дикого типа от антител и других химических атак, но требуют больших затрат энергии и материальных ресурсов.
В 1946 году Джошуа Ледерберг и Эдвард Татум впервые описали феномен, известный как бактериальная конъюгация, используя E. coli в качестве модельной бактерии, и он остается основной моделью для изучения конъюгации. E. coli была неотъемлемой частью первых экспериментов по пониманию генетики фагов , и ранние исследователи, такие как Сеймур Бензер , использовали E. coli и фаг T4, чтобы понять топографию структуры гена. До исследования Бензера не было известно, является ли ген линейной структурой или имеет структуру ветвления.
E. coli была одним из первых организмов, чей геном был секвенирован; полный геном E. coli K-12 был опубликован сайтом Science в 1997 году.
Долгосрочный эволюционный эксперимент Ленского
Эксперименты по длительной эволюции с использованием E. coli , начатые Ричардом Ленски в 1988 году, позволили непосредственно наблюдать основные эволюционные сдвиги в лаборатории. В этом эксперименте одна популяция E. coli неожиданно развила способность аэробно метаболизировать цитрат . Эта способность крайне редко встречается у E. coli . Поскольку неспособность к аэробному росту обычно используется в качестве диагностического критерия, с помощью которого можно отличить кишечную палочку от других близкородственных бактерий, таких как сальмонелла , это нововведение может означать событие видообразования, наблюдаемое в лаборатории.
Ссылки
Источник