Расщепление белков в желудочно кишечном тракте
 «Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
«Расщепление белков в желудочно-кишечном тракте» — это первая из четырёх статья из цикла «Обмен белков в организме человека»
В течение всей жизни в организме происходят одновременно разрушения и биосинтез клеток и тканей. Эти противоположные, но тесно связанные между собой процессы — ассимиляция и диссимиляция — составляют основу жизни. Итак, в организм должны постоянно поступать вещества, необходимые для построения новых клеток. Главная роль в этом принадлежит белкам, так как ни углеводы, ни жиры не могут их заменить в образовании основных структурных элементов органов и тканей. Среди различных преобразований, присущих живой материи, основное место занимает белковый обмен.
В связи с тем, что белки являются азотсодержащими веществами, одним из методов, характеризующим состояние белкового обмена в организме, может быть определение баланса азота. У здорового человека при нормальном питании отмечается состояние белкового равновесия, когда поступление азота компенсирует его затраты. При отрицательном азотистом балансе количество выведенного азота превышает его количество, поступающее в составе белков. Такое состояние может наблюдаться при нарушении деятельности пищеварительной системы, белковом голодании и т п.
Положительный азотистый баланс бывает в тех случаях, когда количество выведенного азота меньше того, что поступает в составе белков. Это характерно для растущего организма, при беременности, при повышении активности процессов биосинтеза белка (например, при физических нагрузках).
Для синтеза белков в организме необходимы различные аминокислоты. Некоторые из них, образующиеся в самом организме, называются заменимыми. Аминокислоты, не синтезирующиеся в организме человека, называются незаменимыми. Они должны регулярно поступать с пищей. Белки, в состав которых входят заменимые и незаменимые аминокислоты в соотношениях, приближающихся к таковым в организме, называют полноценными.
Среди пищевых продуктов практически нет белков, которые полностью соответствуют этим требованиям. Наиболее близки к полноценному белки материнского молока, куриного яйца. Итак, для полного обеспечения здорового организма полноценными белками в суточный рацион должны быть включены различные пищевые продукты как животного, так и растительного происхождения.
Для нормальной жизнедеятельности человека необходимо поступление такого количества полноценного белка, которое будет покрывать все потребности организма. Оно зависит от пола, возраста, интенсивности труда и т.д. С учетом этих факторов разработаны нормы белкового питания. Недостаточное потребление белков приводит к нарушению процессов жизнедеятельности, ухудшению здоровья, а длительное белковое голодание неизбежно заканчивается гибелью.
Белки необходимы для организма, прежде всего, как пластический материал, из которого строятся клетки всех тканей, органов и систем. Однако пищевые белки не могут быть использованы без предварительного расщепления в организме, так как они имеют сложную структуру и видовую специфичность.
Расщепление (гидролиз) белков на аминокислоты, которые лишены видовой и тканевой специфичности, происходит в желудочно-кишечном тракте.
Переваривание питательных веществ (белков, углеводов, липидов) — это процесс гидролиза соответствующих соединений, входящих в состав продуктов питания, который происходит в пищеварительном тракте и приводит к образованию простых биомолекул. Последние за счет действия специфических механизмов мембранного транспорта всасываются в кровь или лимфу.
Переваривание белков начинается в желудке под действием желудочного сока. В состав желудочного сока входит соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка. Она денатурирует белок, облегчает его последующее расщепление. В состав желудочного сока входят кислые фосфаты и некоторые органические кислоты. Соляная кислота способствует превращению профермента пепсиногена, который секретируется главными клетками слизистой оболочки желудка, в активный протеолитический фермент пепсин.
Оптимальная концентрация водородных ионов для пепсина составляет 1,5 — 2,5, что соответствует кислотности желудочного сока в процессе пищеварения. При увеличении рН среды до 6,0 (в кишечнике) пепсин теряет свою активность. Пепсин относится к однокомпонентным ферментам, то есть к ферментам-протеинам. За сутки в желудке вырабатывается около 2 г пепсина.
Каталитическая активность пепсина желудка очень высока. Он катализирует расщепление пептидных связей в молекуле белка, образованных аминогруппами ароматических и дикарбоновых аминокислот. В результате действия пепсина образуются полипептиды различной величины и отдельные свободные аминокислоты.
Кроме пепсина, в желудочном соке содержится протеолитический фермент гастриксин, оптимальное значение рН которого находятся в пределах 3,5 — 4,5. Гастриксин вступает в действие на последних этапах переваривания пищи в желудке.
В желудке грудных детей обнаружен сычужный фермент — химозин. Оптимум действия этого фермента рН 3,5 — 4,0. Под влиянием химозина в присутствии солей кальция казеиноген молока в ходе гидролиза превращается в казеин и молоко свёртывается.
Легче других в желудке перевариваются альбумины и глобулины животного и растительного происхождения; плохо расщепляются белки соединительной ткани (коллаген и эластин) и совсем не расщепляются кератин и протамины.
Частично переваренная полужидкая масса питательных соединений, которая образуется в желудке (химус) периодически поступает через пилорический клапан в двенадцатиперстную кишку. В эту часть пищеварительного канала поступают из поджелудочной железы протеолитические ферменты и пептидазы, которые действуют на пептиды, поступающие из желудка. Каталитическое действие этих ферментов происходит в слабощелочной среде (рН 7,5 — 8,0), которая образуется имеющимися в кишечном соке бикарбонатами.
Большинство ферментов протеолитического действия, функционирующих в тонкой кишке, синтезируются в экзокринных клетках поджелудочной железы в виде проферментов, которые активируются после их поступления в двенадцатиперстную кишку (трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и Б). Гидролиз белков и пептидов, поступающих из желудка, происходит как в полости тонкой кишки, так и на поверхности энтероцитов — пристеночное или мембранное пищеварение.
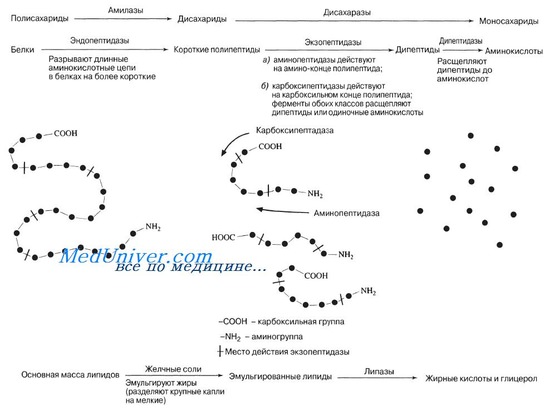
Сок поджелудочной железы поступает в двенадцатиперстную кишку и смешивается с кишечным соком. Эта смесь содержит протеолитические ферменты, расщепляющие белки, альбумозы и пептоны до небольших пептидов, а затем до аминокислот. К протеолитическим ферментам относятся трипсин, химотрипсин, карбоксипептидазы, аминопептидазы и большая группа три- и дипептидаз.
Трипсин находится в соке поджелудочной железы в неактивной форме, в виде профермента трипсиногена. Его активация происходит под действием фермента кишечного сока — энтерокиназы. Для процесса активации необходимы ионы Са2+. Процесс преобразования трипсиногена в трипсин осуществляется путем отщепления небольшого пептида с N-конца пептидной цепи фермента.
Трипсин гидролизует как нерасщепленные в желудке белки, так и высокомолекулярные пептиды, действуя главным образом на пептидные связи между аргинином и лизином. Оптимум рН для трипсина составляет 7,0 — 8,0. Трипсин делает сравнительно неглубокий гидролиз белка, образует полипептиды и небольшое количество свободных аминокислот.
Активность трипсина может снижаться под влиянием ряда ингибиторов. К ним относятся основные пептиды с молекулярной массой 9000 ед. Они обнаружены в поджелудочной железе, крови, легких, в бобах сои. Снижает активность трипсина и мукопротеин, содержащийся в сырых яйцах — авидин.
Химотрипсин — второй протеолитический фермент поджелудочной железы. Он также секретируется в неактивной форме, в виде химотрипсиногена. Под действием трипсина химотрипсиноген переходит в активный фермент — химотрипсин. Действие химотрипсина подобно действию трипсина. Оптимум рН для обоих ферментов примерно одинаковый, химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты (тирозин, фенилаланин, триптофан), а также на пептидные связи, которые не подвергаются воздействию трипсина (метионин, лейцин).
Пептиды, которые образуютсяся в результате воздействия на белки пепсина, трипсина и химотрипсина в нижних отделах тонкой кишки, подвергаются дальнейшему расщеплению. Этот процесс осуществляют карбоксипептидазы, аминопептидазы. Эти ферменты относятся к металлоферментам. Они активируются двухвалентными ионами: Mg2+, Mn2+, Со2+, которые играют важную роль в формировании фермент-субстратного комплекса.
Механизм действия амино- и карбоксипептидаз заключается в отщеплении от пептидов конечных аминокислот, имеющих свободную аминную или карбоксильную группу. Небольшие пептиды, которые остались нерасщепленными и состоят из трех-четырех аминокислотных остатков, подвергаются гидролизу специфическими ди- и триаминопептидазами. В соке поджелудочной железы присутствует фермент эластаза. Эластаза — эндопептидаза, которая также имеет широкую субстратную специфичность, расщепляя пептидные связи, образующиеся остатками аминокислот малого размера — глицина, аланина, серина.
Таким образом, в результате последовательного действия на белки протеолитических ферментов в кишечнике образуются свободные аминокислоты, которые всасываются в кровь через стенку кишечника.
Следующая вторая статья из цикла «Обмен белков в организме человека» — «Обезвреживание продуктов гниения белков в кишечнике». Третья статья «Обмен аминокислот в тканях»
Источник
Переваривание белков. Этапы и последовательность переваривания белковПищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в главе 64, железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться. Пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы. Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
Переваривание белков происходит в 3 этапа:в желудке;в тонком кишечнике;в клетках слизистой оболочки тонкого кишечника.
Расщепление белков происходит при участии нескольких групп ферментов:
Эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи.
Экзопептидазы – катализирует разрыв концевой пептидной связи с образованием одной какой-либо аминокислоты.
К эндопептидазам относятся следующие ферменты: пепсин, гастрин, трипсин, химотрипсин, эластаза.
К экзопептидазам относятся: карбоксипептидазы, аминопептидазы, дипептидазы.
1.Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Железы желудка секретируют большое количество соляной кислоты. Когда кислота смешивается с желудочным содержимым, рН составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина.
Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. Пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы (крупные полипептиды), пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами.
2.Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы.
Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов.
3.Переваривание белков пептидазами энтероцитов. Заключительный этап переваривания белков обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью.
Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дипептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита, где перевариваются до конечной стадии в форме отдельных аминокислот, а отсюда в кровь.
28. Катаболизм аминокислот: образование и обезвреживание аммиака. Токсичность аммиака. Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы. Основными источниками аммиака являются следующие реакции:
неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
Так как аммиак является чрезвычайно токсичным соединением, то в тканях существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата.
1.Синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратнареакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
реакция синтеза глутаминовой кислоты.
2.Синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. Токсичность аммиака обусловлена следующими обстоятельствами:
1. Связывание аммиака при синтезе глутамата вызывает отток α-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток.
2. Ионы аммония NH4+ вызывают защелачиваниеплазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток.
3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов – он конкурирует с ионными насосами для Na+ и K+.
4. Продукт связывания аммиака с глутаминовой кислотой – глутамин –является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть.
5. Использование α-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза γ- аминомасляной кислоты(ГАМК), тормозного медиатора нервной системы.
В клетки печени и почек аммиак попадает в составе глутаминаи аспарагина, глутаминовой кислоты, аланинаи в свободномвиде и идет на синтез мочевины.
Источник