Римские критерии 4 диарея
В статье подробно рассмотрены Римские критерии IV и приведен алгоритм ведения пациентов с синдромом раздраженного кишечника

Введение
Функциональные заболевания кишечника (ФЗК) очень широко распространены во всем мире. Эти расстройства затрагивают все слои общества, независимо от пола, возраста, расы, вероисповедания, цвета кожи или социально-экономического статуса. В 2016 г. были опубликованы Римские критерии IV [1], надежды на которые, к сожалению, не вполне оправдались, т. к. гастроэнтерологи-интернисты так и не получили универсальные инструменты для курации «функциональных» пациентов. В то же время обновленные критерии представляют собой не прекращающие адаптироваться клинические рекомендации, определяющие вектор клинического мышления как в случаях постановки диагноза, так и в случаях выбора методов терапии.
В отличие от предыдущей классификации, в разделе функциональных заболеваний кишечника появилась новая форма – «опиоид-индуцированный запор», призванная обратить внимание клиницистов на резко возросшую частоту применения опиатов и связанное с этим большое количество побочных эффектов. Эта форма не рассматривается как отдельное заболевание, а классифицируется как опиоид-индуцированное неблагоприятное последствие.
Римские критерии IV. Раздел С. Функциональные расстройства кишечника:
C1. Синдром раздраженного кишечника.
C2. Функциональный запор.
C3. Функциональная диарея.
С4. Функциональное вздутие.
C5. Неспецифическое функциональное кишечное расстройство.
С6. Опиоид-индуцированный запор.
Определение и эпидемиология
Сегодня синдром раздраженного кишечника (СРК) – это рецидивирующее функциональное расстройство ЖКТ, главным симптомом которого является боль в животе в непременной ассоциации с изменением кишечной функции, проявляющимся преобладанием либо диареи (СРК-Д), либо запоров (СРК-З) или их чередованием (СРК-С, смешанный вариант). Диагноз СРК остается исключительно клиническим. Сложность изучения СРК, особенно с позиций его эпидемиологии, заключается в отсутствии до сих пор универсального и специфичного биологического маркера.
Согласно метаанализу, опубликованному в 2012 г., в который по довольно строгим критериям отбора вошло 80 клинических исследований (с общим числом пациентов 260 960), распространенность СРК в мире составляет 11,2% (95% ДИ: 9,8–12,8%) [2]. Заболеваемость оценивается как 1,35–1,5%, о чем свидетельствуют 2 отдельных популяционных исследования длительностью 10 и 12 лет [3, 4]. Встречаемость СРК среди женщин остается более высокой, чем среди мужчин. Молодые люди более подвержены развитию заболевания, нежели лица старше 50 лет. Любой случай манифестации клинической картины СРК у пациентов старшей возрастной категории должен настораживать интерниста в отношении исключения органической патологии.
Этиопатогенез СРК очень сложен и до сих пор до конца не изучен. На заре изучения этой проблемы из публикаций мы знали о феномене висцеральной гиперчувствительности, который объяснялся нарушением моторики ЖКТ, с безуспешными попытками увязать особенности этого нарушения с каким-либо вариантом СРК, и недостаточными на тот момент знаниями о нарушениях по оси «головной мозг – ЖКТ». Сегодня среди звеньев этиопатогенеза синдрома как наиболее актуальные рассматриваются социально-экономический статус, генетическая предрасположенность, возможность формирования заболевания у ребенка родителями, страдающими СРК, психологические аспекты, висцеральная гиперчувствительность, нарушения моторики ЖКТ, изменения в нейроэндокринной системе (ось «головной мозг – ЖКТ»), low-grade воспаление, концепция постинфекционного СРК, дисбаланс микробиоты и, наконец, факторы питания [5]. В концепции формирования заболевания в каждом конкретном случае, очевидно, имеет значение несколько этиологических факторов, запускающих несколько патофизиологических механизмов (рис. 1). И сложность курации подобных больных заключается в том, что в каждом конкретном случае сочетание этиопатогенетических механизмов индивидуально [6]. 
Принимая во внимание многокомпонентность причин и механизмов формирования СРК, необходимо отметить, что все эти звенья играют такую же роль и при других функциональных заболеваниях ЖКТ. Факт возможности перекреста функциональной патологии у одного и того же больного сегодня безоговорочно принят Римским соглашением, а наиболее частым «соседом» СРК в этом перекресте является функциональная диспепсия [7, 8]. Это, в свою очередь, существенно усложняет курацию пациентов, приводит к назначению врачами большого количества порой ненужных препаратов и объясняет низкий уровень приверженности пациентов проводимому лечению. Все это крайне важно учитывать при лечении так называемых «функциональных» больных.
Концепция Римских диагностических критериев IV и классификация СРК
Современные Римские диагностические критерии СРК IV [1] имеют ряд принципиально важных отличий от предыдущей редакции. Среди них – анамнез (начало клинических проявлений в течение не менее 6 мес. до постановки диагноза), текущая активность (наличие симптомов в течение последних 3 мес.), частота (указанные в критериях симптомы присутствуют не реже 1 раза в неделю, в отличие от 3 дней в месяц, как предлагалось в Римских критериях III), и все это – при отсутствии очевидных анатомических и физиологических отклонений при проведении рутинного клинического обследования по показаниям, иными словами, при отсутствии «симптомов тревоги».
Римские диагностические критерии СРК IV
Рецидивирующая абдоминальная боль в среднем как минимум 1 день в неделю за последние 3 мес., ассоциированная с 2 и более следующими симптомами:
– связанная с дефекацией;
– ассоциированная с изменением частоты стула;
– ассоциированная с изменением формы стула.
Критерии валидны при условии их наличия в течение последних 3 мес. с началом симптомов не менее 6 мес. назад!
Кроме того, в отличие от предыдущих редакций Римских критериев, из текущего определения исключен термин «дискомфорт» на том основании, что, во-первых, не все языки мира имеют в своем арсенале это слово, а во-вторых, и это, пожалуй, главное, – различная и неопределенная трактовка понятия «дискомфорт» пациентами часто приводит к ошибочному диагнозу. И этот последний факт был документально подтвержден в клиническом исследовании [9].
Таким образом, сегодня главный отличительный симптом СРК – это боль в животе, связанная с дефекацией, в неразрывной ассоциации с нарушением кишечной привычки, а не дискомфорт, вздутие, растяжение или какие-либо другие ощущения, которые могут встречаться у больных с другой функциональной патологией, например, при функциональном запоре или диарее. Эта концепция, отражающая современный взгляд на диагностику ФЗК, наглядно представлена на рисунке 2.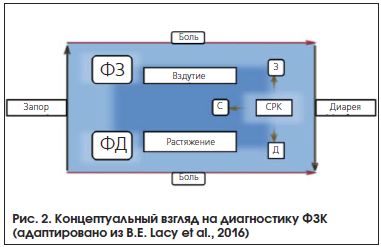
Еще одной отличительной чертой обновленных рекомендаций является замена фразы «облегчение после дефекации» на «связанную с дефекацией», т. к. мировой клинический опыт показывает, что у довольно значительной части больных этого облегчения не происходит, более того, ряд пациентов с СРК отмечают ухудшение после дефекации.
Мы полагаем, что все эти нюансы нового взгляда на СРК позволят существенно снизить количество ложных диагнозов и, наоборот, его гипердиагностики.
Принцип классификации СРК остался неизменным и основан на Бристольской шкале формы стула [10], типы 1 и 2 которой свидетельствуют о запоре, а типы 6 и 7 – о диарее. Более того, использование Бристольской шкалы формы стула позволит не только избежать диагностической ошибки, но и значительно сократить время приема пациента, что в современных условиях работы поликлинического врача является чрезвычайно полезным.
Таким образом, как это было и ранее, опираясь на описанную выше шкалу, принимая во внимание частоту встречаемости того или иного типа стула, врач устанавливает форму СРК. При этом надо помнить, что один и тот же пациент в ходе естественного течения своего заболевания может иметь различные варианты СРК.
Этапы диагностики и дифференциальная диагностика СРК
Как уже не раз говорилось, любая функциональная патология является диагнозом исключения. И когда жалобы и анамнез больного позволяют предположить, например, СРК, следующим обязательным этапом диагностики, равно как и в любом другом случае, является физикальный осмотр, который позволяет успокоить пациента и исключить или заподозрить органическую патологию.
Следующим шагом в диагностике СРК является выполнение лабораторных тестов и инструментального обследования, если таковые не проводились ранее или к ним есть определенные показания. Они включают в себя оценку клинического анализа крови, маркеров воспаления, в частности, С-реактивного белка крови, эндоскопическое исследование (колоноскопию) всем лицам старше 50 лет либо во всех случаях семейного анамнеза колоректального рака, имеющегося гематохезиса, подозрения на микроскопический колит. Кроме того, по показаниям необходимо выполнять серологическую диагностику целиакии у пациентов с преобладанием диареи и при смешанном варианте, особенно у тех, кто не ответил на инициированную эмпирическую терапию, оценивать маркеры функции щитовидной железы при клинических подозрениях на ее патологию; исключить инфекционную природу диареи, синдром мальабсорбции желчных кислот, панкреатическую недостаточность, Clostridium difficile-ассоциированную болезнь, провести дыхательные тесты и др.
Перечень нозологий, с которыми должна проводиться дифференциальная диагностика, и их особенностей представлен в наших предыдущих публикациях [11]. Следует отметить, что объем обследования больного СРК в итоге, безусловно, зависит от уровня профессионализма врача и должен быть регламентирован показаниями.
Лечение
Лечение больных СРК, даже с учетом обновленных клинических рекомендаций, остается очень сложной задачей. Это связано с многообразием факторов, приводящих к развитию заболевания, о чем говорилось выше, чрезвычайно сильной зависимостью рецидивирования заболевания от состояния психоэмоциональной сферы, наличием в большинстве случаев коморбидности и синдрома «перекреста».
В настоящее время в арсенале интерниста при курации пациента с СРК нет универсального инструмента, а именно препарата или комбинации препаратов, которые были бы эффективны в большинстве случаев хотя бы одного из вариантов заболевания.
Попытки разработать эффективную схему терапии СРК с пролонгированным действием до сих пор остаются безуспешными. Это связано еще и с тем, что проблема поиска и объективной оценки эффективности того или иного препарата очень непроста из-за чрезвычайно высокого эффекта плацебо у «функциональных» пациентов, который, по самым взвешенным оценкам, составляет от 25% до 59%, в среднем – 42% [12, 13].
Вот почему, согласно Римским рекомендациям IV, лекарственную терапию, так же как и в предыдущих редакциях, предлагается назначать по принципу преобладающего симптома (табл. 1).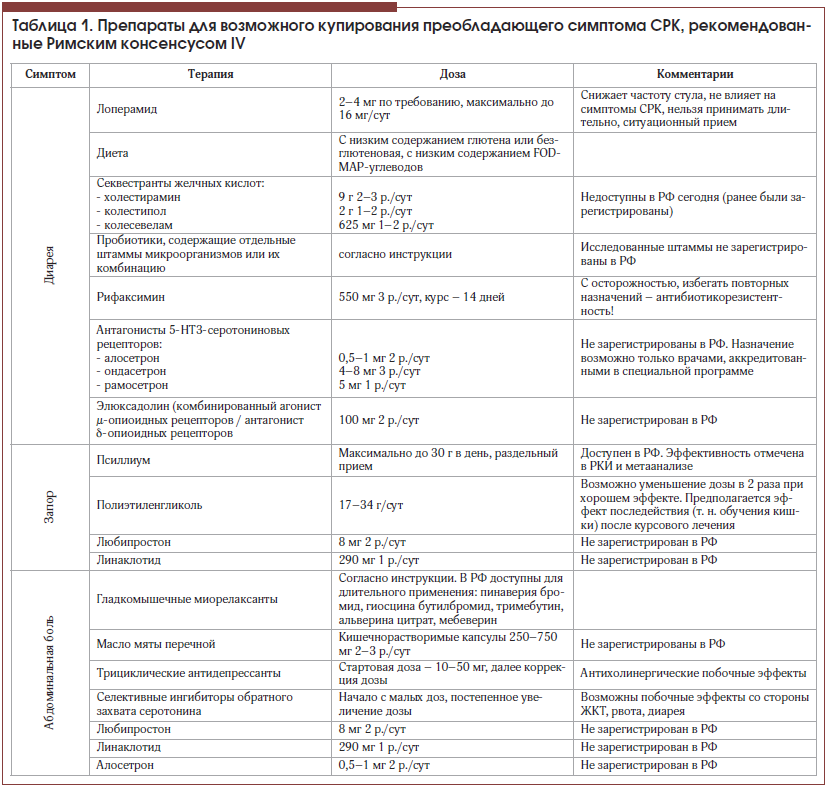
Несмотря на заметное прибавление лекарственных препаратов новых классов, очевидно, что, как и в прошлых версиях клинических рекомендаций, российский гастроэнтеролог располагает лишь 1/3 из предложенных препаратов ввиду отсутствия их регистрации в РФ. Вероятно, поэтому на фоне недобросовестной рекламы «препаратов для СРК» фармакотерапия таких пациентов в реальной практике приводит к необоснованной полипрагмазии. Так, среди назначаемых средств для лечения СРК можно обнаружить ферментные препараты, антациды, препараты, которые вообще трудно классифицировать, имеющие нераспознанный механизм действия, и многое другое.
В качестве так называемой базисной или приоритетной терапии СРК, направленной на борьбу с висцеральной гиперчувствительностью и, соответственно, с болью, свою актуальность сохранили спазмолитики с NNT 5 и трициклические антидепрессанты, также имеющие NNT 5 [14]. Далее в зависимости от варианта нарушения стула рассматривается назначение псиллиума, полиэтиленгликоля и других препаратов с целью нормализации стула, в ряде случаев с дополнительным положительным влиянием на боль.
Что касается появления в рекомендациях группы пробиотиков, то здесь имеется диссонанс. Дело в том, что практически ни один штамм, прошедший в западных странах научную оценку возможности применения при СРК, не зарегистрирован в РФ. И мы полагаем, что экстраполировать эффективность этих штаммов на все препараты с пробиотическими свойствами, представленными в российской аптечной сети, ошибочно.
В связи с таким многообразием указанных проблем необходимо отметить растущий интерес к изучению влияния на клинику СРК так называемой комплементарной медицины и, в частности, фитотерапии, прежде всего, с позиции доказательности [15].
Таким комбинированным фитопрепаратом является Иберогаст® (смесь экстрактов 9 растений), который изначально использовался в основном для лечения функциональной диспепсии в Германии [16]. Иберогаст® является одним из наиболее изученных фитопрепаратов и существует на европейском рынке уже более 30 лет. В его состав входят экстракты из иберийки горькой, дягиля лекарственного, расторопши пятнистой, тмина обыкновенного, чистотела майского, ромашки аптечной, солодки голой, мелиссы лекарственной и мяты перечной [17]. Важно отметить, что многоцелевой характер действия препарата Иберогаст® реализуется путем влияния на различные патогенетические аспекты СРК (спазмолитическое, прокинетическое действие, снижение газообразования, противовоспалительное (антиоксидантное) действие, увеличение секреции хлоридов в кишечнике и т. д.) за счет многокомпонентного состава.
Клинические свойства препарата Иберогаст® были изучены в Германии у 208 пациентов с СРК с различными вариантами течения синдрома в 4-недельном рандомизированном двойном слепом плацебо-контролируемом исследовании. Было продемонстрировано, что применение препарата значительно улучшало качество жизни пациентов с СРК и существенно влияло на болевой абдоминальный синдром, уменьшая его, при этом 94% пациентов отметили переносимость препарата Иберогаст® как «хорошую» или «очень хорошую», при отсутствии значимых в отношении безопасности изменений лабораторных параметров [18]. Этот клинический эффект был опосредован влиянием препарата Иберогаст® на серотониновые (5-HT3 и 5-HT4), мускариновые (М3) и опиоидные рецепторы ЖКТ [17].
Накопленный опыт применения препарата Иберогаст® в лечении СРК позволил включить его в новейшие российские клинические рекомендации «Синдром раздраженного кишечника» в качестве потенциальной дополнительной терапии для достижения курации всего спектра симптомов заболевания [19]. Подобные выводы были и в опубликованном в 2011 г. Кохрейновском метаанализе [20].
Таким образом, в нашем арсенале мы имеет еще один препарат, который может назначаться в зависимости от конкретной клинической ситуации и фенотипа больного как в качестве основной или первичной терапии, так и дополнительной, особенно в случаях сочетания СРК с функциональной диспепсией (рис. 3). Эта рекомендация поддерживается Российским экспертным советом во главе с академиком В.Т. Ивашкиным [21].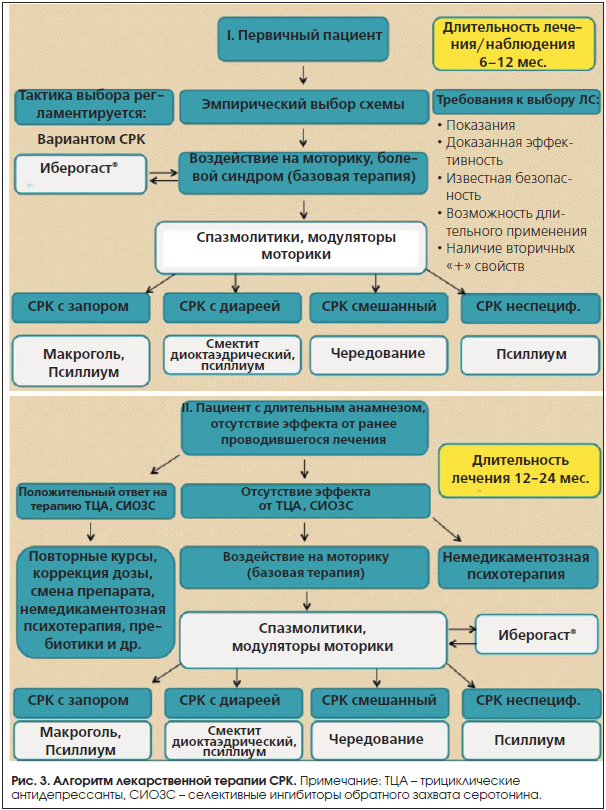
Источник
Новые Римские критерии функциональной диспепсии IV пересмотра
А.А. Шептулин, А.А. Курбатова
Кафедра пропедевтики внутренних болезней ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, Москва, Российская Федерация
New Rome-IV criteria of the functional dyspepsia (review)
A.A. Sheptulin, A.A. Kurbatova
Chair of internal diseases propedeutics, medical faculty, State educational government-financed institution of higher professional education «Sechenov First Moscow state medical university», Ministry of Healthcare of the Russian Federation, Moscow, the Russian Federation
Шептулин Аркадий Александрович – доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова». Контактная информация: arkalshep(а)gmail.com; 119991, Москва, ул. Погодинская, д. 1, стр. 1
Sheptulin Arkady A. – MD, PhD, professor, Chair of internal diseases propedeutics, medical faculty, State educational government-financed institution of higher professional education «Sechenov First Moscow state medical university». Contact information: arkalshep(а)gmail.com; 119991, Moscow, Pogodinskaya str., 1, bld. 1
Курбатова Анастасия Александровна – кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова»
Kurbatova Anastasia A. – MD, assistant-professor, Chair of internal diseases propedeutics, medical faculty, State educational government-financed institution of higher professional education «Sechenov First Moscow state medical university»
Цель обзора. Провести анализ изменений, внесенных в Римские критерии функциональной диспепсии (ФД) IV пересмотра по сравнению с предшествующими критериями.
Основные положения. Определение ФД и ее основных вариантов – постпрандиального дистресс-синдрома (ПДС) и синдрома боли в эпигастрии (СБЭ) в новых критериях не претерпело больших изменений по сравнению с предыдущими. Показано частое сочетание ПДС и СБЭ между собой, с такими симптомами, как тошнота и отрыжка, и рядом других заболеваний: гастроэзофагеальной рефлюксной болезнью и синдромом раздраженного кишечника. Диагноз ФД, по-прежнему, рекомендовано ставить, ориентируясь на соответствие жалоб больного Римским критериям и отсутствие симптомов тревоги. Основное место в лечении ПДС занимают прокинетики, в терапии СБЭ – антисекреторные препараты.
Заключение. Римские критерии ФД IV пересмотра имеют определенные преимущества по сравнению с предыдущими критериями, но в то же время сохраняют существенные недостатки.
Ключевые слова: Римские критерии IV пересмотра, функциональная диспепсия, дефиниция, патофизиология, диагностика, лечение.
Aim of review. To analyze the changes in the IV revision of Rome criteria of the functional dyspepsia (FD) in comparison to existing criteria.
Key points. The definition of FD and its main variants – postprandial distress syndrome (PDS) and epigastric pain syndrome (EPS) in new criteria did not undergo major changes in comparison to previous edition. Frequent combination of PDS and EPS both with each other, with such symptoms as nausea and belching and some other diseases as gastroesophageal reflux disease and irritable bowel syndrome was demonstrated. It is, still, recommended to make the diagnosis of FD, being guided both by compliance of patients symptoms to Rome criteria and the absence of alarm symptoms. The major place in the treatment of PDS is occupied by prokinetics, in EPS treatment – by antisecretory medications.
Conclusion. The fourth revision of Rome criteria of FD have certain advantages in comparison to the previous criteria, but at the same time preserve essential shortcomings.
Key words: Rome-IV criteria, functional dyspepsia, definition, pathophysiology, diagnosis, treatment.
С 22 по 24 мая 2016 г. в Сан Диего проходила очередная Американская неделя гастроэнтерологии. Одним из главных событий этого крупного научного форума стало представление новых Римских критериев функциональных расстройств желудочно-кишечного тракта, которые теперь рекомендовано именовать расстройствами взаимодействия между головным мозгом и желудочно-кишечным трактом (disorders of gut-brain interaction) [2]. Новые Римские критерии данных расстройств заслуживают самой тщательной оценки. В предлагаемом обзоре будет дан анализ Римских критериев IV пересмотра, касающихся функциональной диспепсии (ФД). Они были представлены в устных докладах Американской гастроэнтерологической недели и опубликованы в специальном выпуске журнала «Gastroenterology» [7].
Как известно, Римские критерии III (2006) предусматривали разделение синдрома диспепсии на два варианта: органическую (при язвенной болезни, опухолях желудка и т.д.) и функциональную, что можно было считать вполне логичным [9]. В Римских критериях IV термин «органическая» заменен прилагательным «вторичная». Этот термин менее удачный, поскольку его напрашивающийся антипод («первичная») в новых критериях отсутствует. ФД страдает, по разным данным, 10-30% всего населения (чаще женщины) [4].
Перечень симптомов, входящих в определение ФД (чувство переполнения в подложечной области, раннее насыщение, боли и чувство жжения в эпигастрии) с обязательным указанием на отсутствие признаков органических заболеваний, необходимая продолжительность расстройств (последние 3 месяца при общей продолжительности 6 месяцев), основные клинические варианты ФД – постпрандиальный дистресс-синдром (ПДС) и синдром боли в эпигастрии (СБЭ) – остались в новой редакции такими же, как в Римских критериях III пересмотра. Но если в прежних критериях эпитет «причиняющее беспокойство» (bothersome) касался только чувства переполнения в подложечной области, то в новых критериях он уже отнесен ко всем жалобам.
Частота возникновения симптомов, входящих в СБЭ (боль и чувство жжения в эпигастрии), необходимая для постановки данного диагноза, в новых критериях осталась прежней («по меньшей мере, 1 раз в неделю»), а прежняя частота возникновения симптомов, входящих в ПДС (чувство переполнения в подложечной области и раннее насыщение), требуемая для установления этого диагноза, обозначавшаяся прежде как «несколько раз в неделю», заменена на «более 3 раз в неделю».
При характеристике ФД в новых Римских критериях сделано уточнение, согласно которому симптомы ПДС всегда возникают после приема пищи, тогда как при СБЭ боли и чувство жжения в подложечной области могут появляться после еды, исчезать после приема пищи или отмечаться натощак. Подчеркнуто, что такие признаки, как персистирующая рвота, исчезновение клинических симптомов после опорожнения кишечника, боли в правом подреберье, не свойственны ФД.
Существенным следует считать и дополнение о том, что у больных ФД нередко наблюдаются такие симптомы, как изжога, отрыжка, тошнота, ощущение вздутия в эпигастрии. Раньше в соответствии с прежними Римскими критериями III пересмотра при выявлении, например, у больных с ПДС тошноты и отрыжки нужно было выстраивать следующие нагромождения: «Синдром функциональной диспепсии: постпрандиальный дистресс-синдром. Синдром неспецифической чрезмерной отрыжки. Синдром хронической идиопатической тошноты». Теперь же, согласно новым Римским критериям, врач вправе рассматривать тошноту и отрыжку как «возможные дополнительные признаки» (possible adjunctive features) ФД.
Важным для практикующего врача служит и указание на то, что разные варианты ФД (ПДС и СБЭ) могут сочетаться друг с другом, а также с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) и синдромом раздраженного кишечника (СРК).
Патогенез ФД, как подчеркивается в новых Римских критериях, является комплексным и включает ряд патофизиологических факторов.
К ним прежде всего относится нарушение эвакуаторной функции желудка (замедленное опорожнение у 25-35% больных и ускоренное менее чем у 5% пациентов с ФД). Выраженное замедление опорожнения, сопровождающееся рвотой и потерей аппетита, характерно уже для гастропареза.
Расстройства аккомодации желудка (способности фундального отдела расслабляться после приема пищи) наблюдаются примерно у 1/3 пациентов с ФД (чаще при ее постинфекционном варианте).
У больных ФД часто выявляется гиперчувствительность желудка и двенадцатиперстной кишки к растяжению, а также по отношению к соляной кислоте и липидам.
В Римских критериях IV приводится и ряд новых патофизиологических факторов, которые отсутствовали в прежних критериях: перенесенные инфекции, воспаление слизистой оболочки двенадцатиперстной кишки низкой степени активности, повышение ее проницаемости и увеличение содержания эозинофилов в указанной зоне (дуоденальная эозинофилия).
Известный специалист в области ФД N.J. Talley, выступая на Американской гастроэнтерологической неделе с проблемным докладом по рассматриваемой теме, примерно половину отведенного времени посвятил дуоденальной эозинофилии, назвав ее «новым заболеванием» и отметив, что с ней связаны 40% случаев ПДС и повышение риска последующего присоединения ГЭРБ [10]. Тем не менее, механизмы возникновения дуоденальной эозинофилии при ФД в его докладе остались не затронутыми, и не была объяснена выявленная автором способность ингибиторов протонной помпы (ИПП) снижать содержание эозинофилов в слизистой оболочке двенадцатиперстной кишки.
Значение Н. pylori в развитии ФД оценивается в новых Римских критериях несколько противоречиво. С одной стороны, в разделе, посвященном патофизиологии ФД, эта инфекция рассматривается как возможная причина ФД, если успешная эрадикация ведет к стойкому исчезновению диспепсических жалоб. С другой стороны, в разделе, где обсуждаются принципы лечения ФД, указывается, что подобные случаи следует рассматривать в соответствии с положениями Киотского консенсуса, согласно которым в случае стойкого исчезновения диспепсических жалоб после эрадикации такие больные должны исключаться из группы ФД и расцениваться как пациенты, страдающие диспепсией, ассоциированной с Н. pylori [8].
Постинфекционная ФД возникает у 10-20% больных, перенесших острую желудочно-кишечную инфекцию. К ее развитию предрасполагают генетические факторы и особенности самого инфекционного агента. При этом подчеркивается, что в отличие от постинфекционного варианта СРК постинфекционная ФД может иметь непродолжительное течение.
В ряду причин ФД заметное место отводится и психосоциальным факторам. К ним относятся депрессия и повышенная тревога, невротические реакции, физическое и эмоциональное воздействие в детском возрасте, трудности преодоления стрессовых событий жизни.
К сожалению, столь важным для практикующих врачей вопросам диагностики ФД в Римских критериях IV посвящен скромный абзац, подкрепленный графической схемой, содержащей алгоритм диагностического поиска. Как и в прежних Римских критериях, диагноз ФД предлагается ставить, основываясь на оценке жалоб и истории развития заболевания, отсутствии «симптомов тревоги» и ятрогенных факторов (например, прием нестероидных противовоспалительных препаратов – НПВП), результатах тестирования на Н. pylori и проведения эрадикационной терапии, особенно в странах с высокой частотой обнаружения среди населения этой инфекции (стратегия «test and treat»). Затем должна быть рассмотрена возможность проведения эмпирического лечения больных. При этом, по мнению N.J. Talley [11], применение пиктограмм – рисунков, «художественно» изображающих чувство переполнения в подложечной области («желудок, перетянутый ремнем») или же чувство жжения в эпигастрии («желудок, в котором полыхает пожар»), поможет больным правильно идентифицировать свои неприятные ощущения.
Что касается гастродуоденоскопии, то ее рекомендовано проводить всем пациентам, у которых выявляются «симптомы тревоги». Удивляет, что в случае отсутствия у таких больных изменений при гастродуоденоскопии они, согласно представленному алгоритму, попадают опять в группу ФД (!), хотя, как известно, наличие «симптомов тревоги» априори исключает диагноз функционального расстройства и предполагает необходимость детального комплексного обследования, которое не ограничивается только эндоскопическим исследованием верхних отделов желудочно-кишечного тракта.
В рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению ФД подчеркивается неспецифичность ее клинических симптомов, которые могут встречаться при многих других заболеваниях (например, опухолях желудка, нередко протекающих на ранних стадиях без каких-либо «симптомов тревоги»), и обращается внимание на опасность серьезных диагностических ошибок при отказе от инструментальных методов исследования (в первую очередь, гастродуоденоскопии). При этом диагноз ФД считается диагнозом исключения, который может быть поставлен только после тщательного обследования больного [1].
Лечение ФД включает в себя прежде всего проведение общих мероприятий, таких как образование (education) и переубеждение (reassurance) больных, нормализация образа жизни, диетические рекомендации (частое, дробное питание с ограничением содержания жиров), отказ от кофе, курения, алкоголя и приема НПВП. В новых Римских критериях отмечается целесообразность данных мероприятий, но указывается на отсутствие систематических исследований их доказательности.
Проведение лекарственной терапии определяется вариантом течения ФД. При СБЭ в качестве препаратов первого выбора предлагаются ИПП и H2-блокаторы, которые, по результатам контролируемых исследований, оказываются на 10-15% более эффективными по сравнению с плацебо. При этом подчеркивается, что применение ИПП не приносит успеха при ПДС.
При данном варианте ФД лечение рекомендовано начинать с назначения прокинетиков. Однако делается оговорка, что выводы о большей эффективности этих препаратов по сравнению с плацебо были сделаны в исследованиях, в которых применялись цизаприд и домперидон (как известно, первый препарат уже снят с производства из-за возможного влияния на продолжительность интервала Q-T, а второй по той же причине сейчас существенно ограничен “в правах” и назначается лишь для симптоматического лечения тошноты на срок не более 7 дней). Как более безопасное лекарственное средство приведен комбинированный препарат итоприд (антагонист D2-допаминовых рецепторов и ингибитор ацетилхолинэстеразы), уменьшающий чувство переполнения в подложечной области и устраняющий раннее насыщение. Что касается таких прокинетиков, как эритромицин, азитромицин, АВТ 229, то их применение при ФД, по мнению авторов, не показано в связи с «нефизиологичным ускорением опорожнения желудка».
Перспективным препаратом назван акотиамид (Z-338), который, будучи ингибитором ацетилхолинэстеразы, улучшает аккомодацию фундального отдела и опорожнение желудка и уменьшает выраженность симптомов ПДС. В качестве потенциально эффективных лекарственных средств для лечения нарушений аккомодации фундального отдела желудка приведены агонисты 5-НТ1А рецепторов тандоспирон и буспирон, агонист 5-HT1B/D рецепторов суматриптан.
Новым следует считать появление в числе лекарственных средств, рекомендуемых в Римских критериях IV для лечения ФД, препарата STW-5 (Иберогаст®). Это комбинированный растительный препарат, полученный путем спиртовой экстракции из 9 лекарственных трав. В его состав входят иберийка горькая, дягиль лекарственный, ромашка аптечная, тмин обыкновенный, расторопша пятнистая, мелисса лекарственная, мята перечная, чистотел большой, солодка голая.
Интерес к указанному препарату в Германии возник в рамках концепции многоцелевой или мультитаргетной (multi-target) терапии, предполагающей вместо назначения нескольких средств, влияющих на отдельные звенья патогенеза данного заболевания, применение одного препарата, одновременно воздействующего на несколько звеньев [6].
Иберогаст® нормализует аккомодацию фундального отдела желудка, улучшает эвакуацию желудочного содержимого, уменьшает висцеральную гиперчувствительность, снижает секрецию соляной кислоты, оказывает гастропротективный эффект, улучшая желудочное слизеобразование. Проведенные клинические исследования и выполненные на основе их результатов мета-анализы свидетельствовали о высокой эффективности препарата у больных с ФД (особенно с ПДС) и его хорошей переносимости [3]. Целесообразность применения Иберогаста® определяется и частым сочетанием ФД с СРК, при котором его назначение нормализует также моторику кишечника и уменьшает выраженность болевых ощущений [6].
Возможности использования психотропных средств, часто назначаемых при лечении ФД в качестве препаратов второй линии, оцениваются в новых Римских критериях достаточно сдержанно. Несмотря на указание о их более высокой эффективности по сравнению с плацебо, отмечается, что большинство исследований включали малое число пациентов и были не очень высокого качества. Недавно опубликованные результаты крупного многоцентрового исследования, в котором принимали участие известные специалисты по лечению ФД (в том числе разработчики новых Римских критериев), показали, что амитриптилин в небольших дозах несколько более эффективен при лечении СБЭ по сравнению с плацебо, тогда как ингибитор обратного захвата серотонина эсциталопрам не влияет на опорожнение желудка и не дает эффекта ни при ПДС, ни при СБЭ.
Психотерапевтические методы, применяемые обычно у больных, резистентных к другим способам лечения, хотя и оказались результативными в контролируемых исследованиях, также не были доказательными из-за малого числа наблюдений и низкой сопоставимости групп.
Отмечается также, что выявленные у ряда больных ФД воспалительные изменения слизистой оболочки двенадцатиперстной кишки с повышением содержания в ней эозинофилов делают целесообразным изучение возможности применения у этих пациентов препарата монтелукаст – антагониста cysLT-рецепторов, стабилизирующих мембраны эозинофилов.
Таким образом, завершая анализ новых Римских критериев ФД IV пересмотра можно согласиться с их авторами, которые подчеркнули незначительный характер изменений (only minor changes) no сравнению с предшествующими критериями. Важными в практическом плане нужно считать положение о частом сочетании различных вариантов ФД с тошнотой, отрыжкой, а также с ГЭРБ и СРК. Здесь следовало бы сконцентрировать внимание на тактике лечения сочетанных форм функциональных расстройств, выборе препаратов, эффективных в отношении каждого из сочетающихся заболеваний.
Серьезным недостатком новых критериев (как и предыдущих) остается рекомендация ставить диагноз ФД, ориентируясь главным образом на соответствие симптомов, имеющихся у больного, представленным критериям и на наличие «симптомов тревоги». Отказ от проведения гастродуоденоскопии и ультразвукового исследования органов брюшной полости неминуемо приведет к росту числа диагностических ошибок, учитывая неспецифичность симптомов рассматриваемого заболевания. Поэтому представленные рекомендации в этой части нужно оценивать очень критично.
Список литературы/References
- Ивашкин В.Т., Шептулин А.А., Лапина Т.Л. и др. Диагностика и лечение функциональной диспепсии. Методические рекомендации Российской гастроэнтерологической ассоциации для врачей. М., 2011. 28 с. [Ivashkin V.T., Sheptulin A.A., Lapina T.L. et al. Diagnosis and treatment of the functional dyspepsia. Guidelines of the Russian gastroenterological association for doctors. M, 2011. 28 p.]
- Drossman D.A., Hasler W.L. Rome IV – Functional GI disorders: disorders of gut-brain interaction. Gastroenterology 2016; 150(6): 1257-61.
- Holtmann C, Nandurkar S., Talley N.J., et al. Herbal medicine for the treatment of functional dyspepsia: a systematic review of the literature and meta-analysis. Gastroenterology 2007; suppl. 2. Abstract W1204.
- Houghton L.A., Heitkemper M., Crowell M.D., et al. Age, gender and women’s health and patient. Gastroenterology 2016; 150(6): 1332-43.
- Madisch A., Holtmann G., Plein K., Hotz J. Treatment of irritable bowel syndrome with herbal preparations: results of a double-blind, randomized, placebo-controlled, multi-centre trial. Aliment Pharmacol Ther 2004; 19:271-9.
- Ottilinger B., Storr M., Malfertheiner P., Allescher H.-D. STW 5 (Iberogast®) – a safe and effective standart in the treatment of functional gastrointestinal disorders. Wien Med Wochenschr 2013; 163:65-72.
- Stanghellini V., Chan F.C.L., Hasler W.L., et al. Gastroduodenal disorders. Gastroenterology 2016; 150(6):1380-92.
- Sugano K., Tack J., Kuipers E.J., et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut 2015; 64:133-67.
- Tack J., Talley N.J., Camilleri M., et al. Functional gastroduodenal disorders. Gastroenterology 2006; 130:1466-79.
- Talley N.J. Dyspepsia: How to sort out the mess? Dig Dis Week, San Diego, 2016. Oral presentation.
- Talley N.J. Functional ghastroduodenal disorders // AGA Institute-Rome Found