Роль генетических факторов в этиологии болезней желудочно кишечного тракта

Генетика желудочно-кишечных заболеваний не привлекла к себе такого внимания, как генетика болезней других органов и систем. Однако за последнее десятилетие достигнуты некоторые успехи. Многие из них столь новы, что пока неизвестно, какое отношение они имеют к беременности. Так, зная достаточно о генетике желудочно-кишечных заболеваний, а также о течении ряда более распространенных болезней во время беременности, во многих случаях мы игнорируем отношение между специфическим генетическим предрасположением и свойственными беременности сдвигами.
Наше представление о генетике болезней желудочно-кишечного тракта и большинства других заболеваний одинаково. Мы различаем много болезней, как правило, редких, генетические основы и типы наследования которых вполне понятны [McKusick]. В их числе болезни, наследуемые в соответствии с простыми менделевскими закономерностями, и хромосомные синдромы. На долю этих редких нарушений, даже взятых вместе, приходится лишь небольшая часть общей заболеваемости и смертности, обусловленной болезнями желудочно-кишечного тракта.
Понимание более распространенных заболеваний, таких, как пептическая язва, хронический гастрит, воспалительные поражения кишечника, целиакия, калькулезный холецистит и частые пороки развития, значительно отстает. О их семейной агрегации известно в течение многих лет, но часто неясно, обусловлена ли она генетически. И даже когда доказана роль генетических факторов, не вполне понятен характер наследования. В последнее десятилетие самые обширные исследования предприняты, по-видимому, именно в отношении желудочно-кишечных заболеваний [Rotter et al., Steinberg et al.].
В идеале в настоящей статье следовало бы описать все желудочно-кишечные заболевания, в которых наследственность играет ту или иную роль; показать, как влияет беременность на течение каждого из них; объяснить, каким образом болезнь женщины может повлиять на исход беременности, и, наконец, как влияет пораженный плод на беременность и женщину. К сожалению, это невозможно главным образом по двум причинам.

1 В скобках— сведения об особенностях, четко не указанных е перечне McKusick.
2 Номер соответствует тому, под которым болезнь упоминается в перечне McKusick. Полагают, что болезни с номерами в пределах 10 000 наследуются аутосомно-до-Минантно, от 10 000 до 20 000 — аутосомно-рецессивно, а от 20 000 до 30 000 — рецессивно, сцепленно с Х-хромосомой. Тип наследования болезней, отмеченных звездочками, по мнению McKusick, установлен окончательно. Дополнительные комментарии см. в тексте.
3 Указанные типы наследования с вопросительными знаками — временные классификации.
4 Число в скобках — номер таблицы, в которой болезнь упоминается повторно.

Во-первых, большинство наследственных болезней не охарактеризовано в такой степени, чтобы их можно было изучать независимо друг от друга. Во-вторых, и как вследствие любая информация о взаимодействии между матерью и плодом касается фенотипа (например язвы), который представляет группу нарушений, а не генетически и этиологически разные болезни. Излагая современные представления о генетике желудочно-кишечных . нарушений и взаимодействии между матерью и плодом в случае наличия таких нарушений, мы надеемся поощрить проведение более систематических акушерских исследований по мере накопления знаний в этой области и нацелить акушеров на оценку других болезней желудочно-кишечного тракта, при которых взаимодействия между матерью и плодом пока неизвестны.
Вначале в ряде таблиц будут перечислены некоторые менделирующие болезни, проявляющиеся поражением органов пищеварения. Эти таблицы помогут акушерам, перед которыми встают вопросы генетической консультации, касающиеся возможности наследования различных желудочно-кишечных заболеваний. Данные о взаимодействии между матерью и плодом имеются только в нескольких случаях. Мы обсудим подробно 2 из них, для которых наиболее вероятно менделевское наследование и имеется информация о взаимодействии при беременности.
Затем речь пойдет о распространенных болезнях желудочно-кишечного тракта, в первую очередь о достижениях в изучении их генетики. Будет рассказано, что известно о взаимодействий беременности с каждым из этих заболеваний: как о влияний беременности на течение болезни, так и о влиянии болезни на исход беременности.


Полный обзор генетических аспектов болезней органов пищеварения и всех нарушений со стороны желудочно-кишечного тракта во время беременности интересующийся читатель может найти в следующих статьях и книгах: о генетических аспек тах — McConnell, Bergsma и сотр. Passarge, Rotter и сотр., Steinberg и сотр.; о желудочно-кишечных заболеваниях при беременности — Barnes, Haemmerli, Bynum, Miller.
Все генетики пользуются периодически дополняемым каталогом McKusick менделирующих болезней человека. Мы выбрали из этого каталога и представили в таблицах те из них, при которых поражается желудочно-кишечный тракт, указав тип наследования и распределив в зависимости от пораженного органа или клинического проявления. Большинство неменделирующих синдромов врожденных пороков развития и различных хромосомных синдромов не отражены в этих таблицах, хотя те и другие могут включать пороки желудочно-кишечного тракта. Интересующийся читатель найдет более подробные сведения о них в работах Smith, Passarge, а также в главе настоящей книги, написанной Simpson.


Пояснения к первой таблице относятся и ко всем последующим. Читателю, не знакомому с книгой McKusick, полезно скопировать эти таблицы. Пользуясь ими, следует помнить, что если перед номером болезни, соответствующим реестру McKusick, нет звездочки, это означает отсутствие уверенности в типе наследования. В таких случаях пользоваться приведенными сведениями для генетического консультирования не рекомендуется без подробного анализа данных, на которых основана классификация.
Хотя в таблицах перечислены в первую очередь менделирующие формы патологии, читатель заметит, что под рубрикой типа наследования, помимо «доминантный», «рецессивный» и «сцепленный с полом», даны и другие. Гетерогенность указана для тех болезней, которые в действительности, по-видимому, представляют собой группу нозологических форм, часть которых наследуется по законам Менделя. Термин «мультифакториальный» озлачает, что болезнь как будто бы удовлетворяет традиционной мультификаториальной модели наследования (много генов с малым эффектом, действующих аддитивно, плюс возможное влияние окружающей среды).
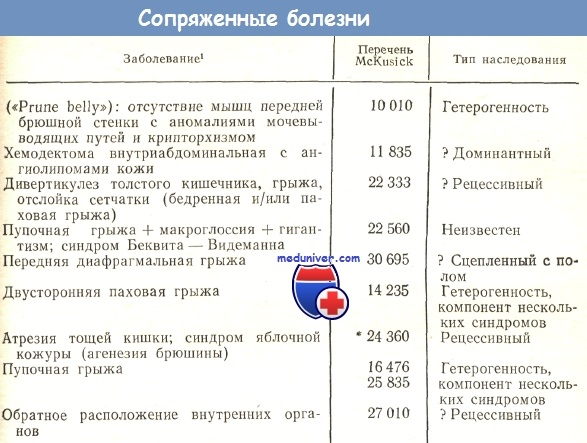

Под сложным наследованием имеется в виду, что болезнь, может быть, нозологически обособлена, но, судя по современным представлениям, ее наследование не объяснимо мутацией гена в единственном локусе и в то же время оно не мультифакториальное. Не исключено, что болезни со сложным наследованием гетерогенны или детерминированы мутантными генами, расположенными не в одном локусе.
Термины «гетерогенность», «сложность» и «мультифакториальность» применены в тех случаях, когда болезни изучены более или менее подробно, получены веские основания предполагать их наследственную обусловленность, но тем не менее тип наследования предрасположенности неясен. В отношении целиакии указано наследование через 2 локуса. При обсуждении целиакии представлены свидетельства в пользу такого типа наследования. Многочисленные пороки развития желудоч но-кишечного тракта являются компонентами различных синдромов; это тоже указано в таблицах.


Рассмотрена генетика желудочно-кишечных заболеваний, в частности тех, при которых имеет место взаимодействие между матерью, плодом и беременностью как таковой. Большинство наследственных болезней обусловлено переносом вариантных родительских генов потомкам, но здесь мы сосредоточили внимание только на тех болезнях, при которых имеет место дополнительное взаимодействие с беременностью в плане влияния на мать, на плод или на беременность. Эти категории взаимодействия включают следующее:
1) желудочно-кишечное заболевание женщины может повлиять на течение беременности или исход для плода;
2) беременность или фенотип плода может повлиять на течение желудочно-кишечного заболевания матери, выраженного клинически или субклинически;
3) желудочно-кишечные нарушения у плода могут повлиять на течение беременности;
4) целостность желудочно-кишечного тракта плода зависит от материнского фактора. Это взаимодействие может продолжаться и в послеродовый период.
Подобные взаимодействия между матерью и плодом безусловно более многочисленны, чем можно себе представить на современном уровне знаний. При некоторых болезнях, очевидно, активен не один путь. Закончим обсуждение кратким резюме относительно известных механизмов взаимодействия между матерью и плодом при тех формах патологии, о которых шла речь в настоящей главе.
При обусловленном дефицитом цинка энтеропатическом акродерматите больные фенотипически нормальны до тех пор, пока их не отняли от груди. Какой-то фактор женского молока, по-видимому, предотвращает появление клинических симптомов. Следовательно, это заболевание служит примером того, как материнский фактор, переносимый с грудным молоком, влияет в данном случае положительно, на фенотипическую экспрессию наследственной болезни. Кроме того, эпидемиологические данные и эксперименты на животных свидетельствуют о том, что дефицит цинка в организме матери может приводить к порокам развития ЦНС.
Накопление информации об исходах беременности у женщин с ЭА явится важным источником данных для ответа на этот вопрос. К сожалению, сообщения о случаях беременности у больных ЭА слишком скудны, чтобы можно было сделать вывод о частоте пороков развития.
Дети с врожденной хлоридной диареей неизменно рождаются от многоводной беременности. По-видимому, многоводие — результат внутриутробной диареи у плода. Это заболевание служит примером того, как желудочно-кишечная патология у плода может повлиять на течение беременности.
Переходя к более распространенным заболеваниям, например, пептической язве, сталкиваемся с несколько необычной ситуацией, когда во время беременности болезнь матери идет на убыль или даже нередко наступает полная ремиссия. Углубление в этиологию язвенного диатеза и его патогенетические механизмы поможет ответить на вопрос, одинакова ли реакция язв разной этиологии на беременность.
В случае пилоростеноза имеются веские основания предполагать материнское наследственное влияние, поскольку у больной матери больные дети рождаются с большей вероятностью, чем у больного отца. Кроме того, не исключено материнское средовое влияние, заключающееся в том, что эмоциональное состояние во время беременности матери, которая сама здорова, может способствовать появлению нарушения у развивающегося ребенка.
У женщин с целиакией в активной фазе болезни снижена способность к зачатию. Кроме того, связанное с беременностью повышение потребности в питательных веществах может проявить болезнь у тех женщин, у которых она протекала субклинически, — еще один пример того, как беременность ухудшает течение болезни.
Данные о взаимодействии между матерью и плодом при воспалительных кишечных заболеваниях (ВКЗ) различны в зависимости от того, идет ли речь о язвенном колите или болезни Крона. В случае язвенного колита способность больных женщин к зачатию не снижена и частота рецидивов во время беременности примерно такая же, как в отсутствие беременности, хотя лри тяжелом поражении, вероятно, повышается частота спонтанных выкидышей. Что касается болезни Крона, единственным твердо установленным эффектом является снижение фертильности, приписываемое спаечной непроходимости маточных труб.
Рецидивы возникают, но не с такой частотой, как у небеременных женщин. При обеих болезнях наибольшее число рецидивов приходится на I триместр и послеродовой период, вероятно потому, что в это время наименее выражено защитное действие эндогенных стероидов. В прошлом материнская заболеваемость и смертность не были редкостью при ВКЗ. Однако с достижениями в области лечения смертность матерей больше не должна расти. О неблагополучных исходах для плода — спонтанных абортах, мертворождениях и врожденных пороках развития — в ранних работах тоже сообщали чаще, чем наблюдают теперь в учреждениях, имеющих опыт лечения таких больных.
Давно известна клиническая связь между беременностью и образованием желчных камней. Скорее всего она обусловлена повышением уровня половых стероидов и задержкой зарождающихся кристаллов холестерина во время беременности — следующий пример влияния беременности на течение болезни. Если во время беременности возникает необходимость в холецистэктомии, она, по-видимому, безопасна и для матери, и для плода.
Нарушения, объединяемые общим термином «наследственные гипербилирубинемии», служат отличными примерами взаимодействия между матерью и плодом. Рецидивирующий внутрипече-ночный холестаз беременных, как свидетельствует название, — это доброкачественная желтуха, возникающая только во время беременности или приема противозачаточных препаратов. Имеются некоторые указания на то, что его следствием являются преждевременные роды. Синдром Дабина — Джонсона обычно обостряется с беременностью, хотя его течение вариабельно.
Может быть неблагоприятный исход для плода — спонтанный выкидыш или мертворождение, но судя по опубликованным данным такой исход, возможно, бывает не чаще, чем при неосложненных беременностях. Хроническое повышение уровня неконъю-гированного билирубина в сыворотке крови, наблюдаемое при синдромах Джилберта и Криглера — Найяра II типа, по всей видимости не зависит от беременности и не оказывает сколько-нибудь ощутимого влияния на прогноз для плода. Транзиторная семейная гипербилирубинемия новорожденных — пример того, как материнский генотип влияет на фенотип плода. При этом нарушении у матерей, по-видимому, присутствует ингибитор конъюгации билирубина в печени, действие которого приводит к гипербилирубинемии новорожденного и, следовательно, возможности ядерной желтухи.
Таким образом, отдельным наследственным желудочно-кишечным заболеваниям присущи все возможные пути взаимодействия между матерью, плодом и беременностью как таковой. Чтобы продолжать улучшать акушерскую помощь, мы должны больше узнать обо всех этих болезнях пищеварительного тракта.
– Рекомендуем далее ознакомиться со статьей “Энтеропатический акродерматит при беременности – течение, прогноз”
Оглавление темы “Наследственные болезни при беременности”:
- Почечная гликозурия при беременности – течение, прогноз
- Гипофосфатазия при беременности – течение, прогноз
- Цистинурия при беременности – течение, прогноз
- Цистиноз при беременности – течение, прогноз
- Гепатолентикулярная дегенерация (болезнь Уилсона) при беременности – течение, прогноз
- Поликистоз почек при беременности – течение, прогноз
- Туберозный склероз при беременности – течение, прогноз
- Наследственные болезни желудочно-кишечного тракта в таблицах
- Энтеропатический акродерматит при беременности – течение, прогноз
- Врожденная хлоридная диарея при беременности – течение, прогноз
Источник
ГКР — глюкокортикоидные рецепторы
ДИ — доверительный интервал
ЖКТ — желудочно-кишечный тракт
ИЛ — интерлейкин
ОШ — отношение шансов
СРК — синдром раздраженного кишечника
ФД — функциональная диспепсия
ЭБС — эпигастральный болевой синдром
5-HTTLPR — ген транспортера серотонина
C385A — ген эндоканнабиноидного метаболизма
Несмотря на значительное число научных публикаций, посвященных вопросам механизмов формирования функциональных заболеваний желудочно-кишечного тракта (ЖКТ), данный вопрос по-прежнему неясен. Предложенные концепции индуцированных стрессом, постинфекционных причин формирования функциональных заболеваний не позволяют в полной мере объяснить конкретные и понятные механизмы, лежащие в основе патогенеза данных расстройств.
В последние годы все больше внимания уделяется вопросам связи генетических нарушений с формированием различных органических и функциональных заболеваний не только органов ЖКТ и эндокринной системы, но и бронхолегочных, сердечно-сосудистых, суставных и других патологий [1, 2]. Исходя из этого представляет научный интерес возможное наличие генетических нарушений у пациентов с функциональными заболеваниями верхних и нижних отделов ЖКТ.
Впервые мысль о возможном влиянии генетических особенностей на формирование функциональных заболеваний ЖКТ возникла в процессе клинических наблюдений и результатов проспективных исследований, показавших увеличение заболеваемости в семьях, в которых прослеживалась высокая распространенность этой патологии у близких родственников [3] и у монозиготных близнецов [4].
При изучении полиморфизма генов у пациентов с функциональной диспепсией (ФД) выявлен ряд изменений, ассоциированных с развитием различных ее вариантов. Связь полиморфизма C825T гена GNB3 установлена с высоким риском развития как постпрандиального дистресс-синдрома [5], так и эпигастрального болевого синдрома (ЭБС) [6]. В другом исследовании выявлен высокий риск развития ФД у носителей гена TRPV1 G315C [7].
В популяции инфицированных Helicobacter pylori носители гена TLR-2−196−174 отличались низким риском развития ФД [8], в связи с чем сделано предположение, что данный генотип может быть ответственен за моделирование степени воспалительного ответа у носителей H. pylori.
С учетом одной из ключевых ролей серотонина в нарушениях моторики ЖКТ проводились исследования возможных генетических нарушениях в серотонинергической системе. При этом получены весьма противоречивые результаты у пациентов с различными вариантами функциональных заболеваний ЖКТ. В исследовании [9] показано, что у пациентов с синдромом раздраженного кишечника (СРК) отмечались изменения в гене транспортера серотонина (5-HTTLPR) в виде формирования длинных и коротких аллельных вариантов, что приводило к уменьшению содержания транспортера серотонина, и, как следствие, снижало его захват. Хотя у пациентов с СРК генотип SS полиморфизма гена 5-HTTLPR связан с высоким риском формирования СРК с диареей, в двух других исследованиях, посвященных выявлению данного полиморфизма у лиц с ФД, полиморфизм гена 5-HTTLPR у больных ФД не обнаружен [10, 11]. При этом у пациентов с СРК выявленный полиморфизм гена 5-HTTLPR ассоциирован со значительным увеличением психологических и поведенческих проблем, а также с наличием частых эпизодов депрессии.
Для оценки возможной связи симпатической адренергической дисфункции с повышением висцеральной гиперчувствительности в желудке у больных ФД проводилось изучение роли полиморфизма пресинаптических ингибиторов адренорецепторов α2A и α2B, однако никакой статистически значимой связи с симптомами диспепсии в данном исследовании не выявлено [12].
Кроме того, не удалось выявить связей между генетическими особенностями полиморфизма гена эндоканнабиноидного метаболизма (C385A) у пациентов с сочетанием нарушения аккомодации фундального отдела желудка с нарушением опорожнения желудка у небольшой группы больных ФД [6].
В исследовании в группе из 109 пациентов с ФД показано, что пациенты, у которых отмечался полиморфизм гена G315C, отличались значительно более низким риском выраженных клинических проявлений как ЭБС, так и постпрандиального дистресс-синдрома [13]. Значительно более низкий риск формирования ФД отмечался у пациентов — носителей гена SCN10A 3218 CC, который отвечает за низкую активность натриевых каналов 1.8, отвечающих за висцеральную гиперчувствительность [14].
Проводились попытки изучения полиморфизма генов у пациентов с ФД, при этом выявлена статистически значимая ассоциация между фактором, ингибирующим миграцию макрофагов, — 173С и полиморфизмом гена IL17F-7488T в подгруппе пациентов с симптомами ЭБС [7].
Косвенное доказательство участия воспаления в механизмах формирования ФД получено в исследовании [15], результаты которого показали наличие выраженной связи полиморфизма гена циклооксигеназы-1 с формированием симптомов ЭБС у женщин. Вместе с тем исследование полиморфизма гена нейрорецептора S, который вовлекается в воспалительные изменения и повышение висцеральной чувствительности, не выявило статистически значимых изменений данного гена у пациентов с ФД [16].
Немаловажное значение отводится генетическим нарушениям в формировании СРК. При изучении особенностей гена 5-HTTLPR, который локализуется в хромосоме 17q11.1—17q12, получены противоречивые результаты. Так, в метаанализе результатов исследований из стран Запада и Азии относительно связи генотипа 5-HTTLPR и формирования СРК показано, что среди жителей Кавказа и Азии отношение шансов (ОШ) формирования СРК у пациентов с подвидами генотипа SS или LS по сравнению с LL составило 1,0 (при 95% доверительном интервале — ДИ от 0,8 до 1,2, а с подвидами генотипа SS по сравнению с LL или LS — 1,0 (при 95% ДИ от 0,7 до 1,4) и результаты не были статистически значимыми [17]. В то же время исследование, проведенное в Индии, показало, что имеется связь генотипа SS с формированием СРК с запорами [18]. При этом в исследовании, проведенном в Индии, выявлена более высокая частота генетических нарушений у мужчин по сравнению с женщинами, что пока не нашло должного объяснения [19]. Исследование, проведенное у пациентов с СРК в Германии и Великобритании, показало, что частота генетических нарушений гена 5-HTTLPR у женщин и мужчин находится в соотношении 1,3—1,5:1 [20, 21]. Низкая распространенность генотипа SS у пациентов с СРК отмечена в исследовании [22], особенно при варианте с диареей, однако в данное исследование были включены только мужчины (34 — с СРК и 30 — группы контроля).
Полиморфизм гена 5-HTTLPR также отмечен у 21 мужчины и 117 женщин с СРК, при этом не выявлена зависимость между наличием данного полиморфизма и степенью тяжести симптомов поражения ЖКТ или степенью выраженности депрессии и беспокойства у пациентов [23]. Вместе с тем в этом же исследовании отмечено, что носители генотипа 5-HTTLPR аллель STin2.9 VNTR отличались сниженным уровнем социального функционирования.
В исследовании показано, что носители полиморфизма гена 5-HTTLPR (аллель S) отличались более высокими показателями болевой чувствительности при растяжении прямой кишки, при этом данная особенность выявлялась как у пациентов с СРК, так и у здоровых носителей данного гена [9]. В исследовании [5] получены данные, что у пациентов с СРК — носителей гена 5-HTTLPR отмечается увеличение регионального кровотока в головном мозге в ответ на растяжение кишечника, особенно выраженное в коре орбитофронтальной области. Аналогичные результаты в ответ на стимуляцию ректосигмоидного отдела кишечника получены и в другом исследовании [24]. Принимая во внимания эти данные, можно отметить, что у пациентов с СРК повышение болевой чувствительности кишечника сопровождается повышением активности участков мозга, ответственных за эмоциональную сферу.
Помимо изучения полиморфизма гена 5-HTTLPR у пациентов с СРК проводились и другие работы по исследованию иных генов, связанных с серотонинергической системой. Так, изучались особенности гена рецепторов 5-HT2A, расположенных в головном мозге, ядре блуждающего нерва и в ЖКТ [25]. Показано, что полиморфизм гена 1438 (G/A) ассоциирован с такими нарушениями, как неврогенная анорексия, алкогольная зависимость, обсессивно-компульсивные расстройства, с сезонными аффективными расстройствами [26, 27]. В исследовании, проведенном в Турции у 54 пациентов с СРК и 107 здоровых лиц, показано, что при СРК отмечается более высокая статистически значимая частота носительства гомозиготного аллеля С полиморфизма 102 Т/С и гомозиготного аллеля, А полиморфизма 1438 G/A гена рецепторов 5HT2A; при этом отмечено, что генотип ТТ полиморфизма 102 Т/С ассоциировался с более выраженным болевым синдромом у пациентов с СРК [28].
В исследовании, проведенном в Греции с участием 124 пациентов с СРК и 234 здоровых лиц, показана высокая распространенность аллеля, А и генотипа АА полиморфизма гена 1438 (G/A) у пациентов с СРК, однако связи наличия полиморфизма 102 С/Т у пациентов с СРК и степенью тяжести болевого синдрома в данном исследовании не отмечено [29].
Помимо указанных нарушений в серотонинергической системе у пациентов с СРК отмечены нарушения в α2-адренергической рецепторной функции, что ассоциировалось с изменениями в двигательной функции кишечника и механизмах гиперсенситивности [30]. Кроме того, выявленные изменения в полиморфизме гена α2C Del 322−325 часто ассоциируются с формированием СРК с запорами [31], в то время как полиморфизм α2A-1291 C>G часто связан с формированием СРК с диареей [32]. Полиморфизм гена Val158Met катехол-О-метилтрансферазы — фермента, участвующего в метаболизме катехоламинов, также связан с высокой частотой формирования СРК, и у пациентов с данным полиморфизмом отмечается уменьшенный порог болевой чувствительности [33].
Нарушения в гене каннабиноидных рецепторов также наблюдаются у пациентов с СРК. Так, в исследовании [34] показано, что полиморфизм в 3 цепочках каннабиноидного рецептора CNR1 ассоциирован с высокой частотой формирования СРК и более выраженным болевым синдромом.
Показана роль полиморфизма одиночного нуклеотида в CRH-R1 рецепторе в механизмах формирования СРК [35]. Выявлено [36], что наличие индивидуальной генетической особенности rs806378 в рецепторе CNR1 связано с ускоренным кишечным транзитом у больных СРК с диареей, а также с повышенной чувствительностью кишечника к растяжению газом.
Ряд исследований посвящен изучению полиморфизма генов провоспалительных и противовоспалительных цитокинов у пациентов с СРК. В изучении полиморфизма 1082 G/G гена провоспалительного цитокина интерлейкина (ИЛ) 10, отмечено, что наличие данного полиморфизма связано со значительно более низким риском формирования у пациентов с СРК [37]. В другом исследовании, посвященном изучению полиморфизма генов цитокинов у больных СРК, показано, что имеется связь между аллелем ИЛ-8+ 396G, а также ИЛ-10−1082A и формированием у пациентов СРК [38]. Другим полиморфизмом ИЛ-10, который ассоциирован с формированием СРК, был ИЛ-10−819 T>C, при этом наиболее часто данная генетическая особенность встречалась у пациентов с вариантом СРК с диареей [39].
При изучении полиморфизма гена α-фактора некроза опухоли у пациентов с СРК получены противоречивые результаты. Так, наличие полиморфизма 308 G/A оказалось связано с протективным влиянием в отношении формирования СРК [40], в то время как наличие генотипа G/G увеличивало частоту формирования СРК у пациентов.
Результаты исследования по изучению полиморфизма 825C>T гена GNβ3 показали, что у пациентов с СРК имеется статистически значимое взаимодействие между наличием желудочно-кишечной инфекции и аллелем Т; это отражает наличие тесной связи между генетическими особенностями и факторами внешней среды у пациентов данной категории [41].
В последние годы появились исследования, показавшие, что имеется генетическая связь в реализации воздействия стресса на организм у пациентов с СРК. Выявлено [42], что тяжелая психологическая травма в детском возрасте снижает экспрессию глюкокортикоидных рецепторов (ГКР) путем гиперметилирования гена ГКР у больных СРК. Нарушение экспрессии гена ГКР приводит к неполноценному ответу гипоталамо-гипофизарной системы в ответ на стрессорное воздействие, уменьшая ее защитную функцию. Это продемонстрировано в экспериментальных исследованиях на животных, у которых на фоне сильного стресса при рождении имелось гиперметилирование гена ГКР, что приводило к длительному повышению в крови уровня стрессорных гормонов кортикостероидов [43]. Как показано в дальнейших исследованиях, у пациентов с СРК с нарушением гена ГКР на фоне увеличения в крови уровня стрессорных гормонов кортикостероидов происходит повышение уровня провоспалительных цитокинов — ИЛ-6 и 8. Это приводит к нарушению обмена аминокислоты триптофана и вследствие этого — частым эпизодам депрессий и беспокойства [44—46].
Помимо исследований, посвященных изучению влияния полиморфизма генов на механизмы формирования функциональных заболеваний ЖКТ, в последние годы уделяется внимание фармакогенетическим особенностям пациентов с СРК. В частности, изучение полиморфизма 2D6 гена цитохрома P-450 (CYP) — CYP2D6 показало, что в различных географических регионах мира отмечаются различные виды CYP [47]. Число функционирующих аллелей (>3, 2, 1 и 0) определяет, каким будет метаболизм в CYP2D6: ультрабыстрым, быстрым, промежуточным или медленным, при этом около у 1% жителей Азии и 5—10% жителей Кавказа метаболизм является медленным [48]. Наиболее частыми нефункциональными аллелями являются CYP2D6*3, CYP2D6*4, CYP2D6*5, и CYP2D6*6; данные комбинации встречаются примерно у 98% жителей Кавказа [49]. Между тем нефункционирующие аллели CYP2D6 могут быть ответственны за недостаточный эффект от применения у пациентов с СРК трициклических антидепрессантов и ингибиторов обратного захвата серотонина [50].
При изучении фармакогенетических особенностей эффективности препаратов алосетрон и тегасерод у пациентов с СРК отмечено, что оптимальное клиническое действие антагониста рецепторов 5-НТ3 алосетрона встречается у носителей генотипа 5-HTTLPR LL, в то время как агонист рецепторов 5-HT4 у данной категории носителей генотипа будет гораздо менее эффективным [51].
При оценке влияния вариантов гена KLB и его подтипа FGFR4 на чувствительность кишечника у пациентов с СРК к препаратам желчных кислот показано, что носители данного генотипа отличались значительным ускорением кишечного транзита при СРК с диареей и запорами в ответ на хенодезоксихолевую кислоту и колезевелам [52—54].
Таким образом, результаты представленной обзорной статьи демонстрируют участие генетических механизмов в формировании функциональных заболеваний верхнего и нижнего отделов ЖКТ. Безусловно, проведенные исследования охватывали небольшой контингент пациентов и для более доказательной базы идентификации риска связи генетических нарушений и данными заболеваниями требуется проведение более крупных многоцентровых исследований с участием представителей различных народностей. Вместе с тем имеющиеся данные позволяют проследить включение генетических нарушений в изменение функционирования оси головной мозг — ЖКТ, в формирование феномена висцеральной гипералгезии, в аспекты клинических и психологических проблем, имеющихся у пациентов с функциональными заболеваниями ЖКТ, а также в недостаточную эффективность назначенной терапии из-за индивидуальных генетических особенностей.
Источник