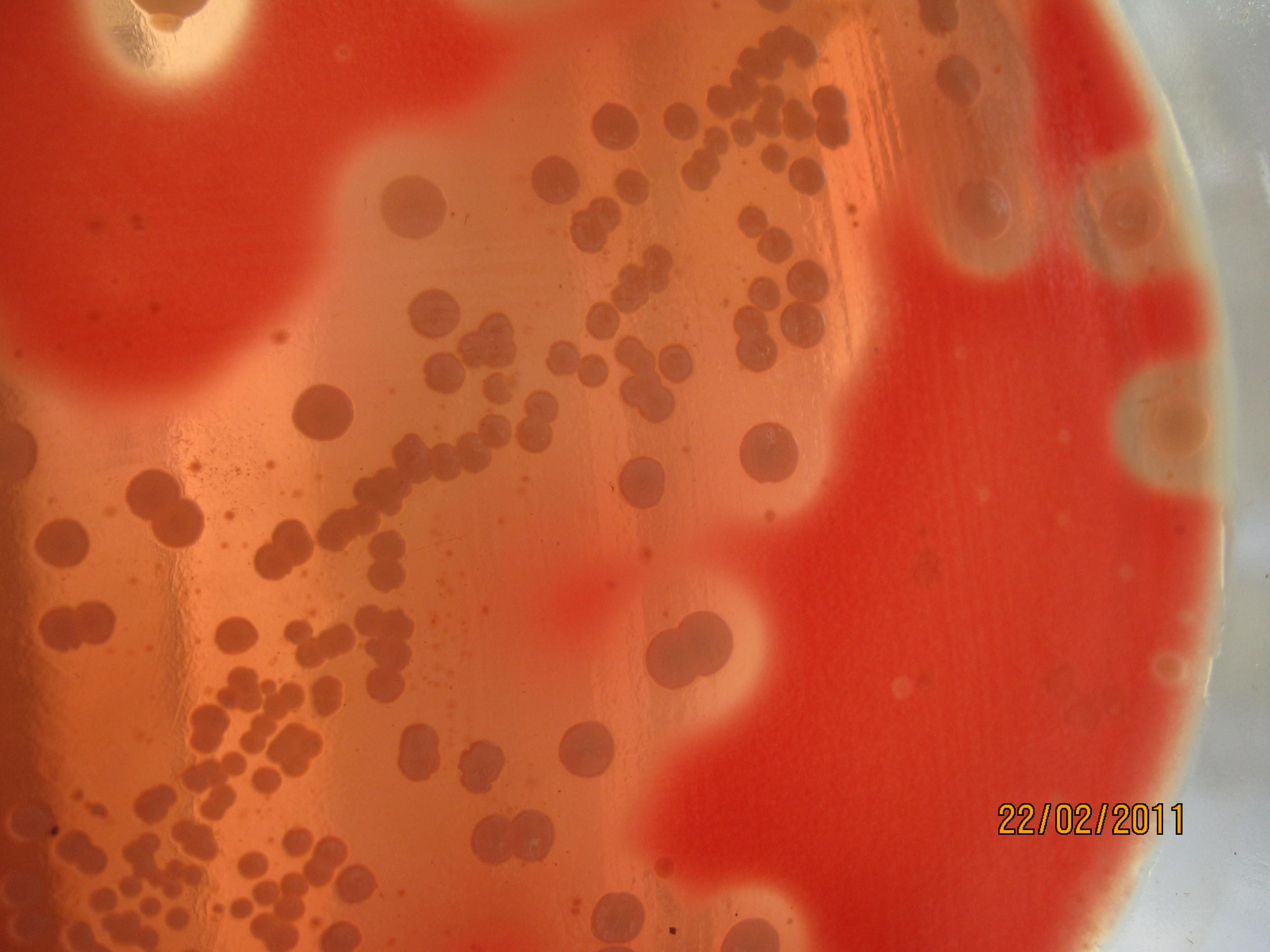
Рост кишечных палочек на среде плоскирева
План ответа макропрепарата.
- Название
- Ингредиенты
- Назначение
- Наблюдаемый результат
- Рост кишечных палочек на среде Эндо.
Среда Эндо – дифференциально-диагностическая среда. В составе среды: лактоза и индикатор кислотности – фуксин. Среда предназначена для выделения (преимущественно из кала и мочи) и дифференциации микроорганизмов семейства Enterobacteriaceae. Лактозопозитивные кишечные палочки, входящие в состав нормальной микрофлоры кишечника растут колониями малиново-красного цвета с металлическим блеском, так как расщепляют лактозу и изменяют рН среды. Лактозоотрицательные микроорганизмы (некоторые патогенные кишечные палочки, шигеллы, сальмонеллы) растут колониями белого или светло-розового цвета.
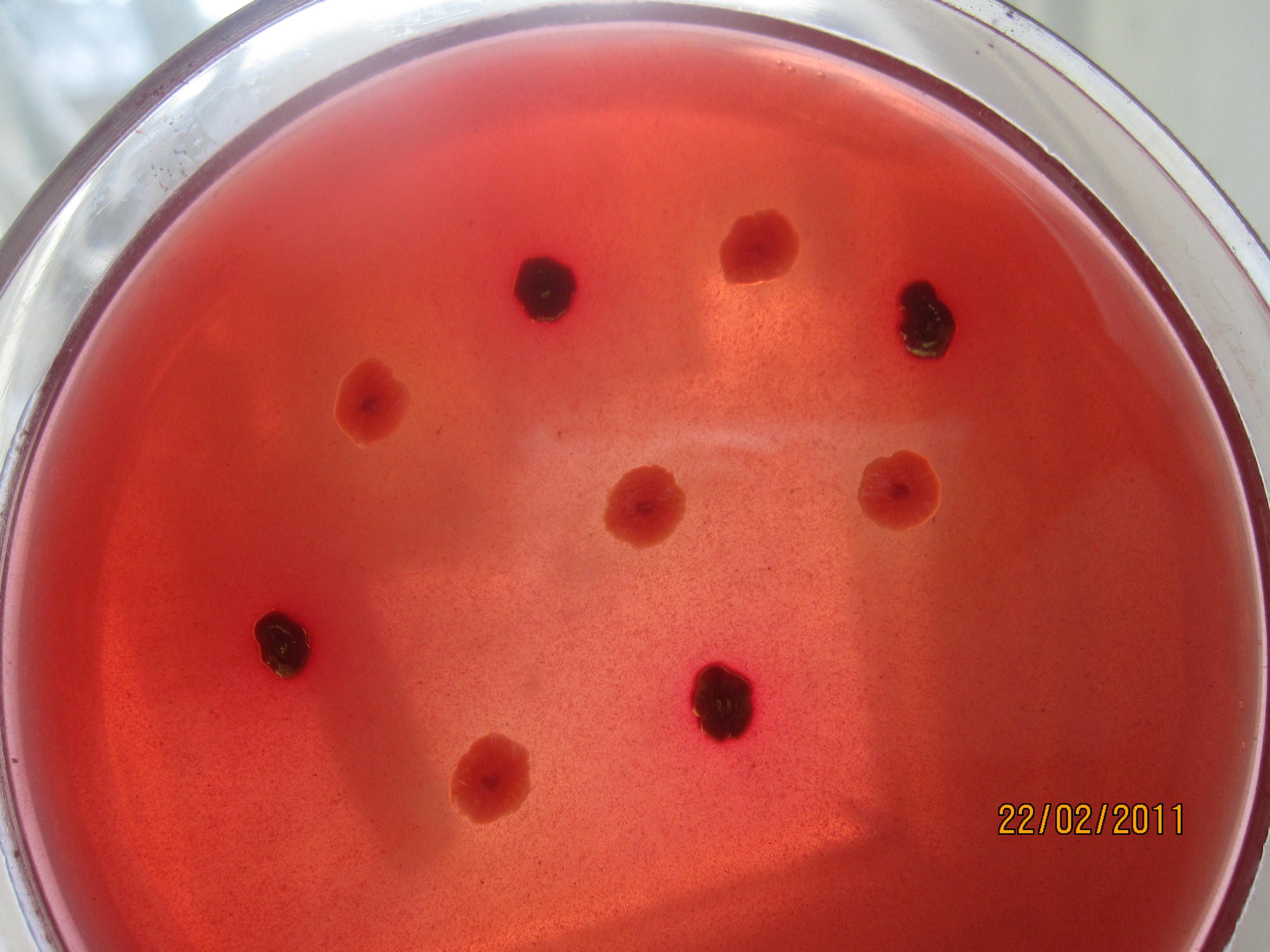
- Рост кишечных палочек и дизентерийных палочек на среде Плоскирева.
Среда Плоскирева – дифференциально-диагностическая среда. Это селективная среда для выделения шигелл и сальмонелл. Готовая среда прозрачна, имеет розовато-желтоватый цвет. Среда Плоскирева относится к плотным средам для выделения чистых культур. В состав среды Плоскирева входят ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять рост грамположительной флоры, значительно задерживать (первые 24 ч) рост эшерихий и другой сопутствующей микрофлоры, подавлять роение протея. Дифференцирующие свойства агара Плоскирева основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют колонии брусничного цвета (индикатор нейтральный красный). Лактозоотрицательные бактерии вырастают в виде бесцветных или слабоокрашенных колоний.
Реакция непрямой (пассивной) гемагглютинации (РНГА).
Эта реакция относится к серологическим реакциям иммунитета между антигенами (АГ) и антителами (АТ). Детерминанта АГ связывается с активным центром АТ. Соединение АГ и АТ осуществляется посредством водородных и гидрофобных связей, взаимодействия ионов, кулоновских и ван-дер-вальсовых сил. Прочность соединения АГ с АТ обеспечивается не только силами связывания, но и оптимальной стерической адаптацией активного центра АТ к АГ-детерминанте.
Серологические реакции протекают в две фазы. Первая – специфическая невидимая, – заключается во взаимодействии АГ с АТ. Вторая фаза – видимая, – проявляется в зависимости от типа реакции, который определяется свойствами АГ, АТ и другими ингридиентами реакций.
Реакция непрямой гемагглютинации (РНГА; син. реакция пассивной гемагглютинации) – метод обнаружения и идентификации антигенов или антител, основанный на возникающем в их присутствии феномене агглютинации эритроцитов, на поверхности которых были предварительно адсорбированы соответствующие специфические антитела или антигены.
Серологический метод. Сыворотка крови обследуемого пациента (содержит неизвестные (искомые) АТ). Эритроцитарный диагностикум – содержит известный антиген, адсорбированный на поверхности эритроцита. Образование комплекса АГ-АТ влечет за собой и склеивание эритроцитов, что легко учитывать. Таким образом, эритроциты не участвуют непосредственно в образовании комплекса АГ-АТ, служат для укрупнения корпускула и соответственно являются индикаторами наличия комплекса АГ-АТ. РНГА более чувствительна, чем РА.
РНГА может использоваться как экспресс-метод, например при диагностике чумы или газовой гангрены. Ингредиенты: исследуемый материал – неизвестный АГ, диагностикум эритроцитарный антительный (содержит известные АТ адсорбированные на поверхности эритроцита). Образование комплекса АГ-АТ влечет за собой и склеивание эритроцитов, что легко учитывать.
Определения чувствительности бактерий к антибиотикам методом индикаторных дисков.
Важное значение в лечении и профилактике инфекционных заболеваний принадлежит химиотерапии и химиопрофилактике, эффективность которых в значительной степени зависит от чувствительности микроорганизмов к антимикробным препаратам. Среди химиотерапевтических средств, используемых для лечения больных с гнойно-септическими инфекциями, ведущее место занимают антибиотики.
Для определения чувствительности выделенных микроорганизмов к антибиотикам широко используется диско-диффузионный метод. Исследуемую культуру суспензируют в стерильном физиологическом растворе приготовляя 1-миллиардную взвесь по стандарту мутности. Бактериальную взвесь (1 мл) стерильной пипеткой наливают на поверхность плотной питательной среды в чашку Петри и равномерно распределяют шпателем. Избыток жидкости удаляют пипеткой. Шпатель и пипетки помещают в стакан с дезраствором. На засеянную поверхность стерильным пинцетом помещают на одинаковом расстоянии друг от друга и отступя 2 см от края чашки бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37°С до следующего дня. По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам. Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов. Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундируюшим в агар полипептидным антибиотикам (например, полимиксин, ристомицин).
Персистентные свойства микроорганизмов – антилизоцимная активность (АЛА).
АЛА – секреторный фактор персистенции. Изучают АЛА по методике О.В. Бухарина с соавт. (1984). Для этого к 1,5% питательному агару добавляют различные дозы яичного лизоцима (от 1 до 5 мкг) и разливают в чашки Петри. После застывания среды на подсушенную поверхность наносят каплю 1 млрд. взвеси суточной агаровой культуры изучаемого микроорганизма. Чашки инкубируют в термостате при 370С 24 часа, после этого выросшие колонии подвергаются обработке парами хлороформа в течение 20 минут, затем наслаивается слой 0,7% питательного агара с 0,1 мл 1 млрд. взвеси суточной агаровой культуры Micrococcus luteus (lysodeikticus) АТСС 15307 (ГИСК им. Тарасевича) чувствительной к литическому действия лизоцима. Учет результатов проводится через 24 часа инкубации в термостате по наличию зоны роста микрококка вокруг тех штаммов, которые нейтрализуют внесенный в слой агара яичный лизоцим. Антилизоцимную активность выражают в мкг инактивированного в среде лизоцима.
На данной чашке видны колонии АЛА+ и АЛА- штаммов микроорганизмов. Над колониями АЛА+ штаммов есть рост микрококка в виде мелких желтых колоний.
Лизоцимная активность.
Лизоцим –термостабильный белок, фермент, разрушает клеточную стенку преимущественно грамположительных бактерий, разрывая β-гликозидные связи между аминосахарами пептидогликана, что способствует образованию протопластов с последующим их лизисом. Содержится во всех тканевых жидкостях, в лейкоцитах, макрофагах и других фагоцитирующих клетках. Продуцируется лизоцим преимущественно клетками моноцитарно/макрофагального ряда. Лизоцим усиливает антибактериальную активность комплекса антиген (микроб)-антитело-комплемент, способствуя лизису пептидогликана клеточной стенки бактерий. Помимо животного раличают растительный и микробный лизоцим.
Микробный лизоцимявляется одним из факторов колонизации. Лизоцимная активность (ЛА) определяется путем посева исследуемой культуры микроорганизма на питательную среду, содержащую 1 млрд. суспензию суточной агаровой культуры Micrococcus luteus (lysodeikticus) АТСС 15307 (ГИСК им. Тарасевича). Результат оценивается после инкубации при 370С в течение суток по зоне лизиса в толще среды индикаторного штамма микрококка вокруг изучаемых колоний.
Иммуноферментный метод
Иммуноферментный анализ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
ИФА появился в середине 60-х годов и первоначально был разработан как метод для идентификации антигена в гистологическом препарате, а также для визуализации линий преципитации в тесте иммунодифузии и иммуноэлектрофореза, а затем стал использоваться для количественного определения антигенов и антител в биологических жидкостях. В разработке метода принимали участия Е. Энгвалл и Р. Пэлман, а также независимо от них В. Ван Вееман и Р. Шурс.
Метод основан на специфическом связывании антитела с антигеном, при этом один из компонентов конъюгирован с ферментом, в результате реакции с соответствующим хромогенным субстратом образовывается окрашенный продукт, количество которого можно определить спектрофотометрически.
Открытие возможности иммобилизации антигена и антитела на различных носителях с сохранением их связывающей активности позволило расширить использование ИФА в различных областях биологии и медицины.
Появление моноклональных антител послужило дальнейшему развитию ИФА, что позволило повысить его чувствительность, специфичность и воспроизводимость результатов.
Теоретически ИФА основывается на данных современной иммунохимии и химической энзимологии, знании физико-химических закономерностей реакции антиген-антитело, а также на главных принципах аналитической химии. Чувствительность ИФА и время его проведения определяется несколькими основными факторами: кинетическими, термодинамическими характеристиками реакции антиген-антитело, соотношением реагентов, активностью фермента и разрешающей способностью методов его детекции. В общем виде реакция антиген-антитело может быть описана простой схемой: [AT]+[АГ]↔[АТАГ]
Разнообразие объектов исследования от низкомолекулярных соединений до вирусов и бактерий, а также необычайно широкий круг задач, связанных с многообразием условий применения ИФА, обусловливают разработку чрезвычайно большого количество вариантов этого метода.
Любой вариант ИФА содержит 3 обязательные стадии:
1. стадия узнавания тестируемого соединения специфическим к нему антителом, что ведет к образованию иммунного комплекса;
2. стадия формирования связи конъюгата с иммунным комплексом или со свободными местами связывания;
3. стадия превращения ферментной метки в регистрируемый сигнал.
Принципальная схема иммуноферментного анализа для выявления АТ является следующей. Известный АГ (вирус, белок) – диагностикум фиксируется на твердой фазе. К нему добавляют сыворотку обследуемого с неизвестными АТ. После инкубации и промывки на антигене остаются специфичные к нему АТ, если таковые имелись в сыворотке обследуемого. Для обнаружения комплекса АГ-АТ, к нему добавляют кроличью антиглобулиновую сыворотку меченую ферментом (АГС-Ф). Для получения данной сыворотки иммунизируют кролика глобулинами человека. Полученную от кролика сыворотку метят каким-либо ферментом, например, пероксидазой хрена. Если в обследуемой сыворотке есть АТ к АГ (диагностикум), то они будут служить антигеном для антиглобулиновой сыворотки. После второй промывки образовавшийся комплекс АГ+АТ+АГС-Ф можно обнаружить, добавив субстрат на фермент (перекись водорода) и индикатор на продукты расщепления субстрата (хромоген на активные формы кислорода). Изменение цвета индикатора свидетельствует о наличии искомых АТ в сыворотке обследуемого.
Среда Китта-Тароцци.
Питательный бульон с глюкозой и кусочками свежих органов животных. Глюкоза и кусочки органов обладают редуцирующей способностью. Сверху среду заливают слоем стерильного масла, которые не пропускает кислород из воздуха в среду. В результате создаются условия для культивирования анаэробных микроорганизмов.
План ответа макропрепарата.
- Название
- Ингредиенты
- Назначение
- Наблюдаемый результат
- Рост кишечных палочек на среде Эндо.
Среда Эндо – дифференциально-диагностическая среда. В составе среды: лактоза и индикатор кислотности – фуксин. Среда предназначена для выделения (преимущественно из кала и мочи) и дифференциации микроорганизмов семейства Enterobacteriaceae. Лактозопозитивные кишечные палочки, входящие в состав нормальной микрофлоры кишечника растут колониями малиново-красного цвета с металлическим блеском, так как расщепляют лактозу и изменяют рН среды. Лактозоотрицательные микроорганизмы (некоторые патогенные кишечные палочки, шигеллы, сальмонеллы) растут колониями белого или светло-розового цвета.
- Рост кишечных палочек и дизентерийных палочек на среде Плоскирева.
Среда Плоскирева – дифференциально-диагностическая среда. Это селективная среда для выделения шигелл и сальмонелл. Готовая среда прозрачна, имеет розовато-желтоватый цвет. Среда Плоскирева относится к плотным средам для выделения чистых культур. В состав среды Плоскирева входят ингибирующие вещества (желчные соли, бриллиантовый зеленый, йод), вследствие чего она должна полностью подавлять рост грамположительной флоры, значительно задерживать (первые 24 ч) рост эшерихий и другой сопутствующей микрофлоры, подавлять роение протея. Дифференцирующие свойства агара Плоскирева основаны на изменении рН в кислую сторону при росте лактозоферментирующих бактерий, которые образуют колонии брусничного цвета (индикатор нейтральный красный). Лактозоотрицательные бактерии вырастают в виде бесцветных или слабоокрашенных колоний.
Рост стафилококка на кровяном агаре.
Кровяной агар (КА) – сложная плотная питательная среда для культивирования прихотливых видов микроорганизмов и выявления гемолизинов (определения у МО одного из факторов вирулентности – гемолитической активности). На 100 мл расплавленный и остуженный до 450С мясо-пептонный агар (МПА) добавляют 5 мл отмытых эритроцитов барана или эритроцитарной массы крови человека (I группы), аккуратно перемешивают, разливают в чашки Петри. На поверхность застывшего и подсушенного КА засевают чистую культуру исследуемых микроорганизмов, после суточной инкубации при 370С определяют зоны гемолиза вокруг выросших колоний. Зоны гемолиза виды в виде полного (β-гемолиз) или частичного (α-гемолиз) просветления вокруг колоний. На данной чашке видны колонии стафилококков бело-серого цвета с зонами полного просветления вокруг, что свидетельствует о наличии у этих микроорганизмов гемолитической активности.
4. Реакция преципитации в агаре для определения токсигенности дифтерийной палочки.
Реакция преципитации относится к реакции иммунитета между антигенами (АГ) и антителами (АТ). Детерминанта АГ связывается с активным центром АТ. Соединение АГ и АТ осуществляется посредством водородных и гидрофобных связей, взаимодействия ионов, кулоновских и ван-дер-вальсовых сил. Прочность соединения АГ с АТ обеспечивается не только силами связывания, но и оптимальной стерической адаптацией активного центра АТ к АГ-детерминанте.
Серологические реакции протекают в две фазы. Первая – специфическая невидимая, – заключается во взаимодействии АГ с АТ. Вторая фаза – видимая, – проявляется в зависимости от типа реакции, который определяется свойствами АГ, АТ и другими ингридиентами реакций. В реакции преципитации (РП) участвует растворенный антиген. При контакте с антителами – преципитинами образуется осадок. Реакцию преципитации можно проводить в жидкой среде (в пробирках) и в геле (в чашках Петри).
Одной из разновидностей РП в геле является реакция определения токсигенности дифтерийной палочки. Для этого в чашку Петри на питательную среду помещают полоску стерильной фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой. Эта сыворотка содержит АТ к дифтерийному токсину, получается путем иммунизации животного (кролика) анатоксинами (токсин лишенный вирулентности-токсигенности, но сохранивший иммуногенность-антигенность). Затем на плотнуб питательну среду в чашке высевают испытуемые культуры в виде пятачков на расстоянии 0,6-0,8 см от края фильтровальной бумаги. Чашки инкубируют при 370С в течение суток. При наличии токсигенной культуры в месте взаимодействия токсина с антитоксином образуются линии преципитации в виде дуг. Дуга – это визуальное отображение взаимодействия АТ диффундирующих из фильтровальной бумаги и АГ – экзотоксинов, выделяемых токсигенными культурами.
Источник
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
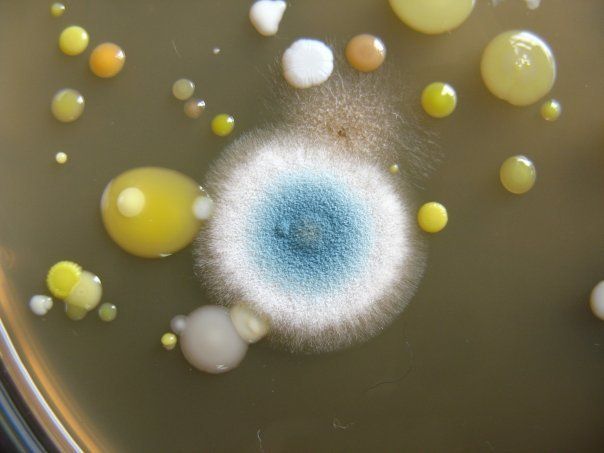
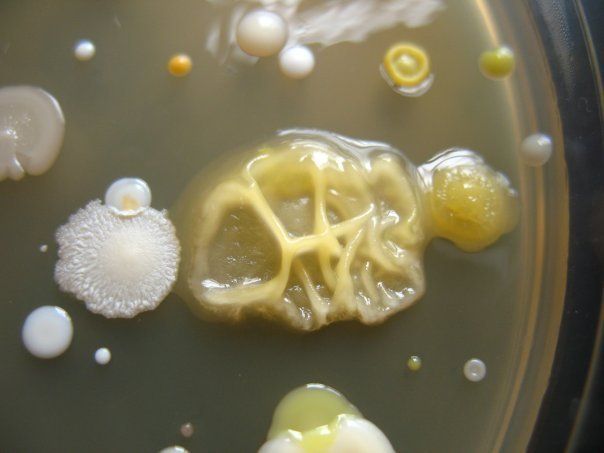 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
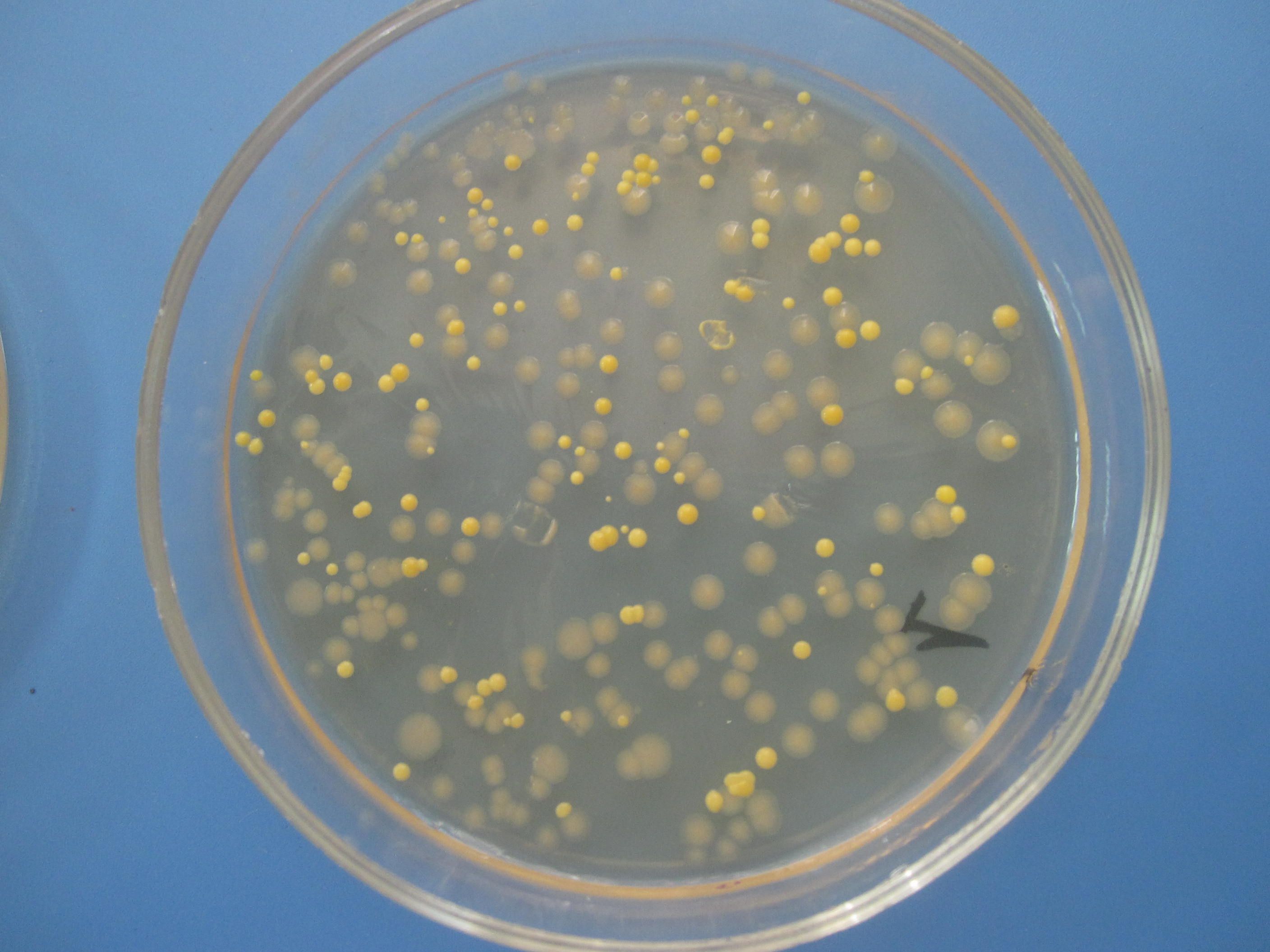
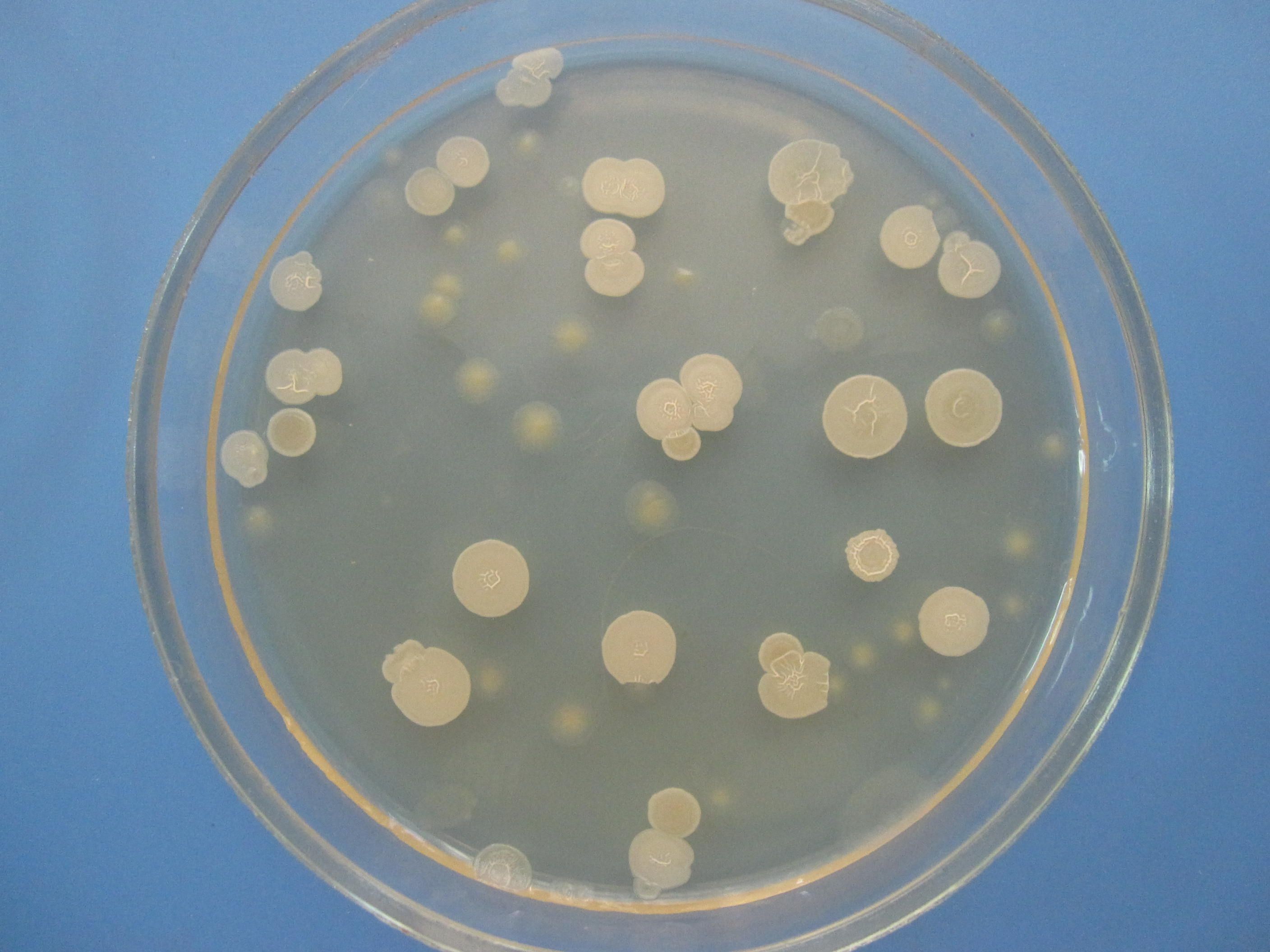 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
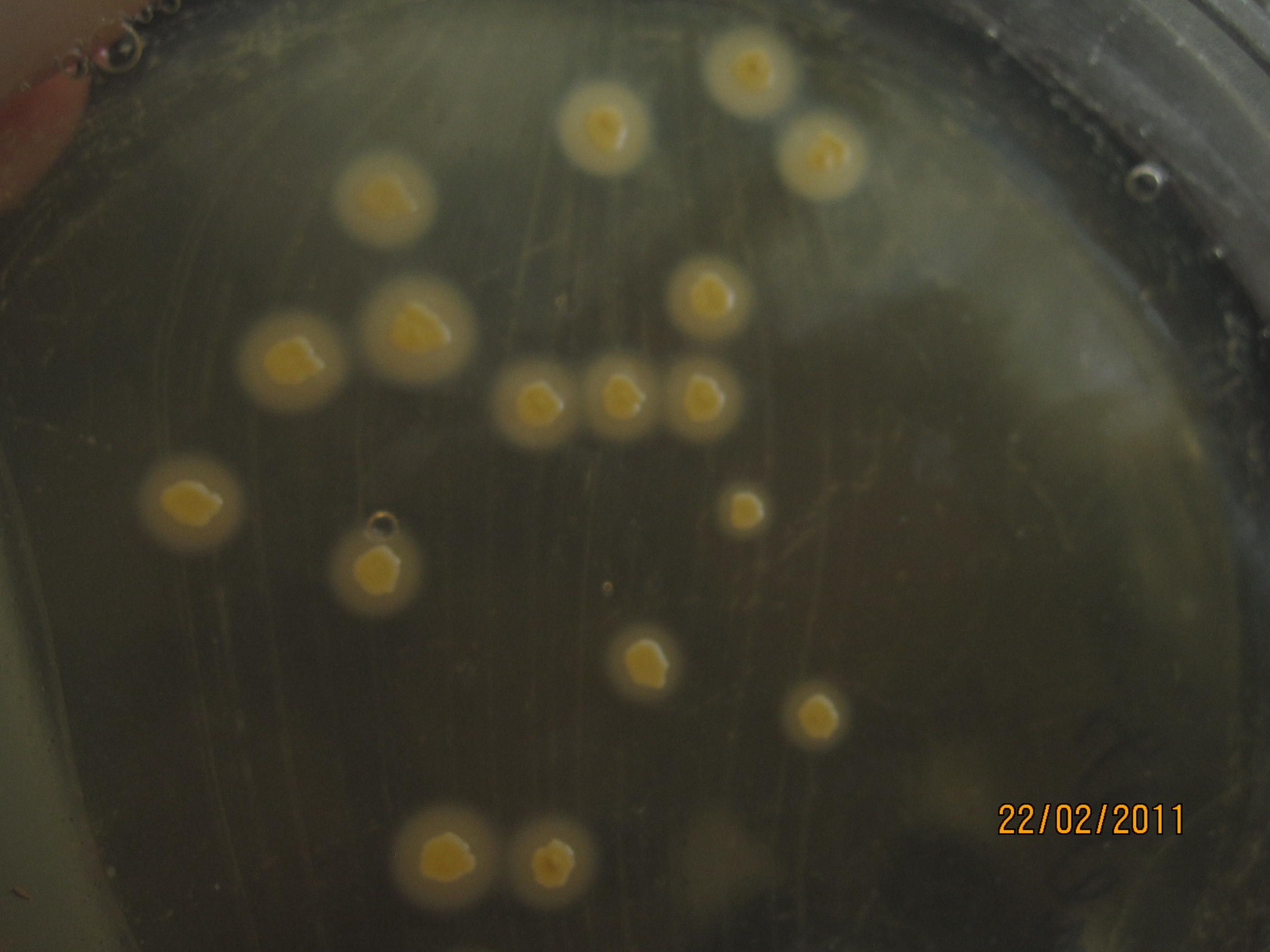
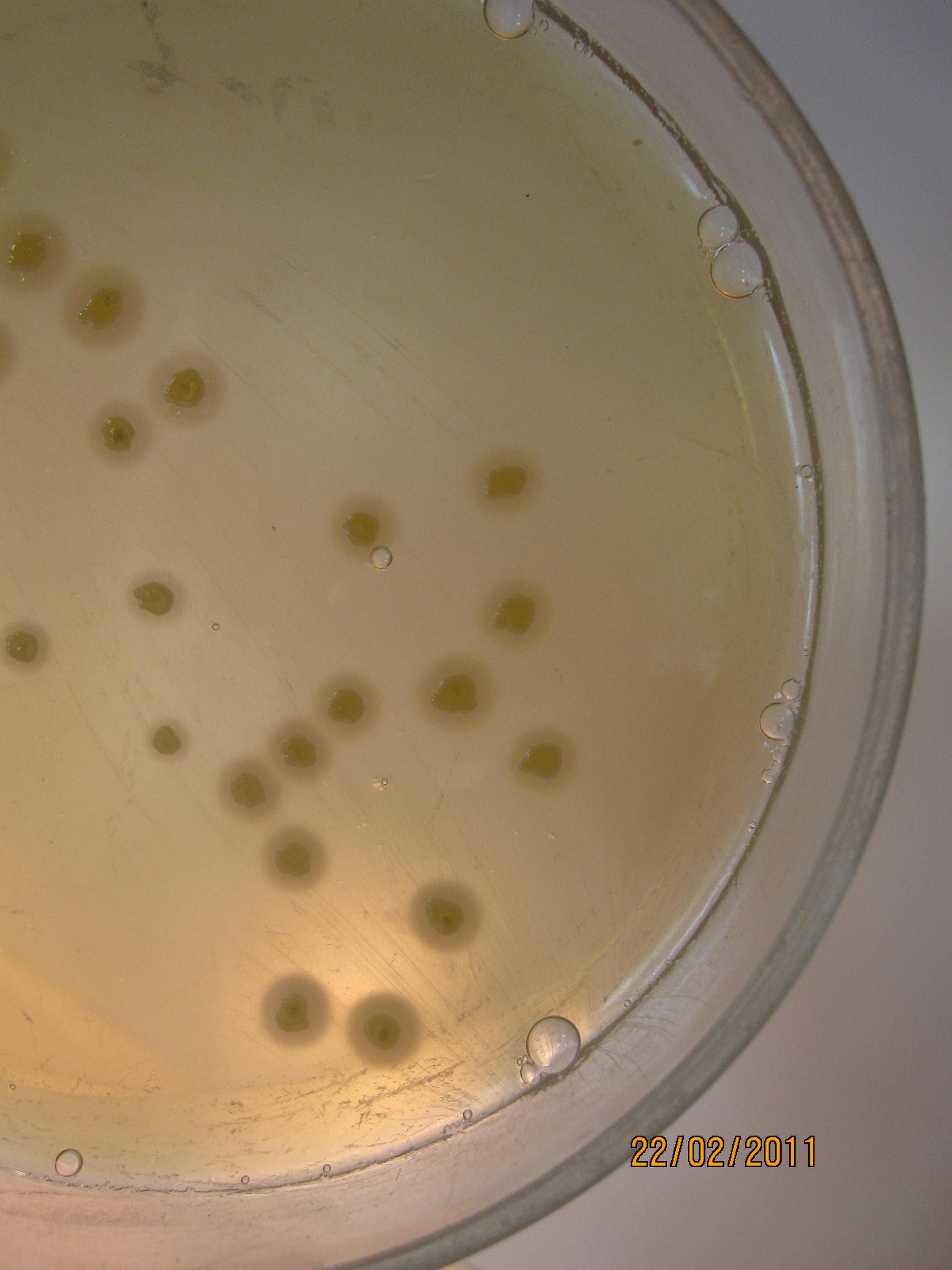 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
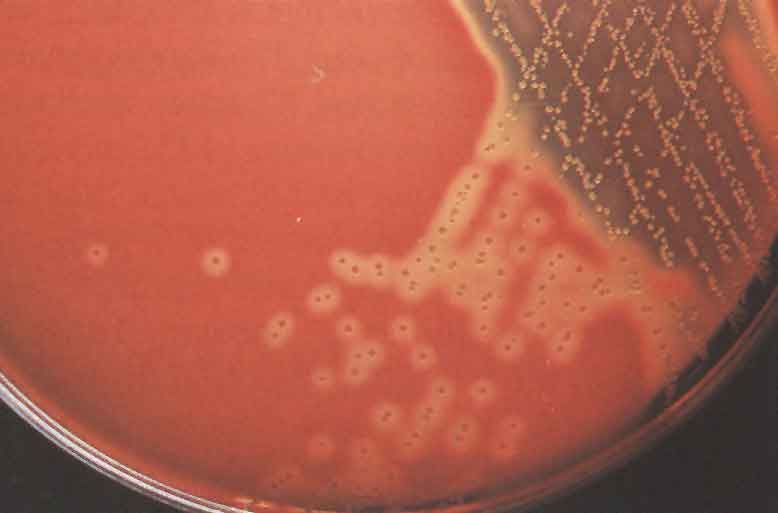
 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
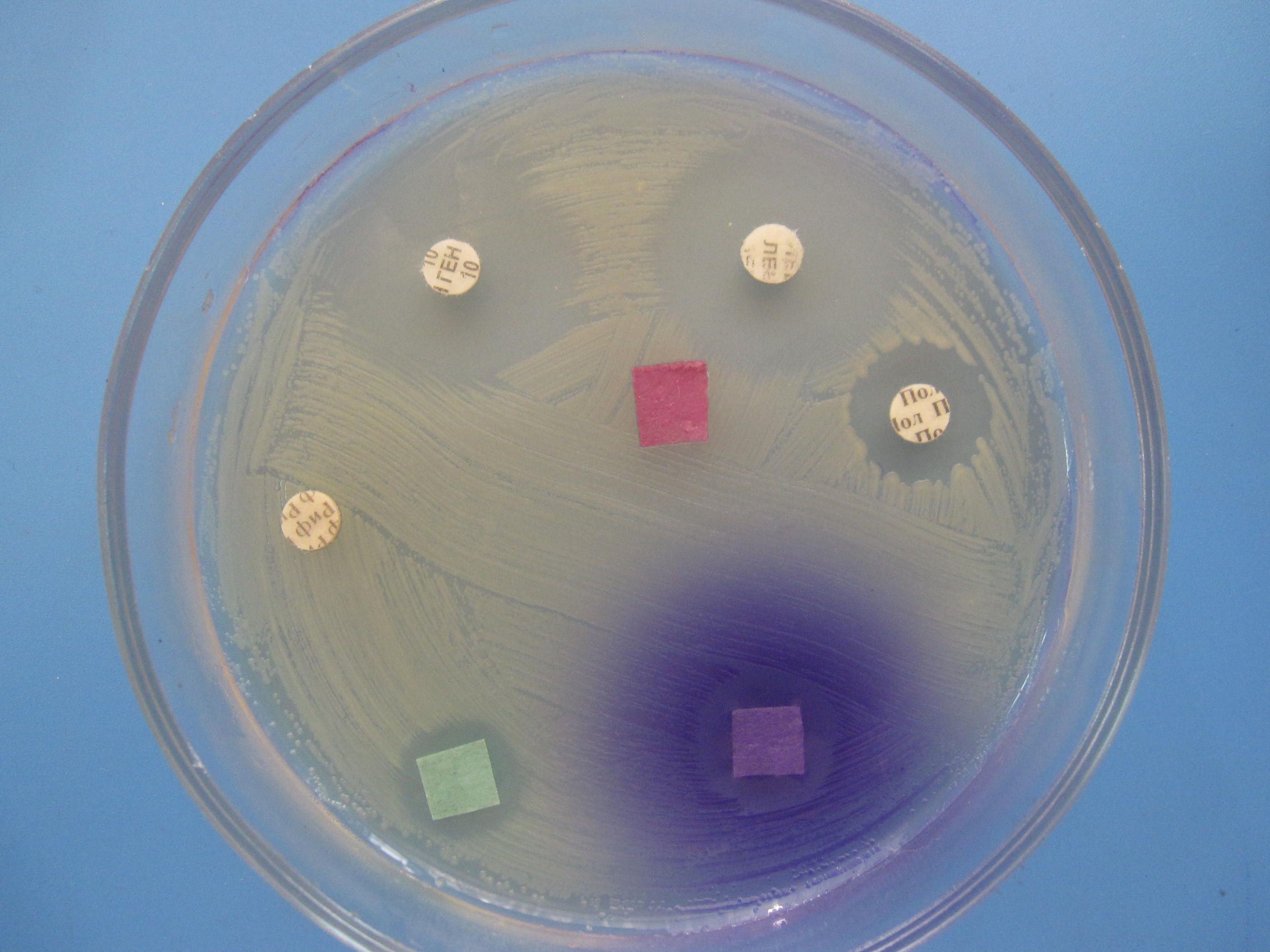 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
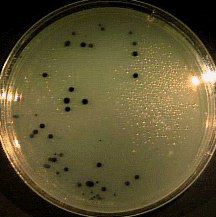
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
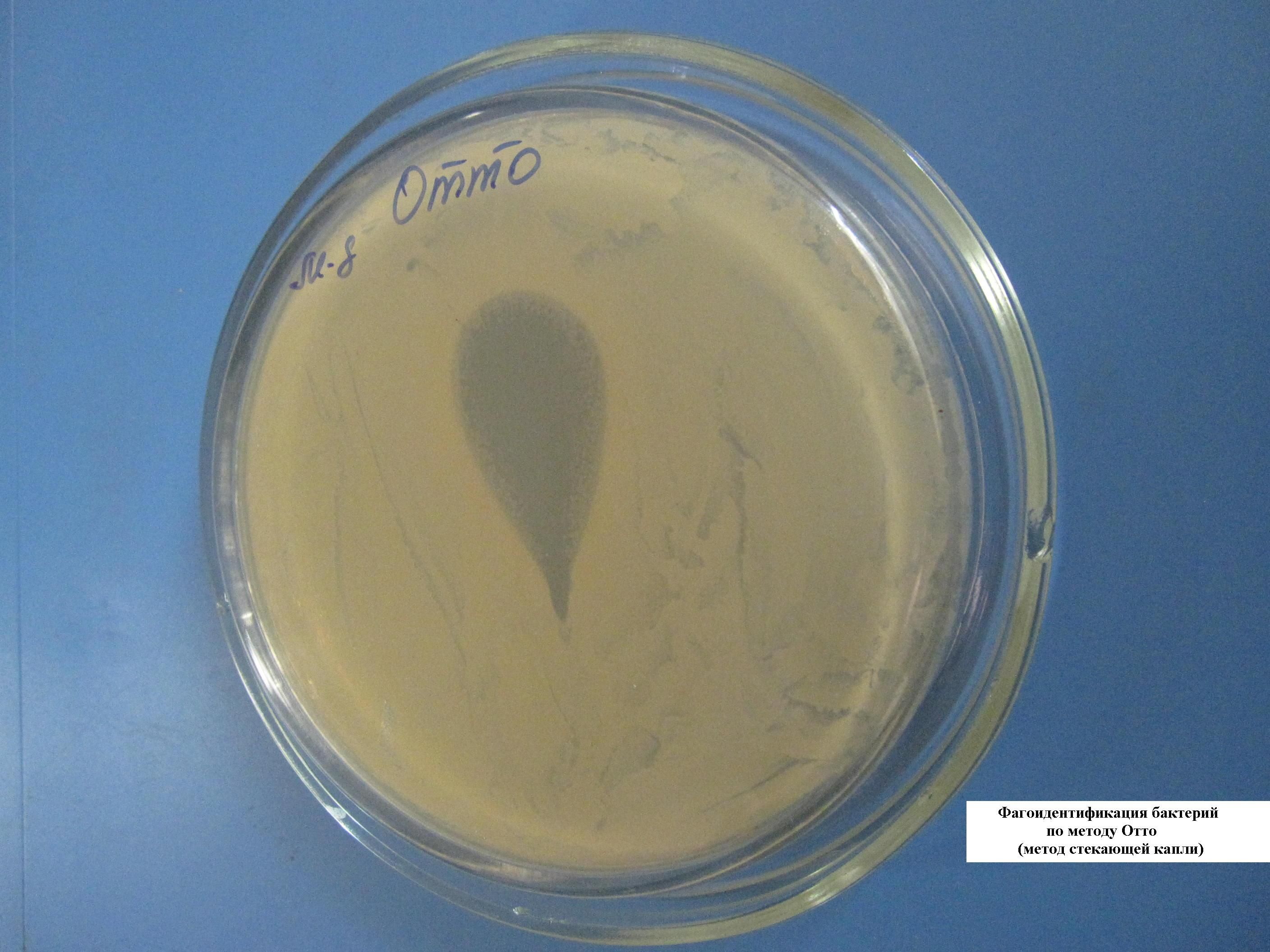
 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
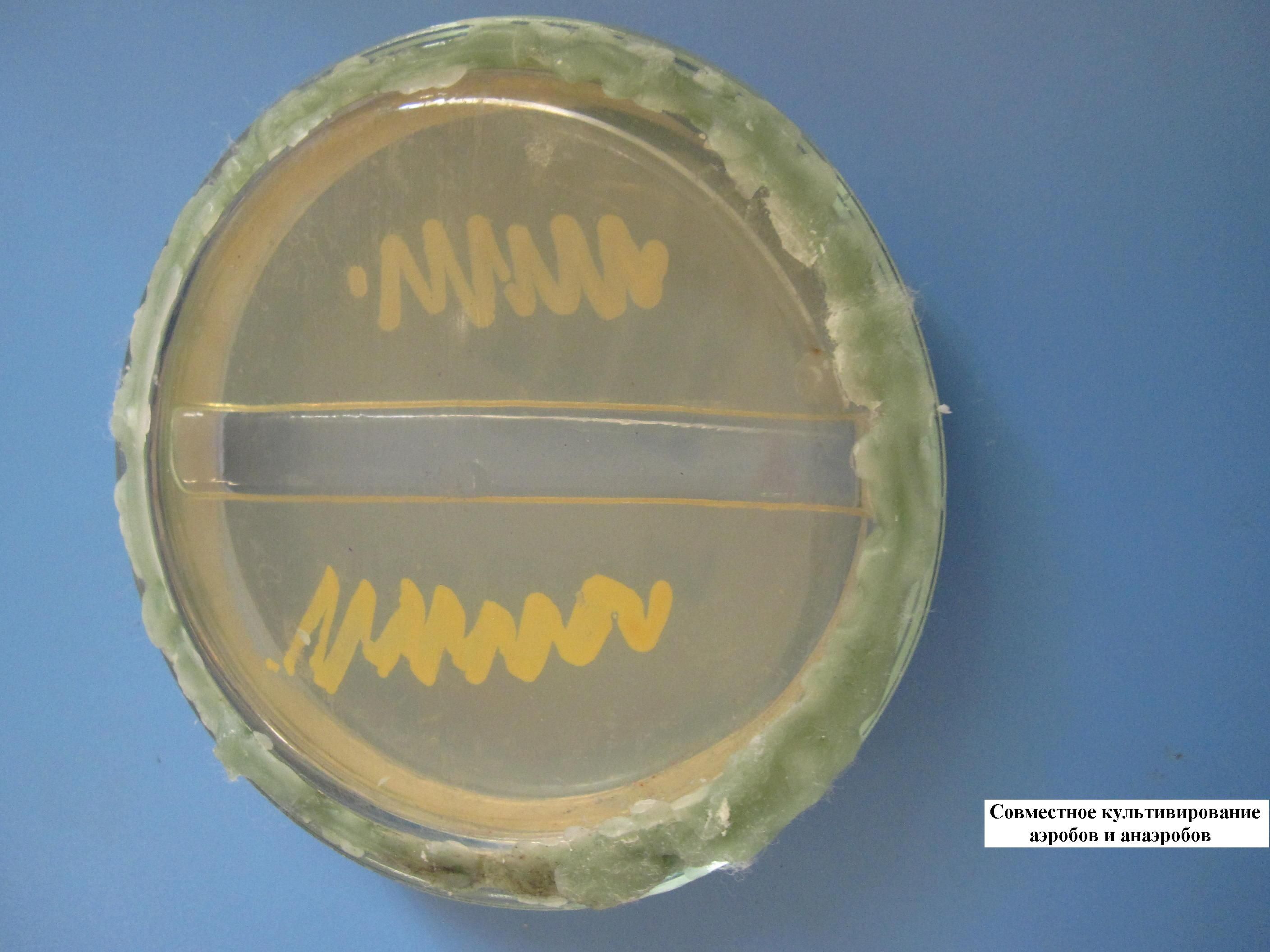
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
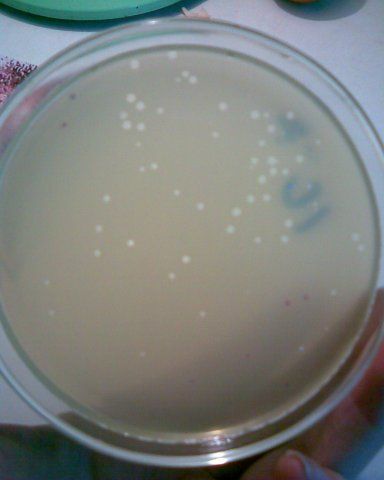 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
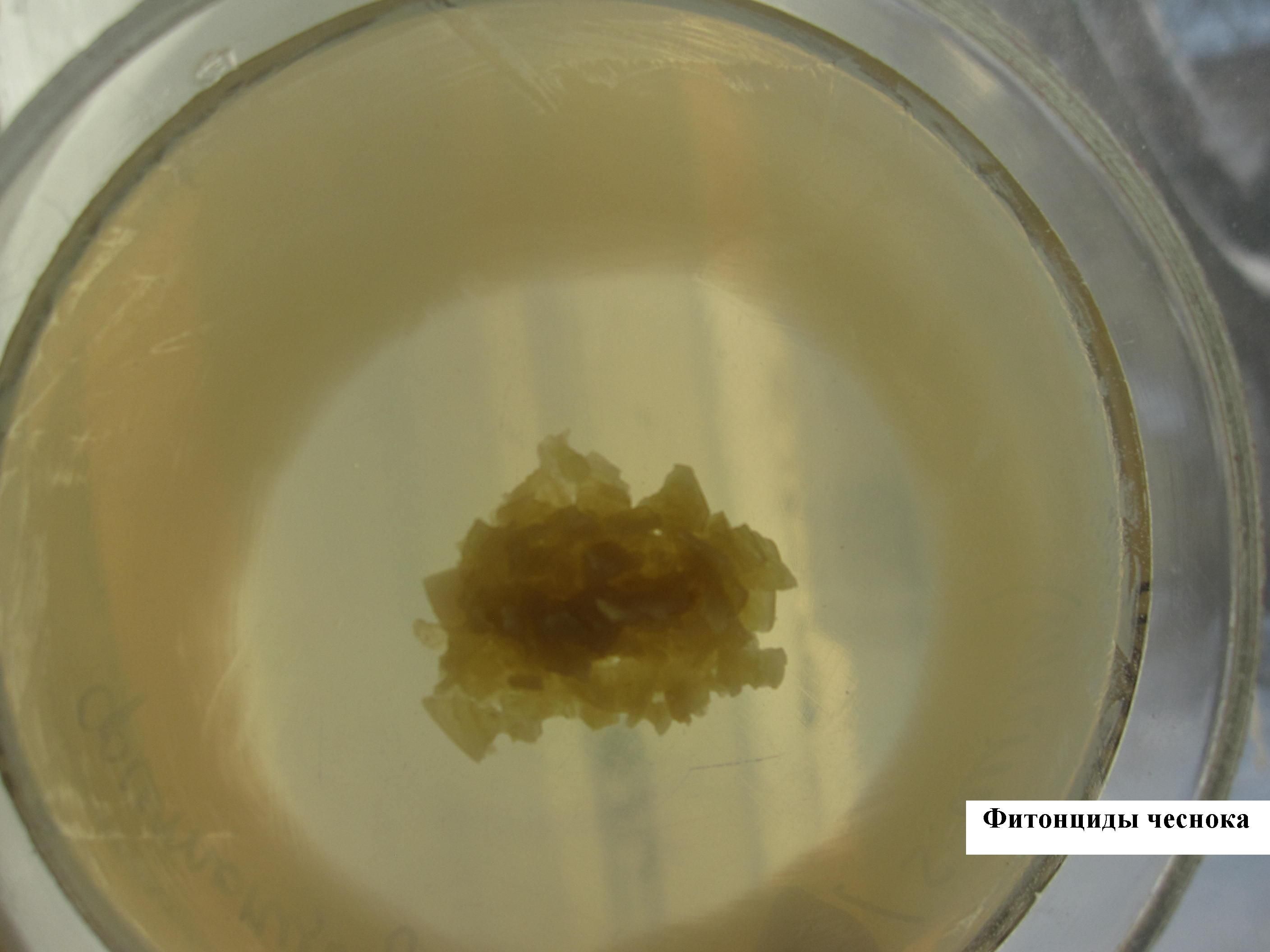 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник