Среда эндо для кишечной палочки
È1f/Xì3 ¤”ÎÖðÍcâ³°+m©0϶¸¤µõg£ÔâÁ9â|^씣ùUÔºäi(¨^cd¾¥hyµdîá0$Ó|«ËÛ¶éBU»a´òeD`¥¯reî(JõcË_¡,_;(¡bzyÿöÔÚ[wAQi]4ì¨Y6hI´*YjE¬b_´Ö°57(ªå~}Mr°h%Jq ¥’£Æh6áý¸Ú®Èu;hïu#ÉÀthíë甶CSbÒ롨!”l¸zWrÂNEJ^éí¥#£yXb¶El~ä6ª²egS+ÎGæA)vPsÌZz
®ß ðó9lòyÑ8¤ÊÙss{ÙÒiÔÚ0ZýçPoÚußRQG¡0
V¿¶UaëÚ6©xÑdå¢YZXÝà$h£ªÐn4+X#©¸E¶Õ×´æBqµ!K¨°EÿrÚ.ËðÅv.yÑH]·ª¦äµ¿¦ãx-:;óÂ×öªL£ã)iê}ç$ù*ìÖ+ÇMî9″°ÿ9£R ³fð¹ÔbïVZZÇ”²@5ªa^P¨ºàS§²µNO#k¼¶2
Æ;ré°XrDDÖ(Ç279ºÇBV{¯ D|T®^ø*îLýsä’ ?]¶£S
¶
·f/Á5 MÉa4+ÁÒæÑë~fCö )a®¨è!Å_1r¢ºuHWÎ*D´B`~þUuj.7PÔ«ç×¢û^ûÅñSJ©È¯ÃaÐ?UzÕHaÌVPæÕ¹|0sA}EÎ[⹦âéK_KßêÆïÆ*T(IXçT%nìX0Æ¢Neåk³ $4]ÑçKÂØ*
+KRcõÔÇåcNN¤&xeuÚÝby8n¢Ï¤ómdEªÑ®âd°ÖgÐÚP¾9ÖDN ű2`B4Ô”33S2OZM
X´&MA·e3.©
`6ôNú+:îýá³ÝáÄ^Ѻ¿y5ªV¤·Áì
Vª&°¬µú9+kÍÂc¹Vé~?7Ö%½ÈRåBiª%Y^cþÄÖº,’
Kª
ÍË6ÃΧÚQ,æk.ÍxCåöâV@d*lfSãm+4lL&[ .¨±¬øAöxà=Pø¦Â7ú¨á÷}ÜÕÄÎXL«*Ì)£¼1¦[ÈsCâJf¶u$Âê¼$¨T$çD>*ðI_yiQök°Æú辫ÃEi-±’3~ÈWxìóL÷KAó®c1j, ÒÄL6Í ø3@¾ 6Ö(°ÁÙúÈa+®±|K}7�68%
L-kƾ¤N®-)Î
1ñ?>Ô;I*6Ìÿß/d_jj%£_øø°FÖ$SAúÕ
»9UuRKå¼ôCe¾êÏÐìhYÃ?¢Â;7À£%¡”ËöµSSʾà ÚNlè8a£{ZDcvØ}zÒð *Fæ~®4ãí¹¨¨¡1/ë
ô±2±óüQ2Fä^ÄÞRQm*ÂÂǨt¦ßÂ8ï6#T:óo¡
40B¥3 Rû§”#T:pèéÒ4§*`vHÓ¼óR w!ñíú/jJÇvÁ3ÒïØ.D%tÄ;¶Ë
$|LGÛåÌ>¦£íBGêPéØ.´þáí2í#í2%$íúz#JtlñP¤PéØ.£®è®uDÐ=X© o©Ökkl-|p-gÎ?ì[å]ë¨ CkWÄÁµù)rwm£ôrÚçö|’vN÷UYQ§¾bgZ¾LÞؼI3Ôa .ƶùßZY’´Aê/#T:¡
Úg&mulm´Õ±µÑVÖ&[[mulm´Õ¡µÉVÇÖF[í®íÚj¾3·ÕËþwÅ»(ò_EPU(´^ÏVû§ôMÉýýf?ô
endstream
endobj
14 0 obj
>
endobj
15 0 obj
>
endobj
16 0 obj
>
endobj
17 0 obj
[ 18 0 R]
endobj
18 0 obj
>
endobj
19 0 obj
>
endobj
20 0 obj
>
endobj
21 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/Annots[ 23 0 R 25 0 R 26 0 R 29 0 R 33 0 R 34 0 R 35 0 R 41 0 R 51 0 R 55 0 R 56 0 R 58 0 R] /MediaBox[ 0 0 595.32 841.92] /Contents 22 0 R/Group>/Tabs/S/StructParents 2>>
endobj
22 0 obj
>
stream
xµMÛ6ïütLæ÷°`k×EHQ=,rXl4nÒ`/ý÷å¢4´$qÕ$¯-êqøp43òþðíõóǧç×æînx}}zþóÃÍãþüåëûýù¯öï>}~yzýüå¥mã}×ÏÛÍþ$GnηÖPÿ5ݧãÍù¯í6࿶Ç7Íïó/ÛÍ?ùïíFICõ%”T6Åo¶ßl^*Á¥$ëÃèÁþã¬þz¦âÄò³É5ý¿æám×4ûwà·ÝÏ÷
Í&ÁvWÓËQøryl¥Ñ¶Ý ÿªüÏÉ¿?øÚ:øèiÓ^Ô©¯)å3F
ðÌh6É¢FÏtÁ3
¼nÞ
®ÐàÊ
#Oý(ÙjìÒ¥Tø÷®5èc¢FzK/ü®Yç/*¿´`É´*.ÇϯǬó&Öa¹ÌyØ0gpråϤhY¿QIú®jdqÏù-ùDIEÍÌÊÍ7¸K0ǯ¬ä:”ù°x
íöðCAußZa«p±ßió÷Hs8íRtçz:ã«ìÝôR¸°¿·¦[&ÑF%°{þT×2¯_ôVàòºxÅU³gÌm+/¸ á±ÿ};H¡&öoSJ£««.¬
$/ùoe]²ö7îRÑ}Ëzhw &¼íÚ]·épÏâJ°âðotÇL
!;EnÙ:Î7 ÍÄM²ËäÊ ¸ÑzWÍ-w0ùh9;GD6vn
½Ù¿QJqNfÊ ãéTYÐ%ÐÍ2èÝV®aôC©ÅÙú8Âj~ÇiFéy}L6&Àfx8ßåÁWE´³·¢
?æñ£*»òE÷ÃXÉðزo|Ù¿d`j)%8Qr”u
cä:±¼+qì
/ÜÇVÌýÍL C+/ï
,ÄkãÆÙÅØÞcB±³ñ3Qx
½ø°çÂßæT6Ïå¨+)a]{å«Æû·b¯=}²Jê
¿huübE~+ ¼´³ WV
*n;Fâ¼üë&lJ@ú²N_àmOïYEOzÇaôüð2º½R@5’Y WðØ5èU Ù¿^
ùf
T^
ßâÌÂ[Yú)mûУpÀðÃиL_Q%UV lXÊCcÀÛNð!¿$6Ê£ö.êEÜÍ!c8íÐv§¸d¶äÜX¿yÒ%vu%!ôêvçrE(-ToãÐkåo1Ùb~’ØBÊñ%]áZX”²á!¬ú3X±d
j°h|ñÊPù{ª*¢¨R_îpfÖmHXÂÑhø5ÑcÄäEà£2/ç3k6®Wä[IÈ|±ÆÜ]!ûàåÅ2û7J)ê«X;/u
o4£*ÀñøD8EÂe`Ùü,âÅ b¢Oø õú/¶0R
¢YW?µý±íSx¤OÏýÛïN¥×¤ÛÄĹanãwÁcW Ûj”.ìß(%á)
º8Tàxü x±ÍÁ
õaÙüìÊ”Qúð¥FÀEq¨r1^«1}GT¡±E³”wÄp±ÎKå16ßà&â!ÏÛשËÎÑé&¥ç(ImÇÚ4e«Ì/Ë åÄ2
O¦ôl|é¼PHÍÏ^YMJåqù0qhULà]
cLµaYpÒÆîPº’³@h°0T,²ÿÊòRé²YÊKík4vòÒÂBföoÝÚwUé
ÖhnUXãñÖ¦u¡Ä,ź²ÎÜÂrÀú~xLß±m§G¢’)®RÇ’+øTW¬QK廨d*)^OÕík2 M|lÍ 3Æ®@¶á°ý[ɶ¾ZRº5XÖx|ÂZKK^(-Ëæ§RzFªÿö¤pSó
>W ô*ÂQ¸{Ö¨äÀÜWe¦ÏmÝÍ¥pIE
A*U§2wM*>1U^¼ OçR¤©ÊdìU¸ð8´FET¬Feç¤â£«ónd¸óº:ÉÜo-[·F¶ ÂBZ£R`A¡jd]f)Ñ
o% »LKxªW£R`I}½»LpÂëT
ì2¦¡íR£R`QùªD
èúäÛ§U*tµ!®î»
²®bÄêE%fp
endstream
endobj
23 0 obj
>/F 4/Dest[ 24 0 R/XYZ 40 794 0] /StructParent 3>>
endobj
24 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 66 0 R/Group>/Tabs/S/StructParents 15>>
endobj
25 0 obj
>/F 4/Dest[ 24 0 R/XYZ 40 388 0] /StructParent 4>>
endobj
26 0 obj
>/F 4/Dest[ 28 0 R/XYZ 40 794 0] /StructParent 5>>
endobj
27 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 71 0 R/Group>/Tabs/S/StructParents 16>>
endobj
28 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 83 0 R/Group>/Tabs/S/StructParents 17>>
endobj
29 0 obj
>/F 4/Dest[ 32 0 R/XYZ 40 794 0] /StructParent 6>>
endobj
30 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 95 0 R/Group>/Tabs/S/StructParents 18>>
endobj
31 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 99 0 R/Group>/Tabs/S/StructParents 19>>
endobj
32 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 105 0 R/Group>/Tabs/S/StructParents 20>>
endobj
33 0 obj
>/F 4/Dest[ 32 0 R/XYZ 40 581 0] /StructParent 7>>
endobj
34 0 obj
>/F 4/Dest[ 32 0 R/XYZ 40 131 0] /StructParent 8>>
endobj
35 0 obj
>/F 4/Dest[ 40 0 R/XYZ 40 794 0] /StructParent 9>>
endobj
36 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 106 0 R/Group>/Tabs/S/StructParents 21>>
endobj
37 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 112 0 R/Group>/Tabs/S/StructParents 22>>
endobj
38 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 113 0 R/Group>/Tabs/S/StructParents 23>>
endobj
39 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 119 0 R/Group>/Tabs/S/StructParents 24>>
endobj
40 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 123 0 R/Group>/Tabs/S/StructParents 25>>
endobj
41 0 obj
>/F 4/Dest[ 50 0 R/XYZ 40 476 0] /StructParent 10>>
endobj
42 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 124 0 R/Group>/Tabs/S/StructParents 26>>
endobj
43 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 128 0 R/Group>/Tabs/S/StructParents 27>>
endobj
44 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 132 0 R/Group>/Tabs/S/StructParents 28>>
endobj
45 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 141 0 R/Group>/Tabs/S/StructParents 29>>
endobj
46 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 145 0 R/Group>/Tabs/S/StructParents 30>>
endobj
47 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 150 0 R/Group>/Tabs/S/StructParents 31>>
endobj
48 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 154 0 R/Group>/Tabs/S/StructParents 32>>
endobj
49 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 156 0 R/Group>/Tabs/S/StructParents 33>>
endobj
50 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 161 0 R/Group>/Tabs/S/StructParents 34>>
endobj
51 0 obj
>/F 4/Dest[ 54 0 R/XYZ 40 500 0] /StructParent 11>>
endobj
52 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 166 0 R/Group>/Tabs/S/StructParents 35>>
endobj
53 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 172 0 R/Group>/Tabs/S/StructParents 36>>
endobj
54 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 177 0 R/Group>/Tabs/S/StructParents 37>>
endobj
55 0 obj
>/F 4/Dest[ 54 0 R/XYZ 40 133 0] /StructParent 12>>
endobj
56 0 obj
>/F 4/Dest[ 57 0 R/XYZ 40 713 0] /StructParent 13>>
endobj
57 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 184 0 R/Group>/Tabs/S/StructParents 38>>
endobj
58 0 obj
>/F 4/Dest[ 65 0 R/XYZ 40 794 0] /StructParent 14>>
endobj
59 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 185 0 R/Group>/Tabs/S/StructParents 39>>
endobj
60 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 186 0 R/Group>/Tabs/S/StructParents 40>>
endobj
61 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 187 0 R/Group>/Tabs/S/StructParents 41>>
endobj
62 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 188 0 R/Group>/Tabs/S/StructParents 42>>
endobj
63 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 189 0 R/Group>/Tabs/S/StructParents 43>>
endobj
64 0 obj
>/XObject>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 190 0 R/Group>/Tabs/S/StructParents 44>>
endobj
65 0 obj
>/ProcSet[/PDF/Text/ImageB/ImageC/ImageI] >>/MediaBox[ 0 0 595.32 841.92] /Contents 198 0 R/Group>/Tabs/S/StructParents 45>>
endobj
66 0 obj
>
stream
xµ[Ko7¾Ðè£D-¾0ÀÌHd `v¢ØbËq´ý÷[U$»Iö-[ÒôLw±ªXõ±ê#çzÿýåó/ÝÍÍõþååáñÓÓÝûëûço¿]ßÿ÷ÛÓõ»¿>¼|~þºÛuÛcw¸??»>ÉÎ÷Þt÷ñÁ?Þ)ÑÎzÓ{ÑÝ9?cÝGüõÓùÙûîò·îþ_çgwððßçgZÙÞ:¸YõªÓ=Sç½Ý÷§ó³ÿÐ}ÝxªFîÆ¡²Q}L-z’J])þww¿»îúºðãÏ·+ß0¡LèýîJÂk£vôç ?nw¥ðµÝqq®é3? Ëw.õ)Þ®èÞbLÂ¥ßéüA]^²t3”w.w£¡Á1ct¶¥%
&Îásçz!Tgè¥Ù”DV3z%Êôzp°ó¬¦îÉL°özÚ©üRL¬3£pÍ{R¨½¬7¬µvÃ|i®MþÖaçàõø)½ÄK^îBÄlQYHÝ·è,ê½u>Aw»ã 3j¶2²A=7½ð
¢ï.ÕÅ÷Ë+yñ¿^ð×Ó¥W¿Ãgøâñ^=}_é%Ti3áml/좷&u30¥5½µ1g5fÌáCð£júÑ4ý¨î¥.Lø)ùê¼ø.¾á/ôÛ3ü,9Þ mr°m:!Ö«ívMeH²^ÈîÜá VÉÓ²je?PÚöB¼×Ö½Kð&P4’³æÂòóáß_Üë¿YCÕ>úÞþßýg£ysÞ8(
0ë´ûmÌÐÔ2#Ò`ZêdC@ }ÞÖmooÀùEo¶©ÊÓ3io£óÂ)µ,à|»7 ¬ÙÖOÜ
G”´ ¾6i ï~¶lðÖÓú|ÿ g©~x’®VA»¶5à:S¢ÌÀDP¸è×íòmsÊθQaVb= UΦê
8«c½hZÙ ØÖüäXhAÑ Ë
ïCà¬
5W÷yvª|0rãÕF*f¤r¦{ï
©É}z]GÙ=E(ÜÓ¨TU39Ü.]ÃXQ¬R_mXyE;ÿ¹SX¼3ÍØ)L)g±:Ö7 z!²M¿cÑgÒív¸/t#7b=mYq £4zæ´ã¬ ÿÂ̧]ø(
í竔ɵÑPöl¤¸j}Kµ±g”mñ+sh£%§ú/òÊοHÓ5íB%ÛÕÃEãbQÆU!²òõ®2Aü*eå!gTÀ°Øæϸ¬ù¢Bï8ÏPÚr*MQ4
föÍe>íÚMW
Ô4¢×ù8]”®/øFD´(D%øÆ&zÖÜØhìdo¦n:ð10ØK%¬¯ðzØù%øô´Él!=«Óëçx/eyï:i§ç Q@áTpqÉe`NpðÚ3§Íó5és@)!6h*e(¥4ß
÷ý¸¾k#è¹¼ÀTÏuDÆ×5F =³Óà*X]8ÔSû*weHªäjUÊ÷¶blëC?Kþu
ToKý*ëª}{uôv¦4nu5³û{Ðr5¦Rfl
ãBÈMRÊýÿ¹SqѪ$
,qYÇkʱü.PóçÙ®
ÑBOF© OgÛ~±T`ÂòXÒñÞ1í¹”, Ãi½È[YÃÒ¬4È&R¸Ü=ã¿8FâÁ&Ñüá;¥¨ÏÖ9JS©2Ø”Em¥>¥p×o¢>.KUÐEEWxîįïG=õDo
ã#±t¥fzÈ&1c=²
qÓC»`RȪ¼¯»Ì-íKÔÔêzfô0Î~Ø®Ä6%Ûª¢pú £.}}Mÿ)f ¸£09-GXgò*QöGT¡aµÛ,ksý´Ò>XÜ”[¥Æ½éÆ_%õl0&ªyÆÓs¢2ÝÉð½KûBõîaF;rý7¿ãOÛKUï*_PuØr=ã%µÍsܪÖ̪ÞF1JCEG®åVVÎr¤Jû êͬÉ3Û|Ú+®{gKåÄB¡¨ Êï½ÚdV×p?úÞ¤ã&áè.ÆÄJT¤©Mñ3D/ã2Åë]
påúEJ
OáÊæý¸ð=¯¡ÌÂýõBå÷o+|2Ý|X¥+A7}G@Ih2ÙOÂÕ SÏWíbD=áßoñÔt¥->Ö¤]ÂÛ´ß*dÎZû1y”ÄU$
(ö²O¹ÍV_ZKÂÓÎ¥²[»ÑÕoQi6õúÂظ¼Òtì/Dd+îúæ¹ùjuXd´!³ÝJÙ{Ö ¿óå/¶1Òò
¯Ã1ït¶Êlßxªå
ΩínÝäÐ;85Ú*M²IGÐM:UµØ¬C;èLuï^sfÈöüÞK7sLGqó”»
6x·¬ð´k
A=Ì¥å©+ç=È6>5Ù]·ä;Îè0jþØѤ¶üïó3Ü=7:,[Ó9Å#È»þùËÃÇ’´ÛçnîOf¶çÛfbÌ&ªÑ´OiDÊÐ:7ºEfû©A¦6;#ô %ÍS6и¬¼¢ã§
WrÊ#û2ınâ&ÚtÌ36wççiµóÃWÑVªeFúêZ84lEÚ¢0OeÇSó!ñdI
y¬Äª7-&ÅA§Qíø]»T.Tûrá`ÍÅùòü«ßëâ±|vÀJCaÁÌòLN¿ÃÆçPïFÒ¯*»²·,Oùÿ»û¨¬
endstream
endobj
67 0 obj
>
endobj
68 0 obj
>
endobj
69 0 obj
>
stream
ÿØÿà JFIF ` ` ÿÛ C
$.’ “,#(7),01444’9=82
Источник
Оглавление темы “Эшерихии. Эшерихиозы. Кишечная палочка. Шигеллы. Дизентерия.”:
1. Диагностика энтеробактерий. Выявление энтеробактерий. Диагностические подходы для энтеробактерий.
2. Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
3. Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.
4. Патогенез поражений кишечной палочкой. Клинические проявления коли инфекции. Кишечные инфекции ( коли-инфекции ). Энтеротоксигенные кишечные палочки.
5. Энтероинвазивные кишечные палочки. Энтеропатогенные эшерихии. Энтерогеморрагические кишечные палочки.
6. Энтероадгезивные кишечные палочки. Уропатогенные эшерихии. Инфекции мочевыводящих путей вызванные кишечной палочкой. Бактериемия эшерихий.
7. Менингит вызванный кишечной палочкой. Респираторные инфекции вызванные эшерихиями ( кишечной палочкой ).
8. Микробиологическая диагностика кишечной палочки. Диагностика кишечной палочки. Выявление эшерихий.
9. Лечение эшерихиозов. Лечение кишечной инфекции. Профилактика эшерихиозов. Профилактика кишечной инфекции.
10. Шигеллы. Дизентерия. Бактериальная дизентерия. Шигеллез. История дизентерии. Серовары шигелл. Серовары возбудителей дизентерии.
Эшерихии. Эшерихиозы. Свойства эшерихий. Кишечная палочка. Escherichia coli. Морфология кишечной палочки. Культуральные свойства кишечной палочки.
Своё название бактерии получили в честь немецкого педиатра Т. Эшериха, впервые выделившего Escherichia coli из содержимого кишечника детей. Род образуют подвижные (перитрихи) прямые палочковидные бактерии размером 1,1-1,5×2,0-6,0 мкм. В мазках они располагаются одиночно или парами. У большинства штаммов существуют капсулы или микрокапсулы.
Температурный оптимум для роста эшерихий 37 °С. Эшерихии ферментируют углеводы с образованием кислоты или кислоты и газа, оксидаза-отрицательны и каталаза-положительны.
Эшерихии входят в состав микрофлоры толстой кишки теплокровных, пресмыкающихся, рыб и насекомых. Эшерихии — основная аэробная микрофлора кишечника, вызывающая, однако, обширную группу заболеваний человека, известных как эшерихиозы.
Эшерихиозы характеризуются не только клиническим полиморфизмом, но и создают особую эпидемиологическую ситуацию. Основное медицинское значение имеет кишечная палочка (Escherichia coli). Кишечные палочки рассматривают как санитарно-показательные микроорганизмы (СПМ) при анализе воды и пищевых продуктов.

Кишечная палочка. Escherichia coli
В настоящее время среди прочих энтеробактерии кишечная палочка — основной возбудитель эшерихиозов у человека.
Морфология кишечной палочки. Культуральные свойства кишечной палочки
Кишечная палочка имеют типичную для энтеробактерий форму и представлены короткими подвижными палочками с закруглёнными концами.
• На плотных средах бактерии образуют плоские выпуклые мутные S-колонии с ровными или слегка волнистыми краями (3-5 мм в диаметре) либо сухие плоские R-колонии с неровными краями.
• В жидких средах растут диффузно, вызывая помутнение среды и образование осадка (реже формируют поверхностную плёнку или пристеночное кольцо).
• На средах Хисса кишечная палочка может образовывать газ. На селективно-дифференциальных средах колонии принимают цвет, соответствующий окраске среды. На агаре Эндо лактоза-положительные эшерихии образуют фукс и ново-красные колонии с металлическим блеском, лактоза-отрицательные — бледно-розовые или бесцветные с тёмным центром. На среде Левина бактерии формируют тёмно-синие колонии с металлическим блеском, а лактоза-отрицательные — бесцветные, на среде Плоскирева — соответственно красные с жёлтым оттенком или бесцветные. На КА могут давать полный гемолиз.
– Также рекомендуем “Биохимические свойства кишечной палочки. Антигены кишечной палочки. Антигенная структура кишечной палочки. Серовары кишечной палочки.”
Источник
На среде Эндо кишечная палочка образует круглые, выпуклые, гладкие колонии малиново-красного цвета с металлическим блеском. Среда Эндо — это дифференциально-диагностическая среда, которая кроме питательной основы, среда содержит 1% лактозу и насыщенный спиртовой раствор основного фуксина. Свежеприготовленная среда Эндо бесцветна или слегка розовая. При росте на этой среде кишечная палочка разлагает лактозу, образуются кислые продукты, они восстанавливают фуксин из бесцветного соединения в красный и поэтому вырастают колонии, окрашенные в малиново-красный цвет.
3. Изучить развёрнутую реакцию агглютинации с “живой” и “гретой” культурой при идентификации возбудителя колиэнтеритов.
Метод диагностики: бактериологический
Ингредиенты реакции: бактериальная суспензия (взвесь бактерий в физиологическом растворе), диагностические сыворотки, содержащие антитела к О55 и К11 антигенам, физиологический раствор.
Постановка: Диагностические сыворотки разводят в двух рядах, используя физиологический раствор. Для приготовления бактериальной суспензии добавить культуру с поверхности питательной среды в 3-5 мл физиологического раствора, разлить взвесь в 2 стерильные пробирки. Одну из них прогреть на водяной бане при 100°С в течение часа. В первый ряд добавляем несколько капель «живой» бактериальной суспензии, во второй ряд добавляем несколько капель бактериальной суспензии, «гретой» на водяной бане. Инкубируем в термостате 24 часа и учитываем результат.
Учет реакций агглютинации: Положительный результат — образование белого зонтика, отрицательный образование белой пуговки. Реакция считается положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а с живой не менее, чем 1:200 (диагностический титр реакции). Если реакция положительна, то выдают ответ в следующей формулировке “Выделена патогенная кишечная палочка серовара О55:К11.
Учесть биохимические свойства E. coli.
Ингредиенты: Среда Ресселя, которая содержит лактозу и глюкозу и пестрый ряд Гиса, состоящий из пяти углеводов. Кроме питательной основы и углевода к среде добавлен индикатор. Исходный цвет среды розовый, при образовании кислоты цвет среды становится синим. Газообразование улавливают с помощью поплавков-коротких стеклянных трубочек, запаянных с одного конца, помещенных в питательную среду, открытым концом вниз. Образование индола и сероводорода определено с помощью индикаторных бумажек. При образовании индола индикаторная бумажка, пропитанная насыщенным раствором щавелевой кислоты, розовеет. При образования сероводорода индикаторная бумажка, пропитанная уксуснокислым свинцом, чернеет.
Постановка: Пересев колоний со среды Ресселя на ряд Гиса и МПБ и инкубация 24 часа в термостате.
Биохимические изменения на пестром ряду с посевом кишечной палочки
| Лактоза | Глюкоза | Маннит | Мальтоза | Сахароза | МПБ | |
| Индол | Сероводород | |||||
| До кислоты и газа | До кислоты и газа | До кислоты и газа | До кислоты и газа | – | + | – |
Таким образом, для кишечной палочки характерна ферментация лактозы, глюкозы, мальтозы и маннита с образованием кислоты и газа, отсутствие ферментации сахарозы и образование индола.
Заполнить таблицу «Заболевания, вызываемые диареегенными E. сoli».
Решение ситуационных задач
III модуль «Кишечные инфекции»
Занятие № 2
ТЕМА: Микробиологическая диагностика дизентерии, брюшного тифа, паратифов А и В, сальмонеллезных гастроэнтеритов
ЦЕЛЬ ЗАНЯТИЯ: знать таксономию, основные свойства возбудителей, эпидемиологию, микробиологическую диагностику, принципы профилактики и лечения
уметь:учитывать характер роста на средах Эндо, Левина возбудителей дизентерии, ставить реакцию агглютинации на стекле, делать пересев на среду Ресселя, учитывать их биохимические свойства и реакцию агглютинации с парными сыворотками, реакцию Видаля
Задание на дом
1. Вопросы для самоподготовки:
1) Характеристика биологических свойств и особенности микробиологической диагностики дизентерии.
2) Характеристика биологических свойств и особенности микробиологической диагностики брюшного тифа, паратифов А и В.
3) Характеристика биологических свойств и особенности микробиологической диагностики сальмонеллёзных гастроэнтеритов.
Источник
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
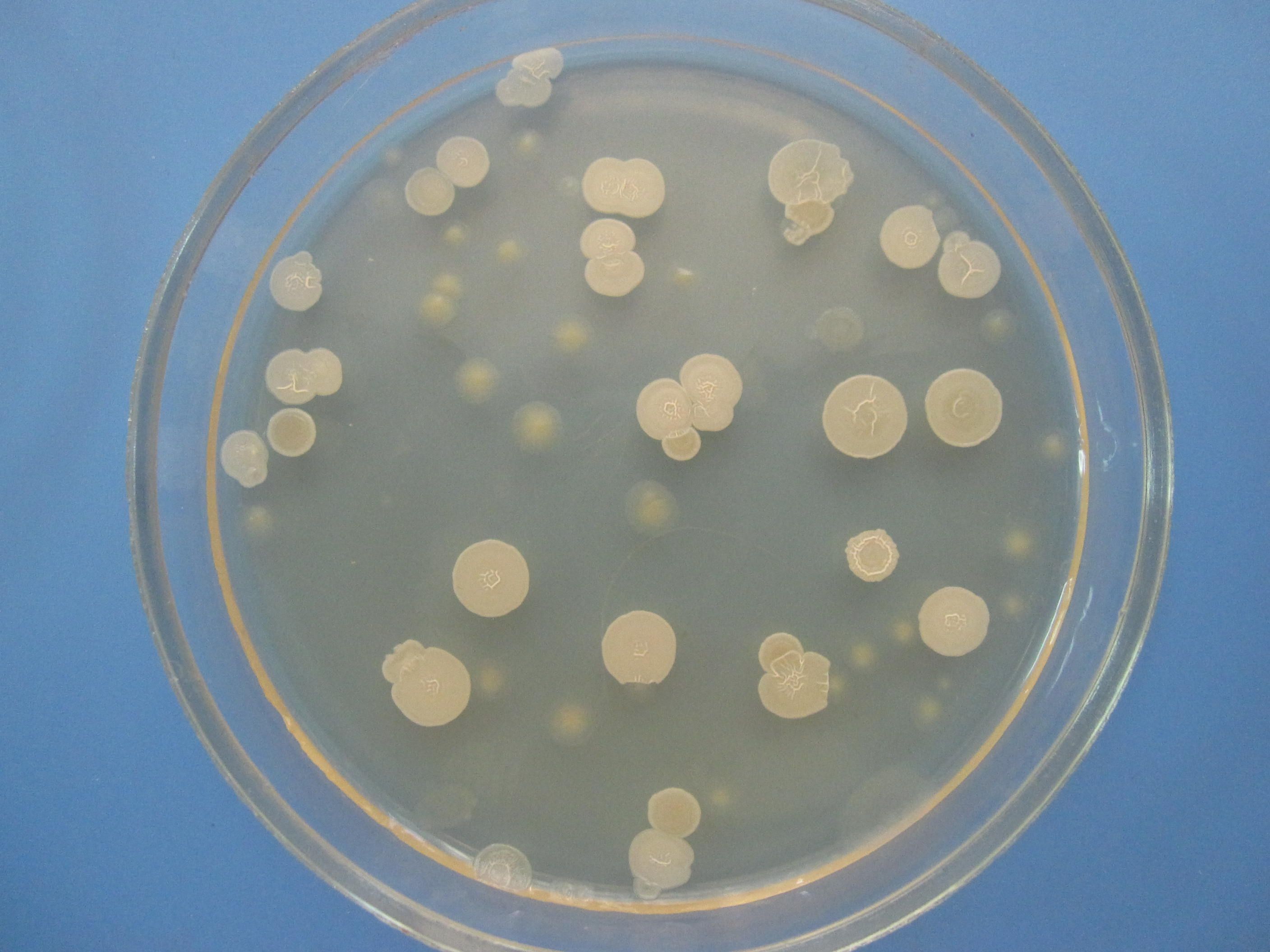 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
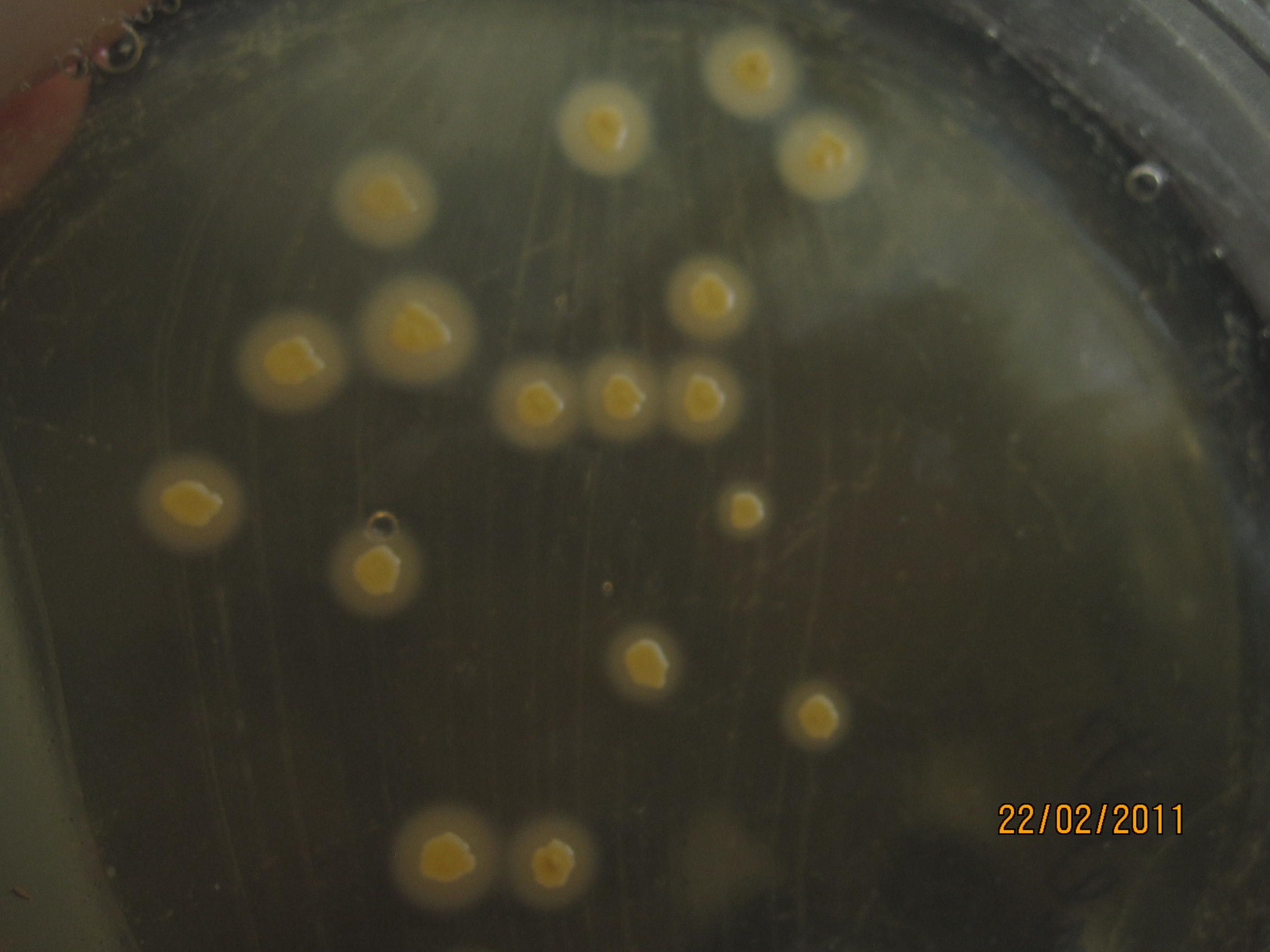
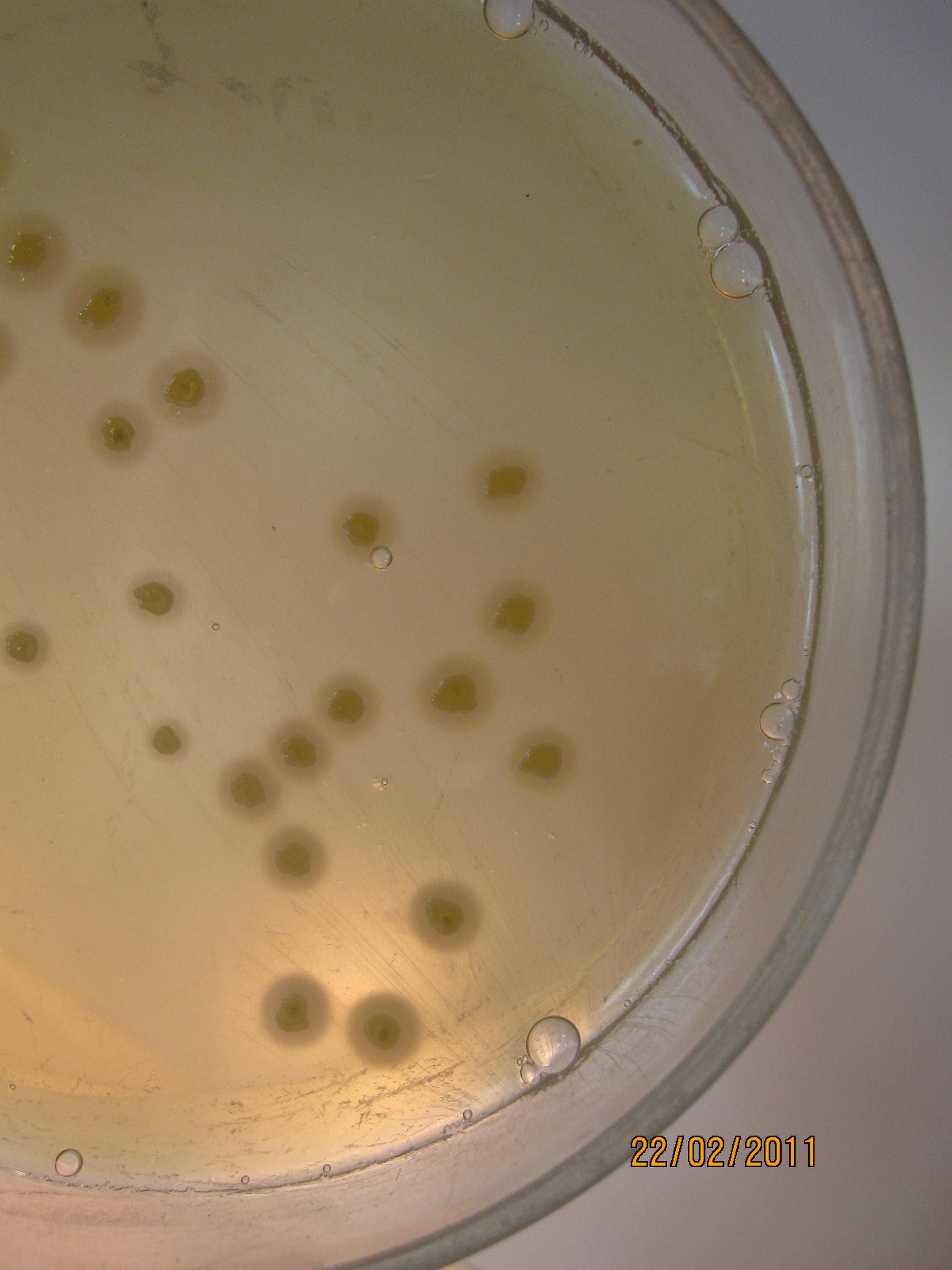 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
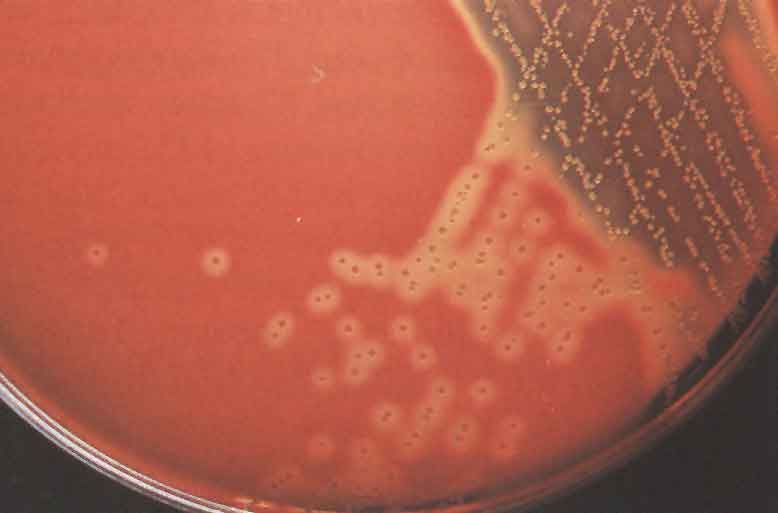
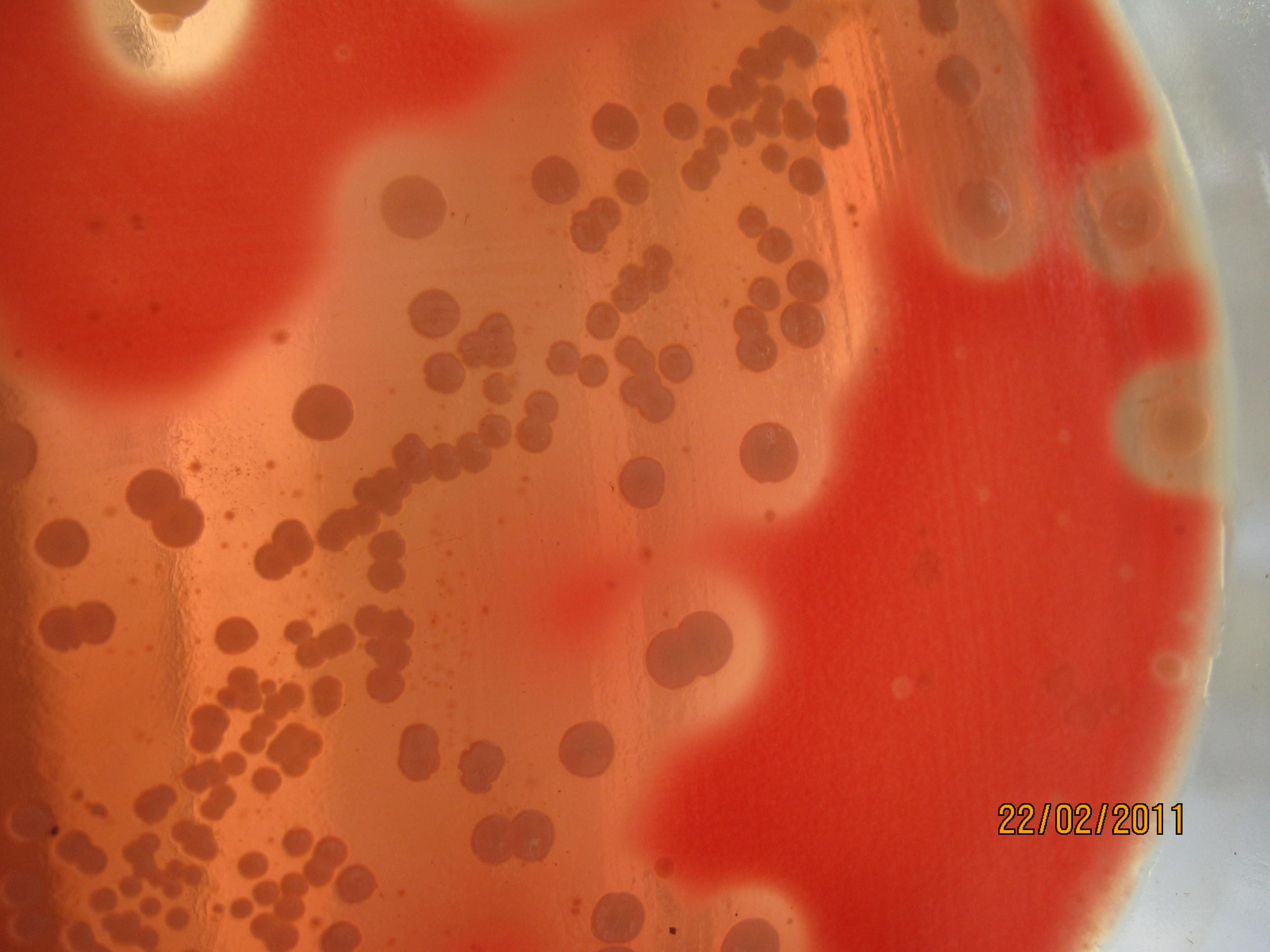
 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
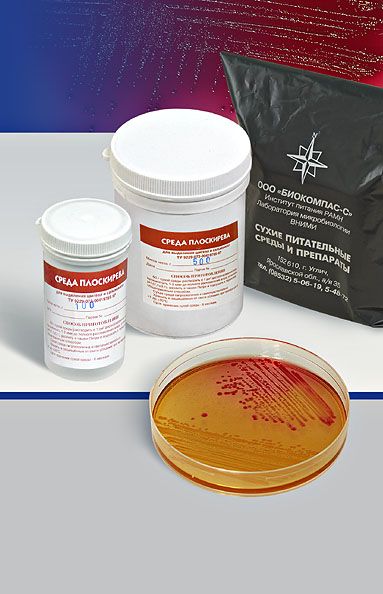
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
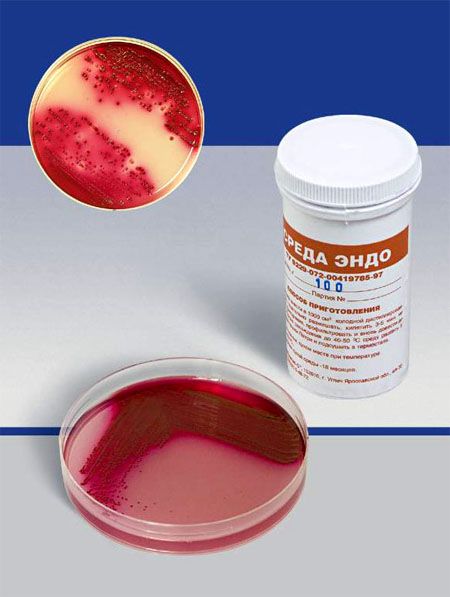
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
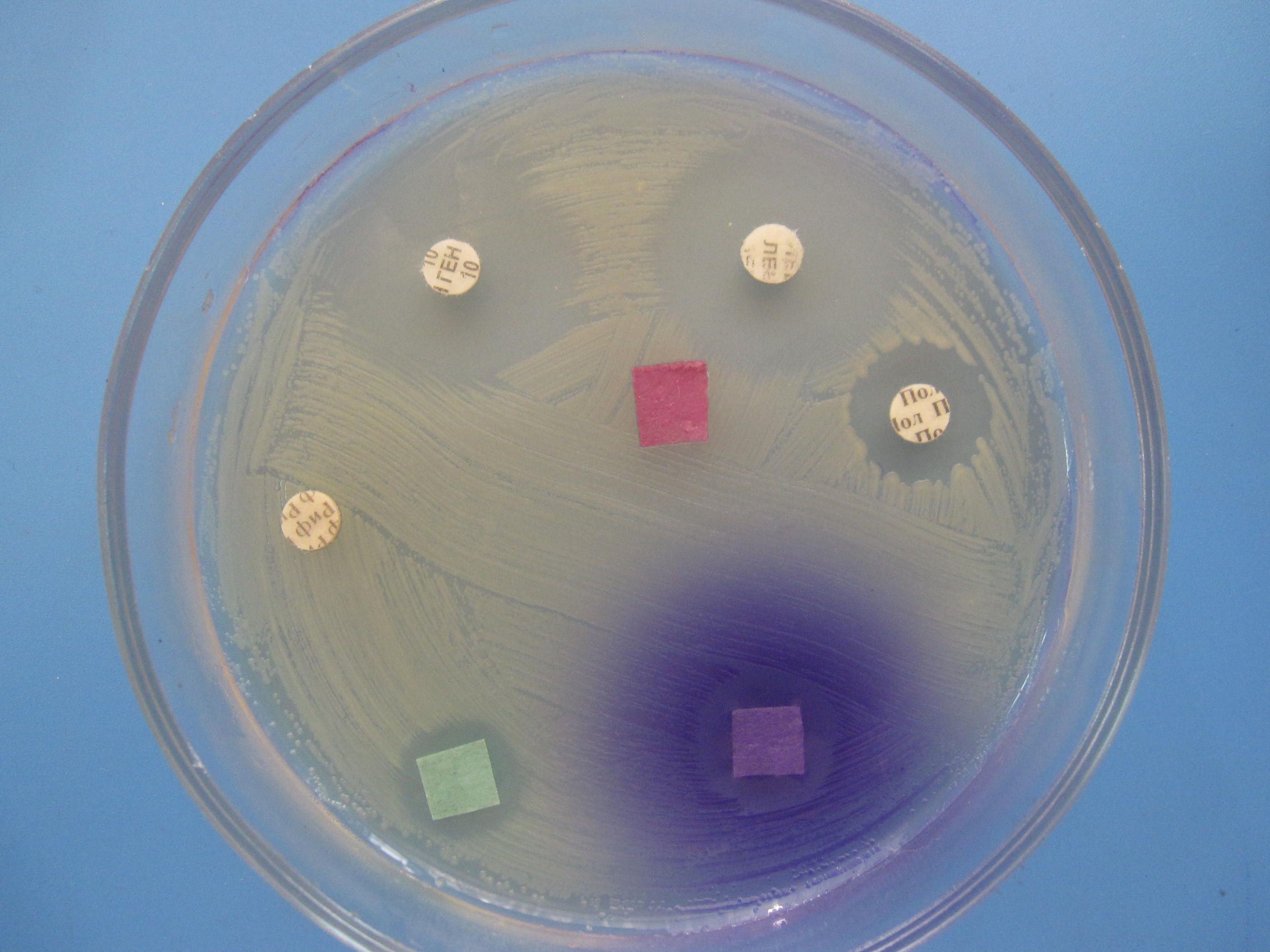 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
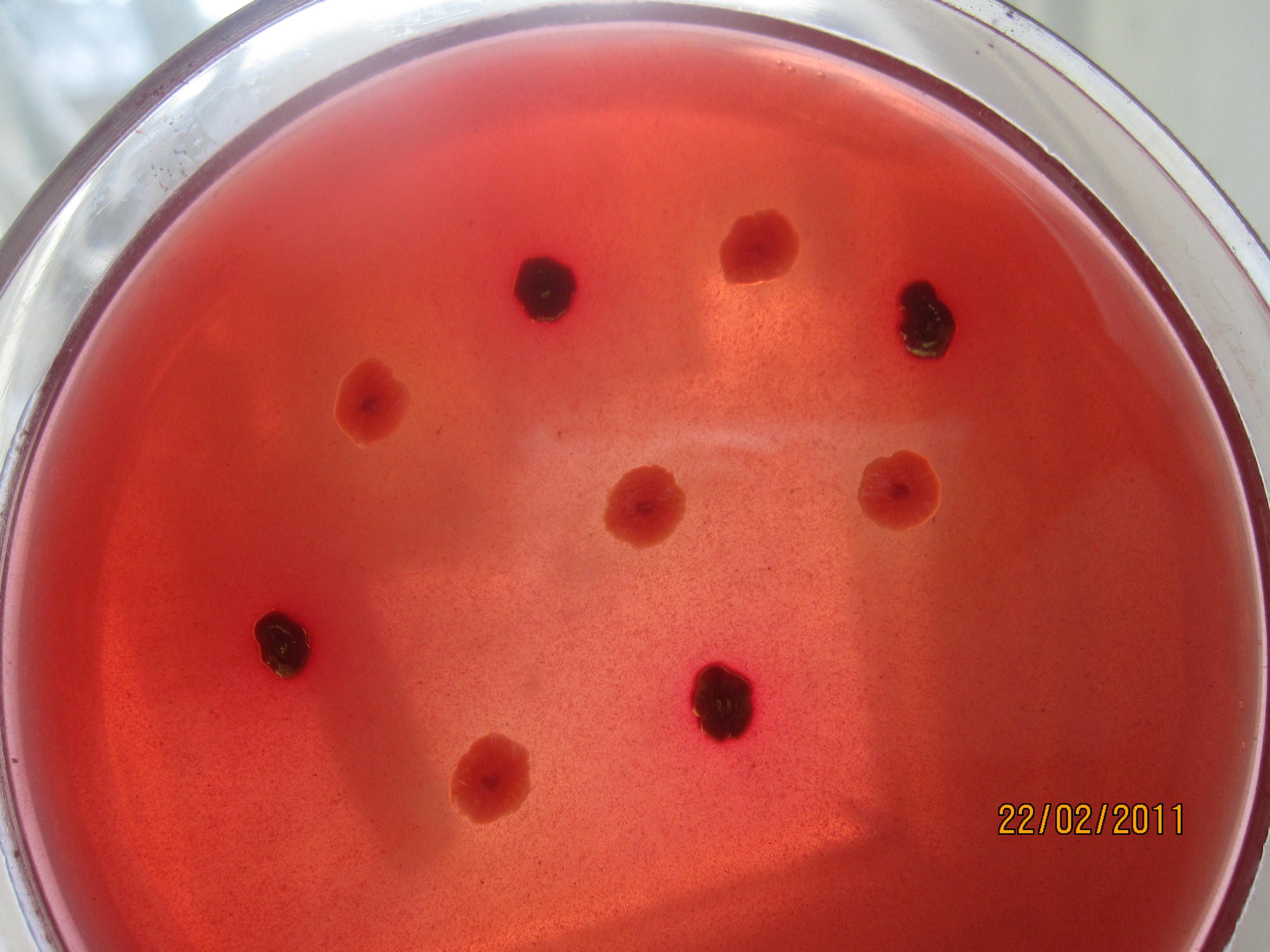
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
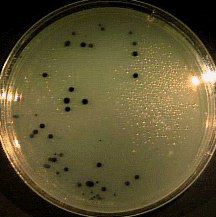
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
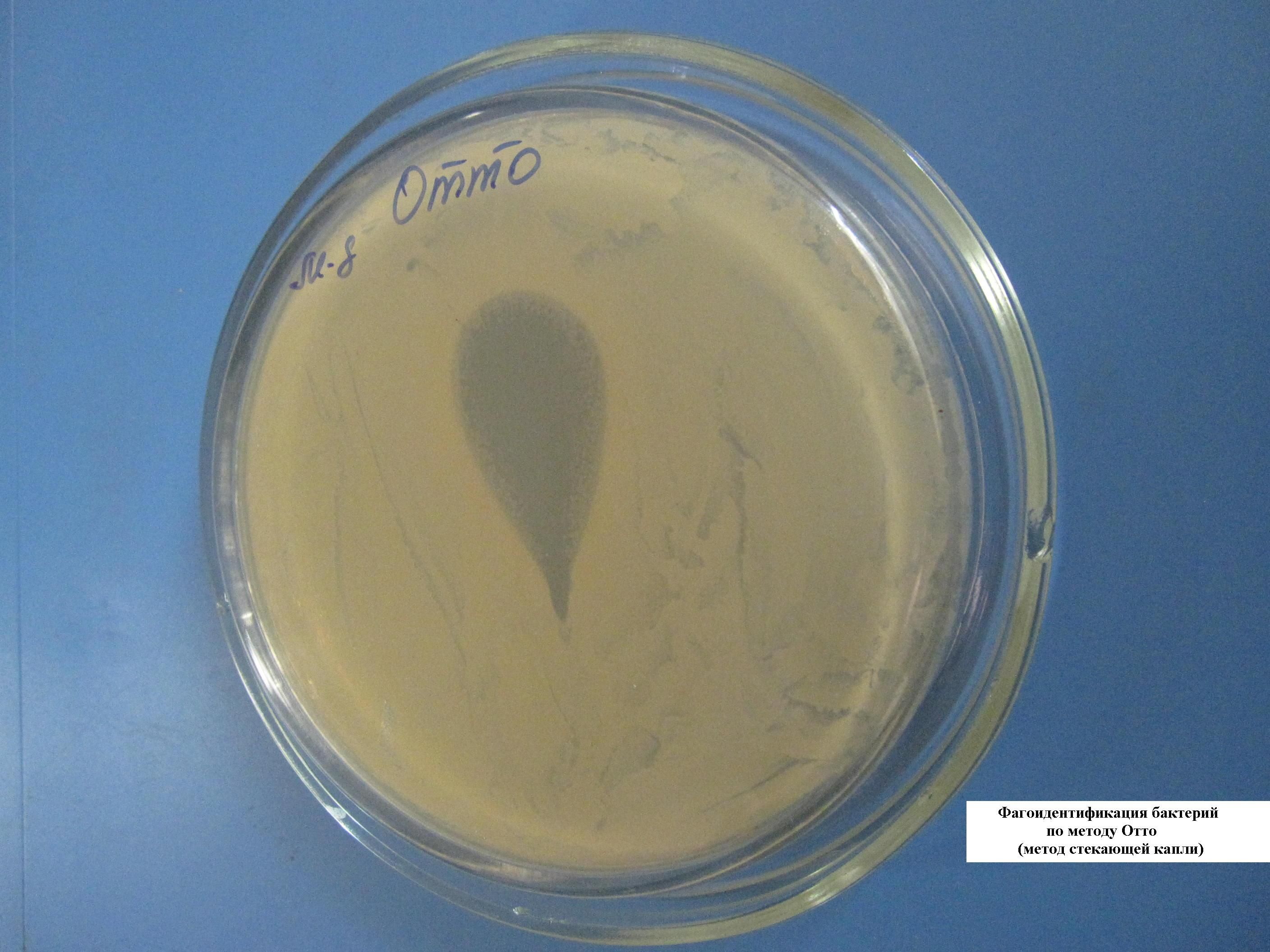
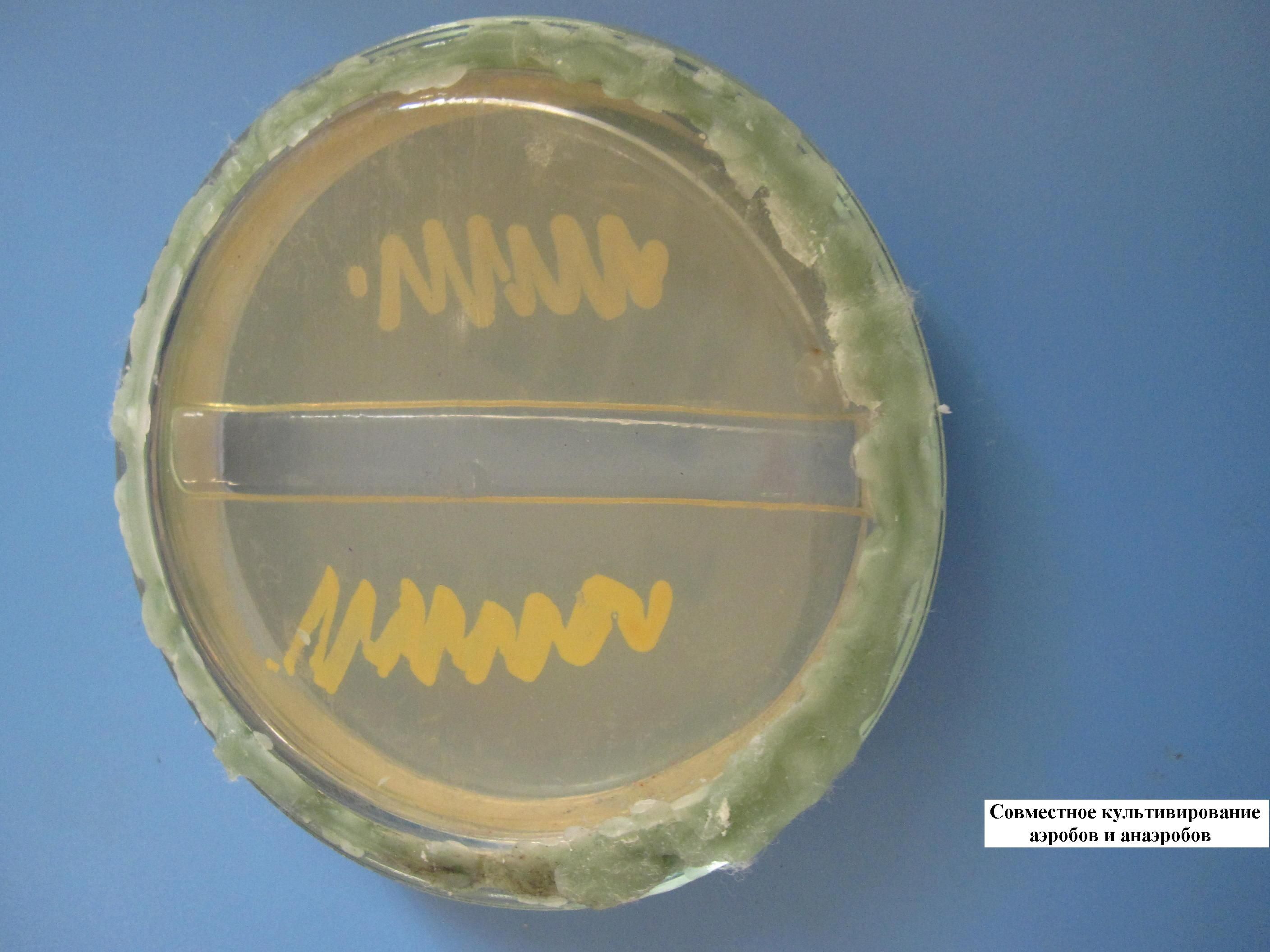 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
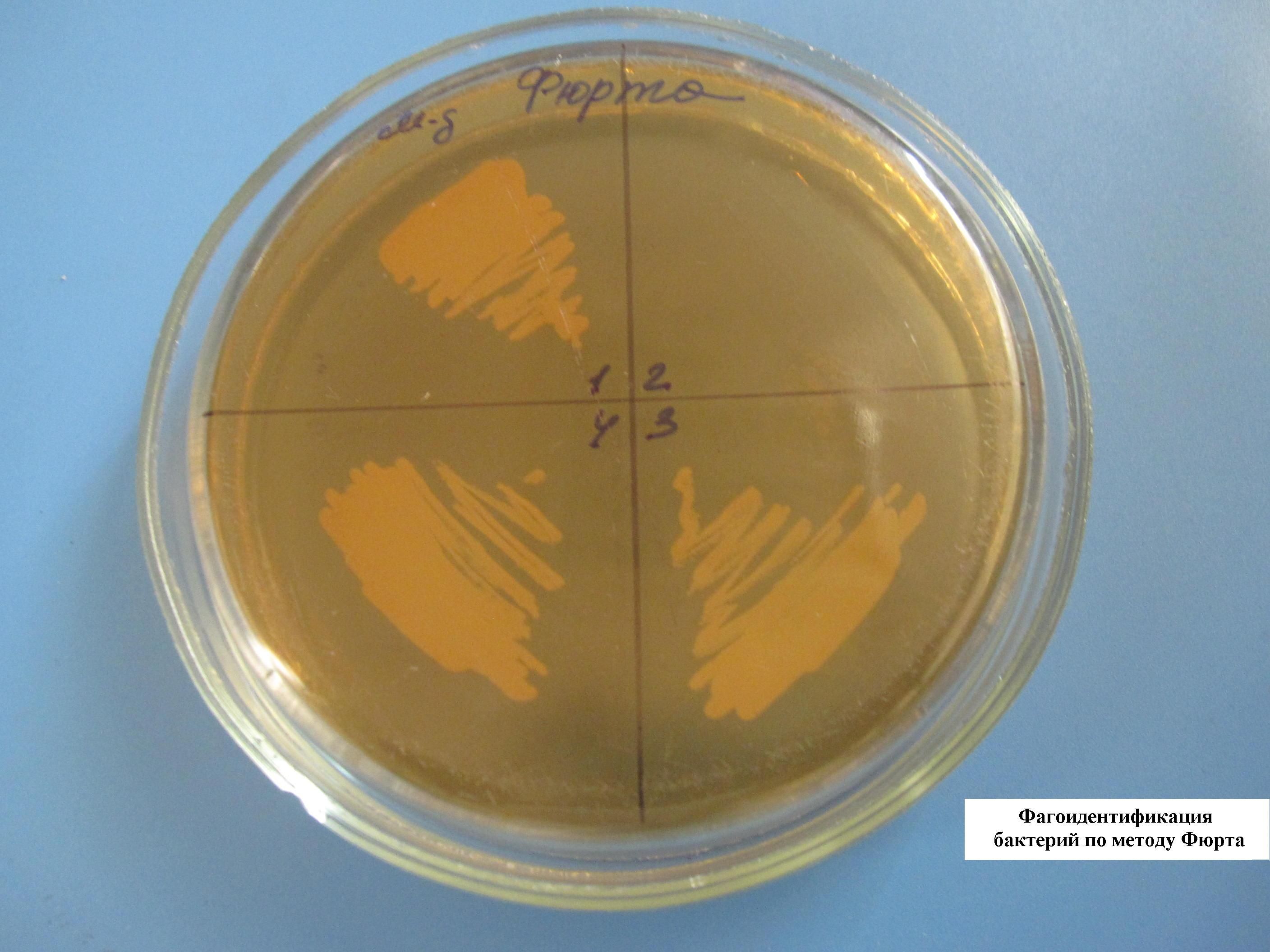 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
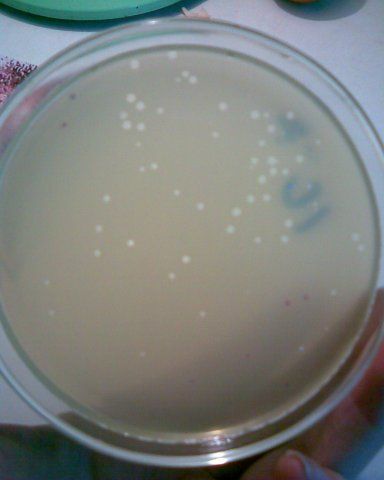 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
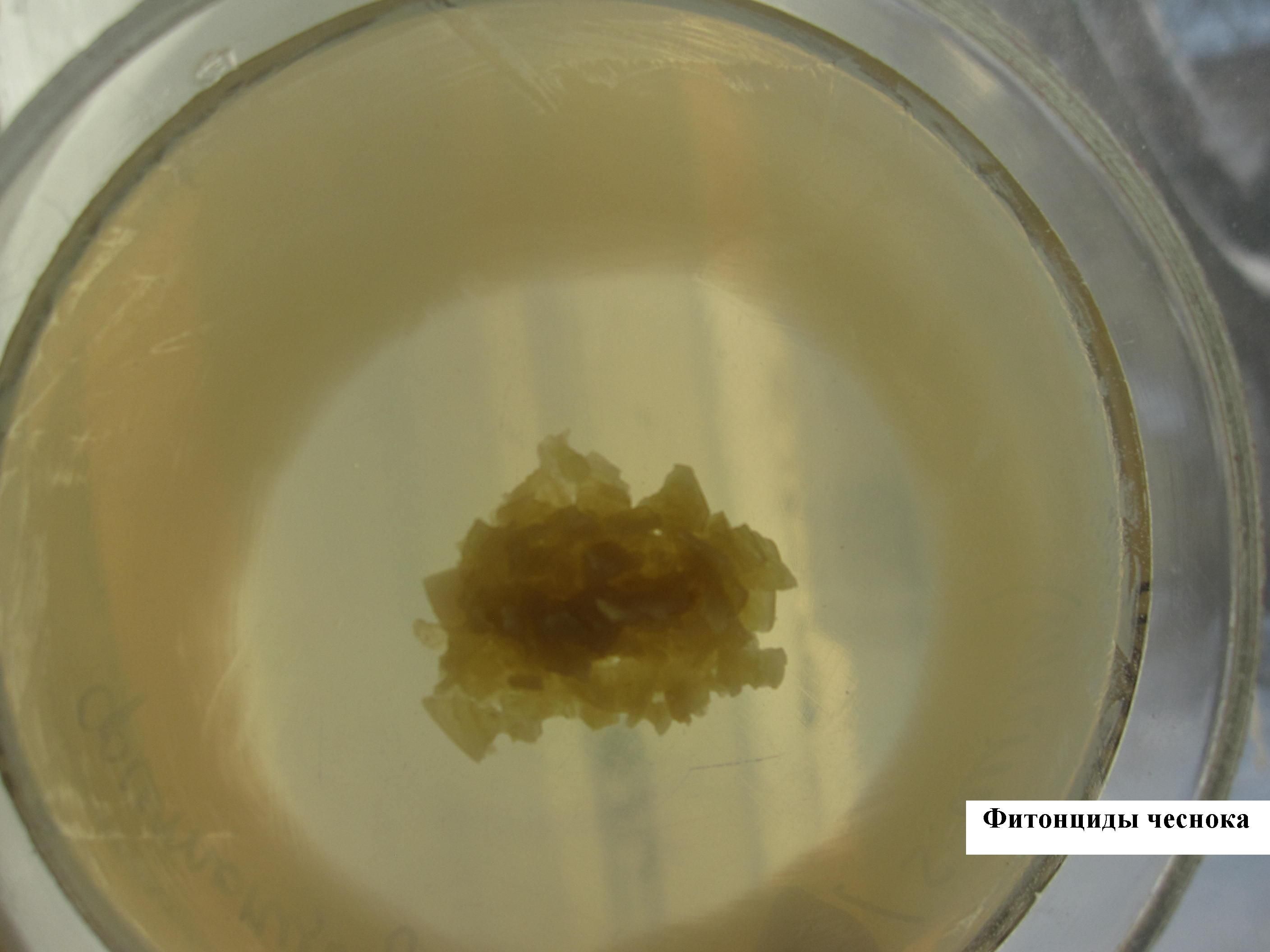 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник