Среда олькеницкого кишечная палочка

| Вид микроба | Лактоза | Глюкоза | Маннит | Мальтоза | Сахароза | МПБ | |
| Индол | Сероводород | ||||||
| E. coli | КГ | КГ | КГ | КГ | – | + | – |
Примечание: К Г – ферментация углевода сообразованием кислоты и газа, (–) – отсутствие ферментации или образования
Ферментативная активность изучена на пестром ряду. Кроме питательной основы и углевода к среде добавлен индикатор бромкрезолпурпур. Исходный цвет среды фиолетовый, при образовании кислоты цвет среды становится желтым. Газообразование улавливают с помощью поплавков – коротких стеклянных трубочек, запаянных с одного конца, помещенных в питательную среду, открытым концом вниз. Образование индола определено с помощью реактива Ковача: при положительной реакции конец бумажки окрашивается в малиново-розовыйцвет.
4. Знакомство со схемой лабораторного диагноза эшерихиоза по схеме(зарисовать табл.3)
Среди кишечных палочек встречаются представители, которые способны вызывать заболевания кишечника, варьирирующие от умеренной диареи до тяжелого холероподобного заболевания. В основном заболевания возникают у детей 1 года жизни, но могут возникать также у детей старшего возраста и взрослых.
Кишечные палочки, вызывающие поражения кишечника, разделяют на три группы:
1. Энтеропатогенные кишечныепалочки (ЭПКП)– поражают детей первого года жизни, особенно часто в коллективах (серогруппы 026,055, 0111 и др.)
2. Энтеротоксигенные кишечные палочки (ЭТКП)– поражают детей старше года и взрослых людей (серогруппы 01,05,06 и др.). Эта группа кишечных палочек характеризуется способностью продуцировать энтеротоксин, который реагирует с аденилциклазной системой клеток эпителия слизистой тонкого кишечника, нарушает их функции вызывает холероподобные заболевания.
3. Энтероинвазионные кишечные палочки (ЭИКП)– поражают детей старше года и взрослых людей (серогруппы 025,0124 и др.) Эта группа кишечных палочек обладает способностью к инвазии в клетки слизистой оболочки толстой кишки и вызывает дизентериеподобные заболевания.
Помимо перечисленных заболеваний, которые могут принимать эпидемический характер, кишечные палочки могут вызывать аппендицит, перитонит, цистит, пиелонефрит и т.д. В последние годы нередко кишечные палочки самостоятельно или в ассоциациях с другими бактериями вызывают внутрибольничные инфекции в хирургических, педиатрических стационарах и др.
Кишечные палочки, выделяемые от больных различными заболеваниями, как кишечной, так и не кишечной локализации, невозможно различить от представителей нормальной микрофлоры ни по морфологическим, ни по культуральным свойствам. Дифференциация их проводится на основе антигенной структуры.
Главной особенностью ЭПКП является антигенная структура, постоянная и характерная для каждого штамма. Учитывают соматический 0-антиген, соматический К-антиген и жгутиковый Н-антиген.
Общепризнано, что поставить клинический диагноз острой кишечной инфекции нельзя. Обязательна постановка лабораторного диагноза. Основным в лабораторной диагностике является бактериологический диагноз.
Исследуемый материал: испражнения, рвотные массы.
Испражнения в количестве 3–5 гр. помещают в пробирку с изотоническим раствором хлорида натрия или глицериновой смесью. Целесообразно брать последние порции, т.к. при колиэнтеритах поражается тонкий кишечник. У грудных детей материал для исследования берут с пеленок. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя. Рекомендуется забор материала сделать до начала лечения.
Бактериологический метод. Бактериологический диагноз основан на выделении чистой культуры и определении её серовара.
Исследуемый материал засевают на среду Эндо, предварительно разведя его физ. раствором. Через сутки изучают колонии, выросшие на среде. Кишечные палочки вырастают на среде Эндо в виде малиново-красных колоний с металлическим блеском или без него. Отбор колоний патогенных кишечных палочек проводят с помощью ориентировочной реакции агглютинации с диагностической сывороткой. Употребляют смесь ОКБ – сывороток против патогенных кишечных палочек, соединяя не более 5 сывороток. Для постановки ориентировочной реакции агглютинации исследуют не менее 10 колоний. Если ни одна из них не агглютинирует, дают ответ: “Патогенные кишечные палочки не обнаружены”. Из колоний с положительной реакцией агглютинации делают посев в пробирки со средой Олькеницкого (Клиглера) или скошенным агаром и ставят в термостат на 18–20 часов.
На следующий день (3 день исследования) просматривают посевы на среде Олькеницкого и скошенном МПА. Состав среды Олькеницкого (трехсахарная среда с мочевиной): к 100 г МПА расплавленного и охлажденного добавляют I г лактозы, I г сахарозы, 0,1 г глюкозы, I г мочевины, 0,02 г соли Мора, 0,03 г гипосульфита и индикатор ВР (водный голубой и розоловая кислота). Среду разливают так, чтобы был столбик и скошенная поверхность. Посев культуры делают штрихом на скошенную поверхность и уколом в глубину столбика. Ферментация глюкозы происходит в анаэробных условиях (её в среде мало), в этом случае цвет изменится только в столбике (среда посинеет). При ферментации лактозы или сахарозы среда посинеет как в столбике, так и на скошенной поверхности. При разложении мочевины (рН сдвигается в щелочную сторону) цвет среды станет оранжевым. Газообразование определяют по разрывам среды. При образовании сероводорода среда чернеет.
На скошенном МПА энтеропатогенные кишечные палочки образуют влажный блестящий сероватый налет.
На среде Олькеницкого кишечная палочка вызывает посинение среды, как в столбике, так и на скошенной поверхности, наблюдаются разрывы среды пузырьками газа (ферментация лактозы и глюкозы до кислоты и газа). Выделенную культуру проверяют в реакции агглютинации на стекле сначала с той же смесью сывороток, а затем раздельно с каждой сывороткой, входящей в смесь.
При отсутствии реакции агглютинации дают отрицательный ответ. При положительной реакции агглютинации необходимо подтвердить принадлежность выделенной культуры к роду кишечных палочек. Для этого культуру засевают на жидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, в пробирку с МПБ для обнаружения индола и сероводорода, определяют подвижность.
Для окончательной идентификации выделенной эшерихии ставят развернутую реакцию агглютинации с типовой коли-ОКВ-сывороткой. Реакцию ставят с живой культурой для установления К-антигена и с гретой культурой для установления О-антигена.
По результатам пестрого ряда и развернутой реакции агглютинации может быть дан окончательный ответ.
Серологическая диагностика при кишечных инфекциях используется для подтверждения этиологического значения выделенных эшерихий, заподозренных в качестве возбудителя, в научно-исследовательских целях для изучения патогенеза и иммунитета кишечных заболеваний.
Основана она на обнаружении антител в сыворотке крови. Обнаруживают О-антитела в реакции агглютинации, используя в качестве антигена культуру, выделенную от больного и кипяченую в течение 2 часов. Положительная реакция проявляется непостоянно, титр антител невысокий – ниже 1:100. В-антитела не обнаруживаются.
Можно использовать реакцию пассивной гемагглютинации, которая более чувствительна. В качестве диагностикума используют эритроциты барана, сенсибилизированные смывом 48-часовой культуры, кипяченой 2 часа. Следовательно, в РПГА также выявляют только О-антитела. Эта реакция позволяет отличить больных от людей, выделяющих энтеропатогенные кишечные палочки без клинических проявлений болезни. У последних антитела не обнаруживаются.
Ускоренные методы лабораторной диагностики. Классическое бактериологическое исследование длится 4–5 дней. Это не всегда устраивает и клиницистов и эпидемиологов, поэтому прилагается много усилий, чтобы сократить время исследования и ускорить ответ лаборатории. Для решения этой проблемы предложено использовать наиболее рациональные питательные среды, сокращать интервалы между исследованиями, а также применять методы, основанные на определении антигенной структуры кишечных палочек. Наиболее чувствительным и быстрым методом является метод иммунофлюоресценции, основанный на обнаружении специфического антигена кишечных палочек в исследуемом материале с помощью флюоресцирующих антител.
Этапы бактериологического исследования
при подозрении на эшерихиоз
Первый день
1. Сделать посев испражнений больного на среду Эндо. Для этого взять немного материала пипеткой и эмульгировать его в физиологическом растворе или глицериновой смеси, каплю эмульсии нанести на среду Эндо петлей или пипеткой. Стерильным шпателем растереть каплю на небольшом участке среды, затем, не прожигая шпатель, втереть оставшийся на нем материал по всей поверхности. Чашки с посевом поставить в термостат на 24 часа.
Второй день
2. Изучить посевы на среде Эндо, описать выросшие колонии.
Отобрать малиново-красные колонии с металлическим блеском или без него с помощью ориентировочной реакции агглютинации (не менее 10). Для постановки реакции стерильной петлей взять часть колонии и смешать с каплей агглютинирующей диагностической поливалентной сыворотки. Поливалентные сыворотки готовят в производственных условиях, они содержат антитела к нескольким сероварам эшерихий из одной серологической группы. При положительной реакции агглютинации оставшуюся часть колоний отсеять на скошенный агар или среду Олькеницкого. Если же ни одна из десяти колоний не дала агглютинации, выдать отрицательный ответ.
Третий день
3. Изучить посевы на скошенном агаре и среде Олькеницкого.
3.1. Поставить ориентировочную реакцию агглютинации на стекле с поливалентной сывороткой. Если реакция агглютинации положительна, поставить реакцию агглютинации на стекле с каждой типовой сывороткой, входящей в поливалентную.
3.2. Подтвердить принадлежность выделенной культуры к эшерихиям. Для этого изучить ферментативные свойства, сделав посев на жидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой. Сделать также посев на МПБ для определения образования индола и сероводорода.
3.3. Провести окончательную серологическую идентификацию культуры. Для этого поставить развернутую реакцию агглютинации с живой и гретой культурой. Диагностическую типовую сыворотку разводят от 1:100 до титра сыворотки, указанного на этикетке. Из разведений приготовить два ряда пробирок. Приготовить антиген. Для этого смыть культуру с поверхности среды 3–5 мл физиологического раствора, разлить взвесь в 2 стерильные пробирки. Одну из них прогреть на водяной бане при 100°С в течение часа. В первый ряд разведений сыворотки внести по 2 капли живой культуры, во второй – по 2 капли гретой культуры. После встряхивания пробирки поместить в термостат на 18–20 часов.
Четвертый день
Учет результатов. Заключение по исследованию
4.1. Просмотреть посевы на пестром ряду. Для кишечной палочки характерна ферментация лактозы, глюкозы, мальтозы и маннита с образованием кислоты и газа, отсутствие ферментации, сахарозы, образование индола. Учет реакции агглютинации провести с помощью лупы. Агглютинация с живой культурой крупнохлопчатая (Н-агглютинация), с убитой – мелкозернистая (О-агглютинация).
Таблица 3
Источник
#Трёхсахарный_агар_Олькеницкого
(трехсахарный железистый агар (TSI-агар)).
Это плотная среда желтовато-розового цвета, скошенная в пробирке так, чтобы на дне оставался столбик высотой около 3-х см. Агар Олькеницкого – комбинированная питательная среда, содержащая глюкозу, лактозу, сахарозу, мочевину, а также соль Мора – сернокислую соль железа и аммония. Пересев на 3-х сахарный агар делают особым образом. Бактериологической петлей или запаянной пастеровской пипеткой наносят микробную взвесь на поверхность скошенной среды в пробирке штрихом снизу вверх, а затем делают 1-2 прокола на всю глубину среды до дна. При росте энтеробактерий среда Олькеницкого изменяется следующим образом:
– бактерии, расщепляющие лактозу и сахарозу, изменяют цвет всей среды (и столбика, и «скоса») с розового на желтый за счёт появления большого количества кислых продуктов и резкого снижения рН. (Агар Клиглера содержит только два сахара, поэтому по скошенной поверхности учитывают только ферментацию лактозы);
– если ферментируется только глюкоза – желтеет лишь столбик среды, а скос («косяк») остается розовым за счёт подщелачивания поверхности продуктами распада пептона в аэробных условиях;
– при расщеплении мочевины вся среда окрашивается в малиновый цвет. Учёт гидролиза испытуемой культурой мочевины на среде Олькеницкого удобнее проводить через 48 часов культивирования и позднее. При положительном результате среда, ранее изменившая цвет на жёлтый за счёт ферментации сахаров, снова краснеет;
– при выделении любого газа в глубине столбика среды появляются трещины, пузыри, разрывы;
– при выделении сероводорода соль Мора чернеет, в глубине среды появляются пятна черного цвета.
По росту на 3-х сахарном агаре можно провести предварительную дифференциацию энтеробактерий.
1. Pseudomonas aeruginosa (псевдомонада) – изменяет только глюкозу, при этом активно гидролизует мочевину; сероводород не выделяет. Образует зелёный пигмент.
2. Proteus sp., как правило, образует большое количество сероводорода, гидролизует мочевину. Среда приобретает малиново-чёрный цвет.
3. Сальмонеллы, как правило, образуют сероводород, лактозоотрицательны, расщепляют глюкозу и не ферментируют мочевину. Поэтому при их росте 3-х сахарный агар становится трехцветным: скос остается ярко-розовым; столбик приобретает желтый цвет; на дне или в глубине агара среда чернеет.
4. Escherichia coli – кишечная палочка, изменяет все три сахара, сероводород не выделяет, мочевину не расщепляет. Трёхсахарный агар становится жёлтым. имеются пузыри и разрывы среды за счет выделения индола;
5. Enterobacter – использует все три сахара, сероводород не выделяет; по сравнению с эшерихией – пузырей и разрывов среды, как правило, гораздо меньше. Поверхность скоса может подщелачиваться за счёт расщепления пептона;
6. Klebsiella sp. характеризуется вариабельностью биохимических свойств. Сероводород не образует. Лактозу может не изменять или изменять замедленно. Может с разной скоростью (иногда очень быстро, иногда замедленно) гидролизовать мочевину;
7. Serratia sp. сероводород не выделяет, лактозу – не расщепляет. Может вырабатывать ярко-красный пигмент, визуально изменяющий среду;
8. Citrobacter sp. характеризуется выраженной вариабельностью биохимических свойств. Может имитировать рост сальмонелл, эшерихий, энтеробактеров и других энтеробактерий.
Удачной идентификации!
Источник
ПИТАТЕЛЬНЫЕ СРЕДЫ
(для просмотра изображений в полном размере, щелкните по ним правой кнопкой мыши и выберите пункт “ОТКРЫТЬ ИЗОБРАЖЕНИЕ В НОВОЙ ВКЛАДКЕ”)
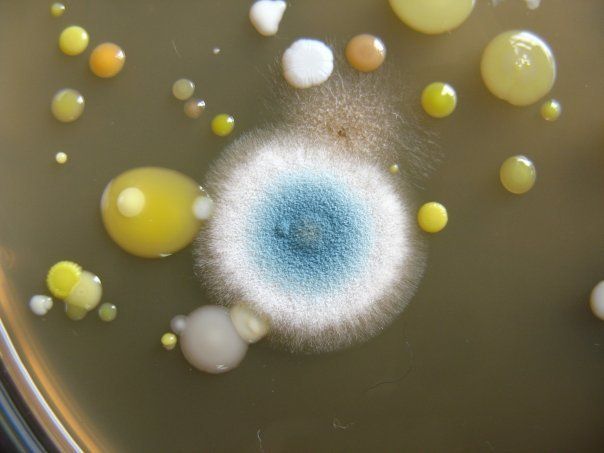
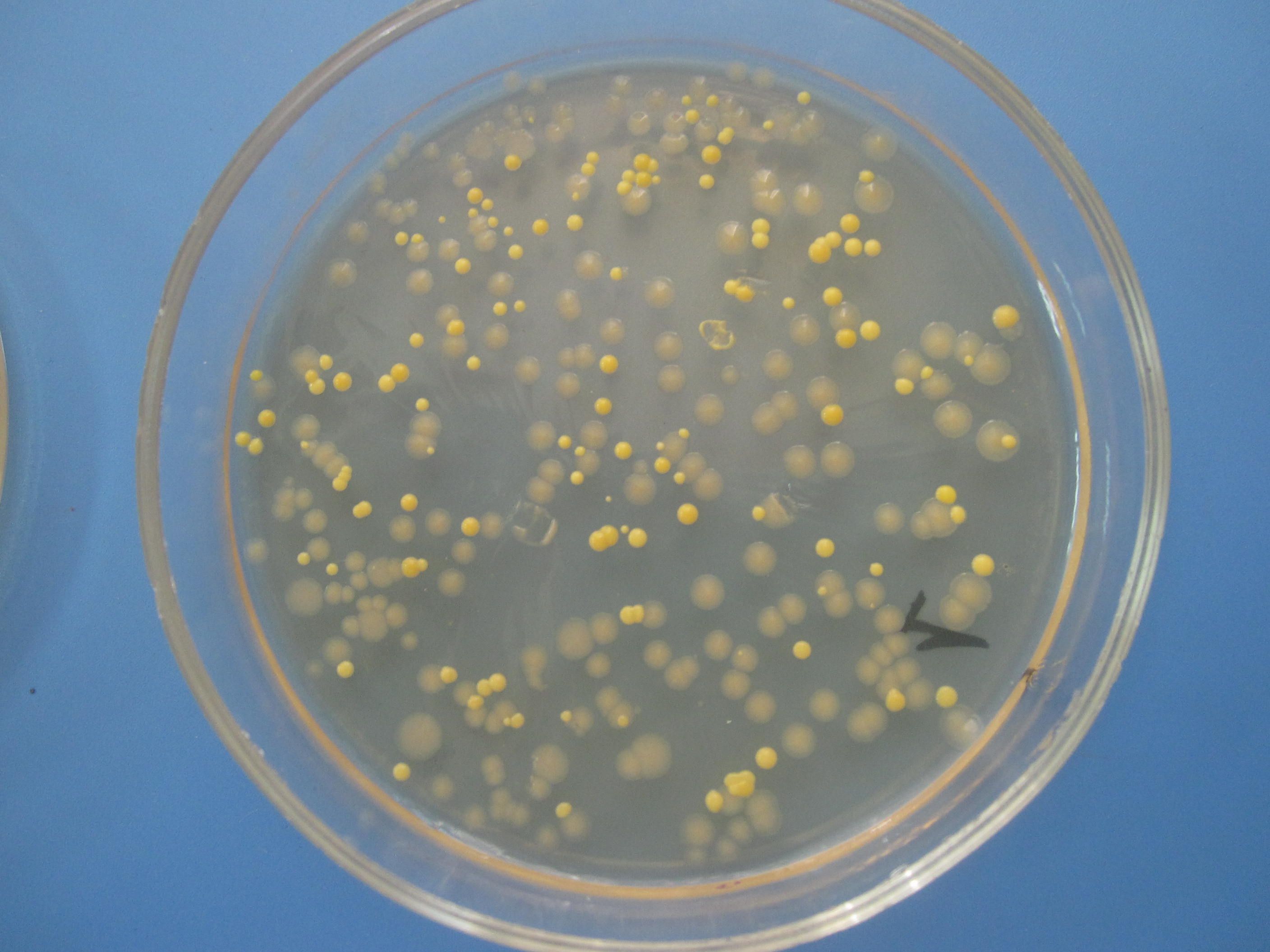
 ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
ПИТАТЕЛЬНЫЙ АГАР используют для выращивания бактерий, содержит гидролизат кильки, экстракт дрожжей, агар, хлорид натрия и дистиллированную воду. Растворяют ингредиенты, кипятят, фильтруют, стерилизуют (120 гр. С 20 минут). Затем разливают в стерильные пробирки или чашки Петри. На чашке с агаром видны разнообразные колонии микробов, выросшие в при посеве воздуха.
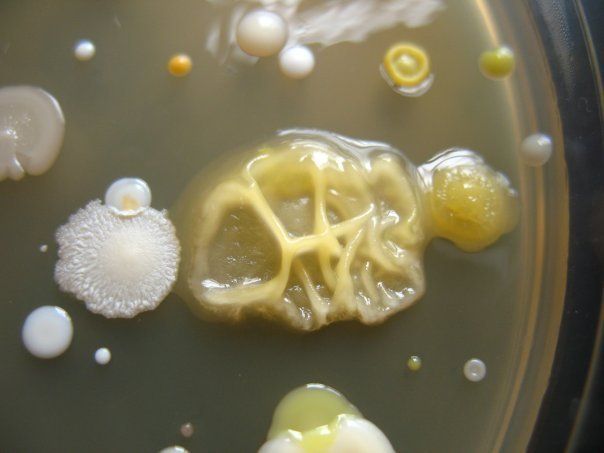
 СМЕСЬ БАКТЕРИЙ
СМЕСЬ БАКТЕРИЙ
На чашке с МПА видны различные колонии бактерий, отличающиеся по цвету, форме, размерам, прозрачности…. Культуральные свойства Escherichia coli: круглые с ровными краями, гладкие, влажные, слизистые, полупрозрачные колонии.
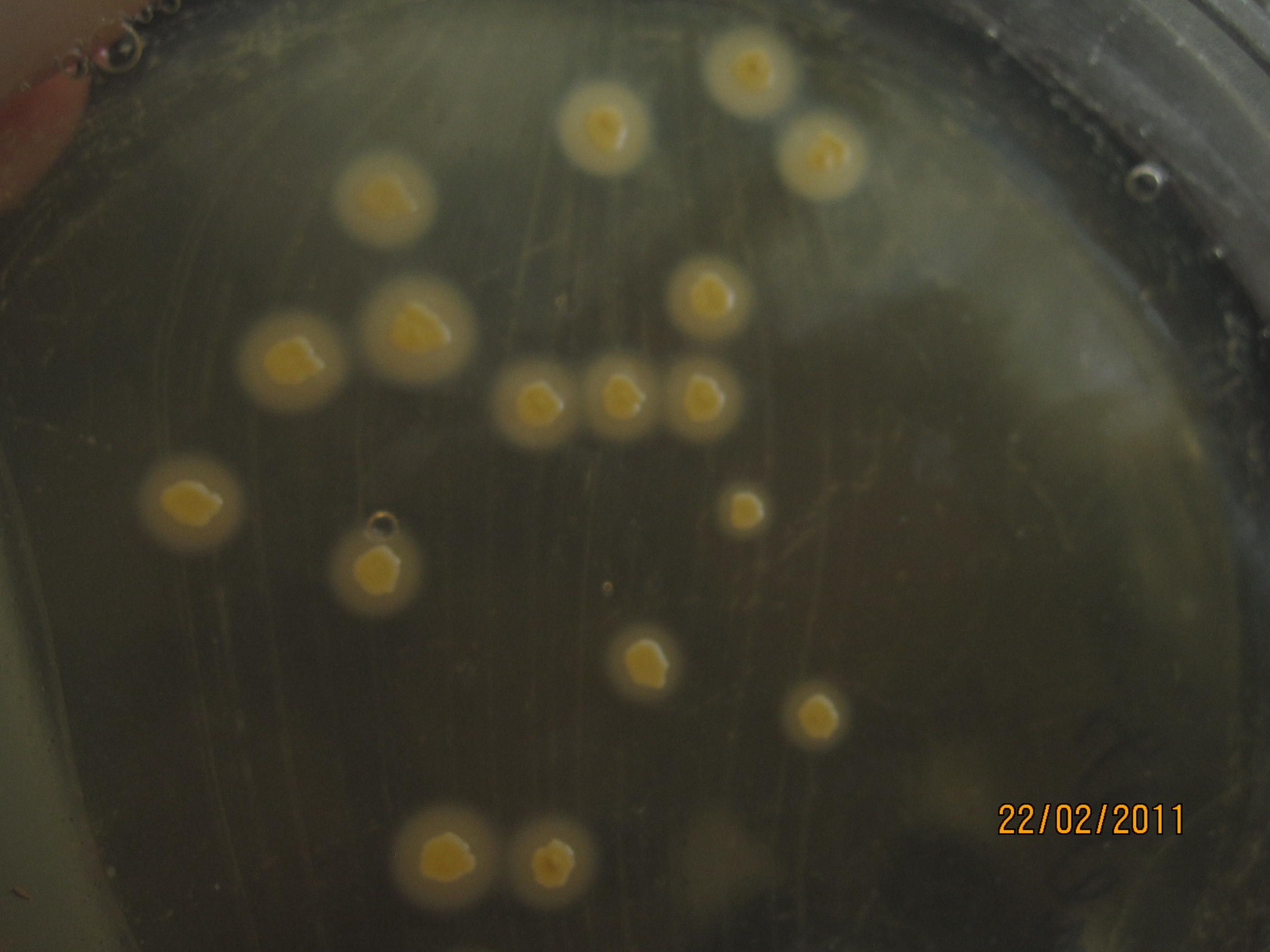
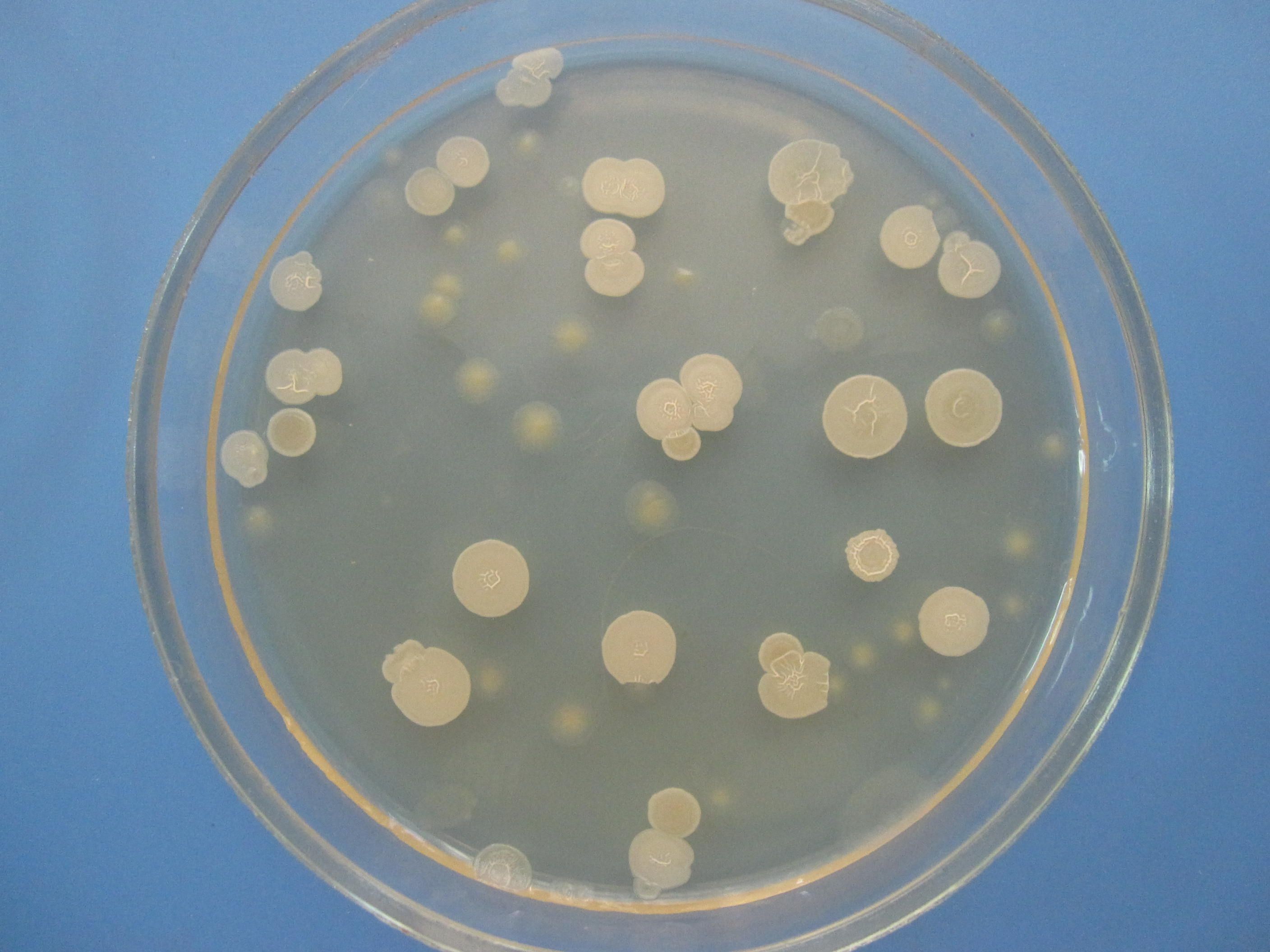
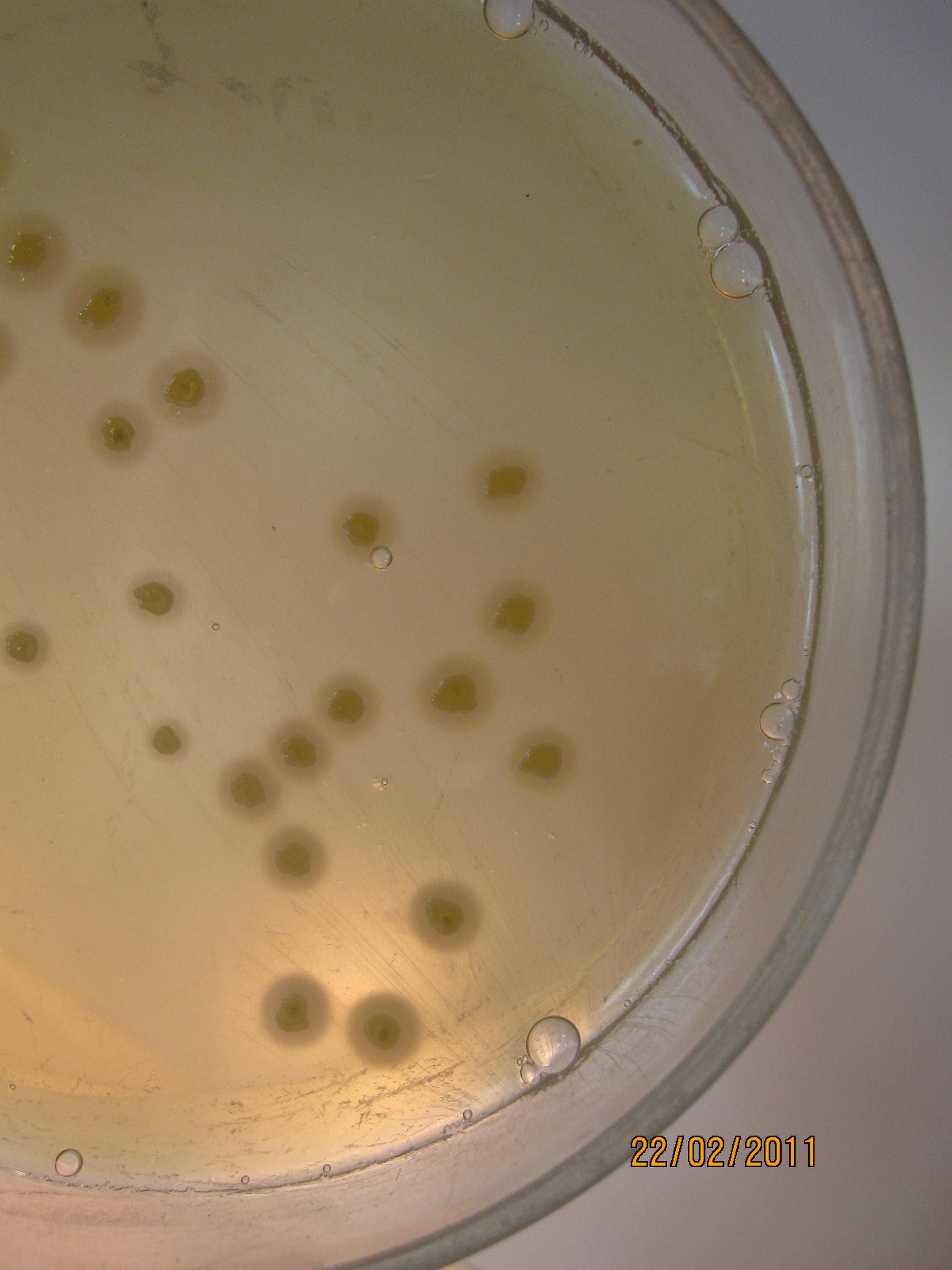 ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
ЖЕЛТОЧНО-СОЛЕВОЙ АГАР ЧИСТОВИЧА – селективная среда, предназначенная для культивирования стафилококков. Содержит питательный агар, желток куриного яйца, повышенные концентрации хлорида натрия (8-10%), которые не препятствуют размножению стафилококков и обеспечивают элективность среды для данных микробов. Среда позволяет дифференцировать лецитиназопозитивные стафилококки, вокруг колоний которых образуются зоны помутнения с перламутровым оттенком.
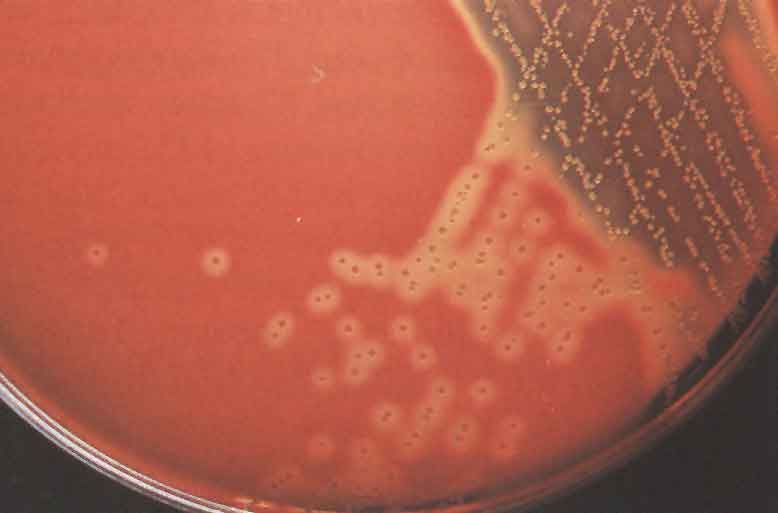
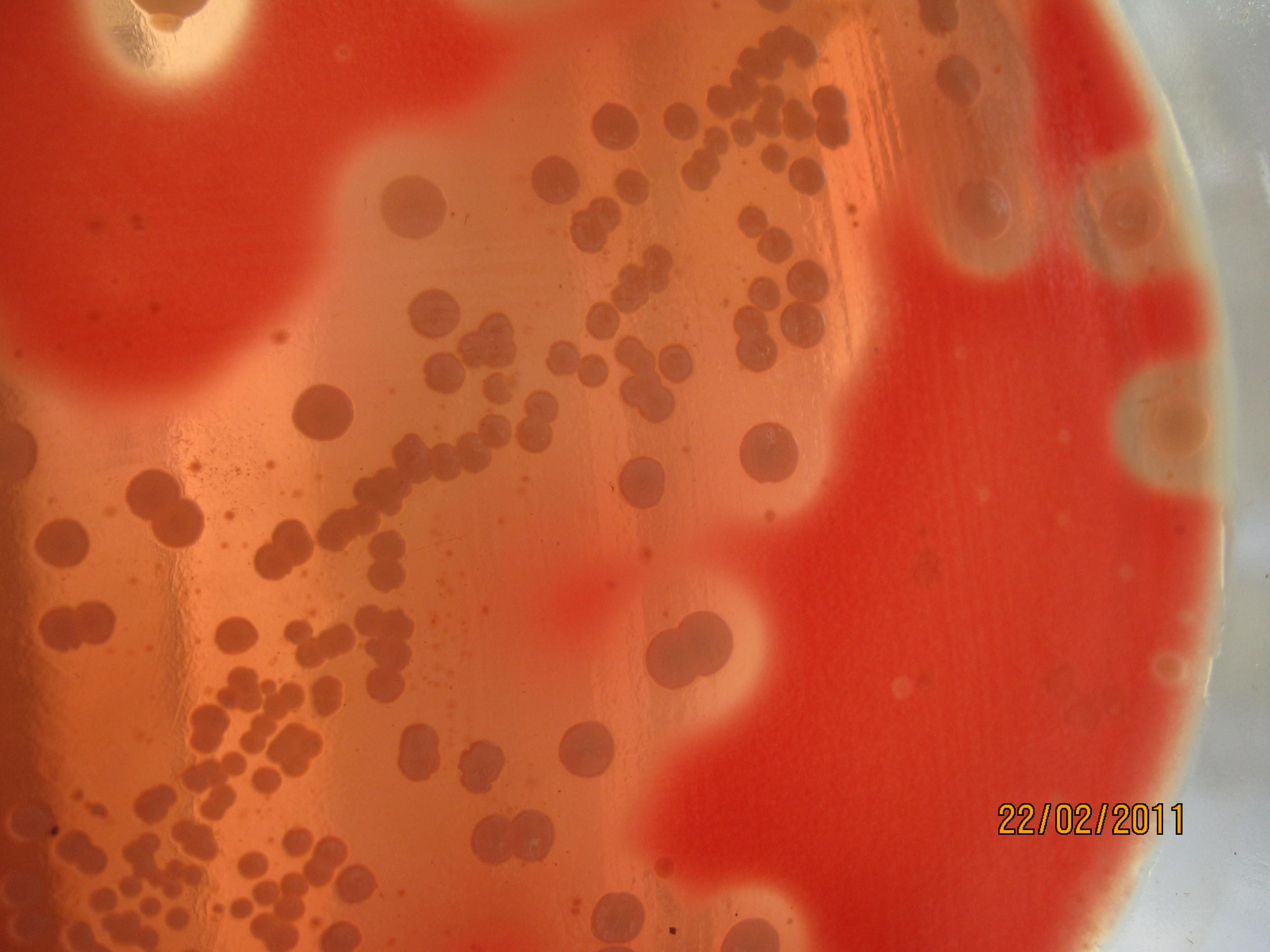 КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
КРОВЯНОЙ АГАР питательная среда для выявления гемолитических свойств бактерий. К расплавленному остуженному (до 45-50 гр С) питательному агару асептически добавляют 5-10% дефибринированной крови, хорошо перемешивают и сразу же разливают в чашки Петри. Вокруг выросших колоний отчетливо видны прозрачные зоны гемолиза.
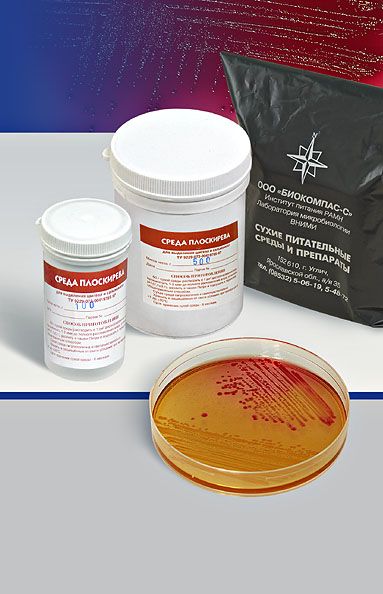
 СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
СРЕДА ПЛОСКИРЕВА – дифференциально-диагностическая и селективная, способствует лучшему росту некоторых бактерий (возбудители брюшного тифа, паратифов, дизентерий) и подавляет рост других (кишечная палочка и пр.). Содержит питательный агар с лактозой, бриллиантовым зеленым, солями желчных кислот, минеральными солями и индикатором (нейтральный красный). Лактозонегативные колонии вырастают бесцветными, лактозопозитивные – красными. На некоторых модификациях среды Плоскирева выявляется еще и способность сальмонелл выделять сероводород: выросшие колонии чернеют.
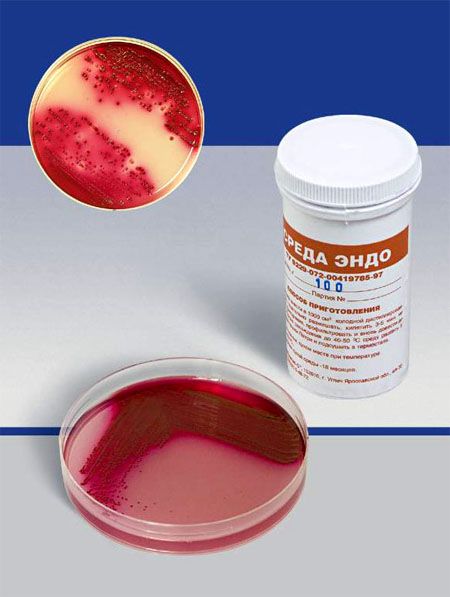
 СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
СРЕДА ЭНДО предназначена для выделения энтеробактерий, обнаружения эшерихий. Состоит из питательного агара, 1% лактозы и индикатора – основного фуксина, обесцвеченного сульфитом натрия. Свежеприготовленная среда бесцветна или имеет бледно-розовую окраску. При росте лактозоположительных бактерий их колонии окрашиваются в темно-красный цвет с металлическим блеском; лактозоотрицательные кишечные палочки образуют бесцветные колонии.
 СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
СРЕДА ОЛЬКЕНИЦКОГО (ТРЕХСАХРНЫЙ АГАР) предназначена для дифференциации энтеробактерий по способности сбраживать углеводы в присутствии индикатора.
Рост на трехсахарном железосодержащем агаре:
1. Контроль (незасеянная среда)
2. Salmonella серовара Typhimurium
3. Escherichia coli
4. Shigella flexneri
5. Salmonella серовара Typhi
Пептический перевар животной ткани, гидролизат казеина, дрожжевой и мясной экстракты являются источником азотистых веществ, серы, микроэлементов, витаминов группы В и др. Лактоза, сахароза и глюкоза – ферментируемые субстраты. Тиосульфат натрия в сочетании с ионами железа являются индикатором на сероводород, феноловый красный – индикатор рН.
Микроорганизмы, ферментирующие глюкозу, способствуют образованию многих кислот, изменяющих цвет среды с красного на желтый. Большее количество кислот освобождается в столбике (при ферментации), по сравнению со скошенной частью (окисление). Бактерии образуют также щелочные продукты (в ходе окислительного декарбоксилирования пептона). Принципиальное значение имеет соотношение глюкоза/лактоза(сахароза) = 1:10. Индикатор феноловый красный становится желтым при значениях рН менее 6,8. При исходном значении рН=7,4 требуется относительно небольшое количество кислот для развития желтого окрашивания среды. Щелочные продукты могут нейтрализовать небольшое количество кислоты, образуемое в скошенной части при ферментации глюкозы. Таким образом, щелочной (красный) скос и кислый (желтый) столбик указывают, что микроорганизм ферментирует глюкозу, но не ферментирует лактозу и/или сахарозу. Бактерии, ферментирующие помимо глюкозы лактозу и/или сахарозу, образуют большое количество кислот, которое не может быть нейтрализовано аминами, поэтому скос и столбик будут кислыми (желтыми). Если в ходе ферментации образуется газ, его можно определить по пузырькам и характерным разрывам среды. Некоторые виды бактерий восстанавливают тиосульфат до сероводорода, который, взаимодействуя с ионами железа, образует нерастворимый черный преципитат сульфида железа. Восстановление тиосульфата происходит только в кислой среде и почернение обычно бывает в зоне столбика.
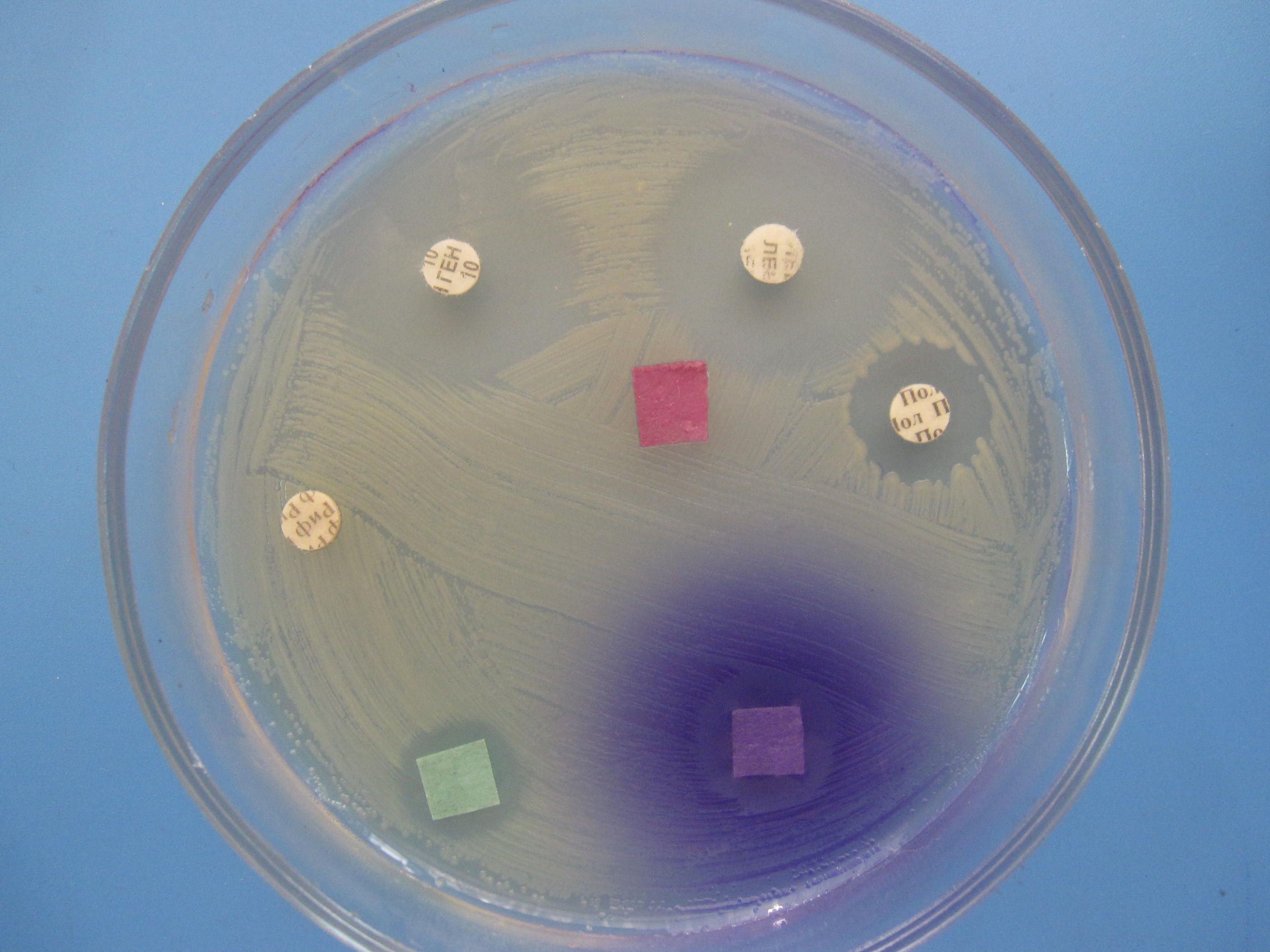 ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ МЕТОД ДИСКОВ
Бактериальную культуру засевают газоном на питательный агар, после чего на его поверхность пинцетом помещают на равномерном расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 0 С в течение суток. По диаметру зон задержки роста культуры судят о ее чувствительности к соответствующим антибиотикам. При зоне задержки роста до 15 мм культура расценивается как нечувствительная или низко чувствительная, 15 – 24 мм – средняя чувствительность, 25 мм и более – высокочувствительная.

 СРЕДА ВИЛЬСОНА-БЛЕРА
СРЕДА ВИЛЬСОНА-БЛЕРА
(ЖЕЛЕЗО-СУЛЬФИТНЫЙ АГАР) используется для выделения анаэробных бактерий. Готовится из питательного агара, к которому добавляют 1% глюкозы, хлорид железа и сульфит натрия. Анаэробные клостридии (Clostridium perfringens) образуют на среде колонии черного цвета за счет образования соединений железа с серой.
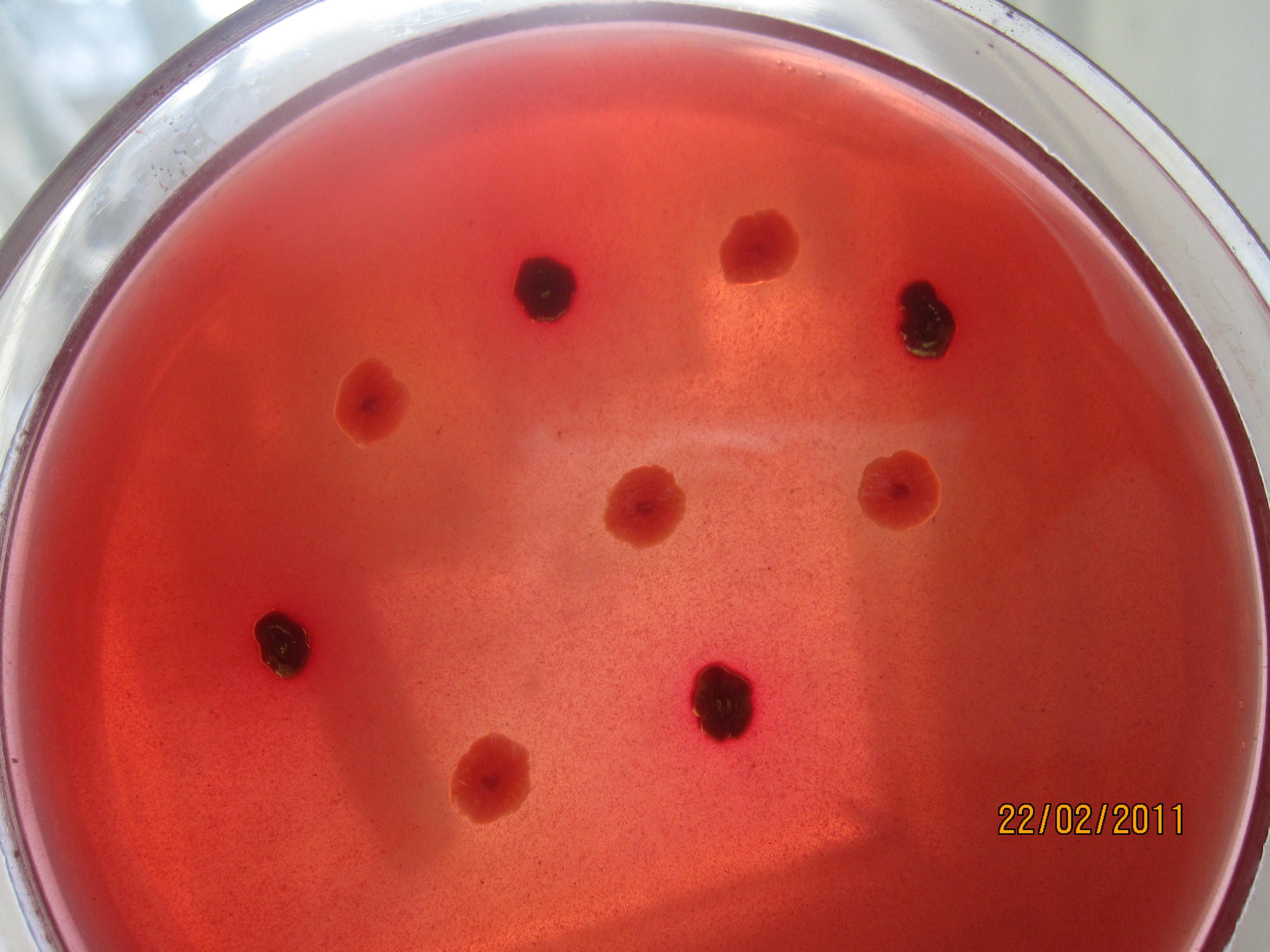
 ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.
ВИСМУТ-СУЛЬФИТНЫЙ АГАР селективная среда для выделения сальмонелл. Готовая среда непрозрачна, зеленоватого цвета. Содержит глюкозу, неорганические соли, бриллиантовый зеленый, питательный агар. Бриллиантовый зеленый и висмут подавляют рост грамположительной флоры и многих энтеробактерий, в том числе шигелл, эшерихий. Сальмонеллы при росте на среде выделяют сероводород, который взаимодействует с солями висмута. В результате образуются колонии черного цвета с металлическим оттенком на зеленоватом фоне среды.

 СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
СРЕДЫ ГИССА дифференциально-диагностические питательные среды для выявления ферментативной активности бактерий (кишечной группы). Содержат 1% пептонную воду, 0,5% раствор определенного углевода (глюкоза, лактоза, мальтоза, манит, сахароза и др.) и индикатор Андреде (кислый фуксин в растворе NaOH). Среда при рН 7,2-7,4 – бесцветна, при ферментации углеводов приобретает красный цвет . В пробирки со средой помещают поплавок (небольшая трубочка, один конец которой запаян) для улавливания газообразных продуктов, образующихся при расщеплении углеводов.
 СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
СРЕДА КИТТА-ТАРОЦЦИ обеспечивает рост многих спорообразующих и строгих аспорогенных анаэробов. Ее используют для культивирования и хранения клостридий. Состоит из питательного бульона, 2% глюкозы и кусочков печени или мясного фарша для адсорбции кислорода. Перед посевом среду прогревают на кипящей водяной бане в течение 10-15 минут для удаления воздуха. После посева среду заливают небольшим слоем вазелинового масла. Выросшие анаэробы вызывают помутнение питательной среды.
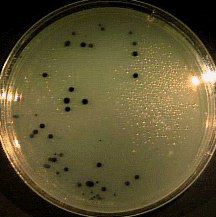
 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ОТТО (МЕТОД СТЕКАЮЩЕЙ КАПЛИ)
На чашку с МПА шпателем выполняется посев суточной бульонной культуры бактерий. Затем наносят каплю известного бактериофага и, наклонив чашку, дают капле несколько растечься по поверхности питательной среды. Через сутки наблюдают полную задержку роста в месте внесения диагностического фага.
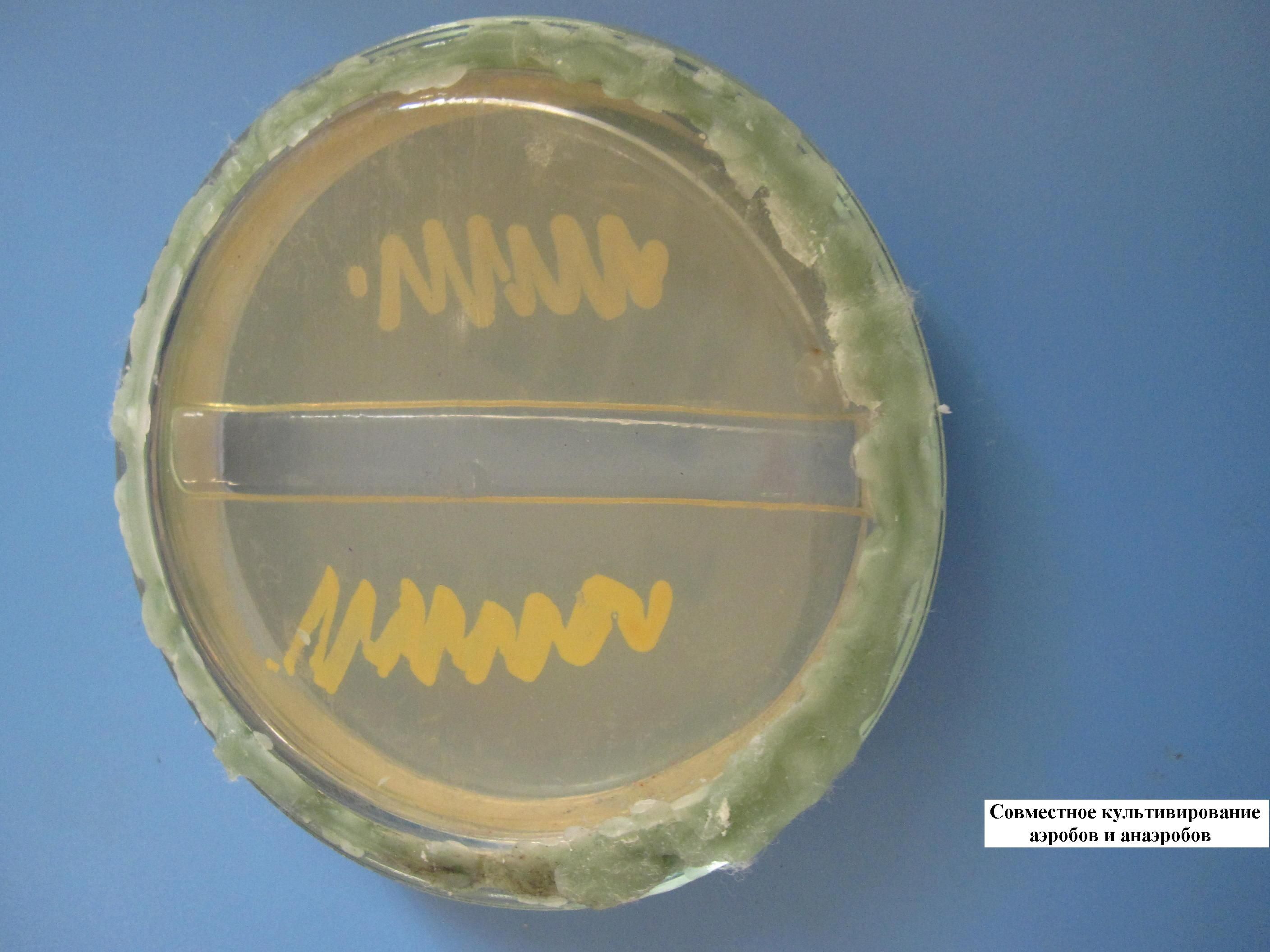
 ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
ФАГОТИПИРОВАНИЕ БАКТЕРИЙ ПО МЕТОДУ ФИШЕРА
Испытуемую суточную бульонную культуру засевают на МПА, затем условно делят чашку на квадраты. В каждый квадрат наносят по одной капле различных фагов. После суточной инкубации в термостате отмечают квадраты, в которых отмечается лизис бактерий. Фаготип бактериальной культуры определяется типом лизирующего ее фага.
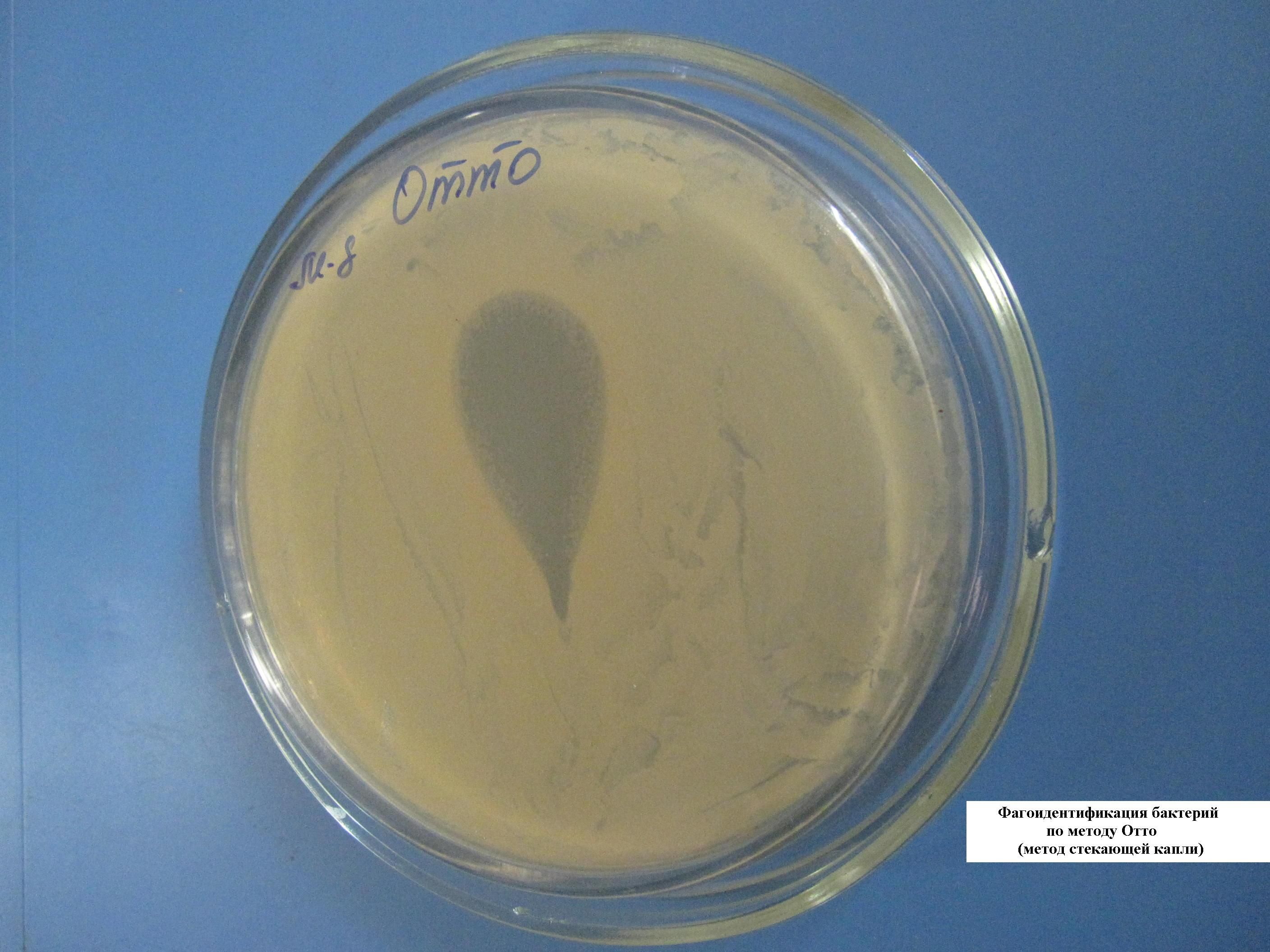
 СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
СОВМЕСТНОЕ КУЛЬТИВИРОВАНИЕ АЭРОБОВ И АНАЭРОБОВ (МЕТОД ФОРТНЕРА)
В чашке с сахарным агаром вырезается «траншея» («ров») для невозможности миграции, смешивания разных культур бактерий. С одной стороны выполняется посев культуры аэробных бактерий, с другой – умеренно строгих анаэробов. Чашка закрывается, ее края запаиваются парафином (с целью не допустить попадания воздуха, кислорода внутрь чашки). Сначала вырастают в присутствии кислорода аэробы, а затем – анаэробы.
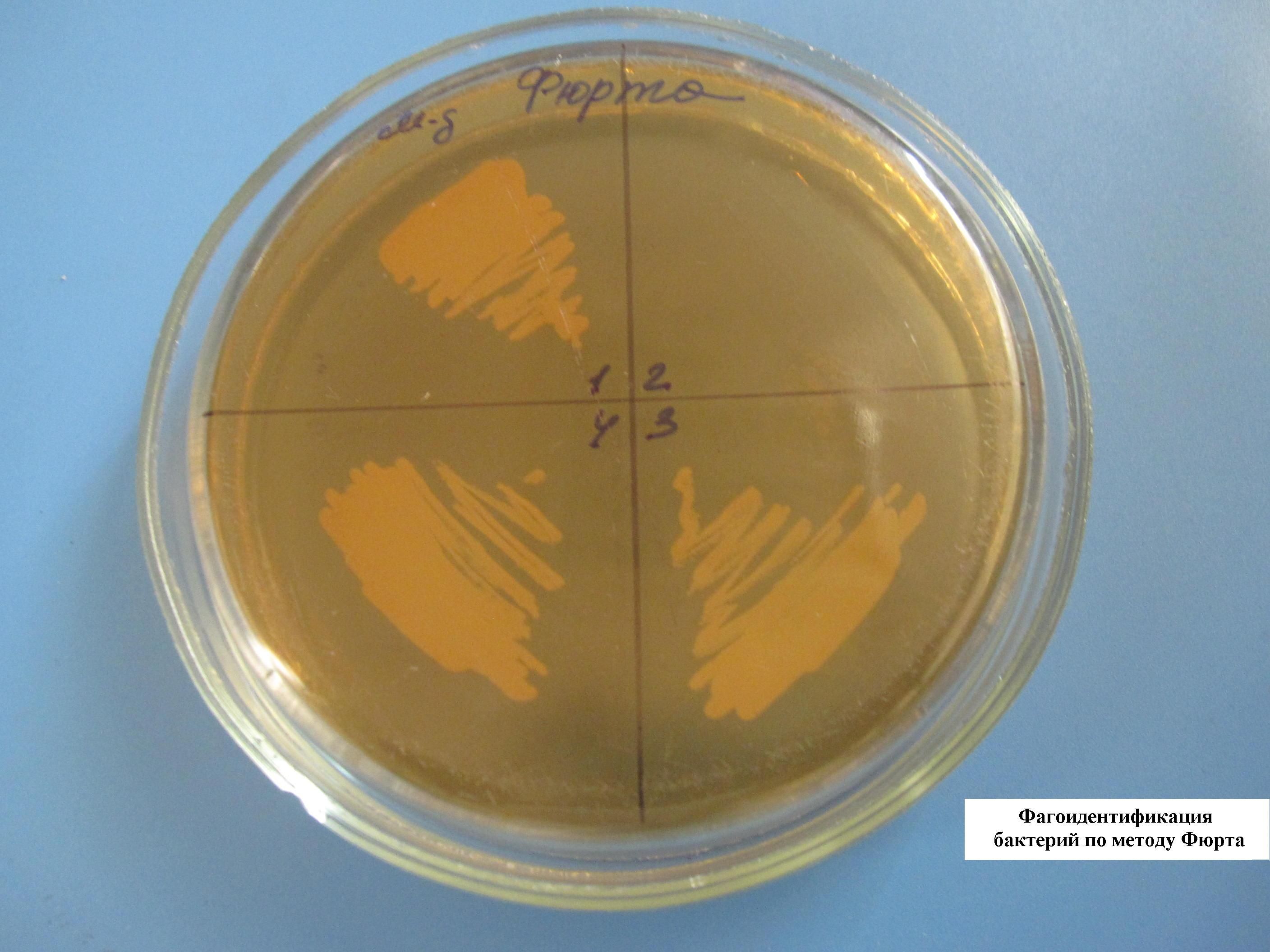 ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
ФАГОИДЕНТИФИКАЦИЯ БАКТЕРИЙ ПО МЕТОДУ ФЮРТА
В расплавленный и остуженный МПА (45-50 гр. С) добавляют определенный бактериофаг и выливают в чашку Петри. Чашка с полученным агаром делится на несколько секторов, в каждый из которых засеваются неизвестные культуры, выделенные от больных. Там, где культура соответствует бактериофагу, наблюдается отсутствие роста (лизис) бактерий.
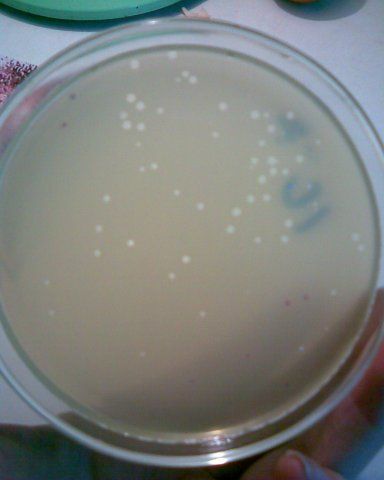 ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
ТИТРОВАНИЕ БАКТЕРИОФАГА ПО МЕТОДУ ГРАЦИА
1,0 мл фага смешивают в пробирке с 0,5 мл бактериальной культуры и добавляют в эту же пробирку расплавленный МПА. Все содержимое выливают в чашку с МПА. Дают застыть верхнему тонкому слою и ставят в термостат. При встрече фага с бактерией, происходит лизис последней и образуется негативная колония фага. Такие негативные колонии затем подсчитывают для определения титра. Титром фага называют количество фаговых частиц в 1 мл препарата фага.
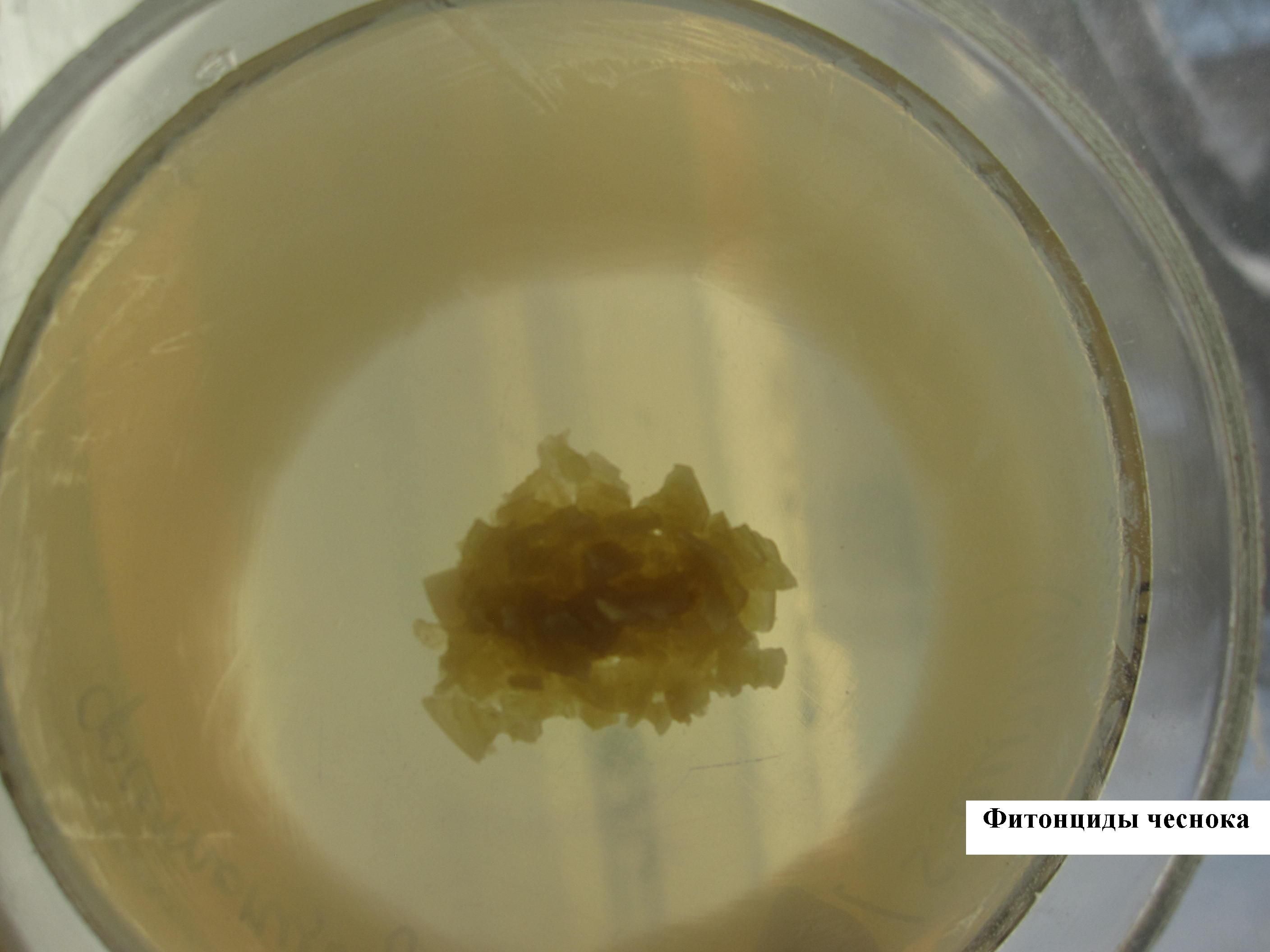 ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
ОПЫТ ВЫЯВЛЕНИЯ ФИТОНЦИДОВ ЧЕСНОКА
Чашку с МПА равномерно засевают шпателем суточной бульонной культурой бактерий (например, стафилококка). В центр посева помещают дольку чеснока, предварительно измельченного. Инкубируют в термостате. Через сутки отчетливо видна зона отсутствия роста вокруг измельченного чеснока (стерильная зона).
Источник