Среды для выделения кишечной палочки
Глюкозо-пептонная среда (Эйкмана) (ГПС)
Глюкозо-пептонная среда готовится в двух модификациях: концентрированная и разведенная. Концентрированная глюкозо-пептонная среда. К 1 л водопроводной воды прибавляют 100 г пептона, 100 г глюкозы и 50 г хлористого натрия. Сначала в воде растворяют пептон и соль, кипятят, фильтруют и, добавив в фильтрат глюкозу, устанавливают pH 7,4. Если необходимо, среду подщелачивают. После установления pH среду кипятят; если образовался осадок, фильтруют.
Концентрированную среду разливают в бродильные сосуды 1 и пробирки с поплавками с таким расчетом, чтобы при посеве среда разбавлялась посевным материалом в 10 раз. Для посева 100 мл воды нужно в бродильный сосуд поместить 10 мл ГПС, а в пробирки для посева 10 мл воды вливают по 1 мл ГПС. Стерилизация концентрированной глюкозо-пептонной среды осуществляется в кипятильнике Коха по 30 мин в течение трех дней.
В практической работе для сокращения срока стерилизации глюкозо-пептонной среды можно рекомендовать следующий режим. Температуру автоклава вначале доводят до 120°С и стерилизуют среду при этой температуре 5 мин. Постепенно снижают давление в автоклаве, выпуская пар и прекратив нагрев, до 0 ат (что соответствует температуре 100 °С) и при 100 °С (при открытом паровыпускном клапане) выдерживают среду еще 15 мин.
Разведенная глюкозо-пептонная среда содержит в 10 раз меньше всех плотных ингредиентов, чем концентрированная. Это достигается прибавлением к одной части концентрированной среды девяти частей воды. Разведенную глюкозо-пептонную среду разливают в пробирки с поплавками по 9 мл. Стерилизуют так же, как и основную среду. Используют разведенную глюкозо-пептонную среду при посеве малых количеств воды или ее разведений.
Среда Булира
При санитарной оценке воды и молока для определения в них коли-титра вместо ГПС можно применять среду Булира в разведенном и концентрированном виде.
Концентрированная среда Булира – основной раствор. Используется она в тех случаях, когда для посева берут 10 мл воды и более. К 1 л мясопептонного бульона добавляют 2,5 г маннита и после растворения устанавливают pH 6,8-7,0. Кипятят среду 10 мин, затем в горячий раствор добавляют насыщенный водный раствор нейтральрота до появления ясной вишнево-красной окраски. Среду фильтруют и разливают в бродильные сосуды и пробирки с поплавками с таким расчетом, чтобы при посеве среда разбавлялась посевным материалом в 3 раза. Обычно среды в бродильный сосуд наливают в 2 раза меньше, чем вносится посевного материала, т.е. для посева 10 мл воды в бродильный сосуд наливают 5 мл среды, для посева 100 мл воды нужно налить 50 мл среды и пр. Стерилизация среды Булира проводится в кипятильнике Коха по 30 мин в течение трех дней. Можно стерилизовать ее и в автоклаве при 120 °С в течение 15 мин.
При исследовании молока, а также при анализе воды, когда для посева берут небольшие количества продукта, готовят разведенную среду Булира: к одной части концентрированной среды приливают две части воды. Разведенную среду Булира разливают в пробирки с поплавками по 6-7 мл. Стерилизуют, как указано выше. Среда ГПС и среда Булира являются средами накопления.
Среда Кеслера
Среда Кеслера применяется для определения коли-титра в молоке и других молочных продуктах. К 1 л водопроводной воды добавляют 10 г пептона и 50 мл бычьей желчи. Смесь кипятят на водяной бане при помешивании в течение 20-30 мин, фильтруют ее через вату и в фильтрате растворяют 10 г лактозы. Объем доводят до 1 л. pH среды устанавливают 7,4-7,6, добавляют 2-4 мл 1%-ного раствора (водного) генцианвиолета на 1 л среды. В пробирки с поплавками разливают по 5 мл среды и стерилизуют 15 мин при 120 °С.
Источник
.
4.2.2.1. Среда Кесслер с лактозой.
К 1 куб. дм водопроводной воды добавляют (10,0 +/- 0,1) г пептона и 50 куб. см желчи крупного рогатого скота. Смесь кипятят на водяной бане при помешивании 20 – 30 минут. Затем фильтруют ее через ватно-марлевый фильтр, добавляют 2,5 г лактозы, доводят объем водой до 1 куб. дм. Устанавливают pH 7,4 – 7,6, используя 1 н растворы NaOH или HCl и проверяя значение pH на потенциометре или универсальной индикаторной бумагой. Добавляют 4 куб. см 1-процентного раствора генцианового фиолетового, разливают в колбы по 90 куб. см и в пробирки по 10 куб. см, закладывают поплавки (пробирки Уленгута) отверстием книзу.
Стерилизуют при (121 +/- 2) град. C в течение 15 минут.
4.2.2.2. 1% раствор генцианового (кристаллического) фиолетового.
Взвешивают (1,0 +/- 0,01) г генцианового (кристаллического) фиолетового, помещают в мерную колбу вместимостью 100 куб. см и доливают до метки дистиллированной водой. Раствор хранят при температуре (4 +/- 1) град. C в течение 7 суток.
4.2.2.3. Среда Кесслер с лактозой из сухих питательных сред.
Среда готовится согласно прописи на этикетке банки.
4.2.2.4. Среда Эндо.
Среду Эндо производства ДагНИИ питательных сред готовят согласно прописи на этикетке банки. Изготовленную и разлитую в стерильные чашки Петри среду можно хранить при температуре (4 +/- 1) град. C до 10 суток.
4.2.2.5. Среда на индол.
Взвешивают (10,0 +/- 0,1) г сухого панкреатического гидролизата казеина (или 100,0 куб. см жидкого панкреатического гидролизата казеина с содержанием 500 мг% аминного азота), (5,0 +/- 0,1) г хлористого натрия, (1,0 +/- 0,01) г ДЛ-триптофана, растворяют в 1000 куб. см дистиллированной воды. Доводят pH до 7,0 +/- 0,1 н растворами NaOH или HCl и, измеряя значение pH на потенциометре или по универсальной индикаторной бумаге, разливают в пробирки по 5 куб. см, стерилизуют 15 минут при (121 +/- 2) град. C.
4.2.2.6. Реактив на индол (Эрлиха).
Взвешивают (5,0 +/- 0,1) г пара-диметиламинобензальдегида в стеклянном стакане вместимостью 100 куб. см, помещают в коническую колбу вместимостью 200 куб. см и растворяют в (50 +/- 1) куб. см этилового спирта. С помощью мерного цилиндра вместимостью 100 куб. см медленно добавляют (50 +/- 1) куб. см концентрированной соляной кислоты. Раствор хранят в колбе с притертой пробкой при температуре (4 +/- 1) град. C.
4.2.2.7. Среда Кларка.
Взвешивают (5,0 +/- 0,1) г пептона, (5,0 +/- 0,1) г глюкозы, (5,0 +/- 0,1) г двузамещенного фосфорнокислого калия. Растворяют ингредиенты в 950 куб. см дистиллированной воды, устанавливают pH 6,9 +/- 0,1, используют 1 н растворы NaOH или HCl, проверяя значение pH на потенциометре или универсальной индикаторной бумагой. Доводят общий объем до 1 куб. дм дистиллированной водой и фильтруют при необходимости. Разливают в пробирки по 5 куб. см, стерилизуют в течение 20 минут при (115 +/- 2) град. C.
4.2.2.8. 90% раствор этилового спирта.
Добавляют к (900 +/- 5) куб. см 96-процентного этилового спирта (60 +/- 1) куб. см дистиллированной воды в колбе емкостью 100 куб. см.
4.2.2.9. Раствор индикатора метилового красного.
Взвешивают (0,1 +/- 0,001) г индикатора метилового красного, количественно переносят в мерную колбу вместимостью 500 куб. см, растворяют в (300 +/- 1) куб. см 90-процентного раствора этилового спирта (п. 4.2.2.8), добавляют до 500 куб. см дистиллированной водой. Хранят раствор в колбе с притертой пробкой при температуре (4 +/- 1) град. C.
4.2.2.10. 5% раствор альфа-нафтола.
Взвешивают (5,0 +/- 0,1) г альфа-нафтола, растворяют в (100 +/- 1) куб. см абсолютного этилового спирта. При отсутствии абсолютного этилового спирта можно использовать ректификованный этиловый спирт 96 град. Раствор должен быть свежеприготовленным.
4.2.2.11. 40-процентный раствор гидроокиси калия.
Взвешивают (40,0 +/- 0,1) г гидроокиси калия в стакане вместимостью 100 куб. см, переносят в мерную колбу вместимостью 100 куб. см, растворяют в (60,0 +/- 1) куб. см дистиллированной воды, затем доводят до метки дистиллированной водой. Раствор хранят при температуре (4 +/- 1) град. C.
4.2.2.12. Среда Козера.
Взвешивают (1,5 +/- 0,1) г натрия-аммония фосфорнокислого, (1,0 +/- 0,01) г калия фосфорнокислого двузамещенного, (0,2 +/- 0,01) г магния сульфата, (3,0 +/- 0,1) г натрия лимоннокислого трехзамещенного. Растворяют в 950 куб. см дистиллированной воды. Добавляют 10 куб. см 0,5-процентного спиртового раствора бромтимолового синего. Устанавливают pH 6,8 1 н растворами NaOH или HCl, проверяя значение pH на потенциометре. Доводят объем дистиллированной водой до метки (1 куб. дм). Разливают по 10 куб. см в пробирки, стерилизуют в течение 15 минут при (121 +/- 2) град. C.
4.2.2.13. 0,5-процентный раствор бромтимолового синего в спирте.
Взвешивают (0,5 +/- 0,01) г бромтимолового синего, помещают в мерную колбу вместимостью 100 куб. см и доводят этиловым спиртом до метки. Раствор хранят при температуре (4 +/- 1) град. C в течение 30 суток.
4.2.2.14. Среда Симмонса.
Среда готовится аналогично среде Козера (п. 4.2.2.12). Но после измерения pH в нее добавляют (20 +/- 0,1) г агара на 1 куб. дм, прогревают на водяной бане до растапливания агара, стерилизуют в течение 15 минут при (121 +/- 2) град. C. Разливают в стерильные чашки Петри или пробирки.
Источник
Среда Хейфеца.Выпускается в сухом виде. В состав, кроме основных питательных компонентов (вода, пептон, маннит, натрия хлорид), входят розоловая кислота, раствор метиленового синего. Готовая среда красно_фиолетового цвета, при росте кишечной палочки рН сдвигается в кислую сторону, и среда приобретает зеленоватую окраску.
ХБ.В 1000 мл воды растворяют 10 г пептона, 5 г маннита, 5 г хлорида натрия. Приготовленную смесь кипятят 15–20 мин, устанавливают рН 7,4–7,6, процеживают через бумажный фильтр, кипятят фильтрат 10 мин, охлаждают до температуры +60_С, после чего прибавляют 30 мл дрожжевого диализата, 15 мл желчи, 10 мл раствора хинозола и 10 мл 1,6%_ного спиртового раствора бромкрезола пурпурного. Среду разливают в стерильные пробирки по 7–8 мл.
Среда Кесслера.К 1000 мл дистиллированной воды добавляют 10 г пептона и 50 мл бычьей желчи. Смесь кипятят на водяной бане при помешивании в течение 20–30 мин, фильтруют через вату, добавляют 2,5 г лактозы, доводят объем дистиллированной воды до 1000 мл, устанавливают рН 7,4–7,6, добавляют 2 мл 1%_ного водного раствора генцианвиолета, разливают в пробирки с поплавками по 8–10 мл и стерилизуют при температуре +121_С в течение 10 мин. Готовая среда имеет темно-фиолетовый цвет.
Индикация сальмонелл.Навесок колбасы массой 25 г от объединенной пробы, тщательно измельченный ножницами, вносят во флакон, содержащий 100 мл среды обогащения (Мюллера, Кауфмана, хлористо-магниевой) или 225 мл селенитового бульона. Флакон встряхивают и помещают в термостат при температуре +37_С, через 24 ч петлей или пастеровской пипеткой проводят высев из среды обогащения в чашки Петри со средой Эндо, Плоскирева, Левина или ВСА. Посевы помещают в термостат при температуре +37_С на 16–24 ч. На среде Эндо, Плоскирева и Левина бактерии из рода сальмонелл образуют бесцветные колонии. На ВСА сальмонеллы образуют черные или коричневые колонии с металлическим блеском, при этом участок среды под агаром чернеет. Не менее 5 изолированных колоний, характерных для сальмонелл, пересевают на трехсахарный агар Крумвиде–Олькеницкого в модификации Ковальчука штрихом по скошенной поверхности и уколом в столбик и инкубируют при температуре +37_С в течение 12–16 ч.
При росте сальмонелл на трехсахарном агаре цвет скошенной поверхности среды розовый, столбик — желто-бурый. Газообразование устанавливают по наличию трещин и разрыву столбика агара, при образовании сероводорода питательная среда чернеет.
Другие грамотрицательные бактерии семейства энтеробактерий дают следующие изменения цвета трехсахарного агара:
-БГКП окрашивает среду в синий или сине-зеленый цвет с образованием газа или без него;
-палочка протея окрашивает среды в ярко-красный цвет (вследствие расщепления мочевины), в случае выделения Н2S может появиться черный осадок с возможным разрывом агара.
Для дальнейшей идентификации бактерий готовят мазки, которые окрашивают по Граму, микроскопируют, а также изучают антигенные свойства путем постановки РА на предметном стекле с поливалентной (или комплексной) сальмонеллезной агглютинирующей сывороткой. Далее проводят идентификацию с помощью монорецепторных О- и Н-агглютинирующих сальмонеллезных сывороток.
Обнаружение подвижных (кроме S. gallinarum и S. pullorum) грамотрицательных палочек, дающих характерный рост на элективных средах, не ферментирующих лактозу и сахарозу, сбраживающих глюкозу и маннит до кислоты и газа (S. typhisuis маннит не ферментирует), образующих Н2S и не образующих индол, дающих положительную реакцию агглютинации с комплексными, монорецепторными О- и Н-агглютинирующими сальмонеллезными сыворотками, указывает на выделение бактерий из рода сальмонелл.
Индикация протеяв Н_форме проводится внесением исследуемого продукта в конденсат свежескошенного МПА (метод Щукевича). Посевы помещают в термостат на 18–24 ч при температуре +37_С. При наличии в исследуемом продукте протея подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Посевы выдерживают 24 ч в термостате и сутки при комнатной температуре, затем учитывают результат: на поверхности питательной среды стафилококки образуют слегка выпуклые круглые колонии с ровными краями, т. е. S-формы; на желточно-солевом агаре вокруг колоний стафилококков появляется «радужный венчик», что является одним из признаков их патогенности (лецитовителазная активность).
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда. Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию подвижная палочка поднимается вверх по скошенной поверхности агара, образуя вуалеобразный голубоватый налет. Культура издает характерный гнилостный запах.
Обнаружение полиморфных грамотрицательных палочек, подвижных, сбраживающих глюкозу и мочевину, не ферментирующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Индикация стафилококкав исследуемом продукте основана на изучении морфологии, культуральных свойств и способности некоторых стафилококков ферментировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Вначале исследуемый продукт разводят 1 : 10, вносят в МПБ, содержащий 6,5% натрия хлорида. Через сутки после инкубирования в термостате проводят пересев на молочно-солевой агар для изучения наличия пигмента и на желточно-солевой агар для выявления лецитиназной активности.
Посевы выдерживают 24 ч в термостате и сутки при комнатной температуре, затем учитывают результат: на поверхности питательной среды стафилококки образуют слегка выпуклые круглые колонии с ровными краями, т. е. S-формы; на желточно-солевом агаре вокруг колоний стафилококков появляется «радужный венчик», что является одним из признаков их патогенности (лецитовителазная активность).
Не менее чем из 5 типичных колоний готовят препараты, которые окрашивают по Граму и микроскопируют. При наличии стафилококков обнаруживают грамположительные кокки, располагающиеся в виде беспорядочных кучек и гроздьев винограда.
Для подтверждения патогенности выделенных стафилококков ставят реакцию плазмокоагуляции по следующей методике: в пробирку с 0,5 мл цитратной плазмы крови кролика, разведенной физраствором (1 : 5), вносят петлю чистой суточной культуры стафилококка и помещают в термостат при температуре +37_С. Реакцию плазмокоагуляции предварительно учитывают через 3–4 ч (осторожно наклоняя, не встряхивая пробирку). В сомнительных случаях пробирки оставляют в термостате для окончательного учета через 24 ч. Реакцию считают положительной, если плазма коагулирует в сгусток (реакцию оценивают по степени плотности сгустка от одного до четырех плюсов).
Индикация сульфитредуцирующих клостридий (СРК)в колбасе основана на учете специфического роста клостридий в железосульфитсодержащих средах. При взаимодействии натрия сульфита с хлоридом железа образуется сульфат железа, который вызывает почернение питательной среды.
Для выявления СРК 1 мл исследуемой взвеси стерильной пипеткой вносят в пробирку с 9 мл жидкой сульфит-циклосериновой среды или среды Вильсон–Блера. Затем проводят последовательные пересевы на аналогичные объемы среды и получают возрастающие 10_кратные разведения суспензии. Посевы выдерживают 18–20 ч при температуре +37_С, при наличии СРК среда чернеет.
Для подтверждения принадлежности выделенных культур к клостридиям проводят пересев на поверхность агаризованной плотной среды Вильсон–Блера и инкубируют в анаэробных условиях при температуре +37_С в течение 24–48 ч. Отбирают типичные колонии и изучают микроорганизмы по морфологическим и некоторым культурально-ферментативным свойствам, в частности, по отрицательной реакции на каталазу.
Если в посевах (в 4 колониях из 5) обнаружены СРК, спорообразующие палочки, грамположительные, каталаза-отрицательные, способные расти в анаэробных условиях, то делают заключение о наличии в продукте СРК по максимальному разведению суспензии, в посеве которого наблюдается почернение среды. Например, если характерные изменения наблюдаются в пробирках с разведением 10–1, то считают, что в 1 г исследуемого продукта содержится 10 клеток, при аналогичных изменениях в пробирках с разведением 10–2 — 100 клеток.
При получении неудовлетворительных результатов микробиологического анализа готовой продукции по требованию контролирующих организаций проводят исследование вспомогательных материалов при постоянном входном контроле.
Источник
Глава 18. Эшерихии – Л. Б. Богоявленская, Ф. К. Черкес
Этот род представлен только одним видом бактерий – Е. coli, но объединяет множество вариантов. Разновидности кишечной палочки отличаются по биологическим свойствам, у них могут быть разные наборы ферментов (биовары) и разная антигенная структура (серовары).
Кишечная палочка впервые выделена в 1888 г. Эшерихом из испражнений человека и названа по его имени.
Естественным местом обитания E. coli является кишечник человека. Кишечная палочка – представитель нормальной микрофлоры кишечника.
В процессе жизнедеятельности E. coli вырабатывает ферменты, способствующие пищеварению (например, расщепляющие клетчатку), синтезирует некоторые витамины (например, витамины группы В). Кроме того, эти бактерии проявляют антагонистическое действие в отношении патогенных микроорганизмов, таких как возбудители Дизентерии, брюшного тифа, токсикоинфекций. Отсутствие кишечной палочки в толстом кишечнике ведет к тяжелому заболеванию – дисбактериозу. При этом нарушается нормальный состав микрофлоры кишечника, развиваются протей, кокковая флора, грибы и т. п.
При снижении устойчивости организма (голодании, переутомлении и т. п.) эшерихии могут проникнуть в Другие органы и ткани и стать причиной тяжелых патологических процессов. Таким образом, можно считать, что эшерихии – типичные условно-патогенные микроорганизмы: в обычных условиях они являются сапрофитами, а ПРИ изменении условий вызывают заболевания.
Выделяясь с фекалиями, кишечная палочка попадает во внешнюю среду. Обнаружение E. coli в почве, воде и на других объектах свидетельствует об их фекальном загрязнении, а определение количества E. coli (коли-титр, коли-индекс) характеризует санитарное состояние объекта (см. “Санитарная микробиология”).
Морфология. E. coli – короткие, в среднем 0,5-3,0 × 0,5-0,8 мкм палочки. Грамотрицательны. В большинстве случаев они подвижны, перитрихи. Однако некоторые варианты кишечной палочки неподвижны. Многие штаммы образуют капсулу. Спор не образуют.
Культивирование. Кишечная палочка – факультативный анаэроб. Хорошо растет на простых питательных средах при 37° С и рН среды 7,2-7,8. Штаммы E. coli, выделенные из кишечника человека и животных, развиваются и при 43-45° С, а кишечные палочки холоднокровных при этих условиях не размножаются. Это различие в свойствах E. coli разного происхождения используют для определения санитарного состояния объекта, так как только обнаружение E. coli теплокровных свидетельствует о санитарном неблагополучии.
На МПА кишечная палочка образует мутноватые, слегка выпуклые влажные колонии с ровным краем. На МПБ дает равномерное помутнение. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Для идентификации эшерихий используют дифференциально-диагностические среды: Эндо и агар с эозинметиленовым синим (ЭМС). На среде Эндо кишечная палочка растет в виде малиново-красных колоний с металлическим блеском или без него. На среде ЭМС – в виде темно-фиолетовых колоний.
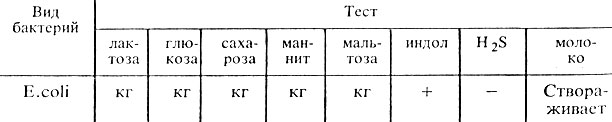
Ферментативные свойства. E. coli обладают значительной ферментативной активностью. Расщепляют лактозу, глюкозу, маннит, мальтозу, сахарозу и другие углеводы и спирты с образованием кислоты и газа. Лротеолитические свойства: образуют индол. Желатин не расщепляют. Отдельные биовары не ферментируют лактозу и сахарозу (табл. 29).

Таблица 29. Ферментативные свойства эшерихий
Примечание, кг – образование кислоты и газа; + наличие признака; – отсутствие признака.
Токсигенность. Эшерихий обладают эндотоксином (лиггополисахарид).
Антигенная структура. Эшерихий различаются по антигенной структуре микробной клетки, что положено в основу классификации бактерий этого рода. Различают три типа антигенов эшерихий: О-антиген (соматический), К-антиген (капсульный) и Н-антиген (жгутиковый). Термостабильный О-антиген является липополисахариднопротеиновым комплексом и расположен в клеточной стенке бактерий. О-антиген определяет принадлежность культуры к серологической группе. Описано более 170 таких групп. Некоторые компоненты О-антигена являются общими для разных О-групп эшерихий, а иногда и других энтеробактерий (шигелл, сальмонелл и др.). К-антигены эшерихий различны: А, В, L и М. Антигены А и М – термостабильны, В и L – термолабильны. К-антиген расположен в микробной клетке более поверхностно, чем О-антиген, и поэтому в его присутствии реакция агглютинации живой культуры с О-сывороткой не происходит. Для выявления О-антигена культуру прогревают в течение часа при 100° С: К-антиген при прогревании разрушается, а О-антиген становится способным вступать во взаимодействие с сывороткой. Установлено, что у эшерихий имеется около 100 типов К-антигенов, в основном типа В-антигенов (термолабильных). Н-антиген имеется только у подвижных штаммов, так как он связан с жгутиками. У эшерихий известно более 50 типов Н-антигена. Определение Н-антигена позволяет установить серовариант выделенной культуры (рис. 40).
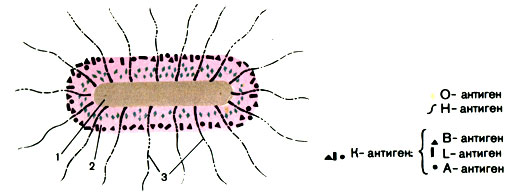
Рис. 40. Антигенная структура энтеропатогенной кишечной палочки. 1 – цитоплазма; 2 – клеточная стенка; 3 – жгутики
Характеристику антигенного состава выделенной культуры эшерихий дают на основании результатов реакции агглютинации с сыворотками, содержащими О-, К- и Н-антитела. При этом определяют, какие антигены имеются в культуре, а их сочетание характеризует антигенную формулу выделенной культуры, т. е. ее серовариант. В табл.30 представлены примеры антигенной структуры некоторых серовариантов E. coli, у которых К-антигены являются В-антигенами.
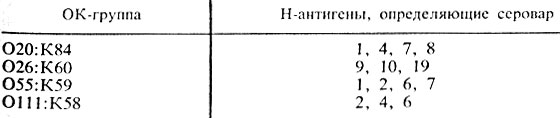
Таблица 30. Антигенная структура эшерихий
Если культура агглютинируется ОК-сывороткой ОП1:К58 (В4) и Н-сывороткой “6”, то значит выделен серовариант E. coli О111:В4:Н6; если отмечена реакция агглютинации с ОК-сывороткой О26:К60 (В6) и с Н-сывороткой “11” – выделена культура E. coli 026:В6:Н11 и т. п.
Кроме определения сероварианта E. coli, можно определить и фаговар выделенной культуры. Имеются наборы бактериофагов, которые лизируют эшерихии отдельных серогрупп. По лизису культуры одним из фагов устанавливают ее фаговар. Определение фаговаров имеет эпидемиологическое значение.
Антагонистическое действие E. coli, их способность подавлять рост гнилостных и патогенных бактерий используют для создания бактерийных препаратов для лечения дисбактериоза и различных заболеваний кишечника (колибактерин, бификол).
Устойчивость к факторам окружающей среды. E. coli довольно устойчивы. При 55° С они погибают в течение часа, при 60° С – за 15 мин. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Восприимчивость животных. Эшерихии отдельных серогрупп патогенны для различных животных и вызывают у них заболевания желудочно-кишечного тракта. Из лабораторных животных наиболее чувствительны к E. coli морские свинки, кролики, белые мыши. В зависимости от способа введения культура кишечной палочки вызывает различные патологические процессы: воспаление и абсцесс при подкожных инъекциях, перитонит и сепсис – при внутрибрюшинном и внутривенном введении.
Источники инфекции. Больной человек. При этом бактерии проникают в организм из внешней среды (экзогенная инфекция). Кишечная палочка может также вызвать развитие патологического процесса “изнутри” (эндогенная инфекция).
Пути передачи. Основной путь передачи при экзогенной форме инфекции – контактно-бытовой (непрямой контакт). Возбудители могут быть перенесены на грязных руках, через посуду, игрушки, белье, пищу, мух.
Патогенез. Заболевания, вызываемые эшерихиями, называют эшерихиозами. Развитие эшерихиозов зависит от пути внедрения возбудителя в организм и от серогруппы, к которой принадлежит возбудитель. При проникновении бактерий через рот могут возникнуть кишечные заболевания детей и взрослых. Некоторые О-группы эшерихии (серовары) наиболее часто являются возбудителями заболеваний человека. Такие бактерии называют энтеропатогенными кишечными палочками (ЭПКП). В настоящее время известно много вариантов ЭПКП, обусловливающих разное течение эшерихиозов. Различают несколько групп ЭКПК:
группа I – возбудители колиэнтерита у детей раннего возраста (серогруппы О111, О26, О55, О86 и др.);
группа II – возбудители дизентериеподобных заболеваний у детей и взрослых (О25, О124, О143, О144 и др.);
группа III – возбудители холероподобных заболеваний (О1, О5, О6, О78 и др.).
Попадая в пищевые продукты, кишечная палочка может в них размножаться. Употребление в пищу таких продуктов ведет к развитию пищевой токсикоинфекции.
Развитие эндогенной инфекции приводит к поражению различных органов: воспалению желчного пузыря (холецистит), мочевого пузыря (цистит), заражению крови (сепсис) и др.
Иммунитет. Иммунитет вырабатывается только в отношении одного сероварианта эшерихии – возбудителя данного заболевания. Многообразие эшерихии делает практически этот иммунитет недейственным. В развитии иммунного состояния при заболевании детей большое значение имеет образование IgM-антител, которые не проходят через плаценту, а значит не передаются от матери. IgA-антитела к эшерихиям передаются ребенку от матери с грудным молоком.
Профилактика. Соблюдение личной гигиены и санитарно-гигиенического режима. Специфическая профилактика отсутствует.
Лечение. Антибиотики: ампициллин, тетрациклин и др. В настоящее время выпускают колипротейный фаг, использование которого дает хорошие результаты.
Контрольные вопросы
1. Каковы основные признаки бактерий семейства кишечных?
2. Какие антигены имеются у эшерихии?
3. Какие лечебные препараты готовят из кишечных палочек?
Микробиологическое исследование
Цель исследования: выделение и идентификация ЭПКП.
Материал для исследования
1. Испражнения.
2. Рвотные массы.
При необходимости исследует отделяемое из носа и зева, гной из уха, кровь, мочу, кусочки органов трупа.
При возникновении очага заболеваний коли-энтеритом исследуют (по эпидемиологическим показаниям) пищевые продукты, смывы с рук обслуживающего персонала, игрушек и других предметов.
Способы сбора материала

Способы сбора материала
Примечание. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя.
Основной метод исследования
Бактериологический
Ход исследования
Первый день исследования

Первый день исследования
Второй день исследования
Вынимают из термостата засеянные накануне чашки и просматривают их в падающем или проходящем свете. При наличии малиново-красных колоний на среде Эндо (с металлическим блеском или без него) или фиолетовых на среде ЭМС ставят пробную реакцию агглютинации на стекле для дифференциации ЭПКП от других разновидностей эшерихий.
Для постановки пробной реакции агглютинации отбирают не менее 10 изолированных колоний, отмечая или нумеруя их на обратной стороне чашки; часть каждой намеченной колонии снимают петлей и агглютинируют в капле поливалентной сыворотки или иммуноглобулина. Испытывают только часть колонии, чтобы в случае положительной реакции агглютинации можно было из оставшейся части колонии выделить чистую культуру.
Типовые или поливалентные эшерихиозные сыворотки (или иммуноглобулины) изготовляют в производственных условиях. Поливалентные эшерихиозные ОК-сыворотки (или ОК-иммуноглобулины) содержат антитела к нескольким О- и К-антигенам эшерихий. С их помощью ориентировочно определяют принадлежность выделенной культуры к ЭПКП. Например, поливалентная сыворотка О26, О55, О111 позволяет выявить одноименные культуры эшерихий. Сыворотки разводят согласно указанию на этикетке.
В лаборатории можно приготовить смесь отдельных ОК-сывороток, соединяя не более 5 сывороток, чтобы разведение каждой было не выше 1:10.
Постановка пробной реакции агглютинации. На одно или два хорошо обезжиренных предметных стекла наносят 10 капель поливалентной сыворотки (или иммуноглобулина). В каждую каплю вносят часть намеченной колонии и растирают ее. Колонии, давшие реакцию агглютинации, отсевают в пробирки со скошенным агаром и ставят в термостат на 18-20 ч. Если ни одна из 10 колоний не дала реакции агглютинации, дают отрицательный ответ.
Третий день исследования
Вынимают из термостата посевы и просматривают их. На МПА энтеропатогенные кишечные палочки образуют обычно влажный, блестящий, сероватый налет, реже он бывает мутным. Выросшую на скошенном агаре культуру проверяют повторно в реакции агглютинации на стекле с поливалентными эшерихиозными сыворотками (или иммуноглобулинами). Если выделенная культура дает реакцию агглютинации с поливалентной сывороткой (иммуноглобулином), то ее агглютинируют с каждой типовой сывороткой (иммуноглобулином) раздельно в разведении 1:5 – 1:10. Агглютинация с живой культурой имеет ориентировочное значение.
Далее необходимо подтвердить принадлежность выделенной культуры к роду Эшерихия биологическими тестами. Для этого производят посев культуры на полужидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой и другими сахарами, а также на бульон или пептонную воду для определения образования индола и сероводорода. Для этого в пробирки под пробку опускают две индикаторные бумажки, смоченные реактивами, выявляющими образование этих веществ. Одна бумажка при наличии индола краснеет, другая при наличии сероводорода чернеет.
При ферментации Сахаров реакция среды становится кислой и цвет индикатора изменяется. Если, помимо кислоты, образуется газ, в среде появляются пузырьки. Одновременно определяют подвижность бактерий: делают посев в полужидкий (0,2%) агар уколом. Подвижные бактерии дают помутнение всей среды, неподвижные – растут только по уколу.
Для окончательной идентификации выделенной культуры ставят развернутую реакцию агглютинации с живой и гретой культурами: с живой – для определения К-антигена, с гретой – для определения О-антигена. Для постановки развернутой реакции агглютинации антиген готовят следующим образом: 3-5 мл изотонического раствора натрия хлорида смывают культуру со скошенного агара. Полученную суспензию разливают в две пробирки. Одну из них прогревают на водяной бане при 100° С в течение часа.
Развернутую реакцию агглютинации ставят в двух рядах пробирок. Сыворотку в обоих рядах разводят в соотношении 1:50 – 1:100 (в 1-й пробирке) до титра, указанного на этикетке ампулы с сывороткой. В первый ряд добавляют по 2 капли живой культуры, во второй – по 2 капли гретой культуры.
Пробирки встряхивают и помещают в термостат на 18-24 ч.
Четвертый день исследования
Производят учет изменений сред Гисса, регистрируют образование индола и сероводорода.
Большинство представителей эшерихий ферментирует углеводы с образованием кислоты и газа, расщепляет белковый питательный субстрат до образования индола.
Учет пробирочной реакции агглютинации проводят при помощи лупы или агглютиноскопа. Агглютинация с живой культурой крупнохлопчатая, с убитой – мелкозернистая. Реакцию считают положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а живая культура агглютинируется сывороткой, разведенной не менее чем 1:200. Играет роль и соотношение антител к гретой и живой культуре. Разведение сыворотки, в котором отмечается агглютинация с гретой культурой, должно превышать разведение сыворотки, в котором агглютинируется живая культура, не менее чем в 2 раза. В табл. 31 приведены различные варианты результата реакции агглютинации.
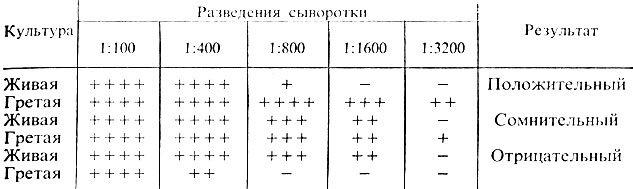
Таблица 31. Результаты реакции агглютинации с культурами эшерихий
Примечание. Возможны три варианта реакции: 1) гретая культура агглютинируется сывороткой в больших разведениях, чем живая, реакция – положительная; 2) живая и гретая культура дают агглютинацию в одинаковых разведениях сыворотки. Такой результат может свидетельствовать об отсутствии в культуре К-антигена; агглютинация живой и гретой культур в