Стромальные опухоли желудочно кишечного

Гастроинтестинальные стромальные опухоли – группа редких злокачественных новообразований желудочно-кишечного тракта мезенхимального происхождения. Клинические проявления зависят от локализации неоплазии. Возможны ощущение быстрого насыщения, боли, вздутие живота, кровотечения и явления кишечной непроходимости. На поздних стадиях выявляются снижение веса, лихорадка, анемия, гипертермия и нарушения функции органов, пораженных отдаленными метастазами. Диагноз выставляют на основании жалоб, данных объективного осмотра, КТ, УЗИ, эндоскопического исследования и результатов биопсии. Лечение – операция, химиотерапия.
Общие сведения
Гастроинтестинальные стромальные опухоли (ГИСО) – группа новообразований неэпителиального происхождения, располагающихся в подслизистом слое полых органов желудочно-кишечного тракта. В 60-70% случаев поражают желудок, в 20-30% – тонкий кишечник, в 5% – прямую кишку, менее чем в 5% – пищевод. В отдельных случаях выявляются в области сальника, брыжейки и забрюшинного пространства, хотя механизм развития таких неоплазий за пределами полых органов пока не изучен. Гастроинтестинальные стромальные опухоли составляют менее 1% от общего количества онкологических поражений ЖКТ. Обычно развиваются после 40 лет, пик заболеваемости приходится на 55-60 лет.
На момент обнаружения некоторые новообразования данной группы могут выглядеть доброкачественными, однако специалисты всегда рассматривают подобные опухоли как потенциально злокачественные. Нередко наблюдается агрессивное течение, на момент постановки диагноза у 15-50% пациентов выявляется метастатическое поражение печени или брюшины. Реже гастроинтестинальные стромальные опухоли метастазируют в кости, плевру и легкие. Основной причиной развития считают наследственную предрасположенность. Некоторые исследователи указывают на связь между видом мутации и уровнем расположения неоплазии. Лечение осуществляют специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
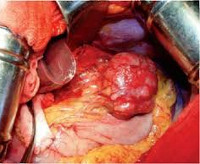
Гастроинтестинальные стромальные опухоли
Классификация гастроинтестинальных стромальных опухолей
До 80-х годов прошлого века специалисты считали, что новообразования данной группы происходят из гладкомышечной ткани и рассматривали подобные опухоли как леомиосаркомы, лейомиомы и лейомиобластомы. После внедрения в клиническую практику иммунногистохимических методик и электронной микроскопии было установлено, что клетки гастроинтестинальных стромальных опухолей происходят из интерстициальных клеток Кахаля, представляющих собой связующее звено между интрамуральными узлами периферической нервной системы и клетками гладких мышц полых органов ЖКТ. Одной из основных функций таких клеток является координация перистальтики стенки пищевода, желудка и кишечника.
Макроскопически гастроинтестинальные стромальные опухоли представляют собой рыхлые мягкие узлы розоватого, серого или светло-коричневого цвета с участками ослизнения. Диаметр узлов может колебаться от 1 до 35 см. В процессе роста такие новообразования могут сливаться, образуя конгломераты или кистозные структуры. В центре крупных неоплазий обычно обнаруживаются участки некроза, в ткани новообразований видны кистозные полости с кровоизлияниями.
При микроскопическом исследовании образца гастроинтестинальной стромальной опухоли обнаруживаются веретенообразные и эпителиолидные клетки, располагающиеся на расстоянии друг от друга либо группирующиеся в скопления, разделенные тонкими прослойками соединительной ткани. Отмечается полиморфизм клеток. Веретенообразные клетки образуют пучки и завитки. Эпителиолидные клетки имеют более четкие границы, форма таких клеток округлая или полигональная. Цитоплазма веретенообразных и эпителиоидных клеток светлая, ядра клеток округлые или овальные.
С учетом особенностей гистологического строения выделяют следующие типы гастроинтестинальных стромальных опухолей:
- Веретеноклеточные. Составляют около 70% от общего количества стромальных новообразований. Преобладают веретенообразные клетки с округлыми или вытянутыми мономорфными ядрами.
- Эпителиоидные. Встречаются в 20% случаев стромальных неоплазий. Преобладают полигональные или округлые клетки с овальными или округлыми светлыми ядрами.
- Илеоформные. Составляют 10% от всех гастроинтестинальных стромальных опухолей. Отмечается выраженный клеточный полиморфизм.
Кроме того, выделяют редко встречающиеся онкоцитарные, мезотелиомоподобные и перстневидноклеточные ГИСО.
Симптомы гастроинтестинальных стромальных опухолей
Патогномоничные симптомы отсутствуют, клиническая картина определяется расположением новообразования. Возможны затруднения глотания, чувство преждевременного насыщения, вздутие или боли в животе. У 20% больных гастроинтестинальная стромальная опухоль на начальных стадиях протекает бессимптомно. Из-за неспецифичности и неяркой выраженности проявлений пациенты обращаются к врачу в среднем через 4-6 месяцев после появления первых признаков болезни. Нередко такие неоплазии становятся случайной находкой при проведении КТ, эзофагогастродуоденоскопии и других исследований. Иногда гастроинтестинальные стромальные опухоли обнаруживают во время хирургического вмешательства по поводу другого заболевания.
При прогрессировании онкологического процесса более чем у половины больных наблюдаются желудочно-кишечные кровотечения, сопровождающиеся меленой или кровавой рвотой. У многих пациентов развивается постгеморрагическая анемия. Высокая вероятность кровотечений при ГИСО объясняется частым изъязвлением новообразования. У 10-30% больных гастроинтестинальными стромальными опухолями отмечаются признаки кишечной непроходимости. На поздних стадиях выявляются снижение массы тела, потеря аппетита, слабость и увеличение живота, обусловленное асцитом и/или растущим новообразованием. При пальпации живота определяется опухолевидное образование. При метастазировании в печень возможно увеличение органа и желтуха той или иной степени выраженности.
Диагностика гастроинтестинальных стромальных опухолей
Лечение гастроинтестинальных стромальных опухолей
Основным методом лечения ГИСО является хирургическое вмешательство. Объем операции определяется в зависимости от локализации и распространенности неоплазии. Стандартом является радикальная резекция патологических очагов вместе с 1-2 см окружающих здоровых тканей. Удаленную гастроинтестинальную стромальную опухоль отправляют на срочное микроскопическое исследование, при выявлении злокачественных клеток по линии разреза осуществляют иссечение пораженного участка.
Из-за редкого лимфогенного метастазирования лимфаденэктомию не производят (за исключением гастроинтестинальных стромальных опухолей прямой кишки, которые в 25-30% случаев метастазируют в лимфоузлы). При единичных метастазах в печени выполняют радиочастотную термоабляцию или оперативное удаление вторичной опухоли. При неоперабельных новообразованиях назначают предоперационную химиотерапию, затем проводят повторное обследование. При появлении признаков резектабельности новообразование иссекают, в остальных случаях продолжают лечение химиопрепаратами.
Прогноз зависит от расположения, распространенности и размера гастроинтестинальной стромальной опухоли. Средняя пятилетняя выживаемость составляет 48%. До 5 лет с момента радикального хирургического вмешательства удается дожить 50% больных, при опухолях диаметром более 10 см этот показатель снижается до 20%. Отмечается высокая вероятность рецидивирования, в течение 2 лет после радикальной резекции рецидивы выявляются у 80% пациентов. Средняя продолжительность жизни при неоперабельных гастроинтестинальных стромальных опухолях по различным данным колеблется от 10 до 21 месяца.
Источник
Гастроинтестинальные стромальные опухоли (ГИСО, ГИСТ) появились чуть больше 20 лет назад, когда усовершенствовали электронный микроскоп, их выделили из компании разнообразных лейомиом. ГИСТ – русскоязычная аббревиатура с английского. Это опухоли зрелого возраста, до 40 лет они встречаются очень редко, преобладают мужчины в середине седьмого десятка жизни. Предполагается, что заболеваемость не растет, просто диагностика стала лучше.

Причина стромальных опухолей
Стромальные опухоли происходят из мезенхимы, из которой у зародыша формируется соединительная ткань и мышцы, некоторые оболочки сосудов и кожа. Причина ГИСО – сбой в формировании гладкомышечной ткани. Подозревают, что родоначальником ГИСО становятся клетки, отвечающие за ритмичное сокращение – перистальтику органов желудочно-кишечного тракта. Они обладают электрической активностью и переносят возбуждение с нервного волокна на мышечное, поэтому носят сложное имя «возбудимые интерстициальные клетки Кахала». ГИСТ и клетки Кахала похожи по строению и обладают мутировавшим геном c-kit, кодирующим синтез определенного белка.
В ГИСО белок отвечает за все жизненно важные процессы, а поскольку он регулирует образование и жизнь опухолевых клеток, он становится онкобелком. Мутировавший с-KIT имеется в 95 из сотни гастроинтестинальных стромальных новообразований. ГИСО не наследуются, не имеют «своего предрака», возникают на фоне полного здоровья, не существует факторов риска. Если вы эпизодически ощущаете желудочный дискомфорт, пройдите обследование в Европейской онкологической клинике, специалисты которой знают всю патологию ЖКТ.
Диагностика ГИСО
В диагностике ГИСО возможности клиники определяют всё – нет возможностей – нет такого заболевания. Идеально сочетание эндоскопии с УЗИ – эндосонография, которая позволяет видеть внутри и за пределами желудка – состояние рядом находящихся структур и всю толщину желудочной стенки.
Главный диагностический критерий – иммуногистохимическое выделение в опухолевых клетках онкобелка KIT (CD117). Этот онкобелок синтезируют мелкоклеточный рак легкого и глиобластома, лейкоз из тучных клеток, метастазы меланомы и сосудистые образования, то есть возможен ложноположительный ответ при не гастроинтестинальной стромальной опухоли, к примеру, при поражении желудка или кишки лейкозом.
Дикими называют стромальные опухоли без с-KIT, таких пять на сотню всех гастроинтестинальных новообразований, внешне они ничем не отличаются от положительных по с-KIT, но течение и реакция на лекарственные препараты у них другая. Поскольку при диагностике с-KIT определяется только в двух экзонах из четырех, но в двух не исследуемых он может быть. В диких опухолях возможна мутация альфа-PDGFR или рецептора инсулинового фактора роста (IGF1R). Когда вообще не находят ни единого маркера, то выполняется молекулярно-генетический анализ, он способен выделить стромальную опухоль, негативную по всем известным критериям диагностики.
ГИСО растет под неизмененной слизистой, заметить маленький узел может только специалист с большим опытом наблюдения стромальных образований.
Симптомы стромальных опухолей желудка
Каждую пятую опухоль обнаруживают случайно при обследовании по другому поводу, узел же может постигать трети метра, ничем серьезным себя не проявляя. Причина частого бессимптомного течения – подслизистый рост, когда опухоль распластывается в стенке и выбухает наружу – в брюшную полость. К моменту обнаружения стромального образования у каждого третьего уже выявляются метастазы, преимущественно в печень, часто – канцероматоз брюшины, а вот легочная ткань поражается нечасто.
Никаких специфических проявлений нет, такие же симптомы возникают при других заболеваниях желудочно-кишечного тракта. В среднем от появления первых признаков неблагополучия до выявления патологического образования проходит почти полгода.
Клиника похожа на гастрит: быстрое насыщение малыми порциями еды, чувство распирания под ложечкой, может быть эпизодическое вздутие живота. По мере увеличения узла появляется тошнота и рвота недавно съеденным. Боли нехарактерны, они отмечаются только у каждого седьмого пациента и практически никогда не бывает клинической картины «острого живота». ГИСТ не прорастает в другие органы, а оттесняет их с анатомического «законного» места.
У половины пациентов имеются признаки желудочного кровотечения: слабость, анемичность крови, эпизоды жидкого черного стула из-за изъязвления слизистой над распадающейся крупной ГИСТ.
Что характерно только для ГИСТ?
Это не клинические симптомы, а сочетание стромальной опухоли с другими новообразованиями у девочек и молодых женщин. Синдром проявляется в сочетании ГИСО с параганглиомой, как правило, на шее или в животе, и доброкачественными гамартомами легких. Называется триада Карнея, сегодня таких пациентов чуть больше сотни. Гамартомы никак себя не проявляют, их обнаруживают при рентгеновском обследовании, а гормонально активная параганглиома вызывает повышение давления. Составляющие триаду процессы появляются с интервалом в несколько лет.
Когда гастроинтестинальное стромальное образование сопровождается множественными параганглиомами, то это синдром Карнея-Стратакиса, он генетически наследуется и вызван недостатком одного фермента, опять-таки поражает женщин. От врачей зависит своевременность выявления возможных метастазов, когда они хорошо лечатся. В Европейской онкологической клинике кумулирован опыт клинического наблюдения,что помогает изменить прогноз заболевания на благоприятный.
Лечение и химиотерапия
При любой злокачественной опухоли радикально лечит только удаление, и при ГИСТ ведущий метод – хирургический. При поражении желудка выполняются резекция или удаление всего органа – гастрэктомия, всё зависит от объема поражения. Лапароскопические операции следует делать только в специализированных учреждениях, поскольку имеется опасность разрыва неплотной псевдокапсулы с выбросом опухолевых клеток в брюшную полость.
Химиотерапия иматинибом имеет хорошую перспективу при наличии мутации гена с-KIT, применяется при метастатической стадии или рецидиве после операции, перед хирургическим этапом для уменьшения размера образования и объема операции. Доза иматиниба зависит от расположения мутации гена KIT, так она увеличивается двукратно при мутации в 9 экзоне. При прогрессировании на фоне химиотерапии используют лекарства второй линии: сунитиниб и дазатиниб. Их используют и при устойчивости ГИСО к иматинибу. В качестве третьей линии лечения применяется регорафениб.
Все ГИСТ активные химиопрепараты относятся к таргетным средствам – точно нацеленным, что не исключает токсические реакции на них. Химиотерапия не обязательно должна сопровождаться плохим качеством жизни, у специалистов Европейской онкологической клиники есть возможности минимизации побочных реакций. А при метастазах ГИСО в печени в клинике выполняется методика радиочастотной аблации, которой владеют единицы российских специалистов.
Источник
Е.Б. ШАХНОВИЧ, врач-онколог МСЧ №4 ФМБА России (Москва)
Болезнь среднего и пожилого возраста
Гастроинтестинальные стромальные опухоли (GIST-Gastrointestinal Stromal Tumors), впервые описанные в 1983 г. M.T. Mazur и H.B. Clark, относятся к наиболее часто диагностируемым мезенхимальным опухолям ЖКТ. Раньше GIST классифицировались как один из многочисленных типов сарком мягких тканей, включавших опухоли из гладкомышечной ткани (лейомиомы, лейомиобластомы и лейомиосаркомы), а также опухоли из нервного гребня (шванномы). На сегодняшний день GIST – это самостоятельная нозологическая единица, имеющая индивидуальные гистологические, иммуногистохимические и молекулярно-генетические признаки.
GIST чаще всего встречаются в среднем или пожилом возрасте и редко развиваются у лиц моложе 40 лет. Согласно анализу данных американского регистра SEER (Surveillance Epidemiology and End Results), средний возраст на момент постановки диагноза составлял 63 года. А по данным двух европейских популяционных исследований – от 66 до 69 лет. Заболеваемость мужчин и женщин GIST схожа, хотя данные некоторых исследований позволяют предположить несколько более высокую предрасположенность у мужчин. Указанные опухоли, как правило, развиваются в желудке (40-60% случаев) и тонкой кишке (30-35% случаев), реже встречаясь в ободочной или прямой кишке (5-16% случаев) и пищеводе (не более 1% случаев).
Кошачьей саркомой болеет и человек
GIST характеризуются специфичными гистологическими особенностями, в частности, наличием в морфологической картине веретеновидных, эпителиоидных, а в некоторых случаях – плейоморфных мезенхимальных клеток. Для них характерен и ряд фенотипических характеристик, присущих кишечным «водителям ритма», известным также как интерстициальные клетки Кахаля.
Согласно результатам иммуногистохимического анализа практически во всех GIST экспрессируется белковый гомолог вирусного онкогена v-kit кошачьей саркомы Hardy/Zuckerman (кластер дифференцировки 117 [CD117]), трансмембранный тирозинкиназный рецептор фактора роста стволовых клеток.
К прочим идентифицированным при помощи иммуногистохимических методов маркерам относятся: молекула, условно названная как discovered on GIST 1 (DOG1) (которая присутствует в 87% GIST), протеинкиназу тэта (приблизительно в 80% случаев), CD34 (60-70%), а также актин гладкомышечных клеток (30-40%). В некоторых же GIST отмечаются также положительные результаты иммунологических анализов на белок S-100 (5%), десмин (1-2%) и кератин (1-2%) (1, 5-8).
Характерный иммуногистохимический профиль GIST можно использовать для дифференциального диагноза между ними и гладкомышечными опухолями (т.е. истинными лейомиомами и лейомиосаркомами), а также шванномами.
Ключевое молекулярное событие
Охарактеризовать ключевое молекулярное событие, лежащее в основе этиологии неопластической трансформации, приводящей к развитию подобных опухолей, стало возможным вследствие идентификации в 1998 году мутаций протоонкогена KIT, сопровождающихся активацией его функций. Ген KIT кодирует блок KIT, выступающий в качестве трансмембранного рецептора фактора роста стволовых клеток. Кроме того, аналогичные, однако взаимоисключающие, мутации были затем также идентифицированы в небольшом количестве GIST и со стороны гена, кодирующего ?-рецептор тромбоцитарного фактора роста (PDGFR?).
Мутации KIT и PDGFR? характеризуются вполне определенными клинико-патоморфологическими фенотипами. Например, GIST с мутациями экзона 9 гена KIT, имеющимися приблизительно у 10-15% пациентов с подобными опухолями, часто расположены в тонкой кишке, в то время как мутации PDGFR? (имеющиеся приблизительно в 5% случаев GIST) более распространены в эпителиоидных стромальных опухолях, развивающихся в желудке.
Вместе с тем мутации генов KIT и PDGFR? присутствуют не во всех GIST: подобных мутаций нет в 10-15% случаев новообразований. Следует отметить, что мутации генов KIT или PDGFR? приводят к конститутивной активации тирозинкиназы рецепторов KIT и PDGFR? соответ-cтвенно.
Точный диагноз GIST следует основывать на морфологии опухоли и иммуногистохимических данных. Согласно руководствам NCCN и ESMO при очагах размером от 2 см и выше показано иссечение и биопсия. Что же касается мелких очагов (до 2 см), в руководствах ESMO признаются сложности, связанные с проведением биопсии, и рекомендуется эндо-cкопическое УЗИ и далее – наблюдение. А вот иссечение считается целесообразным лишь для очагов в пищеводе, желудке и в двенадцатиперстной кишке в случае увеличения их размера. При очагах в прямой кишке иссечение считается показанным вне зависимости от их размера.
Локализация очага крайне важна
Согласно совместному заявлению, принятому в 2001 году объединенной рабочей группой национальных институтов здоровья, созданной для изучения GIST, риск агрессивных клинических характеристик следует стратифицировать на основании размера опухоли и количества митозов. Вместе с тем в руководствах ESMO и NCCN признается также тот факт, что согласно более современной классификации еще большей прогностической значимостью обладает и локализация опухолевого очага.
Это положение основано на наблюдении лучшего прогноза при GIST, расположенных в желудке, по сравнению с небольшими стромальными опухолями кишечника, в том числе прямой кишки, того же размера и с тем же количеством митозов. Кроме того, руководствами ESMO признается важность разрыва опухоли (как спонтанного, так и при выполнении хирургической резекции) в качестве неблагоприятного прогностического фактора, учитывая сопровождающую его контаминацию брюшины.
Стандартом в случаях локализованных форм GIST является хирургическое лечение, которое, к сожалению, дает неудовлетворительные результаты: почти у 50% больных развивается рецидив в течение 5 лет после операции. В то же время химиотерапия и лучевая терапия малоэффективны в борьбе с этими патологиями. Действенность этих методов составляет около 15%.
Новая эра в лечении GIST
С открытием иматиниба мезилата (таргетный препарат, ингибитор тирозинкиназ рецепторов c-kit, PDGFRa, PDGFRb, BCR-ABL) началась новая эра в лечении больных. Результаты нескольких исследований позволяют говорить о целесообразности применения иматиниба (Гливека) у пациентов, относящихся к категории повышенного риска, после хирургической резекции. В частности, американское исследование III фазы Z9001, проведенное ACOSOG (American College of Surgeons Oncology Group,), представляло собой крупное, рандомизированное, двойное слепое исследование, в котором изучались пациенты с GIST размером не менее 3 см, с экспрессией KIT.
Результаты этого исследования были основаны на данных по 682 получавшим лечение пациентам, по которым было показано, что адъювантная терапия Гливеком в дозе 400 мг в сутки позволяла существенно повысить безрецидивную выживаемость в течение 1 года по сравнению с плацебо. Согласно ESMO нет общепринятой точки зрения о целесообразности применения Гливека в качестве адъювантной терапии по поводу локализованных GIST, хотя у пациентов с высоким риском рецидивирования этот препарат можно использовать в качестве адъювантной терапии в течение 1 года.
В США на основании данных, полученных в проведенном ACOSOG исследовании III фазы Z9001, Гливек (в дозе 400 мг в сутки) применяется для адъювантной терапии у взрослых пациентов после полного хирургического удаления GIST с положительным статусом по KIT.
В прошлом возможности лечения пациентов с рецидивированием заболевания или метастатическим процессом были ограничены. Однако в настоящее время, согласно данным, полученным в клинических исследованиях по изучению Гливека в данной популяции, ожидаемая медиана продолжительности жизни после постановки диагноза составляет от 4 до 5 лет.
Стойкие объективные ответы
Первоначальные результаты исследования II фазы B2222 продемонстрировали достижение стойких объективных ответов у пациентов с распространенными GIST при использовании Гливека в дозах от 400 до 600 мг в сутки, при этом полученные для 2 различных доз результаты были схожими (частота частичных ответов – 53,7%; частота стабилизации заболевания – 27,9%). Согласно данным последующего долговременного наблюдения за участниками этого исследования, применение Гливека позволило увеличить продолжительность жизни пациентов таким образом, что медиана составляла 57 месяцев, при этом отмечались схожие благоприятные эффекты у пациентов, как достигших объективных ответов, так и достигших стабилизации заболевания.
Исследования S0033 и EORTC 62005 представляли собой 2 многоцентровых рандомизированных исследования III фазы, в которых проводилось сравнение приема Гливека в стандартной дозе (400 мг в сутки) с приемом Гливека в высокой дозе (800 мг в сутки) у пациентов с распространенными GIST, при этом в случае прогрессирования на стандартной дозе допускался переход в группу высокой дозы. Согласно первоначальному отчету по исследованию EORTC 62005 можно было сделать вывод о том, что применение Гливека в высоких дозах увеличивало продолжительность жизни без прогрессирования по сравнению со стандартной дозой.
Однако при долговременном наблюдении (медиана которого составила 40 месяцев) продолжительность жизни без прогрессирования на 2 уровнях доз оказалась схожей. Более того, в исследовании S0033 не было обнаружено никакой значимой разницы в исходах между 2 уровнями доз Гливека. Общая продолжительность жизни для 2 доз была идентичной. Вместе с тем в субпопуляции пациентов, у которых имелись мутации экзона 9 гена KIT, применение Гливека в высоких дозах обладало значимым благоприятным эффектом на продолжительность жизни без прогрессирования по сравнению со стандартной дозой.
Эти пациенты раньше считались неоперабельными
ESMO предлагает применение Гливека в дозе 400 мг в сутки, за исключением пациентов с мутациями экзона 9 гена KIT. Рекомендуемая начальная доза у них составляет 800 мг в сутки. При развитии прогрессирования опухоли на дозе в 400 мг/сут дозу Гливека следует увеличить до 800 мг/сут. Это может оказаться особенно оправданным при наличии мутаций в экзоне 9.
Канадскими руководствами предлагается рассмотреть вопрос об использовании начальной дозы в 800 мг/сут при наличии мутации экзона 9 гена KIT или мутации PDGFR? D842V (замена валином (V) аспарагиновой кислоты (D) в аминокислотном остатке 842 продуктов гена PDGFR?) при рецидивирующем или метастатическом заболевании. Кроме того, ими рекомендуется также рассмотреть вопрос об увеличении дозы до 800 мг/сут у пациентов, ранее достигших ответа, в случае развития прогрессирования или вторичной резистентности.
У некоторых пациентов с GIST, ранее считавшихся нерезектабельными, применение Гливека может сделать возможным проведение хирургического лечения. Неоадъювантная терапия Гливеком рекомендована руководствами ESMO тем пациентам, у которых не представляется возможным выполнение оперативного вмешательства, а также у пациентов, которым показаны менее травматичные циторедуктивные оперативные вмешательства.
Руководствами NCCN рекомендуется неоадъювантная терапия Гливеком при погранично-резектабельных опухолях, а применительно к резектабельным GIST – в случае высокого риска, обусловленного сопутствующими заболеваниями. Что касается канадских руководств, то согласно их рекомендациям решать вопрос о неоадъювантной терапии Гливеком следует в случаях, когда выполнение оперативного вмешательства характеризуется высоким риском осложнений или утраты функции органа и можно решать вопрос о выполнении последующего оперативного вмешательства в промежуток от 4 до 12 месяцев после максимального уменьшения размеров опухоли.
Могут возникнуть вторичные мутации
Однако в период лечения иматинибом могут возникать вторичные мутации, приводящие к развитию резистентности к нему (вторичная резистентность), а у 12-14% больных GIST имеется первичная резистентность к иматинибу. У 7% больных отмечается непереносимость препарата. В таких случаях, согласно руковод-cтвам ESMO и NCCN, обоснован переход на сунитиниб малат (мультитаргетный ингибитор тирозинкиназ рецепторов PDGFRa и b, VEGF 1 (flt) и 2 (flt), c-kit, FLT3, обладающий противоопухолевой и антиангиогенной активностью), который был одобрен в качестве терапии второй линии по поводу GIST в случае прогрессирования заболевания и непереносимости иматиниба.
Сунитиниб обладает активностью против KIT и PDGFR?, а также других путей, имеющих значение в патогенезе таких опухолей, в частности, в отношении рецептора сосудистого эндотелиального фактора роста. В рандомизированном исследовании III фазы применение сунитиниба в дозе 50 мг в сутки в режиме, состоящем из циклов по 4 недели лечения с 2 неделями без лечения, позволило существенно увеличить время до прогрессирования, по сравнению с плацебо, у пациентов с распространенными GIST, характеризовавшимися резистентностью к иматинибу или его непереносимостью. Отмечается активность сунитиниба при непрерывном приеме в дозе 37,5 мг, с благоприятными результатами сравнения подобного с режимом терапии в течение 4 недель с последующими 2 неделями перерыва. Кроме того, сунитиниб, по-видимому, обладает активностью в отношении вторичных мутаций, затрагивающих центр связывания аденозинтрифосфата (АТФ), но не в отношении вторичных мутаций, затрагивающих петлю активации KIT, при этом обе подобные разновидности мутаций резистентны к иматинибу.
Изучаются и другие препараты
В лечении GIST изучается и ряд других препаратов, включая нилотиниб, маситиниб, дазатиниб и сорафениб. Нилотиниб представляет собой тирозинкиназный ингибитор второго поколения, для которого характерно достижение более высоких внутриклеточных концентраций при данных новообразованиях по сравнению с иматинибом, что позволяет предположить потенциальную активность этого соединения в отношении некоторых клеточных линий, резистентных к иматинибу.
Недавно было завершено регистрационное исследование III фазы применения нилотиниба в качестве терапии третьей линии у пациентов с GIST после утраты эффективности как иматиниба, так и сунитиниба. В этом исследовании 248 больных были рандомизированы либо в группу нилотиниба (в дозе по 400 мг 2 раза в сутки), либо в группу оптимальной поддерживающей терапии, которая могла включать, а могла и не включать, тирозинкиназный ингибитор.
При прогрессировании пациентам разрешалось перейти в группу нилотиниба. Начато рандомизированное исследование III фазы по сравнению нилотиниба в дозе 800 мг в сутки и иматиниба в дозе 800 мг в сутки в качестве терапии первой линии у пациентов с распространенными и/или метастатическими опухолями.
Маситиниб, ингибитор тирозинкиназы c-KIT немутантного типа и его активированных форм – PDGFR?, PDGFR?, Lyn-киназы/киназы очаговой адгезии, а также рецептора 3 фактора роста фибро-бластов – изучен в исследовании I фазы у пациентов с GIST в повышающихся дозах. Максимальной переносимой дозы в этом исследовании достигнуто не было. Однако доза в 12 мг/кг была сочтена максимальной, которую можно рекомендовать для долговременной терапии, а также была продемонстрирована клиническая активность маситиниба. В настоящее время проводится исследование II фазы монотерапии маситинибом у пациентов, ранее не получавших иматиниб, у которых имеются неоперабельные, местно-распространенные или метастатические GIST.
Предварительные результаты говорят о частоте достижения контроля заболевания в 97%, медиане продолжительности жизни без прогрессирования в 44 месяца, 2-летней выживаемости без прогрессирования в 60% и 3-летней общей выживаемости в 90%, наряду с относительно хорошей переносимостью побочных эффектов.
Итак, GIST являются относительно редкими новообразованиями, лечение которых подразумевает использование мультидисциплинарного подхода. За последние несколько лет были опубликованы 3 крупных руководства по ведению пациентов с данными опухолями, основные моменты которых и отражены в данном обзоре. Несмотря на некоторые расхождения между ними, рекомендации, содержащиеся в этих руководствах, схожи.
Источник