Тирозиновая трнк кишечной палочки

В классических учебниках молекулярной биологии структура мРНК эукариот охарактеризована весьма чётко — метилированный гуанин, связанный через трифосфатную группу с 5′-концом РНК (5′-кэп), 5′-нетранслируеамая область (НТО) с сайтом «посадки» рибосомы, кодирующая белóк последовательность, 3′-НТО и поли(А)-хвост. Наличие последнего считается критическим фактором — отщепление поли(А)-хвоста, или деаденилирование, вызывает деградацию мРНК. Однако последние работы показали, что поли(А) является не единственно возможной 3′-терминальной последовательностью — к этому «хвосту» может быть дополнительно присоединён поли(У)-«хвостик» различной длины.
Известно, что матричная РНК (мРНК) является главным посредником между ДНК и белок-синтезирующим аппаратом. У прокариотических организмов только что транскрибированная мРНК функционально активна и начинает транслироваться немедленно. У эукариот же после транскрипции пре-мРНК подвергается созреванию. Только правильно созревшая мРНК транспортируется из ядра в цитоплазму и служит матрицей для синтеза белка.
Поскольку количество вновь синтезированного белка прямо пропорционально количеству содержащейся в цитоплазме соответствующей мРНК, регуляция времени жизни последней является критическим фактором, регулирующим скорость синтеза белкá. Нарушения этой регуляции ведут к катастрофическим процессам, — в частности, потере контроля над основными процессами в клетке и трансформации клетки в раковую. Поэтому любая мРНК имеет схожую структуру — кодирующая область в центре и регуляторные фрагменты по краям (рис. 1).
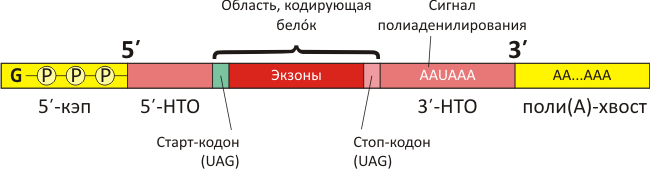
Рисунок 1. Строение мРНК эукариот. Любая мРНК начинается с кэпа (от англ. cap — шапка, кепка) — метилированного остатка гуанина, который присоединён нестандартной связью (через три фосфатных группы). Наличие кэпа критично для функционирования мРНК в клетке. За ним следует 5′-нетранслируемая область (НТО), которая не кодирует белóк: её функция — «узнавание» рибосомы и регулирование трансляции. Сама кодирующая область начинается после «стартового» нуклеотидного триплета АUG и заканчивается стоп-кодоном (UGA или другими). За стоп-кодоном следует 3′-НТО, которая также важна для регуляции синтеза белка. Заканчивается вся молекула поли(А)-хвостом, который, как оказалось, всё-таки может состоять не только из аденозинов, но также включать остатки уридина (см. текст).
Основной механизм регуляции известен: на 3′-конце каждой мРНК находится регуляторная последовательность, состоящая практически полностью из одного нуклеотида — аденозина (А), из-за чего она и получила название поли(А)-хвост. Её длина регулируется рядом ферментов — она может и удлиняться, и обрезаться. Известно, что почти всегда длина поли(А)-хвоста определяет время жизни (точнее, полураспада) всей молекулы. Когда поли(А)-хвост укорачивается настолько, что не может более выполнять свои функции (связывать регуляторный комплекс белков), происходит отрезание кэпа ферментом Dcp1. Стандартная схема распада мРНК начинается с постепенного деаденилирования 3′-конца экзонуклеазой PARN. После этого мРНК уже не может участвовать в инициации транскрипции, и расщепляется экзонуклеазами.
В общем, наличие и функции поли(А)-хвоста неоспоримо важны. Но недавно оказалось, что не только поли(А) выполняет роль такого регулятора. Было открыто явление уридинилирования 3′-конца мРНК, т. е. модификация поли(А)-хвоста поли-уридином (поли(У)) [2]. Обнаружилось, что поли(А)-хвост может модифицироваться одним или многими остатками уридина, что, по-видимому, ведёт к инициации расщепления мРНК. Такой механизм уже обнаружен у ряда организмов (одноклеточных водорослей Chlamydomonas reinhardtii, дрожжей Schizosaccharomyces pombe, лягушки Xenopus laevis, цветкового растения Arabidopsis thaliana) и, вероятно, будет обнаружен и у многих других.
Такая распространённость заставляет взглянуть на поли-уридинилирование мРНК как на универсальный второй путь регуляции «жизни» мРНК в клетке. Сведений пока ещё очень мало, но уже открыта белковая машинерия, обеспечивающая «пришивку» уридина к мРНК, — это семейство терминальных уридиниловых терминаз (TUTases, PUPases) [3]. Ранее было известно, что они модифицируют некоторые малые ядерные РНК (например U6) и таким образом стабилизируют их структуру и время жизни. Однако в случае мРНК, модификация её «поверх» поли(А) уридином (достаточно всего нескольких нуклеотидов) вызывает узнавание мРНК специальным комплексом вызывающих деградацию ферментов — Lsm1–7, — которые запускают процесс деградации мРНК по стандартной схеме: деаденилирование, декэпирование и экзонуклеазное расщепление. И хотя наличие нескольких уридинов на 3′-конце может показаться не очень важной деталью, всё-таки это не так. Для этого сделаем короткий экскурс в методы современной молекулярной биологии.
Мониторинг мРНК в клетках (как тотальной, так и отдельных типов) на сегодня является одним из самых точных методов для описания состояния клетки и, соответственно, — целых органов. Дело в том, что ДНК является стандартной «базой данных», одинаковой во всех тканях организма (с некоторыми оговорками, на которых мы тут останавливаться не будем). Однако намного более важно узнать, какие гены и с какой интенсивностью активируются в каждой ткани или органе. Самая ценная информация — это уровень экспрессии индивидуальных генов в определённый отрезок времени. Анализ профиля синтеза белков по регистрации присутствия самих белковых молекул может быть недостаточно точен, поскольку многие белки довольно стабильны и могут сохраняться достаточно долгое время. Кроме того, основной метод их регистрации — при помощи антител (вестерн-блоттинг) — довольно капризен, и не во всех случаях может помочь. По этой причине анализ присутствия самих белков не во всех случаях может дать ответ на многие вопросы, которые можно получить, анализируя содержание мРНК и профили её экспрессии. Анализ «спектра» мРНК даёт намного более ценную информацию об активности генов — за счёт короткого времени жизни РНК в цитоплазме мы всегда узнаём самые «свежие» новости, а сам метод намного более чувствителен (за счет ПЦР-амплификации исходных образцов).
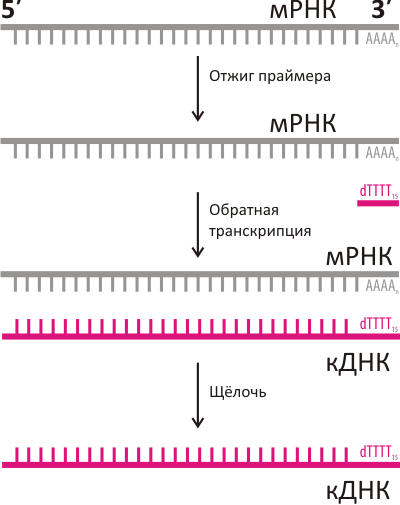
Основной подход к исследованию мРНК базируется на методе обратной транскрипции (рис. 2), происходящем из открытия Д. Балтимором, Р. Дульбекко и Г. Теминым явления обратной транскрипции у вирусов (Нобелевская премия по физиологии и медицине, 1975). Ими был описан фермент обратная транскриптаза, который, используя молекулу РНК в качестве матрицы, строит вторую, комплементарную, цепь, но уже ДНК. Такая одноцепочечная комплементарная ДНК получила название кДНК (cDNA). Лабораторными методами эту кДНК можно «умножить» в миллионы раз и сохранить для последующего анализа. На методе обратной транскрипции базируются многие современные методы исследования для анализа клеточной системы транскрипции-трансляции.
Однако тут есть один нюанс — чтобы обратная транскрипция началась, нужна короткая стартовая «затравка» (праймер), которая была бы комплементарна 3′-концу РНК (рис. 2). До сегодняшнего дня в качестве универсального праймера в основном использовался олигонуклеотид поли(Т), комплементарный поли(А)-хвосту. Теперь, когда оказалось, что поли(А)-хвост не столь уж инвариантен, возникает вопрос: является ли «универсальный» поли(Т)-праймер настолько уж универсальным? В свете описанного открытия, возможно, он может не связываться и не выявлять целые пулы мРНК с уридинами на 3′-конце, которые оказываются фактически «невидимыми» для традиционных алгоритмов в молекулярной биологии. А если учесть, что метод обратной транскрипции на основе поли(Т) и последующая ПЦР-диагностика являются сейчас основными инструментами для определения экспрессии генов, открытие альтернативных 3′-концов может вызвать необходимость пересмотреть истинность целых массивов данных, которые сегодня считаются исходной базой для молекулярных исследований.
- S. Ito-Harashima, K. Kuroha, T. Tatematsu, T. Inada. (2007). Translation of the poly(A) tail plays crucial roles in nonstop mRNA surveillance via translation repression and protein destabilization by proteasome in yeast. Genes & Development. 21, 519-524;
- Olivia S Rissland, Chris J Norbury. (2009). Decapping is preceded by 3′ uridylation in a novel pathway of bulk mRNA turnover. Nat Struct Mol Biol. 16, 616-623;
- William Marzluff. (2009). A new way to initiate mRNA degradation. Nat Struct Mol Biol. 16, 613-614.
Источник
Задание 1. Выберите правильные ответы.
1. При выделении лактозного оперона из клетки использовано явление:
- а) трансформации;
- б) транспозиции;
- в) трансфекции;
- г) трансдукции
2. Первым химически синтезированным геном был ген:
- а) тирозиновой тРНК;
- б) аланиновой тРНК;
- в) лейциновой тРНК;
- г) метиониновой тРНК
3. Явление обратной транскрипции характерно для ДНК:
- а) кишечной палочки;
- б) бактериальных плазмид;
- в) ретровирусов;
- г) умеренных бактериофагов
4. Ферменты, нарезающие ДНК на фрагменты, носят название:
- а) лигазы;
- б) трансферазы;
- в) топоизомеразы;
- г) рестриктазы
5. Молекула, которую предполагается использовать в качестве вектора, должна обладать способностью к:
- а) трансформации;
- б) транспозиции;
- в) трансмиссии;
- г) трансдукции

Задание 2. Заполните пропуски в предложенных утверждениях.
1. Впервые выделение гена из клетки было осуществлено в лаборатории американского генетика … .
2. Первый синтезированный группой Кораны ген оказался неработоспособным, так как не содержал … участков.
3. Явление обратной транскрипции характерно для вирусов, геном которых состоит из … .
4. Ферменты, разрезающие молекулы ДНК в определенных точках, называются … рестриктазами.
5. Поиск фрагмента с нужным геном осуществляется на … средах.
6. Наиболее популярными прокариотическими векторами являются … .
7. Комплекс вектора и гена называется … .
8. В генной инженерии растений широко используется вектор, созданный на основе … бактерии Agrobacterium tumenfaciens.
9. Для трансформации клеток человека в качестве вектора используют вирус … .
10. Для превращения бактериальной клетки в фабрику синтеза белка или какого-либо другого биологически активного вещества ее обрабатывают … , который препятствует делению.
11. Промышленное производство биологически активных веществ с использованием методов генной инженерии называется … .
12. Короткие, меченые радиоактивными изотопами, фрагменты ДНК, которые используются для поиска введенного в клетку гена, носят название молекулярных … .
Задание 3. Укажите, какие из предложенных ниже утверждений правильные.
1. Первым геном, выделенным из клетки, был лактозный оперон Agrobacterium tumenfaciens.
2. В основе химического синтеза гена лежит процедура его “сшивки” из коротких фрагментов.
3. Для того, чтобы при введении в клетку ген экспрессировался, достаточно синтезировать его структурную часть.
4. Явление обратной транскрипции в норме наблюдается у ретровирусов.
5. Рестриктазы всегда разрезают молекулу ДНК в строго определенных местах.
6. Молекула-вектор должна обязательно обладать свойством трансмиссии.
7. Вектор может переносить в клетку только один структурный ген.
8. Вектор состоящий из плазмиды и ДНК фага λ называется космида.
9. Для того, чтобы клетка стала фабрикой синтеза нужного белка, она должна интенсивно делиться.
10. Успех в генной инженерии растений связан с созданием эффективного вектора на основе Т-ДНК Agrobacterium tumenfaciens.
Контрольные вопросы
1. Какое генетическое явление было использовано при выделении из клетки кишечной палочки лактозного оперона?
2. Что такое гетеродуплекс?
3. Почему первый химически синтезированный группой Корано ген оказался неработоспособным?
4. Кем впервые было открыто явление обратной транскрипции?
5. На какой стадии развития ретровируса происходит обратная транскрипция?
6. Как называется ДНК, которая синтезируется на РНК-матрице?
7. Какой фермент осуществляет обратную транскрипцию?
8. Что означает сайт-специфичность ферментов рестриктаз?
9. Каким образом производится идентификация фрагментов, полученных при обработке ДНК рестриктазами?
10. Какими свойствами должен обладать идеальный вектор?
11. Какие генетические структуры используются в качестве векторов?
12. Как называется комплекс: ген + вектор?
13. Что собой представляет космида?
14. Из ДНК какой бактерии получают вектор для введения генетической информации в растительные клетки?
15. Что такое обезоруженный вектор?
16. Какой вирус используется в качестве вектора в генной инженерии человека?
17. Какой способ введения гена в растительную клетку считается сейчас наиболее эффективным?
Ответы к заданиям по генетике
При подготовке к экзамену по биологии пригодятся также материалы книг:
Лекции по общей биологии
Генетика и селекция. Теория. Задания. Ответы
Сборник задач по генетике с решениями
Зоология беспозвоночных. Теория. Задания. Ответы
Словарь биологических терминов
Биология. Подготовка к экзамену
Источник
Рибонуклеазы (РНК-азы, RN-азы) — ферменты, катализирующие расщепление межнуклеотидных связей в олиго- и полирибонуклеотидной цепи рибонуклеиновых кислот; представляют собой подгруппу нуклеаз. Важнейшая биологическая роль этих ферментов обусловлена их участием в ключевых процессах биосинтеза и функционирования РНК in vivo — репликации (см.), транскрипции (см.), трансляции (см.), а также в посттранскрипционном процессинге (созревании) РНК (см. Рибонуклеиновые кислоты). Высокоочищенные препараты нек-рых РНК-аз используют в медицине в качестве лекарственных средств. Величина активности РНК-аз в биологических жидкостях имеет значение для клин, диагностики ряда заболеваний. Напр., у больных лейкемией (см. Лейкозы) активность РНК-азы в моче значительно увеличивается, однако в сыворотке крови она продолжает оставаться в пределах нормы. При уремии (см.) наблюдают повышение активности РНК-азы в сыворотке крови.
РНК-азы чрезвычайно широко распространены в природе: они присутствуют во всех живых организмах — животных, растениях, грибах и бактериях; нек-рые вирусы (см.) и бактериофаги (см.) способны индуцировать в клетке синтез специфических РНК-аз. РНК-азная активность обнаружена во многих тканях и биол. жидкостях человека: в поджелудочной железе, печени, селезенке, легких, полиморфно-ядерных лейкоцитах, панкреатическом соке, сыворотке крови, моче.
Все ферменты, объединяемые под названием «рибонуклеазы», по характеру каталитического действия являются фосфодиэстеразами, они деполимеризуют РНК без образования неорганического фосфата. Однако механизм разрыва фосфодиэфирной связи, специфичность по отношению к хим. природе азотистых оснований, к вторичной структуре субстрата, а также каталитические, химические и физические свойства достаточно сильно различаются как у РНК-аз из разных источников, так и у различных РНК-аз одной клетки.
По механизму каталитического действия РНК-азы делятся на фосфотрансферазы и фосфогидролазы, что раньше служило основанием для причисления этих РНК-аз к разным классам ферментов (см.). Согласно позднейшим рекомендациям Международного биохимического союза все РНК-азы относят к классу гидролаз и подклассу гидролаз фосфодиэфиров — КФ 3.1.4.
Фосфогидролазы (рибонуклеинат 3′- или 5′-нуклеотидгидролазы; КФ 3.1.4.20) катализируют расщепление 3′,5′-фосфодиэфирных связей в молекуле РНК путем прямого гидролиза. Фосфотрансферазы (см.) осуществляют деполимеризации РНК не прямым гидролизом, а в два этапа: сначала происходит трансфосфорили-рование, характеризующееся внутримолекулярным расщеплением фос-фодиэфирной связи, в к-ром участвует 2′-OH-группа рибозы (см.), с образованием нуклеозид 2′,3′-циклофосфата, затем следует гидролиз нуклеозидциклофосфата и его превращение в нуклеозид-З’-монофосфат либо в виде свободного нуклеотида, либо в виде концевого нуклеотидного остатка в составе олигонуклеотида. Циклизация протекает обычно значительно быстрее, чем собственно гидролиз.
Для большинства РНК-аз характерен эндонуклеолитический тип взаимодействия с субстратом (см. Нуклеазы). При расщеплении полирибонуклеотида внутри полимерной цепи может наблюдаться определенная избирательность; в зависимости от хим. природы азотистых оснований, вблизи к-рых происходит разрыв фосфодиэфирных связей, различают пиримидин-специфичные, пурин-специфичные, гуанил- и аденил-специфичные, а также неспецифичные РНК-азы. Напр., панкреатическая РНК-аза, или РНК-аза I, из животных тканей (рибонуклеинат З’-пиримидиноолигонуклеотид-гидролаза; КФ 3.1.4.22) является высокоспецифичной эндонуклеазой, расщепляющей связь только между фосфатом, присоединенным к С-З’-атому пиримидинового нуклеотида и С-5′-кислороду следующего нуклеотида. РНК-аза Т1 (гуанилрибонук-леаза, рибонуклеинат З’-гуанилолигонуклеотид-гидролаза; КФ 3.1.4.8), полученная из Aspergillus oryzae, катализирует эндонуклеолитическое расщепление РНК строго между гуанозин-З’-фосфатом и 5′-ОН-группами соседних нуклеотидов. Другой фермент из того же источника — РНК-аза Т2 — менее специфичен и лишь отдает предпочтение связям, в к-рых участвуют остатки аденозина, расщепляя почти всю молекулу РНК на З’-монофосфаты.
Примером эндо-РНК-азы, не обладающей специфичностью к хим. природе азотистых оснований, может служить РНК-аза I из E. coli (рибонуклеинат З’-олигонуклеотид-гидролаза; КФ 3.1.4.23), гидролизующая фосфодиэфирную связь у пуриннуклеотидных и у пиримидин-нуклеотидных остатков в положении 3′.
Эндонуклеазы, к-рые расщепляют РНК на З’-монофосфаты, обнаружены практически во всех тканях и у всех организмов. Из бактериальных клеток выделена эндонуклеаза, гидролизующая РНК с образованием З’-монофосфатов, специфичность к-рой определяется одним азотистым основанием. Этот фермент, получивший название РНК-аза Р, способен расщеплять одну определенную фосфодиэфирную связь в предшественнике тирозиновой тРНК, превращая его в зрелую тирозил-тРНК. Способностью узнавать определенные нуклеотидные последовательности в молекулах-предшественниках РНК обладают и другие высокоспецифичные РНК-азы. Специфичность нек-рых ферментов определяется также вторичной и (или) третичной структурой субстрата. Существуют РНК-азы, действующие исключительно на двуспиральные молекулы РНК (эндорибонуклеаза III; КФ 3.1.4.24); выделена группа РНК-аз (КФ 3.1.4.34), к-рые катализируют гидролиз РНК-цепей в молекулах ДНК—РНК-гибридов, но не действуют на ДНК или двуцепочечную РНК.
Разрыв фосфодиэфирных связей под действием эндо-РНК-аз, действие к-рых приводит к образованию 5′-монофосфатов, происходит без циклизации; механизм катализа заключается в прямом гидролитическом расщеплении 3′,5′-фосфодиэфирной связи, поэтому участия 2′-ОН группы в ферментативной реакции не требуется. По этой причине многие эндонуклеазы (как и нек-рые экзонуклеазы), деполимеризующие полинуклеотидную цепь до 5′-монофосфатов (КФ 3.1.4.21), действуют как на РНК, так и на ДНК. Для экзонуклеаз в целом характерно отсутствие выраженной специфичности по отношению к азотистым основаниям нуклеотидов, соседних с расщепляемыми связями. Напр., экзо-РНК-аза II из клеток E. coli (КФ 3.1.4.20) последовательно отщепляет 5′-моно-нуклеотиды с 3′-конца молекулы РНК вплоть до образования олигонуклеотида, содержащего всего 2—4 нуклеотидных звена.
РНК-азы разнообразны по макромолекулярной структуре, по потребности в катионах металлов для проявления каталитической активности, по мол. весу (массе) и оптимальным условиям действия. Отмечена способность практически всех организмов, находящихся на различных ступенях эволюции, продуцировать кислые неспецифичные РНК-азы, мол. вес к-рых находится в пределах от 20 000 до 40 000. В основном РНК-азы — это небольшие, относительно термостабильные глобулярные белки основного характера, нуждающиеся в катионах Mg2+, Mn2+, NH4+, К+ в качестве активаторов. Для проявления максимальной активности и стабильности иногда необходимо присутствие SH-реагентов, таких как дитиотреитол; отдельные РНК-азы обладают субъединичной структурой. Нек-рые из этих ферментов не нуждаются в активаторах и отличаются высокой термостабильностью. Так, панкреатическая РНК-аза способна выдерживать без заметной потери каталитической активности кратковременное кипячение в воде, а ее температурный оптимум находится при 65°. Эта РНК-аза, имеющая мол. вес 13 680, образована единственной полипептидной цепью из 124 аминокислотных остатков; она была первым ферментом, для к-рого удалось установить последовательность аминокислотных остатков в цепи. В 1969 г. Меррифилд (R. В. Merrifield) осуществил полный хим. синтез панкреатической РНК-азы.
Разнообразие РНК-аз связано с разнообразием их функций. Хотя понятно, что физиол. роль внутриклеточных ферментов заключается в расщеплении различных типов функциональных молекул клеточных РНК, в вопросе о том, какова конкретная роль различных РНК-аз в клетке, есть еще нек-рая неопределенность. Очевидно, что РНК-азы могут включаться в регуляторные процессы на стадии репликации, транскрипции и трансляции генетического материала. На уровне репликации и транскрипции ДНК возможно участие РНК — ДНК-специфичных РНК-аз в инициации синтеза ДНК путем удаления РНК-сегментов. В пользу этого предположения свидетельствует их локализация в ядрах клеток. Бактериальные РНК—ДНК-специфичные РНК-азы, по-видимому, участвуют в конформационных изменениях в структуре хроматина (см.) во время клеточного цикла (см. Мейоз, Митоз). Большое число высокоспецифичных ядерных и цитоплазматических РНК-аз участвует в посттранскрипционном процессинге РНК, т. е. в превращении молекул-предшественников в зрелую форму РНК. Это превращение включает в себя процессы модификации нуклеозидов, специфичное расщепление и укорачивание нуклеотидных цепей и добавление специфических нуклеотидных последовательностей на 3′-и 5′- концах молекул (см. Нуклеиновые кислоты). Есть предположения об участии в этих процессах ферментов, расщепляющих двуспиральные участки РНК. Локализованные внутри клетки РНК-азы могут участвовать в специфическом удалении матричной РНК, как только она выполнит свою кодирующую функцию, а также выступать регулятором активности нек-рых ДНК-аз (см. Дезоксирибонуклеазы), ингибируемых РНК.
Внутриклеточная РНК-азная активность контролируется, во-первых, регуляцией процесса биосинтеза РНК-аз и, во-вторых, ингибированием или активацией уже существующих ферментов. Одна из основных ролей при этом принадлежит природным белковым ингибиторам РНК-аз, как строго специфичным, активным лишь в отношении определенного фермента, так и неспецифичным. К факторам, активирующим РНК-азы, относятся полиамины (путресцин, спермин, спермидин), обнаруженные в клетках различных эукариотных организмов (см).
Внеклеточные РНК-азы гл. обр. обеспечивают расщепление РНК при пищеварении или усвоении их клеткой, а также участвуют в разрушении тканей, микроорганизмов и их компонентов, происходящем при различных патол. процессах. В этой связи намечаются пути использования РНК-аз в мед. целях. Так, высокоочищенные препараты панкреатической РНК-азы в комплексе с препаратами протеолитических ферментов и ДНК-азы животного и бактериального происхождения оказались эффективными при лечении трофических язв и длительно незаживающих ран, гнойно-воспалительных процессов в мягких тканях и железистых органах (флегмон, абсцессов, маститов, гнойных лимфаденитов),а также при лечении гнойно-воспалительных процессов в легких, плевре, костях, суставах и воспалительных заболеваний сосудов.
Наиболее распространенными методами измерения активности РНК-аз являются осаждение ферментативно неизмененной РНК из инкубационной смеси с последующим радиоизотопным или спектрофотометрическим определением количества кислоторастворимых продуктов реакции — олиго- и мононуклеотидов, а также спектрофотометрическая регистрация изменений УФ-спектра, обусловленных деполимеризацией РНК или образованием циклических фосфатов на первой стадии изменения РНК, вызванного фосфотрансферазами. В первом случае измеряют увеличение оптической плотности р-ра РНК при 260 нм (гиперхромизм), во втором — уменьшение оптической плотности при 230 нм (гипохромизм).
Библиография: Биосинтез микроорганизмами нуклеаз и протеаз, под ред. А. А. Имшенецкого, М., 1979, библиогр.; Дэвидсон Дж. Н. Биохимия нуклеиновых кислот, пер. с англ., с. 194, М., 1976; Нуклеазы микроорганизмов, под ред. А. М. Безбородова, М., 1974; Фершт Э. Структура и механизм действия ферментов, пер. с англ., с. 388, М., 1980.
П. Л. Иванов.
Источник