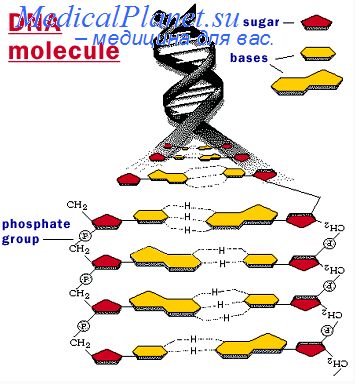
Трансформация клеток кишечной палочки

В основе большиства методов трансформации бактерий лежат данные о том, что обработка бактерий на холоду раствором хлористого кальция и последующее кратковременное нагревание индуцируют у них временное состояние «компетентности», когда они могут поглошать из раствора чужеродную ДНК.
Компетентные клетки Е. coli можно либо приобрести у коммерческих фирм (BRL, Gaithersburg, Maryland, USA), либо получить в лаборатории и использовать их немедленно или заморозить. Коммерческие препараты компетентных клеток обладают высоким качеством и позволяют получить частоту трансформации более 108 колоний на 1 мкг сверхспиральной плазмидной ДНК. Однако эти препараты очень дороги.
В протоколе описан метод получения компетентных бактериальных клеток, обеспечивающий частоту трансформации ~107 трансформированных колоний на 1 мкг плазмидной ДНК. Он идеально подходит для таких бактериальных штаммов, как JM109, НВ101, TG1 и TG2, но с его помощью можно трансформировать примерно с такой же частотой практически любой бактериальный штамм. Такая эффективность трансформации достаточно высока для осуществления всех рутинных операций клонирования в плаз-мидах, однако, например, для получения плазмидных библиотек кДНК, синтезированных на редких мРНК, нужна более высокая частота трансформации и необходимы альтернативные методы.
Метод, описанный в работе, позволяет получать компетентные культуры клеток Е. coli штаммов DH1, DH5 и ММ294, для которых частота трансформации достигает 7,5 • 108 колоний на 1 мкг сверхспиральной плазмидной ДНК. Более высокую частоту (109—1010) можно получить только с помощью электропорации. Этот метод разрабатывался для введения ДНК в клетки эукариот, но недавно его использовали и для трансформации Е. colt. Необходимые для электропорации специальный высоковольтный мини-электрод и кювета для образца вместе с детальным описанием процедуры трансформации поставляются фирмой Bio-Rad. Успешное получение компетентных клеток с помощью описанного в протоколе метода зависит от нескольких факторов. Особое внимание следует обратить на:
а) плотность культуры бактериальных клеток;
б) поддержание во время всех процедур температуры на уровне 0-4 С.
Получение компетентных клеток Е. coli обработкой хлористым кальцием
Материалы
• 0,1 М СаС12
• Диметилсульфоксид (ДМСО)
• Среда LB: 10 г бакто-триптона, 5 г дрожжевого экстракта, 10 г NaCl растворяют в 1 л деионизованной воды и доводят рН до 7,0 с помощью 5 М NaOH. Стерилизуют автоклавированием в жидком цикле.
• Для получения LB-arapa на 1 л среды добавляют 15 г агара Difco и стерилизуют автоклавированием, как описано выше.
• Среда SOB: 20 г бакто-триптона, 5 г дрожжевого экстракта, 0,5 г NaCl растворяют в 950 мл деионизованной воды, добавляют 10 мл 250 мМ НС1, доводят рН до 7,0 с помощью 5 М NaOH и доводят объем до 1 л. Стерилизуют, как описано выше.
• Среда SOC: идентична среде SOB за исключением того, что содержит также 20 мМ глюкозу. После автоклавирования среды SOB ее охлаждают и добавляют 20 мл 1 М стерилизованной фильтрацией глюкозы.
Методика
1. Снимают одиночную бактериальную колонию с чашки с LB-агаром, инкубированной при 37 ‘С в течение 16—20 ч, и переносят ее в 10 мл LB-среды в пробирке на 20 мл. Инкубируют при 37 °С и сильной аэрации (200 об/мин на круговом шейкере) в течение ночи.
2. 1 мл полученной ночной культуры вносят в 100 мл среды LB, налитой в колбу на 1 л, и инкубируют ее при 37 °С и сильной аэрации (200 об/мин на круговом шейкере) в течение примерно 2 ч до достижения плотности ~108 клетка/мл (ОД600 ~ 0,4).
3. Переносят культуру в стерильные охлажденные центрифужные пробирки на 50 мл (Falcon 2070) и охлаждают до 0 С инкубацией во льду в течение 10 мин.
4. Собирают клетки центрифугированием (ротор Sorvall GS3 или аналогичный) при 4300 g в течение 5 мин при 4 С.
5. Сливают надосадок и переворачивают пробирку на 1 мин для полного его стекания.
6. Ресуспендируют клеточный осадок в 10 мл ледяного 0,1 М СаСl2 при осторожном встряхивании и инкубируют клетки во льду в течение 30 мин.
7. Собирают клетки центрифугированием (ротор GS3 или аналогичный) при 4300 g в течение 5 мин при 4 С.
8. Сливают супернатант и переворачивают пробирку на 1 мин, с тем чтобы супернатант полностью стек.
9. Ресуспендируют каждый осадок в ледяном 0,1 М СаСl2(из расчета 2 мл на 50 мл исходного объема культуры). До использования суспензию лучше оставить на 1 ч при 4 С; при 4 °С ее можно хранить до 48 ч (но после 24 ч хранения эффективность трансформации будет снижаться). Суспензию можно разлить на аликвоты и хранить при -70 С.
10. С помощью охлажденного стерильного наконечника для микропипетки переносят по 200 мл каждой суспензии в стерильную полипропиленовую пробирку (Falcon 2059 17 х 100 мм). Добавляют сверхспиральную плазмидную ДНК (не более 50 нг в объеме не более 10 мкл), осторожно перемешивают и 30 мин инкубируют во льду.
Контроли
• Компетентные клетки, к которым добавлено известное количество (от 1 до 20 нг) сверхспиральной плазмидной ДНК.
• Компетентные клетки, к которым плазмидная ДНК не добавлялась.
11. Переносят пробирки ровно на 90 с в водяную баню на 42 °С, Пробирки при этом не встряхивают.
12. Быстро переносят пробирки обратно в лед и инкубируют 2 мин.
13. Добавляют в каждую пробирку 800 мкл среды SOC и для индукции экспрессии кодируемого плазмидой маркера устойчивости к антибиотикам инкубируют их при умеренной аэрации (100 об/мин) в течение 45 мин при 37 С.
14. Переносят до 200 мкл трансформированных компетентных клеток в содержащие соответствующий антибиотик чашки Петри диаметром 90 мм с LB- или SOB-средой. Равномерно распределяют трансформированные клетки по поверхности агара стерильной изогнутой стеклянной палочкой.
15. Оставляют чашки при комнатной температуре до подсыхания.
16. Переворачивают чашки и инкубируют их при 37 С. Колонии становятся видимыми через 12-16 ч.
– Добавляют к 2 мл ресуспендированных клеток 70 мкл ДМСО, аккуратно перемешивают и помещают суспензию на 15 мин в лед.
– Добавляют к каждой суспензии еще 70 мкл ДМСО, опять аккуратно перемешивают и помещают суспензию в лед.
– Быстро разливают суспензию порциями по 50 мкл в охлажденные стерильные микроцентрифужные пробирки и замораживают компетентные клетки в жидком азоте. До использования хранят пробирки при – 70 С.
– При необходимости суспензию размораживают, подержав пробирку в руках, и помещают в лед как минимум на 10 мин.
– Читать далее “Выделение и очистка плазмидной ДНК. Щелочной метод очистки плазмидной ДНК”
Оглавление темы “Выделение ДНК и РНК. Плазмиды”:
1. Одновременное выделение ДНК и РНК. Техника одновременного выделения ДНК и РНК
2. Очистка poly(A)+-PHK. Выделение poly(A)+-PHK
3. Анализ РНК и ДНК. Электрофорез в агарозном геле
4. Электрофорез РНК в формальдегидном геле. Количественный анализ нуклеиновых кислот
5. Определение концентрации ДНК/РНК в УФ-свете. Бактериальные плазмиды
6. Получение компетентных клеток Escherichia coli. Трансформация Escherichia coli плазмидами
7. Выделение и очистка плазмидной ДНК. Щелочной метод очистки плазмидной ДНК
8. Очистка плазмидной ДНК при центрифугировании. Выделение плазмидной ДНК из бактериальной культуры
9. Выделение плазмидной ДНК из больших объемов бактериальных культур. Техника выделения плазмидной ДНК
10. Мечение нуклеиновых кислот. Разновидности мечения нуклеиновых кислот
Источник
молекулярное клонирование кишечная палочка
1. Амплификация интересующего участка гена с помощью полимеразной цепной реакции (ПЦР)- экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе).
Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах, (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК.
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
· ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
· Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК.
· Термостабильная ДНК-полимераза – фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов – Thermusaquaticus (Taq-полимераза), Pyrococcusfuriosus (Pfu-полимераза), Pyrococcuswoesei (Pwo-полимераза) и другие.
· Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
· Ионы Mg2+, необходимые для работы полимеразы.
· Буферный раствор, обеспечивающий необходимые условия реакции – рН, ионную силу раствора.
2. Выделение ПЦР-продукта из геля
Электрофорез ДНК – это аналитический метод, применяемый для разделения фрагментов ДНК по размеру (длине) и форме (в случае, если ДНК образует вторичные структуры, например шпильки). Силы электрического поля, прикладываемого к образцам, заставляют фрагменты ДНК мигрировать через гель. Сахарофосфатный остов молекул ДНК заряжен отрицательно и поэтому цепи ДНК двигаются от катода, заряженного отрицательно, к положительному аноду. Более длинные молекулы мигрируют медленнее, так как задерживаются в геле, более короткие молекулы двигаются быстрее.
К образцам обычно добавляют низкомолекулярный кислый краситель (например, динитрофенол, бромфеноловый синий), чтобы визуализировать ход электрофореза в процессе. Краситель также необходим для того, чтобы определить, когда стоит остановить процесс.
После разделения (иногда краситель вносят в расплавленную агарозу) фрагменты ДНК разной длины визуализируют при помощи флюоресцентных красителей, специфично взаимодействующих с ДНК, например, агарозные гели обычно красят бромистым этидием, который интеркалирует между азотистыми основаниями дуплекса и флюоресцирует в УФ-лучах.
Определение размеров производят путем сравнения коммерчески доступных фрагментов ДНК (DNA ladder, «линейка»), содержащий линейные фрагменты ДНК известной длины.
Выделение продуктов из геля осуществляется, сначала механическим выделением необходимого участка агарозного геля, в котором заключена ДНК, а затем с помощью специальных наборов («ЕВРОГЕН», «Glassmilk», и т.д.) проводится экстракция ДНК.
3. Лигирование ампликона в вектор (обычно плазмида)- образование фосфодиэфирной связи между двумя основаниями одной цепи ДНК, разделенных разрывом, с помощью фермента ДНК-лигазы. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК и в процессах репликации – при удвоении цепи ДНК. Лигирование применяют в молекулярной биологии для соединения каких-либо молекул ДНК.
Сначала проводится рестрикция образца ДНК и плазмиды одной и той же рестриктазой (по липким или тупым концам), затем посредством водородных связей липкие концы плазмиды и образца ДНК «захлопываются» но остается разрыв на векторе, поскольку нуклеотиды сами не способны образовывать фосфодиэфирные связи. Для этого добавляется фермент ДНК-лизага, которая образует фосфодиэфирные связи в новой гибридной молекуле ДНК. Теперь мы имеем готовый вектор.
4. Трансформация полученным вектором E. Coli
Трансформация – то перенос вектора в клетки специального штамма E. coli
Трансформация состоит из двух частей это получение компетентных клеток с ночного высева бактерий с суспензионную среду и непосредственно трансформация. Между этими двумя этапами часто используют недлительную заморозку в жидком азоте или холодильнике на -80, что улучшает производительность. Получение компетентных клеток проходит в несколько этапов, суть которых заключается сначала в отделении клеток от среды LB, а затем в помещении в раствор хлорида кальция с 10мМ TrisHcl и 60% раствор глицерина. На всех этапах используют центрифугирование на низких оборотах(4600об/мин). Непосредственно трансформация осуществляется действием на клетки теплового шока, после добавления раствора плазмиды, смесь охлаждают до +4 градусов, а затем на 2 минуты помещают на водяную баню на +42 градуса. В это время клетка «захватывает» плазмиды, и после добавления среды LB полученную смесь инкубируют в термостате около часа на +37 градусов. После этого происходит растирание клеток на твердую среду, в которую заранее был добавлен антибиотик.
5. Отбор клонов (бактерии, содержащие вставку в плазмиде искомой последовательности)
Отбор клонов осуществляется реакцией ПЦР на исследуемые вставки. Детекция амплифицированного ПЦР-продукта осуществляется так же с помощью электрофореза. При наличии необходимой вставки, ПЦР продукты используются в дальнейшем при реакции секвенирования.
6. Секвенирование – определение последовательности ДНК исследуемого ПЦР-продукта.
Источник
- Главная
- /
- Информация
- /
- Статьи
Один из наиболее распространенных способов получения клеток E.coli для последующей трансформации с очищенной ДНК – инкубация бактерий при низкой температуре в жидкой среде, содержащей катионы Ca. Данная методика была разработана японскими специалистами в области генной инженерии в 1996 году. Метод включает несколько последовательных этапов.
Выращивание колоний E.coli в агаризированной среде SOB
Колонии выращиваются в чашках Петри, заполненных агаризированной SOB, куда биоматериал рассеивается методом «штриха».
 Мягкие и твердые стерильные одноразовые микробиологические петли из полистирола производства итальянской компании Promed выпускаются объемом 1 и 10 мкл | Для этого в стерильных условиях в пробирку с культурой E.coli вводится простерилизованная многоразовая или стерильная одноразовая бактериологическая петля, с помощью которой осуществляется забор материала, перенос его на селективную питательную среду и распределение по ее поверхности зигзагообразным движением. Выращивать колонии в чашках Петри можно при 37°C или при 18°C. В первом случае материал для дальнейшей работы будет готов уже на следующее утро, однако уровень компетентности выращенных таким образом бактериальных клеток получится умеренным. Для получения клеток с более высокой компетентностью материал рекомендуется инкубировать при t 18°C, однако нужно учитывать, что в таком температурном режиме нужной плотности колонии достигнут лишь через несколько суток. |
Глубинное культивирование и охлаждение
После инкубирования 10-12 колоний диаметром от 2 до 3 мм отбираются в колбу емкостью 0,5-1л с 40 мл жидкой среды SOB. Колба помещается на качалку, установленную в термостат, где при температуре 37°C и интенсивном встряхивании (200-300 об/мин) осуществляется глубинное культивирование культуры в течение 2-2,5 часов до достижения оптической плотности 0,6.
После этого сосуд с материалом ставят в мелко-колотый лед, где и производятся все дальнейшие манипуляции.
Центрифугирование и ресуспензирование
Охлаждение после культивирования осуществляется в течение 30 минут, после чего из колбы отбирают 30 мл культуры и центрифугируют материал в пробирке емкостью 50 мл при температуре 4°C в течение 10 минут при скорости 3000 об/мин.
Затем супернатант сливают и центрифугируют бактериальные клетки в течение 20 секунд при аналогичных указанным выше скорости и температуре. После этого жидкую фракцию удаляют пипеткой, а осадок суспензируют в 10 мл буфера ТВ и оставляют на 10-15 минут в мелко-колотом льду (t – 0°C).
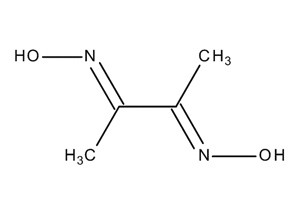 Диметилсульфоксид используется при выращивании компетентных клеток E.coli в качестве криопротектора | Вслед за этим материал вновь подвергается двукратному центрифугированию вышеописанными способами. Выпавшие в осадок клетки ресуспензируются в 2 мл буфера. Затем к культуре добавляется диметилсульфоксид (криопротектор) до достижения концентрации 3,5%, и сосуд выдерживается при 0°C в течение 10-15 минут. Вслед за этим культура вновь центрифугируется при 4°C и скорости 3000 об/мин в течение 10 минут, после чего супернатант сливается. |
Разлив и хранение
Готовая культура разливается в охлажденные стерильные микропробирки по 100 мкл. Оптимальный вариант – трансформация компетентных клеток с очищенной ДНК непосредственно после их приготовления. При необходимости допускается хранение компетентных «кальциевых клеток» в холодильнике в течение 1-2 дней. Однако если культура приготавливается впрок, то сохранить клетки в надлежащем состоянии можно лишь путем заморозки в жидком азоте с последующим хранением при -70°C, иначе они быстро утратят компетентность.
Выбор оборудования и материалов
 Встряхиватель KS 130 kontrol nol марки IKA может работать при температурах от 5 до 50 градусов Цельсия | Выбрать устройство для встряхивания не составляет проблемы – рынок современных лабораторных шейкеров и качалок представлен широким перечнем высокотехнологичных приборов, среди которых можно без труда подобрать аппарат с оптимальными характеристиками. Для центрифугирования идеальным решением по сочетанию цены, функциональности и эксплуатационных характеристик станет выбор в пользу оборудования британской марки Centurion Scientific. Главное преимущество рефрижераторных моделей этой марки – использование уникальной запатентованной технологии принудительного охлаждения, обеспечивающей исключительную точность и стабильность температуры по всему объему центрифужной камеры. |
Под этой маркой выпускаются лабораторные центрифуги со сменными роторами, работающие в различных диапазонах скоростей и предназначенные для решения разных задач.
 Универсальная центрифуга PrO-Hospital HLR идеально справится с подготовкой E.coli для последующей трансформации и позволит успешно решать другие задачи | Если работу с материалом планируется вести по стандартным методикам, вполне достаточным может оказаться функционал охлаждаемых универсальных центрифуг для клинических исследований с 10 ячейками встроенной памяти. Эти приборы относятся к серии Pro-Hospital. Такие же модели, как, например, цитоцентрифуга Pro-CYTLCD или ее более простая модификация Pro-CYTLED, а также центрифуги для разделения крови серии Pro-PRP разработаны с целью подготовки образцов для гистологического анализа методом жидкостной цитологии и получения богатой тромбоцитами плазмы соответственно. Они совместимы с определенными типами роторов, оснащаются предустановленными программами центрифугирования в строго определенных режимах и работают при комнатных температурах. Поэтому при выборе оборудования для работы с клеточными культурами следует обращать внимание именно на аппараты линейки Pro-Hospital с подходящим функционалом – HLR или LLR. |
Для нужд научно-исследовательских лабораторий великолепно приспособлены аппараты серии Pro-Research с сенсорной панелью управления, максимально гибкой настройкой и большим объемом встроенной памяти, позволяющей одномоментно хранить и быстро запускать до 108 методик с различными параметрами.
Крайне важно использовать высококачественные среды и реактивы – это на порядок повышает продуктивность и сводит к минимуму риск порчи биоматериала. Один из лидеров в этой нише рынка – французская компания Biochem, в перечень продукции которой входят стандартные растворы, готовые буферы и среды, а также реактивы для их приготовления.
Вернуться к списку
«АГ Аналитэксперт» представляет современные настольные центрифуги производства компании «Centurion Scientific» специального и общелабораторного назначения. Широкий модельный ряд включает как специализированные устройства, так и универсальные лабораторные центрифуги, совместимые с большим количеством сменных роторов различного объема. Если у Вас возникла потребность купить надежную центрифугу европейского качества, свяжитесь с нами, мы будем рады Вам помочь!
Источник