Уколы при кишечной палочке в моче
Этой статьей мы начинаем рассмотрение представителей микробиологического мира, с которыми чаще всего встречаем в ежедневной клинической практике, и темой сегодняшнего разговора будет кишечная палочка, она же Escherichia coli (E.coli). Актуальность обсуждения данного микроорганизма состоит в том, что кишечная палочка – это чемпион по созданию проблем как для пациентов, так и для медицинского персонала стационаров и в амбулаторной службе. Хуже нее только клебсиелла, но о ней поговорим попозже. При этом E.coli не летает по воздуху и не имеет ножек для самостоятельного перемещения и инфицирование ею – это почти всегда «болезнь грязных рук». С патологией, вызванной этим возбудителем, пациент может прийти к любому врачу, а медицинский персонал может принести уже на своих руках кишечную палочку любому пациенту с одной лишь разницей – это будет не дикий и симпатичный зверек, убиваемый обычным амоксицилином, а вооруженная до зубов особь, умеющая очень эффективно убивать сама. То есть это один из тех врагов, которых совершенно точно надо знать в лицо. Микробиологические аспекты E.coli относится к типичным представителям семейства Enterobacteriaceae, являясь грамотрицательной бактерией, факультативным анаэробом в составе нормальной кишечной микрофлоры человека. Но тут же становится патогеном, выбравшись из среды нормального обитания, хотя отдельные штаммы являются патогенными и для желудочно-кишечного тракта. То есть кишечная палочка относится к кишечным комменсалам, кишечным патогенам и внекишечным патогенам, каждый из которых мы кратко разберем. К штаммам E.coli, действующим как кишечные патогены и встречающимся чаще других, относятся:
Затем тот же штамм обнаружился при вспышке ПТИ в Финляндии, но к тому времени пациентов с диареями до появления микробиологических результатов перестали лечить бактерицидными антибиотиками и ситуация была купирована в зародыше. И третий громкий (для нашей страны) случай – это массовое заболевание питерских школьников в Грузии, где так же был выявлен этот штамм (пресс-релиз Роспотребнадзора по данному случаю лежит здесь).
Когда кишечная палочка выступает внекишечным патогенном? Почти всегда, когда обнаруживается вне места своего нормального обитания.
Этот факт объясняется близким анатомическим расположением двух систем и огрехами в личной гигиене, что позволяет на этапе эмпирической терапии вышеперечисленных заболеваний сразу же назначать препараты, активные в отношении кишечной палочки.
(часть вторая) Практические вопросы диагностики и лечения. Когда мы можем заподозрить, что перед нами пациент с инфекцией, вызванной кишечной палочкой?
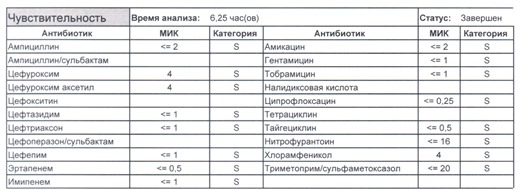
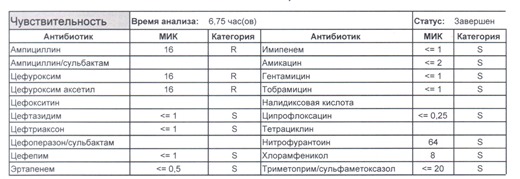
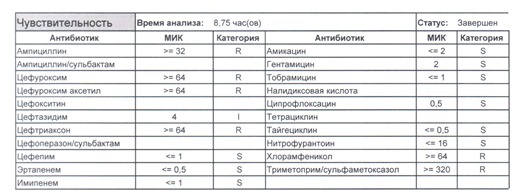
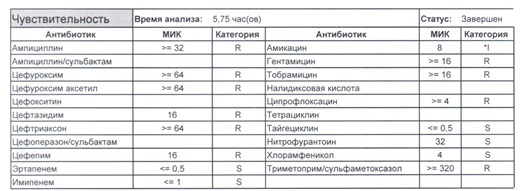
Подтвердить или полностью исключить кишечную палочку из возбудителей может только микробиологическое исследование. Конечно, в современных условиях микробиология уже становится практически эксклюзивом, но мы пришли учиться, а учится надо на правильных примерах, поэтому далее будет рассмотрен ряд антибиотикограмм, выполненных автоматизированными системами тестирования. Вдруг вам повезет, и в вашем лечебном учреждении все уже есть или в ближайшее время будет, а вы уже умеете с этим всем работать? Если вы читаете данный цикл по порядку, то в базовом разделе по микробиологии был выложен ряд антибиотикограмм некоего микроорганизма в контексте нарастания антибиотикорезистентности, и это была наша сегодняшняя героиня – кишечная палочка.
Чем лечим?
Если такая кишечная палочка окажется внекишечным патогенном, и перед вами будет беременная и ИМП (самый частый случай), то нам необходимо преодолеть резистентность к пенициллинам, то есть подавить деятельность пенициллиназ. Соответственно высокую эффективность продемонстрируют препараты с ингибиторами бета-лактамаз, чаще всего амоксициллина/клавуланат, как наиболее безопасный и эффективный. Единственное, пациентку необходимо предупредить, что в результате стимуляции рецепторов кишечника может развиться антибиотик-ассоциированная диарея.
В каких ситуациях мы можем увидеть (или подумать) о таком звере:
Что делать?
Подобный пациент не придет к вам своими ногами, его не увидит амбулаторная служба, это абсолютно стационарные больные, и если их привезут, то только из другого лечебного учреждения. Чаще всего это пациенты палат интенсивной терапии или реанимации, и такой возбудитель носит на 100% нозокомиальный характер. Когда можем его обнаружить:
И всегда это будет ятрогенное поражение как следствие неправильной гигиены рук персонала либо обработки инструментария. Можно возразить «но как же тяжелые перитониты?». Отвечу тем, что для тяжелых перитонитов без дефектов ухода наиболее характерен штамм на третьем рисунке, так как для того, чтобы вырастить такую зверюгу, тяжелому перитониту здоровья не хватит, он от осложнений погибнуть успеет, а сама кишечная палочка ножками ходить не умеет, мы ее исключительно неправильно мытыми ручками разносим, и доказать это элементарно, так как точно такие же штаммы будут высеваться при плановых проверках эпидемиологической службы. Что делать?
Что делать?
А теперь подведем небольшой итог нашего непростого разговора:
Резюмируя вышесказанное, и как бы обидно это ни прозвучало, но почти всегда инфекции, вызванные кишечной палочкой, – это «болезни грязных рук» и показатель микробиологического неблагополучия. И одна из серьезных проблем медико-профилактических служб, так как при всем желании они не смогут полностью изъять источник инфицирования, так как он в прямом смысле находится во всех нас, и только соблюдение санитарных правил и санпросвет. работа могут значительно поспособствовать в сдерживании развития вышеуказанных заболеваний. Вас может заинтересовать
|
Источник
Статьи
Член-корреспондент РАМН, профессор Ю.Г. Аляев
профессор А.З. Винаров
- Неосложненная инфекция нижних мочевых путей (цистит)
- Неосложненный пиелонефрит
- Осложненная инфекция мочевыводящей системы с наличием или отсутствием пиелонефрита
- Уросепсис
- Уретрит
- Специальные формы: простатит, эпидидимит и орхит.
Острый цистит – гнойно-воспалительный процесс слизистой мочевого пузыря, который возникает при отсутствии структурных изменений в почках и мочевыводящих путях, а также у пациентов без серьёзных сопутствующих заболеваний.
Рекомендации EAU, 2004.
Для острого цистита характерен рост монокультуры микроорганизмов.
Наиболее частыми возбудителями являются грамотрицательные энтеробактерии (в основном Escherichia coli) и коагулазонегативные стафилококки.
Т.Hooton, W.Stamm, 1997.
В результате проведенного в России многоцентрового исследования было установлено, что острый цистит в 80% случаев вызывала Escherichia coli, в 8.2% – Proteus spp., в 3,7% – Klebsiella spp., в 3% -Staphylococcus saprophyticus, в 2.2% -Enterobacter spp., в 0.7% – Pseudomonas aeruginosa и др.
Л.Страчунский, В.Рафальский, 1999
Этиологическая структура возбудителей острого цистита
Возбудитель Больные (n=200) абс. % E.coli 158 79 S.saprophyticus 22 11 Proteus mirabilis 7 3,5 S.epidermidis 7 3,5 Enterococcus sp. 6 3,0 Всего 200 100 Урологическая клиника ММА им. И.М. Сеченова
Крупнейшее международное исследование в 252 клиниках 16-ти стран Европы и Канады – ECO-SENS Project завершилось в 2002 году.
Были обследованы 4734 женщины с неосложненной инфекцией мочевых путей.
Escherichia coli выявлена у 77,7 % больных, Proteus mirabilis у 5.2 %, Klebsiella spp.у 2,8 %, другие Enterobacteriaceae в 3.9%, Staphylococcus saprophyticus – 4,6 %, другие микроорганизмы у 5,8 % пациенток.
G.Kahlmeter, 2003.
Важнейшим фактором вирулентности уропатогенных штаммов E.coli и других микробов семейства Enterobacteriaceae следует считать их способность к адгезии к уротелию с помощью:
- ворсинок 1типа (pili)
- ворсинок (pap)
- S ворсинок (sfa)
- афимбриального адгезина 1 (afa1)
- антигенов полисахаридной капсулы микроба.
S.Yamamoto et al. 1995, L. Emody, 2003.
В последние годы отмечена возрастающая распространенность уропатогенных штаммов E.coli. устойчивых к широко используемым в настоящее время антибактериальным препаратам.
Штаммы Escherichia coli, устойчивые к ампициллину встречаются в 33,3% случаев,
- к триметоприму – 20,3%,
- ко-тримоксазолу -18,4%,
- нитроксолину – 94,1%
Л. Страчунский, В.Рафальский, 1999
В исследовании ECO-SENS Project среди штаммов E.coli 42 % обладали резистентностью к одному и более из 12 исследованных антимикробных препаратов.
Отсутствие чувствительности к ампициллину в 29,8 % случаев, сульфаметоксозолу в 30,3 % наблюдений и триметоприму у 15,6 % выделенных штаммов микроорганизмов.
G.Kahlmeter, 2003.
Необходимо помнить, что прием антибактериального препарата нецелесообразен в связи с недостаточной эффективностью при резистентности к нему в популяции более 15-20 % штаммов микроорганизмов.
Острый неосложненный цистит
Задачи лечения
- Быстрое исчезновение клинических симптомов
- Быстрое избавление от возбудителя (микрорганизма)
- Профилактика реинфекции (рецидива).
Эти задачи могут быть адекватно реализованы с помощью короткого курса антибиотикотерапии
Острый неосложненный цистит
Как долго лечить антибиотиком?
- Однократной дозой ?
- Коротким курсом ( 3 дня ) ?
- Традиционным курсом ( 5 – 7 дней) ?
- Длительное лечение ( 3 – 6 недель) ?
Продолжительность антибиотикотерапии при различных видах инфекции мочевыводящих путей
Вид инфекции Продолжительность лечения антибиотиком Острый неосложненный цистит у женщин Короткий курс до 3 дней. Монодозная терапия Монуралом. Неосложненный пиелонефрит 7-14 дней Осложненная инфекция мочевыводящих путей 7-14 дней, иногда до 21 дня Обязательно удаление причины Рекомендации EAU, 2004.
Терапия острого неосложненного цистита короткими курсами (до 3-х дней) или одной дозой является адекватной, а более длительная терапия не имеет никаких преимуществ.
K. Naber, 2004
Триметоприм и его комбинации с сульфаниламидами (ко-тримоксазол) остаются одними из наиболее часто используемых в лечении острого цистита.
Оптимальная продолжительность терапии острого цистита ко-тримоксазолом составляет 3 дня по 960 мг 2 раза в сутки.
K. Naber, 2004.
В исследовании ECO-SENS Project в некоторых Европейских странах ( Ирландии, Испании, Люксембурге,Португалии) резистентные к ампициллину и сульфаниламидам штаммы E.coli были выявлены более чем у 40 % больных, а штаммы устойчивые к триметоприму/сульфаметоксазолу и триметоприму более чем в 20 % наблюдений.
G.Kahlmeter, 2003.
Фторхинолоны
Норфлоксацин (период полувыведения 3-4 часа) для лечения острого цистита рекомендуется принимать по 400 мг 2 раза в день – 3 дня
Ципрофлоксацин и офлоксацин – по 100 мг 2 раза в день – 3 дня K. Naber, 2004.
В исследовании ECO-SENS Project в Испании и Португалии отмечено значительное возрастание резистентности штаммов E.coli к фторхинолонам: более 25 % к налидиксовой кислоте и более 15 % штаммов устойчивых к ципрофлоксацину.
G.Kahlmeter, 2003.
В исследовании ECO-SENS Project устойчивость штаммов E. coli к ко-амоксиклаву, нитрофурантоинам, гентамицину, ципрофлоксацину и фосфомицину трометамолу (Монуралу) была отмечена менее чем у 3 % пациентов.
G.Kahlmeter, 2003.
Однократный прием 3 г фосфомицина трометамола (Монурала) может быть рекомендован для терапии острого неосложненного цистита.
K. Naber, 2004
В качестве монодозной терапии острого неосложненного цистита лишь фосфомицина трометамол может быть эффективным.
Рекомендации EAU, 2004.
Динамика симптомов острого цистита на фоне традиционной терапии фосфомицина трометамолом по 3 г дважды через 24 часа
Показатель (n=60)
Исходно 3-й день 7-ой день абс % абс % абс % Дизурия 60 100 12 20 1 1,6 Боль в надлобковой области 32 53 4 7 Лейкоцитурия 59 98 35 58 3 5 Гематурия 4 7 Бактериурия (103 и более КОЕ/мл) 37 61,6 2 3,4 1 1,6 Урологическая клиника ММА им. И.М. Сеченова
Динамика симптомов острого цистита на фоне монодозной терапии фосфомицина трометамолом 3 г однократно.
Показатель (n=80)
Исходно 3-й день 7-ой день абс % абс % абс % Дизурия 80 100 17 21 1 1,3 Боль в надлобковой области 48 60 4 5 Лейкоцитурия 80 100 38 48 3 4 Гематурия 4 5 Бактериурия (103 и более КОЕ/мл) 61 76 4 5 1 1,3 Урологическая клиника ММА им. И.М. Сеченова
При адекватной монодозной терапии острого неосложненного цистита эрадикация возбудителя происходит в течение нескольких часов, но воспалительный процесс уротелия может продолжаться, поэтому только у 1/3 пациенток клинические симптомы исчезают в течение суток, а у 50% оставшихся больных – в течение 2-х дней. Больные должны быть предупреждены об этом.
Комплайнс
Наиболее частая причина нарушения приверженности лечения – сложный режим приема препарата (соблюдение часового промежутка, длительная по времени терапия и т.д.).
Однократное назначение монурала является простым и удобным для пациента, позволяет не только обеспечить выполнение врачебных рекомендаций, но и улучшить качество жизни.
Белоусов Ю. “Основы клинической фармакологии и рациональной фармакотерапии”
В чем же особенности и преимущества фосфомицина трометамола в терапии неосложненной инфекции мочевыводящих путей ?
Фосфомицина трометамол обладает:
- Особым механизмом действия и оригинальным строением, что определяет отсутствие перекрестной устойчивости с другими антибиотиками.
- Способностью создавать высокие концентрации в моче, сохраняющиеся длительно после однократного приема.
- Уникальной способностью препятствовать адгезии микроорганизмов к уротелию.
- Широким антибактериальным спектром.
Механизм действия Монурала
Фосфомицин подавляет активность пирувилтрансферазы – цитоплазматического фермента, который катализирует первый этап биосинтеза пептидогликана бактериальной стенки.
Фармакокинетика Монурала
- Фосфомицин выводится в неизмененном виде, преимущественно с мочой, посредством клубочковой фильтрации.
- Общий клиренс фосфомицина практически равен его почечному клиренсу.
- Фосфомицин не подвергается реабсорбции и секреции в почечных канальцах
Биодоступность % – 60
Связь с белками – 0
Почечная экскреция – Более 95% в неизмененном виде
C max (мкг/мл) – Более 3500
T 1/2 – 4 часа
Микроорганизмы МПК90 мкг/мл
Escherichia coli 8
Klebsiella spp. 64
Proteus mirabilis 16
Pseudomonas spp. 128
Staphylococcus aureus 4
Enterococcus faecalis 128
Средний уровень концентрации фосфомицина в моче в мкг/мл после однократного перорального приема (3 г)
Фармакокинетика Монурала
- Адекватной для подавления роста большинства уропатогенных бактерий является концентрация препарата в моче, не выше 128 мкг/мл.
- Представленные выше данные позволяют говорить о том, что эффективные концентрации фосфомицина сохраняются в моче в течение 80 часов после приема одной дозы.
!!!! Концентрации препарата в моче, превышающие МПК для E Coli, сохраняются в течение 10 суток.
Адгезия
- Ключевое звено патогенеза ИНМП – адгезия бактерий к клеткам эпителия мочевыводящих путей.
- Адгезия осуществляется благодаря взаимодействию между специфическими рецепторами бактерий (Р – ворсинки и ворсинки 1 типа), расположенными на поверхности фимбрий и рецепторами уроэпителия.
- Адгезия бактерий позволяет противостоять току мочи, скапливаться на поверхности мочевого пузыря и проникать в его ткани.
Влияние Монурала на бактериальную адгезию
- Способность антибиотиков предотвращать адгезию бактерий является решающим фактором, который должен учитываться при выборе препарата для лечения ИНМП. МОНУРАЛ активно подавляет адгезивные свойства Г+ и Г- бактерий на эпителиальных клетках мочевых путей в cубингибирующих концентрациях, соответствующих 1/4 и 1/8 от МПК 90.
МПК 90 фосфомицина для большинства бактерий вызывающих острый цистит 128 мкг/мл.
Mandell GL”Principles and Practice of UT Diseases” 2002
Резистентность E. coli к основным антибиотикам, используемым для лечения инфекций нижних мочевых путей (ECO-SENS проект 2002)
Чувствительность выделенных культур к фосфомицину трометамолу
Возбудитель Количество штаммов, чувствительных к фосфомицину, % E.coli 100 S.saprophyticus 100 Proteus mirabilis 80 S.epidermidis 100 Enterococcus sp. 100 Урологическая клиника ММА им. И.М. Сеченова
Данные по резистентности уропатогенных штаммов E.Coli, выделенных у пациентов с амбулаторными НИНМП ( в % )
Антибиотик АРИМБ (117) АРМИД (428) UTIAP (330) Фосфомицин Ампициллин 31.6 37.1 51.5 Ко-амоксиклав 3.4 2.6 3.9 Цефуроксим 3.4 2.4 3.9 Цефотаксим 1.7 1.2 – Норфлоксацин – – 7 Ко-тримоксазол 14.5 21 35.5 Нитрофурантоин 4.3 1.2 – Налидиксовая кислота – 7 7 Ципрофлоксацин – 4.3 – Резистентность штаммов E.coli мочевых путей к фосфомицину на протяжении длительного периода времени.
Страна Год Количество штаммов % резистентных штаммов USA 1999 1097 Germany 2000 1163 UK 2000 246 0.4 France 1989-2000 4702 0.4-1.9 France 2000 234 0.4 Greece 2000 72 1.4 Spain 2000 92 Spain 2001 1580 1 Italy 1990-2000 963 1 Schito et al., Infection, 1992; Fuchs et al., JAC, 1999;Arzouni et al., Med.Mal.Inf., 2000;
Kahlmeter, JAC, 2000; Daza et al., 2001; Marchese et al., in preparation, 2003
Почему к монуралу не вырабатывается резистентность?
- Используется исключительно для лечения НИНМП.
- Механизм действия абсолютно отличен от механизма действия других антибиотиков.
- Под действием субподавляющих концентраций фосфомицина нарушается способность уропатогенных бактерий к передаче плазмид и синтезу ферментов, определяющих патогенные свойства возбудителя.
- Мутации, обеспечивающие бактериям устойчивость к фосфомицину, ( например, L- α-глицеролфосфатной транспортной системы), лишают эти штаммы преимуществ, делая их “биологически ущербными”, снижая их способность к росту и проявлению патогенных свойств.
Биофильмы уропатогенов при остром неосложненном цистите
Недавние исследования позволяют полагать, что даже при остром неосложненном цистите E. coli могут образовывать биофильмы, препятствующие адекватному антимикробному воздействию многих антибиотиков.
Kumon, AAC, 2000
Выживание E.coli (4 штаммов) в биофильмах после 24 часовой экспозиции с фосфомицином.
Crampton et al., Methods in Enzymology, 2001; Bozzolasco et al., GIMMOC, in press, 2003
Безопасность и переносимость
4278 пациентов, включая детей и беременных женщин показали хорошую переносимость фосфомицина.
побочные явления
- диарея 3,7%
- тошнота 2,4%
- абдоминальные боли 1,9%
Федеральное агентство по контролю над медикаментами, косметическими средствами и пищевыми продуктами США включило фосфомицина трометамол в категорию В, поэтому при необходимости препарат можно принимать во время беременности.
Up of efficacy and safety rmation, mon-us 03.Forest Iaboratories Inc., USA 2002.
Ни у одной из 140 пациенток не было, каких-либо побочных реакций при приеме фосфомицина трометамола, что свидетельствует о его высокой безопасности. В тоже время более длительные курсы лечения (более 5-7 дней) фторхинолонами или ко-тримоксазолом заметно увеличивают частоту побочных реакций.
Нежелательные явления, связанные с лечением НИНМП фосфомицином и другими антибиотиками
Mandell GL”Principles and Practice of UT Diseases” 2002
Среди наших пациенток не было беременных, но известно, что фосфомицина трометамол высокоэффективен в 96 % случаев и безопасен у беременных с острым неосложненным циститом и при асимптоматической бактериурии.
L. Orlandini, 1999
ВЫВОДЫ:
- Адекватная антибиотикотерапия является краеугольным камнем успешного лечения острого неосложненного цистита.
- Формирование резистентности штаммов микроорганизмов к наиболее часто применяемым антибиотикам заставляет изменить спектр лекарственных средств для терапии острого цистита.
При острых неосложненных циститах монурал (фосфомицина трометамол) безусловно является ПРАВИЛЬНЫМ ВЫБОРОМ – вследствие:
- широкого спектра антимикробной активности в отношении подавляющего большинства возбудителей острого цистита;
- низкого уровня антибиотикорезистентности основных уропатогенных штаммов;
- способности поддерживать минимальную подавляющую концентрацию в моче на протяжении длительного периода после приема;
- высокого уровня эффективности и безопасности.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
 Автор: Трубачева Е.С., врач – клинический фармаколог
Автор: Трубачева Е.С., врач – клинический фармаколог