В желудочно кишечном тракте белки расщепляются до
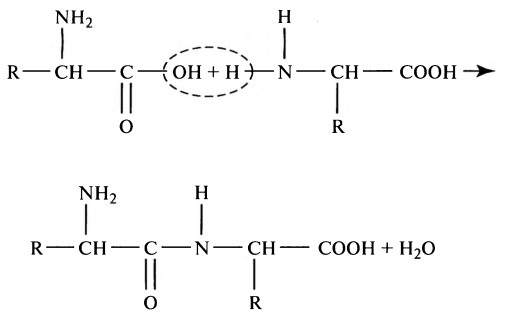
Переваривание белков. Этапы и последовательность переваривания белкова) Пищевые белки. Пищевые белки химически представляют собой длинные цепи аминокислот, соединенных друг с другом пептидными связями. Далее представлена типичная связь:
Характеристика каждого белка определяется типом аминокислот в молекуле белка и последовательностью расположения этих аминокислот. Физические и химические характеристики различных белков, важных для человека, изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). б) Переваривание белков в желудке. Пепсин — важный фермент желудка, расщепляющий белки. Он наиболее активен при рН 2,0-3,0 и не активен при рН выше 5,0. Вследствие этого для проявления расщепляющего действия белка ферментом желудочный сок должен быть кислым. Как объяснено в отдельной статье на сайте (просим вас пользоваться формой поиска выше), железы желудка секретируют большое количество соляной кислоты. Эта кислота секретируется париетальными (кислотопродуцирующими) клетками желез при рН, равным приблизительно 0,8. К моменту, когда кислота смешивается с желудочным содержимым и секретом из некислотопродуцирующих железистых клеток желудка, рН уже составляет в среднем 2,0-3,0, что чрезвычайно благоприятно для активности пепсина. Одной из важных переваривающих особенностей пепсина является его способность переваривать белок коллаген — альбуминоподобный тип белка, который лишь незначительно расщепляется под действием других пищеварительных ферментов. Коллаген — главная составляющая часть межклеточной соединительной ткани мяса; поэтому для расщепления белков мяса ферментами пищеварительного тракта прежде всего необходимо переварить коллагеновые нити. В связи с этим у индивида, у которого отмечается недостаток пепсина в желудочном соке, съеденное мясо хуже подвергается обработке другими пищеварительными ферментами и, следовательно, может хуже перевариваться.
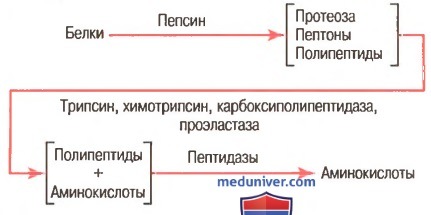
Как показано на рисунке выше, пепсин только начинает процесс переваривания белка, обычно обеспечивая только 10-20% полного переваривания белков и превращение их в альбумозы, пептоны и мелкие полипептиды. Это расщепление белков происходит в результате гидролиза пептидной связи между аминокислотами. в) Переваривание белков секретами поджелудочной железы. Переваривание белка преимущественно происходит в верхних отделах тонкого кишечника, в двенадцатиперстной кишке и тощей кишке под воздействием протеолитических ферментов, секретируемых поджелудочной железой. Частично расщепленные продукты белковой пищи, поступая в тонкий кишечник из желудка, подвергаются воздействию главных протеолитических панкреатических ферментов: трипсина, хемотрипсина, карбоксиполипептидазы и проэластазы (для облегчения понимания просим вас изучить рисунок выше). Трипсин и хемотрипсин расщепляют молекулы белка на небольшие полипептиды; карбоксиполипептидаза отщепляет отдельные аминокислоты от карбоксильного конца полипептидов. Проэластаза, в свою очередь, превращается в эластазу, которая затем переваривает эластические волокна, частично содержащиеся в мясных продуктах. Под действием панкреатического сока небольшой процент белков переваривается до аминокислот. Большинство белков расщепляется до дипептидов и трипептидов. г) Переваривание белков пептидазами энтероцитов, встроенных в ворсинки тонкого кишечника. Заключительный этап переваривания белков в просвете кишечника обеспечивается энтероцитами тонкого кишечника, которые покрыты ворсинками, преимущественно в двенадцатиперстной кишке и тощей кишке. Эти клетки имеют щеточную каемку, которая состоит из сотен микроворсинок, выступающих над поверхностью клетки. В мембране каждой из этих микроворсинок содержатся многочисленные пептидазы, которые выступают над мембраной, где они взаимодействуют с кишечной жидкостью. Наиболее важны два типа пептидаз: аминополипептидаза и некоторые дипептидазы. Они доводят расщепление оставшихся крупных полипептидов до дипептидов, трипептидов и меньшего числа аминокислот. И аминокислоты, и дйпептиды с трипептидами свободно транспортируются сквозь мембрану микроворсинок во внутреннюю часть энтероцита. Наконец, внутри цитозоля энтероцитов находятся другие многочисленные пептидазы, которые специфичны для оставшихся связей между аминокислотами. В течение нескольких минут практически все оставшиеся дипептиды и трипептиды перевариваются до конечной стадии в форме отдельных аминокислот; далее они выходят через другую сторону энтероцита, а отсюда — в кровь. Более 99% конечных продуктов переваривания белков, которые всасываются, являются одиночными аминокислотами. Очень редко происходит всасывание пептидов и чрезвычайно редко всасывается целая молекула белка. Даже крайне малое число всосавшихся молекул цельного белка может иногда вызывать серьезные аллергические или иммунологические нарушения. – Также рекомендуем “Переваривание жиров. Этапы переваривания жиров в кишечнике” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
Как устроена система пищеварения и происходит переваривание пищи в организме человека?
Пищеварение – это комплекс механических и биохимических процессов, происходящих в желудочно-кишечном тракте человека и необходимых для обработки и усвоения пищи. Пищеварительная система – это своеобразная фабрика, на которой все продумано и взаимосвязано. При правильном образе жизни и питании она работает без сбоев и поломок
Ротовая полость
Первый этап пищеварения начинается еще в ротовой полости. Человек откусывает и пережевывает кусочек пищи. В процессе он измельчается и пропитывается слюной, которая обеззараживает его и расщепляет крахмал благодаря содержанию специальных ферментов. В результате во рту формируется пищевой комок.
Внимание! Еда должна поступать в желудок в виде однородной пюреобразной кашицы, частично переваренной слюнными ферментами и требующей минимальных затрат для последующего расщепления.
Язык человека безошибочно распознает, какой продукт он ест: соленый, кислый, сладкий, горький. Эти сигналы необходимы для того, чтобы в желудке заранее выработались нужные пищеварительные соки.
Пищевод
Через глотку подготовленная во рту пища попадает в пищевод. Благодаря сокращениям органа она постепенно проталкивается в желудок. В это время продолжается ее переваривание слюной.
Желудок
Желудок – это полый орган, на внутренних стенках которого располагается несколько складок. В пустом состоянии его объем равен примерно 50 мл. При поступлении пищи он растягивается до 3-4 л.
В желудке разная пища обрабатывается по-разному. Вода, соли, глюкоза и спирт в несвязанном с другими продуктами состоянии могут сразу всасываться. Пищевой комок же подвергается обработке пищеварительным соком, содержащим соляную кислоту, ферменты и слизь. Он выделяется железами желудка и имеет переменчивый состав, разный для каждого вида пищи.
Еда обволакивает поверхность желудка слоями: одна порция вложена во вторую и так далее. Желудочный сок обрабатывает только тот слой пищи, который соприкасается со слизистой оболочкой органа. Ближе к центру еще долгое время происходит переваривание массы слюнными ферментами.
Внимание! В желудке расщепляются лишь белки и то только до олигопептидов. Совсем немного перевариваются жиры. Пища может находиться в нем до 4 часов.
Тонкая кишка
Переваренные слои пищи, расположенные у желудочных стенок, при их сокращении хорошенько перемешиваются, сдвигаются к привратнику и поступают в 12-перстную кишку – первый раздел тонкого кишечника.
Двенадцатиперстная кишка
Поверхность 12-перстной кишки выстлана ворсинками и железками, производящими секрет, который расщепляет белки и углеводы.В полость кишки открывается 2 протока – желчный и поджелудочной железы. По первому поставляется желчь, синтезируемая печенью и хранящаяся в желчном пузыре. Она останавливает действие желудочного сока, эмульгирует жиры, улучшает всасывание расщепленных жиров, аминокислот, витаминов и продвижение каловых масс.
Из протока поджелудочной железы в кишку поставляется панкреатический сок, насыщенный ферментами, которые расщепляют БЖУ. Этот орган также вырабатывает гормоны – инсулин, глюкагон – которые поступают во внешнюю среду и регулируют углеводный и липидный метаболизм.
Тощая и подвздошная кишка
Из 12-перстной кишки разобранная на составляющие масса поступает в тощую, а затем в подвздошную, где происходит всасывание аминокислот, моносахаров, глюкозы, фруктозы, глицерина и жирных кислот в лимфу и кровь.Эти отделы кишечника покрыты ворсинками, а они – микроворсинками. Благодаря такому строению всасывающая способность тонкой кишки увеличивается до 200 м².
Внимание! Каждая ворсинка оснащена капиллярной сетью и лимфатическим сосудом. Через них в кровь поступают аминокислоты, моносахара и глицерин, а в лимфу – глицерин и жирные кислоты. В этом отделе кишечника пищевая масса задерживается на 2-3 часа.
Печень
Кровь от желудка и кишечника движется не в общее кровяное русло, а в воротную вену, по которой она направляется в печень. Это нужно для того, чтобы она очистила ее от побочных продуктов, токсинов и ядов. Сюда же поступают питательные вещества, ведь при проникновении сразу в кровоток их концентрация стала бы смертельной для человека.
Внимание! Печень регулирует белковый, углеводный, жировой обмен, нейтрализует вредные и синтезирует нужные организму вещества.
Толстая кишка
Из подвздошной кишки остатки пищевой массы направляются в толстую. Тут завершается всасывание воды, и происходит формирование кала.
Внимание! В толстой кишке обитает множество микроорганизмов-симбионтов. Они питаются пищевыми отходами, а взамен производят некоторые витамины, ферменты, аминокислоты и защищают территорию от чужих, нередко болезнетворных микробов.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Рецензент: Сергей Шелапугин Эксперт в области здоровья, красоты, правильного питания и спорта
Источник
Оглавление по разделу: «Ответы на вопросы по биохимии»
Навигация
Биологическая роль и структура белков.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот.
Все природные белки состоят из небольшого числа
сравнительно простых структурных блоков, представленных мономерными молекулами
– аминокислотами, связанными друг с другом в полипептидные цепи.
Функции белков:
1) Структурная:
- в соединительной ткани – коллаген, эластин, кератин
- построение мембран и формирование цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности)
- построение органелл – рибосомы
2) Ферментативная:
Все ферменты являются белками
3) Гормональная:
Регуляция и согласование обмена
веществ в разных клетках организма – многие гормо-ны, например, инсулин и
глюкагон.
4) Рецепторная:
Избирательное связывание гормонов,
биологически активных веществ и медиаторов на поверхности мембран или внутри
клеток.
5) Транспортная:
Перенос веществ в крови – липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны – Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки).
6) Резервная: производство и
накопление в яйце яичного альбумина.
7) Питательная: белки грудного
молока, белки мышц и печени при голодании.
8) Защитная: наличие в крови иммуноглобулинов, белков свертывания крови.
P.S. Эта страница за 2 дня (14.02 и 15.02) набрала около 1500 просмотров и входит в топ 10 страниц по просмотрам за прошедшую неделю. Если ты хочешь размещать ответы на вопросы по биохимии, помочь студентам в подготовке к занятиям, то пиши админу на почту support@medfsh.ru. Я отправлю тебе перечень вопросов по теме (та тема, которую ты бы хотел разместить на сайте) (перечень вопросов формируется согласно БашГМУ)
Переваривание белков в желудке: ферменты, система их активации, оптимум pH, специфичность, продукты переваривания.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Регуляция желудочного пищеварения:
Осуществляется нервными (условные и
безусловные рефлексы) и гуморальными механизмами.
К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин выделяется специфичными G-клетками:
- в ответ на раздражение механорецепторов,
- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков),
- под влиянием n.vagus.
Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также гастрин обеспечивает секрецию гистамина.
Гистамин, образующийся в
энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам)
слизистой оболочки желудка, взаимодействует с Н2-рецепторами на
обкладочных клетках желудка, увеличивает в них синтез и выделение соляной
кислоты.
Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока.
Пепсин
Пепсин – эндопептидаза, то есть расщепляет внутренние пептидные связи в
молекулах белков и пептидов.
Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр»прикрыт» N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что «раскрывается» активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), блокирующий работу фермента, т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Оптимум рН для пепсина 1,5-2,0.
Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д.
Гастриксин
Его оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
Роль соляной кислоты в пищеварении
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+ и переносящие ионы Сl– из крови в полость желудка.
Функции соляной кислоты:
- денатурация белков пищи,
- бактерицидное действие,
- высвобождение железа из комплекса с белками и перевод его в двухвалентную форму, что необходимо для его всасывания,
- превращение неактивного пепсиногена в активный пепсин,
- снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
- стимуляция секреции кишечного гормона секретина.
Переваривание белков в кишечнике: ферменты панкреатического и кишечного соков, система их активации, специфичность действия, продукты гидролиза белков.
Двенадцатиперстная кишка и тонкий кишечник в целом
Покинув
желудок, пища подвергается действию панкреатического сока, кишечного сока и
желчи.
Сок поджелудочной железы содержит проферменты–трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы соответственно. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Регуляция кишечного пищеварения
В тонком кишечнике под влиянием низкого рН начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонат-ионами (HCO3–).
Также благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина — панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи. В образовании желчи одновременно принимает участие секретин, стимулирующий продукцию бикарбонатов эпителием желчных протоков.
В целом нейтрализация кислого химуса в двенадцатиперстной кишке происходит при участии панкреатического сока и желчи. В результате его рН повышается до 7,0-7,5.
Трипсин
Выделяемый в pancreas трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к
пептидным связям, образованным с участием карбоксильных групп лизина и аргинина.
Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу. Также трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз три-ацилглицеролов.
Химотрипсин
Образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей.
Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана
Эластаза
Активируется в просвете кишечника трипсином из
проэластазы.
Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Карбоксипептидазы
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Аминопептидазы
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
Толстый кишечник
При богатой белками диете часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами.
Гниение белков в кишечнике: химизм, образование продуктов гниения и детоксикация ядовитых продуктов в печени
При ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Этот процесс получил название гниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород, метилмеркаптан (СН3SН)), так и нейромедиаторы (серотонин, гистамин, октопамин, тирамин). Гниение белков также активируется при снижении перистальтики кишечника (запоры).
В печени происходит обезвреживание токсических веществ, поступающих из толстого кишечника, с помощью двух систем:
- система микросомального окисления,
- система конъюгации.
Цель и суть работы систем обезвреживания заключается в маскировке токсичных групп (например, в феноле токсична ОН-группа) и/или в придании гидрофильности молекуле, что способствует ее выведению с мочой и отсутствию накопления в нервной и жировой ткани.
Микросомальное окисление
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН, приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности. Реакции осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума. Ферменты организуют короткую цепь, которая заканчивается цитохромом P450. Цитохром Р450 включает один атом кислорода в молекулу субстрата, а другой – в молекулу воды.
Субстрат окисления необязательно является чужеродным веществом (ксенобиотиком). Микросомальному окислению также подвергаются предшественники желчных кислот и стероидных гормонов и другие метаболиты.
Конъюгация
Для маскировки токсичных групп и придания большей гидрофильности молекуле существует процесс конъюгации, т.е. ее связывания с очень полярным соединением – таким соединением являются глутатион, серная, глюкуроновая, уксусная кислоты, глицин, глутамин. В клетках они часто находятся в связанном состоянии, например:
- серная кислота связана с 3′-фосфоаденозин-5′-фосфатом и образует фосфоаденозин-фосфосульфат (ФАФС),
- глюкуроновая кислота связана с уридилдифосфорной кислотой и образует уридил-дифосфоглюкуроновую кислоту (УДФГК),
- уксусная кислота находится в виде ацетил-S-KoA.
Образование животного индикана
Примером реакций обезвреживания веществ является превращение индола в животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана.
При повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике.
Пути всасывания аминокислот в кишечнике
Перенос аминокислот через мембраны клеток, как в кишечнике, так и в других тканях, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система.
Транспорт с использованием градиента концентрации натрия – вторичный активный транспорт.
В настоящее время выделяют 5 транспортных систем:
* для крупных нейтральных, в том числе алифатических и ароматических аминокислот,
* для малых нейтральных – аланина, серина, треонина,
* для основных аминокислот – аргинина и лизина, а также для кислых аминокислот – аспартата и глутамата,
* для малых аминокислот – глицина, пролина и оксипролина.
Вторичный активный транспорт основан на использовании низкой концентрации натрия внутри клеток, создаваемой Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Используя движение натрия по градиенту концентрации, белок переносит аминокислоту в цитозоль.
Переносчиком некоторых аминокислот (обычно нейтральных) является трипептид глутатион (глутамилцистеилглицин). При взаимодействии глутатиона с амино-кислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона.
Тканевой распад белков. Роль шаперонов и убиквинта в этом процессе.
Аминокислоты, образующиеся в результате переваривания белков в ЖКТ, поступают в кровь и доставляются в печень, где часть аминокислот используется для синтеза белков крови, а другая часть разносится кровью к разным тканям, органам и клеткам. Второй источник свободных аминокислот эндогенный гидролиз белков. Процесс обновления аминокислот в молекулах тканевых белков происходит с большой скоростью (белки крови — 18-45 суток). Распад тканевых белков осуществляется при участии активной системы протеолитических ферментов, объединенных под названием тканевых протеиназ или катепсинов. Но они не могут действовать в полную силу в организме животного, т.к. для этого необходима кислотная среда 4-5, а такая концентрация ионов Н, которая возникает в тканях после смерти или в очаге воспаления, что сопровождается самоперевариванием ткани. Но, тем не менее, активность протеиназ при рН 7,2-7,8 вполне обеспечивает постоянное самообновление белков.
В тканях различают протеиназы 1,2,3 и 4, которые по механизму действия близко стоят к соответствующим ферментам ЖКТ: 1-пепсин, 2-трипсин, 3-карбоксипептидаза, 4-аминопептидаза. Эти ферменты обеспечивают постоянный гидролиз белков и способствуют формированию фонда свободных аминокислот клеток, межклеточной жидкости и крови.
Шапероны
Шапероны – универсальные консервативные белки, которые связывают другие белки и стабилизируют их конформацию. Они могут исправлять недостатки белков как после их синтеза, так и в процессе синтеза на рибосомах, включатся в мультимерные комплексы или переходить через различные клеточные мембраны. Шапероны предотвращают агрегацию белка перед завершением свертывания и предотвращают образование нефункционирующих или непродуктивных конформаций во время этого процесса.
Убиквитин
В целом роль убиквитина выглядит так. Между убиквитином и белком-субстратом образуется ковалентная связь, возникающая между аминными группами остатков лизина белка и карбоксильной группой концевого остатка убиквитина. Образовавшиеся конъюгаты, которые содержат более чем одну молекулу убиквитина, могут быть деградированы протеиназами, в основном протеасомами. Узнавание белков, подлежащих протеолизу осуществляется так называемым убиктивиновым комплексом, способным взаимодействовать с отработанными или аномальными белками. АТФ расходуется как на стадии образования, так и на стадии деградации конъюгатов убиквитина с белком. Есть основания полагать, что убиквитин вызывает значительные конформационные изменения субстратного белка, что делает этот белок чувствительным к протеолизу. Связывание белка с убиквитином служит сигналом для «узнавания» этого белка протеиназами, что обеспечивает механизм избирательной деградации внутриклеточных белков.
Понятие клеточного метаболического пула аминокислот
Аминокислоты в клетке составляют динамичный пул, который непрерывно пополняется и так же непрерывно расходуется.
Существуют три источника аминокислот для пополнения этого пула:
- поступление из крови,
- распад собственных внутриклеточных белков
- синтез заменимых аминокислот.
Путь дальнейшего превращения каждой аминокислоты зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Реакции превращения
аминокислот в клетке условно можно разделить на три части, в зависимости от
реагирующей группы:
- с участием аминогруппы — здесь подразумевается удаление от аминокислоты аминогруппы тем или иным способом, в результате чего остается углеводородный скелет,
- по боковой цепи (радикалу) — происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образованеия энергии АТФ,
- по карбоксильной группе — связано с отщеплением карбоксильной группы.
Источник