Витамины синтезируются кишечной микрофлорой
Микрофлора кишечника является чувствительной и сложной системой. Она состоит из бифидо- и лактобактерий, благодаря чему организм может самостоятельно бороться с болезнетворными вирусами и патогенными микробами. Здоровую функцию иммунной системы поддерживает также регулярный синтез собственных витаминов – этот процесс происходит преимущественно в нижних отделах кишечника.
Какие витамины синтезируются микрофлорой?
- Витамин К. Необходим для выработки костного белка и полноценной свертываемости крови. При недостаточности витамина человек страдает от подкожных кровоизлияний, слабости сосудов, носовых кровотечений (недостаток развивается у пациентов с дисбактериозом и патологиями ЖКТ).
- Витамин В3. Контролирует окислительные процессы и регенерацию клеток, а также работу нервной системы. Влияет на пищеварение, состояние сердца и сосудов, регулирует уровень АД, очищает организм от продуктов распада и снижает показатели холестерина в крови. Синтез происходит при достаточном поступлении витаминов В2 и В6.
- Витамин В9 (фолиевая кислота). Участвует в формировании кровяных телец, укрепляет иммунитет, регулирует деятельность головного и костного мозга. Крайне необходим беременным женщинам, для правильного формирования головного мозга и нервной системы у плода.
- Витамин В12. Отвечает за метаболизм жиров, углеводов и белков, принимает участие в формировании и функционировании центральной нервной системы, контролирует синтез ДНК и РНК. Витамин является водорастворимым. Его недостатком страдают женщины во время беременности, люди с заболеваниями ЖКТ и злоупотребляющие алкоголем.
- Витамин H (биотин). Регулирует обмен белков и жиров. Участвует в выработке ферментов, влияющих на углеводный обмен, синтез нуклеотидов и коллагена. Опосредованно влияет на состояние кожи. Участвует в переносе углекислого газа.
- Витамин PP (никотиновая кислота). Принимает участие в метаболизме белков, жиров, пуринов. Влияет на уровень липидов в крови и артериальное давление. Обладает слабым антикоагулянтным действием (разжижает кровь).
- Витамин B6 (адермин). Влияет на работу пищеварительного тракта и состояние кожи. Нехватка адермина ведет к нарушению переваривания пищи, повышает риск развития анемии.
За синтез каждого витамина отвечают разные участки кишечника, но большинство продуцируется в толстом отделе кишки. Чем лучше сбалансирован рацион питания, тем большее количество витаминов синтезируется кишечной микрофлорой.
Нужно ли пополнять запасы витаминов извне?
Витаминов, синтезируемых кишечником, может быть недостаточно для полноценного функционирования организма человека.
Так, витамины группы B, вырабатываются, преимущественно, в недостаточных количествах:
- В12 вырабатывается в малом объеме, которого не хватает для нормальной жизнедеятельности. Его запасы пополняются путем употребления телячьей печени, лосося, морепродуктов, мяса говядины и баранины.
- Витамином В3 насыщены орехи, все зеленые овощи, кукуруза, гречневая крупа, печень, бобы, яйца и помидоры.
- Фолиевой кислотой (В9) богаты злаковые, свежие фрукты и овощи, молоко, овсяная крупа, рыба, мясо и яйца.
А вот витамин К синтезируется в достаточных количествах, поэтому при отсутствии заболеваний ЖКТ и нормальном балансе микрофлоры пополнять его запасы нет необходимости.
Причины ухудшения состояния микрофлоры
Факторы, из-за которых общее состояние микрофлоры кишечника ухудшается, зачастую провоцируются самим человеком, но иногда баланс нарушается по причине острых и хронических заболеваний. Наиболее распространенными причинами развивающегося дисбактериоза считаются:
- злоупотребление антибактериальными препаратами – использование этой группы лекарств показано при многих инфекционных заболеваниях, однако их бесконтрольный и необоснованный прием приводит к уничтожению не только патогенных, но и полезных бактерий в кишечнике;
- вредные привычки – курение и злоупотребление спиртными напитками;
- перекусы на бегу, преимущественно сухой пищей – бутербродами, фастфудом, сладкой и углеводной пищей;
- отсутствие в рационе белка и растительной клетчатки – именно эти элементы составляют основу правильного пищеварения и роста полезной микрофлоры;
- гормональный сбой в организме, эндокринные нарушения;
- слишком частое очищение кишечника – в группу риска входят женщины, принимающие препараты для похудения на основе слабительных компонентов;
- инфекционные и аллергические заболевания.
Также баланс полезной микрофлоры нарушается в результате регулярных стрессов, недосыпа, хронической усталости. Дисбактериоз часто диагностируется у жителей неблагоприятных экологических районов, которые вынуждены пить некачественную воду или постоянно вдыхать загазованный воздух вблизи промышленных предприятий.
Как восстановить функции микрофлоры?
В первую очередь, для восстановления полезной микрофлоры кишечника и устранения признаков дисбактериоза, необходимо выявить его причины. Для этого рекомендуется обратиться к гастроэнтерологу и, при острых показаниях, к инфекционисту.
Препараты
Если патология вызвана размножением патогенных микробов, врач назначит антибактериальные препараты пенициллинового ряда или Метронидазол.
Также больному показан прием лекарств на основе культур активных микроорганизмов, пищевых добавок, сорбентов и прочих медикаментов:
- Пробиотики – это средства с активными бактериальными культурами, например, Линекс. Их назначают при дисбактериозе, развившемся на фоне приема антибиотиков.
- Пребиотики – препараты с содержанием питательных субстратов для увеличения полезной микрофлоры. Они улучшают функции кишечника и восстанавливают нормальный баланс – это Лактофильтрум, Лактусан, Прелакс.
- Синбиотики – это сочетание пробиотиков и пребиотиков в одном препарате. К ним относятся Энтерол, Биофлор, Максилак, Нарине.
- Средства от метеоризма, например, Эспумизан;
- Энтеросорбенты, выводящие из организма продукты распада и токсины – Энтеросгель, Смекта, Активированный уголь, Энтерол;
- Препараты для восстановления моторики желудка и кишечника – Имодиум, Дебридат;
- Гепатопротекторы и желчегонные – Карсил, Эссенциале, Аллохол, Гепабене;
- Ферменты для восстановления пищеварительной функции – Креон, Пензитал.
Какие препараты нужны конкретному пациенту – определит врач, исходя из клинических симптомов и результатов анализов (кал на копрограмму и дисбактериоз).
Питание
Основные правила диетического питания:
- приемы пищи должны соответствовать режиму, то есть проводиться в одно и то же время;
- диета должна включать пищевые волокна;
- в меню обязательно включаются молочные продукты, обогащенные комплексом бифидо- и лактобактерий;
- меню разрабатывается по индивидуальной схеме, с учетом списка непереносимости каких-либо продуктов.
Пребиотики – это олиго- и полисахариды, содержащиеся в продуктах: овощах, фруктах, злаковых. Они не всасываются, а ферментируются в тканях кишечника, обеспечивая источник энергии для размножения полезных лакто- и бифидобактерий. Получить эти вещества можно, употребляя лук, чеснок, морковь, тыкву, кабачки, кашу из овсяной крупы.
Олигосахариды с фруктозой содержатся в яблоках, грушах, абрикосах, бананах, ягодах и гранатах. Полисахаридом инулином богаты цикорий, корень лопуха, чеснок.
Употребляя пребиотики, можно обеспечить питание полезным бактериям, уничтожить патогенную флору кишечника, повысить всасывание питательных веществ.
Пробиотики в большом количестве содержатся в молочных и кисломолочных продуктах: кефир, йогурты, кумыс, ацидофилин, Активия, Актимель. Их ежедневное употребление оказывает антагонистическое действие на патогенную флору, смещая баланс в сторону полезных бактерий. Также они подавляют продукцию серотонина, что предотвращает аллергические реакции.
Со списком разрешенных продуктов во время восстановления нормальной микрофлоры кишечника можно ознакомиться в таблице.
| Дисбактериоз на фоне диареи | Дисбактериоз на фоне запора | |
| Мучные, хлебные изделия | Сухой хлеб, сухари, печенье из несдобного теста (перед едой засохшая корочка снимается) | Бисквиты и хлеб из муки 2 сорта подсушенные, несдобное печенье |
| Суп, бульон | Обезжиренные мясные или рыбные супы с отварной крупой и перетертым мясом | На некрепком мясном, рыбном, овощном бульоне |
| Яйца | Не более 2 в сутки, сваренных всмятку или добавленных в суп | Не более 2 в сутки, в виде парового омлета |
| Закуски | Запрещены | Салаты из сырых овощей с растительным маслом или сметаной, ветчина нежирных сортов, вымоченная сельдь, заливное. |
| Рыба | Любая нежирных сортов, приготовленная в виде котлет и фрикаделек на пару | Нежирная, в запеченном или отварном виде, можно есть морепродукты |
| Молочные продукты | Творог нежирный, кефир, сметана, простокваша, сыр – после стихания воспаления | Молоко, ряженка, кефир, сливки, творог, сметана, сыр неострых сортов |
| Фрукты, десерты | Перетертые яблоки, кисели из груш, черемухи, айвы | Любые свежие ягоды и фрукты, можно в виде мармелада, варенья |
| Жиры | Немного сливочного масла | Сливочное, растительное масло |
| Напитки | Чай черный, зеленый, отвары смородины и черемухи, какао и кофе на воде | Отвар шиповника, соки из свежих фруктов, чай с молоком |
| Соусы | На основе сливочного масла, в дополнение к нежирным блюдам | С добавлением зелени, на мясных и рыбных бульонах, томатный, сметанный |
Восстановление нормального баланса микрофлоры, при соблюдении режима питания и приеме нужных препаратов, занимает 3-4 недели.
Источник
Витамины для организма крайне необходимы. С этим вряд ли кто-то поспорит. При этом традиционно многие думают, что витамины поступают в организм извне с едой или в виде фармацевтических готовых комплексов. На деле организм как достаточно сложное устройство может производить необходимые ему вещества сам.
Так, например, те же витамины синтезируются микрофлорой кишечника. И, по утверждению некоторых врачей, они являются даже более полезными, чем те, что мы получаем из витаминных комплексов.
Витамины микрофлоры
Микрофлора кишечника — очень важный элемент функционирования организма в целом. Она ответственна за огромное количество разнообразных процессов, начиная от правильной работы органа и заканчивая формированием иммунитета.
Также микрофлора синтезирует ряд витаминов, которые позволяют ей поддерживать иммунную систему. Итак, какие же витамины синтезируются здесь?
Один из таких важных элементов — витамин К. Он требуется для выработки белка и более качественной свертываемости крови. Также микрофлора обеспечивает кишечник витамином В3, который ответственен за контроль окислительных процессов и помогает лучше регенерировать клетки. Это полезное вещество сказывается на пищеварении, очищает организм от продуктов распада.

Кроме того, микрофлора кишечника может производить витамин В9, известный как фолиевая кислота. Он укрепляет иммунитет. Витамин В12 также может производиться микрофлорой. Его зона ответственности — метаболизм жиров, белков и углеводов. В списке также витамин Н, он же биотин, который ответственен за обмен белков и жиров, а также оказывает влияние на выработку ферментов, которые влияют на углеводный обмен.
Вырабатывается здесь и витамин PP, он же никотиновая кислота. Его зона ответственности — участие в метаболических процессах белков, жиров, пуринов. Он также помогает разжижать кровь. Витамин В6 дополняет список витаминов, которые продуцирует микрофлора кишечника: он непосредственно влияет на работу пищеварительного тракта, а его нехватка становится причиной сбоев в организме.
Кроме того, микрофлора кишечника обеспечивает синтез и других витаминов, которых в общей сложности насчитывается около двух десятков, многие из них не входят ни в один промышленный комплекс.
Нарушение микрофлоры
 Если происходят сбои в микрофлоре кишечника, начинаются проблемы разного плана, в том числе и с выработкой витаминов. «Нарушение выработки витаминов начинается, когда с микрофлорой что-то не так. Вздутие, газообразование, булькает, бурчит, надувается — это очевидный признак сбоя в работе микрофлоры», — отмечает гастроэнтеролог-гепатолог Сергей Вялов.
Если происходят сбои в микрофлоре кишечника, начинаются проблемы разного плана, в том числе и с выработкой витаминов. «Нарушение выработки витаминов начинается, когда с микрофлорой что-то не так. Вздутие, газообразование, булькает, бурчит, надувается — это очевидный признак сбоя в работе микрофлоры», — отмечает гастроэнтеролог-гепатолог Сергей Вялов.
При этом сразу паниковать не стоит, так как поддержка у организма есть. «Витамины есть в некотором запасе, поэтому их хватит на какое-то время. И скорее вы успеете обратить внимание на другие проблемы, чем на сбои из-за проблем работы микрофлоры», — говорит врач.
Есть определенный срок, который можно выждать без какого-либо серьезного ущерба для здоровья: 2-4 недели. Главное в этот период — исключить из своего рациона острое и сладкое, советует гастроэнтеролог. Это позволит не раскармливать микрофлору, которая и так сбоит. В идеале все должно восстановиться само собой.
Но могут быть и неожиданные последствия такой ситуации. «Из-за того, что у нас нарушается микрофлора и отмечается повышенное газообразование, не хватает витаминов, возникает два вида проблем. Первая известна всем: это синдром раздраженного кишечника. Тут появляется боль плюс какие-то нарушения стула. Это может быть диарея, запор или чередование того и другого.

Второй вариант — нарушение синтеза гормонов в кишечнике. Гормоны отвечают за чувство насыщения, поэтому при таком сбое у нас появляется необъятный жор и мы переедаем. Связано это с тем, что гормоны отвечают за то, чтобы при достижении пищей нужных отделов кишечника глубоко внизу мозг получал сигнал, что хватит есть. Или, наоборот, что нужно есть еще. Когда этот сигнал страдает, у нас начинается быстрый путь к ожирению. Причем может развиваться чувство голода, когда только в животе булькает, но со стулом все в порядке», — напоминает Сергей Вялов.
Тут может быть актуальным только один совет: не запускать проблему. Потому что так есть риски серьезного ухудшения. «Нужно правильно ограничить острое и сладкое, чтобы не раскармливать микрофлору, которая и так нарушена. Возможно, этого будет достаточно, а потом через неделю или две можно вернуть себе обратно все эти продукты и понаблюдать. Если не прошло за 2 недели, никак не поменялось с учетом изменения диеты или вернулось, когда вернули продукты в рацион, само уже точно не пройдет», — говорит врач.
В организме все взаимосвязано, а в кишечнике — особенно. И важно внимательно следить за его состоянием, чтобы микрофлора обеспечивала все необходимые функции: формирование иммунитета, выработку витаминов и т. д. В противном случае могут появиться проблемы с пищеварительной системой, решать которые придется долго и сложно.
Причины нарушения микрофлоры
Чтобы предупредить проблемы, важно помнить, что именно приводит к сбоям работы микрофлоры. Так, это может быть прием антибиотиков, вредные привычки, еда всухомятку и на бегу, неправильно подобранное питание с отсутствием клетчатки и избытком сухой пищи, проблемы с гормонами, сбои в работе эндокринной системы, слишком частые клизмы.
Источник
Статья на конкурс «био/мол/текст»: «Мы есть то, что мы едим». Так говорил Гиппократ. Но мог ли он себе представить, насколько он был прав? Судя по последним научным данным, потребляемая пища очень сильно влияет на нашу кишечную микрофлору, которая в конечном счете влияет на наш организм. Причем влияет вполне осязаемо — например, меняя наш вес! Получается замкнутый круг: человек — микрофлора — человек.
Давно известна роль кишечной микрофлоры в регуляции многих процессов организма. К примеру, она формирует защитный барьер слизистой оболочки кишечника, стимулирует иммунную систему [1], нейтрализует токсины, продуцирует витамины, переваривает клетчатку и многое-многое другое. Но наука, как известно, не стоит на месте, и появляются новые данные. Так, например, теперь рассматривается взаимосвязь между состоянием кишечной микрофлоры и ожирением, а также развитием сахарного диабета (СД) 2-го типа!
Что такое нормофлора и каковы ее функции
Напомним, что представляет собой нормальная микрофлора человека. Нормофлора (микрофлора в нормальном состоянии, или эубиоз) — это совокупность микробных популяций отдельных органов и систем, характеризующаяся определенным качественным и количественным составом и поддерживающая биохимическое и иммунологическое равновесие, необходимое для сохранения здоровья человека.
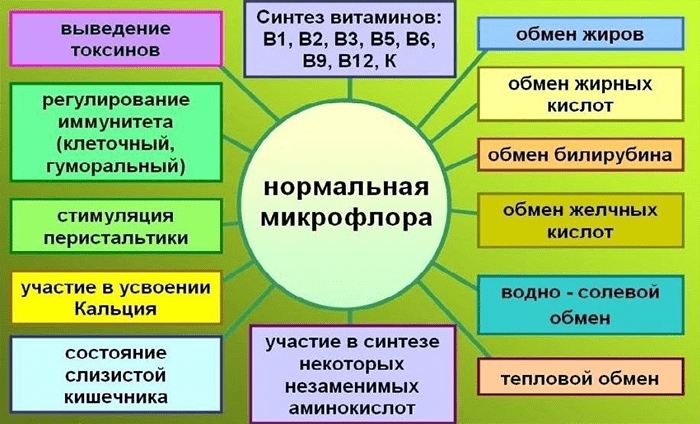
Кишечный микробиом, упоминаемый некоторыми авторами как отдельный орган, несет ответственность за метаболические процессы в организме (рис. 1). Бактерии инактивируют ферменты, гормоны, токсины, разлагают желчные кислоты, нейтрализуют аллергены, образуют молочную кислоту, что помогает пищеварению, способствуют всасыванию витаминов D и B12, кальция и железа в кишечнике, а также синтезируют витамины B1, B2, B6, B12, H, К, C, никотиновую, пантотеновую и фолиевую кислоты [2]. Микрофлора определяет в значительной степени не только физическую составляющую человеческой жизни, но и психическую. Обнаружено, что отходы жизнедеятельности бактерий могут непосредственно влиять на мозг. Например, как минимум два типа кишечных бактерий производят γ-аминомасляную кислоту (ГАМК) [3] — нейромедиатор, ответственный за своевременное гашение процессов возбуждения в центральной нервной системе, а возможно, и помогающий поддерживать нормальный сон и усваивать глюкозу [4]. А последние научные разработки касаются связи состава кишечной микробиоты с проявлением аутизма и депрессии.

Рисунок 1. Основные функции нормальной микрофлоры.
Метаболическая активность кишечной микробиоты, помимо удовлетворения собственных нужд бактерий, способствует извлечению калорий из потребляемой хозяином пищи, помогает запасать эту энергию в его жировых депо, то есть формировать жировую ткань. В экспериментах с гнотобиотическими (безмикробными) и заселенными определенными бактериями мышами было показано, что кишечная микрофлора обеспечивает разложение неперевариваемых хозяином полисахаридов пищи до усваиваемых форм — но это сложно назвать новостью. Находкой же стало то, что этот процесс сопровождался усилением всасывания моносахаридов из кишечника и их поступления в воротную вену — возможно, благодаря повышению плотности капиллярной сети в слизистой оболочке тонкой кишки под влиянием микробиоты. Это вело к усилению печеночного липогенеза, то есть синтеза жирных кислот из углеводов. Дело в том, что клетки печени реагируют на повышение уровня глюкозы и инсулина в крови экспрессией генов транскрипционных факторов ChREBP и SREBP-1, которые активируют гены биосинтеза триглицеридов, то есть жиров. Усиление выработки этих транскрипционных факторов и наблюдали после заселения мышиных кишечников микробиотой. Кроме того, кишечные бактерии помогали размещать новопроизведенные триглицериды в жировых клетках (адипоцитах), вмешиваясь в работу хозяйских генов: микрофлора увеличивала активность необходимой для этого липопротеинлипазы, подавляя в эпителии тонкого кишечника синтез ее ингибитора.
Однако здесь стоит напомнить, что речь шла о мышах, о конкретном энтеротипе их микрофлоры (биоценозе, в котором преобладают определенные группы бактерий) и вообще о базовых функциях микробиоты. Поэтому не нужно на основании этой работы делать вывод о вредном влиянии любых кишечных бактерий на хозяина, просто именно так появилась гипотеза о множественных и взаимосвязанных механизмах влияния кишечной микробиоты на энергетический обмен хозяина, а с ней и надежда на то, что коррекция этого влияния поможет справиться с эпидемией ожирения [5]. Авторы работы предположили, что микробный «биореактор» у одного индивида может быть более энергоэффективным, чем у другого. И факторы, влияющие на это, мы еще затронем.
Микрофлора у людей с нормальным весом и с ожирением различается
Недавние эксперименты показали, что изменения микрофлоры относятся к причинам ожирения, а не к его следствиям. Если кишечник гнотобиотических мышей заселить микробиотой мышей с ожирением, животные будут набирать вес быстрее, чем в случае пересадки бактерий от худых мышей. Более того, по составу микробиоты можно с 90-процентной вероятностью предсказать, есть ли у человека ожирение [6]. Только представьте! А теперь вообразите, что, изменяя состав кишечной микрофлоры человека, можно будет регулировать его вес (рис. 2).

Рисунок 2. Чем примечателен состав микрофлоры кишечника тучного человека?
Многократно выявляли, что при ожирении увеличивается количество представителей типа Firmicutes (например, Clostridium coccoides, C. leptum) и семейства Enterobacteriaceae (Esherichia coli). В то же время снижается количество представителей типа Bacteroidetes (Bacteroides, Prevotella), сокращаются популяции бактерий родов Bifidobacterium и Lactobacillus [7]. Ранее было показано, что высокожировая диета способствует воспалению слизистой оболочки кишечника, опосредованному снижением численности лактобактерий. Это воспаление предрасполагает к развитию ожирения и инсулинорезистентности, то есть СД 2-го типа. В 2016 году в экспериментах с мышами удалось установить связь между этими состояниями и дефицитом конкретных штаммов Lactobacillus reuteri в пейеровых бляшках. Дело в том, что богатая жирами пища обеспечивает отбор бактериальных штаммов, устойчивых к окислительному стрессу. А такими оказались как раз лактобациллы, выделяющие провоспалительные цитокины. И наоборот, вытеснялись из популяции «хорошие» штаммы L. reuteri — продуценты противовоспалительных веществ [8].
Как уже упоминалось, анализ кишечного микробиома выявил резкое уменьшение доли Bacteroidetes и увеличение доли Firmicutes у мышей с наследственным ожирением по сравнению с обычными мышами [9]. Такие же изменения нередко наблюдали и у людей: в одном исследовании 12 пациентов с ожирением отличались от контрольной группы худых сниженным содержанием бактерий Bacteroidetes и повышенным — Firmicutes. Затем пациентов перевели на низкокалорийную диету (питание с ограничением жиров и углеводов) и в течение года следили за изменением состава их кишечной микрофлоры. Оказалось, что диета значительно сокращала численность Firmicutes и повышала долю Bacteroidetes, но самое главное — эти изменения коррелировали со степенью снижения массы тела [9]. Тем не менее взаимосвязь индекса массы тела с пропорцией Bacteroidetes/ Firmicutes пока нельзя назвать доказанной [10].
Изменения обмена веществ
В рамках проекта MetaHIT, посвященного изучению кишечного метагенома, то есть совокупности геномов всех обитателей кишечника, было обследовано 124 европейца [11]. Суммарное количество генов кишечного микробиома в 150 раз (!) превышало количество генов человека. Но стоит отметить, что избыток жирной пищи вел к сокращению бактериального разнообразия: у тучных людей было в среднем на шесть видов бактерий меньше, чем у лиц с нормальной массой тела. Результаты метагеномного анализа разделили участников эксперимента на две группы: носителей «малого генома» (low gene count) и носителей «большого генома» (high gene count). Малый геном — это метагеном, в котором относительно мало генов различных видов бактерий: разница между «малым» и «большим» геномами по количеству генов достигала в среднем 40%. У большинства лиц с бедным кишечным метагеномом преобладали Bacteroides, а с богатым — Methanobrevibacter. При этом две описанные категории людей сильно различались представленностью в их микробиоте групп, формирующих провоспалительный (Bacteroides, Ruminococcus gnavus) или противовоспалительный (Faecalibacterium prausnitzii, Roseburia inulinivorans) фон. Первых гораздо чаще находили у лиц с бедным метагеномом.
Результаты проекта MetaHIT однозначно говорят о том, что обилие кишечной микрофлоры человека коррелирует с его метаболическими маркерами, при этом гены бактерий играют чуть ли не бóльшую роль в патогенезе ожирения, чем наши собственные.
Среди обладателей «малого генома» (23% от всех участников) было больше людей с избыточным весом. Для этой группы в целом были характерны нарушения в ответе тканей на действие инсулина, что вело к повышению его концентрации в крови. У таких людей выявлялось и статистически достоверное снижение содержания так называемого «хорошего холестерина» — липопротеинов высокой плотности, переносящих холестерин от различных тканей к печени для дальнейшей трансформации и утилизации. Также отмечалась тенденция к повышению в крови уровня триглицеридов, свободных жирных кислот и гормона лептина, высокие концентрации которого рассматриваются как независимый фактор риска развития сердечно-сосудистых патологий и тромбозов. (К основным факторам риска относят также специфические варианты липидного профиля, высокое артериальное давление, хронический воспалительный фон и курение.)
В ряде исследований показано, что у людей, в рационе которых преобладают растительные компоненты, в микробиоме доминируют бактерии, расщепляющие полисахариды, — а это как раз представители типа Bacteroidetes, часть которых защищает хозяина от развития локального и системного воспаления. В то же время у любителей растительной пищи снижается количество фирмикутов, а также энтеробактерий, которых нередко называют «патобионтами»: они способны создавать воспалительную среду благодаря липополисахариду своей внешней мембраны и повышению проницаемости кишечного эпителия, что ведет к масштабному проникновению молекул липополисахарида в кровоток и провокации метаболической эндотоксемии, а возможно, и тяги к регулярному перееданию. Кстати, именно так развиваются события на фоне высокожировой диеты. Вегетарианский же рацион, напротив, большинство исследований связывает со сниженным риском развития метаболического синдрома и связанных с ним «болезней цивилизации» [7].
Активное разложение растительной клетчатки соответствующими бактериями толстого кишечника ведет к образованию моносахаридов и короткоцепочечных жирных кислот (КЖК). Последние — особенно масляная кислота — необходимы не только кишечной микрофлоре, но и макроорганизму. Например, они снижают рН кишечного содержимого, вытесняя тем самым из сообщества ряд патобионтов, а главное — обеспечивают энергией энтероциты, защищают их от онкотрансформации и подавляют воспалительные сигнальные пути. Но и здесь не всё так однозначно: с одной стороны, избыток КЖК может усиливать липогенез и потому способствовать развитию ожирения, с другой — в некоторых работах показано благоприятное влияние КЖК на липидный профиль и уровень глюкозы крови. Это позитивное влияние может быть опосредовано связыванием КЖК с клеточными рецепторами, сопряженными с G-белком, — GPR41 и GPR43, — что влечет за собой гормональные изменения, приводящие к ощущению сытости и повышению чувствительности тканей к инсулину. В целом, на последствия продукции микрофлорой больших количеств КЖК влияет масса факторов — от типа и количества пищевого «сырья» до вариаций в бактериальном составе, заложенных еще на ранних этапах развития организма . С другой стороны, пищевые волокна предупреждают метаболические нарушения и независимо от состава микрофлоры. Более того, профилактический эффект преимущественно растительной диеты относительно развития атеросклероза показали исследования, связанные с биотрансформацией L-карнитина: именно некоторые кишечные бактерии, причем вполне полезные с других точек зрения, превращают содержащийся в красном мясе L-карнитин в атерогенные вещества [7], [12].
Кишечные бактерии способны снижать уровень триглицеридов в крови, улучшать глюкозный и липидный метаболизм также за счет непосредственного участия в циркуляции желчных кислот, а уменьшать жировые запасы — путем активации уже упоминавшегося ингибитора липопротеинлипазы [10]. Но пока сложно делать какие-то выводы: слишком уж противоречивы иногда результаты экспериментов. Составить представление о противоречиях и их причинах, а главное — о возможных механизмах, связывающих деятельность микробиоты с метаболизмом хозяина, поможет новый обзор [10].
Роль микрофлоры в развитии СД 1-го и 2-го типов
Лечение и профилактика СД 2-го типа тесно связаны с нормализацией веса. А она требует изменения характера питания (соотношения макро- и микронутриентов) в сочетании с увеличением физической активности: то есть важно создать условия некоторого энергетического дефицита, когда калорий тратится больше, чем поступает [14]. И хотя роль микробиоценоза кишечника в регуляции энергетического обмена ясна не до конца, уже сейчас понятно, что воздействие на микрофлору определенно может способствовать устранению ожирения и компенсации СД 2-го типа.
И, как ни странно, подобное воздействие способно переломить и тревожную ситуацию с заболеванием, в корне отличающимся патогенетически, — СД 1-го типа. Это аутоиммунное заболевание, связанное с агрессией Т-лимфоцитов против β-клеток поджелудочной железы, которые вырабатывают инсулин. Если в случае СД 2-го типа повышение уровня глюкозы в крови происходит вследствие нечувствительности тканей к инсулину (которая мешает клеткам усваивать глюкозу), то при СД 1-го типа просто не хватает самогό инсулина. Для развития этого заболевания требуется стечение ряда обстоятельств — генетических и средовых, а в числе последних, как оказалось, огромную роль играют перестройки кишечного микробиома. Нормофлора кишечника сразу после заселения тренирует иммунную систему хозяина, чтобы та различала своих и чужих, бурно реагировала на чужих, но вовремя останавливалась [13]. Видимо, при СД 1-го типа что-то в этой цепочке ломается.
В одном из экспериментов с крысами, предрасположенными к СД 1-го типа, выявили различия в составе кишечной микрофлоры у животных с уже развившимся диабетом и без него [15]. У последних обнаружили более низкое содержание, как ни странно, представителей типа Bacteroidetes — того, что в ряде исследований от метаболических расстройств, скорее, защищал. Но, как мы знаем, эффекты бактерий радикально разнятся не то что от типа к типу, а даже от штамма к штамму… Применение антибиотиков у этих крыс предотвращало развитие диабета. Исследователи предположили, что изменения кишечной микрофлоры, вызванные приемом антибиотиков, приводят к снижению общей антигенной нагрузки и последующего воспаления, которое может способствовать разрушению β-клеток поджелудочной железы. Однако, как водится, в ряде других экспериментов с животными и людьми эффект антибиотиков (которые, конечно, различались) был обратным [16].
У человеческих детей с СД 1-го типа и здоровых контролей выявили существенную разницу в составе кишечной микробиоты, причем у диабетиков было повышено соотношение Bacteroidetes/Firmicutes и преобладали бактерии, утилизирующие молочную кислоту. У здоровых детей было больше продуцентов масляной кислоты. В целом полагают, что определенные отклонения в составе микрофлоры, происходящие преимущественно в критические периоды онтогенеза (во время эмбриогенеза, рождения, грудного вскармливания и пубертата) способствуют усилению провоспалительной сигнализации со всеми вытекающими иммунными последствиями [16]. Возможно, что из-за сопутствующего нарушения барьерной функции кишечного эпителия выходящие в кровоток и проникающие в панкреатические лимфоузлы бактериальные антигены взаимодействуют с рецепторами NOD2 и провоцируют Т-клетки на атаку панкреатических β-клеток [17].
Таким образом, полученные к настоящему моменту данные создают основу для дальнейшего изучения роли кишечной микрофлоры в механизмах развития ожирения и сахарного диабета 1-го и 2-го типов, а также указывают на возможность профилактики и лечения этих патологий новыми способами — с помощью коррекции нашего микробиома.
- Иммуностимулирующие филаментные бактерии: наконец-то они приручены!;
- Микрофлора желудочно-кишечного тракта. Сайт «Пропионикс»;
- Олескин А.В. (2009). Нейрохимия, симбиотическая микрофлора и питание (биополитический подход). Гастроэнтерология Санкт-Петербурга. 1, 8–16;
- Спокоен как GABA;
- Dibaise Bäckhed F., Ding H., Wang T., Hooper L.V., Koh G.Y., Nagy A. et al. (2004). The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl. Acad. Sci. USA. 101 (44), 15718–15723;
- Зоопарк в моем животе;
- Glick-Bauer M. and Yeh M.-C. (2014). The Health advantage of a vegan diet: exploring the gut microbiota connection. Nutrients. 6 (11), 4822–4838;
- Sun J., Qiao Y., Qi C., Jiang W., Xiao H., Shi Y., Le G.W. (2016). High-fat-diet-induced obesity is associated with decreased antiinflammatory Lactobacillus reuteri sensitive to oxidative stress in mouse Peyer’s patches. Nutrition. 32 (2), 265–272;
- Ley R.E., Bдckhed F., Turnbaugh P.J., Lozupone C.A., Knight R.D., Gordon J.I. (2005). Obesity alters gut microbial ecology. Proc. Natl. Acad. Sci. USA. 102, 11070–11075;
- Khan M.J., Gerasimidis K., Edwards C.A., Shaikh M.G. (2016). Role of gut microbiota in the aetiology of obesity: proposed mechanisms and review of the literature. J. Obes. 2016, 7353642;
- Final Report Summary — METAHIT (Metagenomics of the Human Intestinal Tract). Сайт Европейской комиссии CORDIS (Community Research and Development Information Service);
- Koeth R.A., Levison B.S., Culley M.K., Buffa J.A., Wang Z., Gregory J.C. et al. (2014). γ-Butyrobetaine is a proatherogenic intermediate in gut microbial metabolism of L-carnitine to TMAO. Cell Metab. 20 (5), 799–812;
- Микробиом кишечника: мир внутри нас;
- Korner J. and Leibel R.I. (2003). To eat or not to eat — how the gut talks to the brain. N. Engl. J. Med. 349, 926–928;
- Brugman S., Klatter F.A., Visser J.T., Wildeboer-Veloo A.C., Harmsen H.J., Rozing J., Bos N.A. (2006). Antibiotic treatment partially protects against type 1 diabetes in the bio-breeding diabetes-prone rat: is the gut flora involved in the development of type 1 diabetes? Diabetologia. 49, 2105–2108;
- Paun A., Yau C., Danska J.S. (2016). Immune recognition and response to the intestinal microbiome in type 1 diabetes. J. Autoimmun. 71, 10–18;
- Costa F.R., Françozo M.C., de Oliveira G.G., Ignacio A., Castoldi A., Zamboni D.S. et al. (2016). Gut microbiota translocation to the pancreatic lymph nodes triggers NOD2 activation and contributes to T1D onset. J. Exp. Med. 213 (7), 1223–1239.
Источник