Желудочно кишечный грибок инфекция
29 января 20191626,7 тыс.
К.м.н. Т.Л. Лапина, академик РАМН, профессор В.Т. Ивашкин
ММА имени И.М. Сеченова
Значение грибковой инфекции в гастроэнтерологии или переоценивается, или наоборот, не находит должной оценки. Часто имеет место явная гипердиагностика. Например, на основании наличия грибов Candida в посеве мазка со слизистой ротовой полости у человека без признаков стоматита, или в анализе кала “на дисбактериоз” больного с синдромом раздраженной кишки устанавливается диагноз кандидоза или даже “системного микоза”.
При этом совершенно не учитывается, что грибок является комменсалом человека и широко распространен в окружающей среде (как например, Candida, Aspergillus). Поэтому выделение, скажем, представителей Candida с поверхности кожи, полости рта, из мокроты, мочи и кала должно быть интерпретировано с осторожностью.
Всегда нужно учитывать, что многие грибы не проявляют патогенные свойства, если организм хозяина не ослаблен. Нарушения анатомических, физиологических и иммунологических механизмов защиты организма создают условия для развития инфекционного процесса, вызванного его собственной в обычных условиях непатогенной микрофлорой или сапрофитными микроорганизмами из окружающей среды.
К условиям развития оппортунистической инфекции относятся: лечение кортикостероидами, иммунодепрессантами, антиметаболитами, антибиотиками; СПИД и другие иммунодефицитные состояния; серьезные метаболические расстройства (например, при сахарном диабете, почечной недостаточности); новообразования и противоопухолевая терапия.
Грибковое поражение, в том числе и желудочно-кишечного тракта, развивающееся на фоне тяжелого заболевания, должно быть вовремя распознано и адекватно пролечено, так как эта инфекция может оказать отрицательное влияние на прогноз основного заболевания.
Правильно распознанное грибковое поражение желудочно-кишечного тракта часто обеспечивает основной диагноз. Так, кандидоз ротовой полости и пищевода — одна из “визитных карточек” СПИДа. Одним из важных гастроэнтерологических аспектов рассматриваемой проблемы является также и то, что грибковая инфекция может явиться осложнением энтерального и особенно парентерального питания.
Клиническая картина
Наиболее часто у больных с подавленным иммунитетом отмечается инфекция Candida albicans, реже — другими представителями рода Сandida.
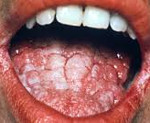
Для кандидозного стоматита характерен белый налет, слегка возвышающийся над слизистой оболочкой ротовой полости и напоминающий свернувшееся молоко или творог. При снятии налета обнажается гиперемированная поверхность, которая может слегка кровоточить (псевдомембранозная форма). При атрофической форме очаги поражения имеют вид эритемы. Симптомы включают в себя сухость, жжение, частое снижение вкусовой чувствительности.
Кандидозный стоматит широко распространен среди больных СПИДом (один из наиболее частых вариантов манифестации заболевания), а также при применении антибиотиков, кортикостероидов и противоопухолевых средств.
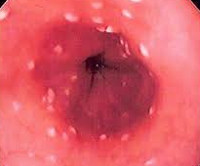
Грибковые эзофагиты — чаще всего кандидозные. Они развиваются при иммунодефицитных состояниях, антиботикотерапи, часто у больных сахарным диабетом (высокая концентрация глюкозы в слюне благоприятна для роста грибов), у лиц старческого возраста или с нарушенным трофологическим статусом. Грибковые эзофагиты встречаются и при ахалазии кардии, других двигательных нарушениях, например в рамках склеродермии, и при стенозах пищевода.
Клинически грибковые эзофагиты проявляются дисфагией и одинофагией (болезненное глотание). В тяжелых случаях специфический эзофагит может осложняться кровотечением, перфорацией, стриктурой пищевода или развитием кандидомикозного сепсиса. При эндоскопическом исследовании определяются желто-белые рельефные наложения на гиперемированной слизистой оболочке пищевода.
Рентгенологическое исследование может выявить множественные дефекты наполнения различных размеров. Диагноз подтверждается при микроскопическом исследовании мазков, полученных при эзофагоскопии.
Жалобы на дисфагию и дискомфорт за грудиной у больного СПИДом служат основанием для широкого дифференциального диагноза, так как поражение пищевода у этих больных может быть вызвано и вирусами (простого герпеса, цитомегаловирусом), и развитием саркомы Капоши, и другими причинами. Однако диагностику кандидозного эзофагита нельзя назвать сложной.
Наличие грибкового стоматита у ВИЧ-инфицированного больного с дисфагией, скорее всего, укажет на правильную этиологию эзофагита, а эндоскопия с микробиологическим или гистологическим исследованием однозначно устанавливает диагноз в 95,5% случаев (I. McGowan, I.V.D. Weller, 1998).
При подавлении иммунной системы и общем ослаблении организма возможно развитие грибкового гастрита, наиболее частым возбудителем которого являются представители рода Candida, Histoplasma, Mucor.
Кандидоз с поражением тонкой и толстой кишки, как причина диареи — не столь частое явление, как это может показаться на первый взгляд. Диарея — один из наиболее частых симптомов иммунодефицитных состояний, причем не только инфекционные агенты становятся ее причиной. Однако роль грибковой инфекции (в том числе Candida), как причины диареи, невелика.
Так, при СПИДе возбудителями инфекционного процесса в тонкой и толстой кишке, сопровождающегося диареей, являются, в первую очередь, простейшие — Cryptosporidium, Microsporidium (Enterocytozoon beineusi), Isospora belli, Giardia lamblia. Из вирусов, связанных при СПИДе с развитием диарейного синдрома, следует назвать цитомегаловирус и вирус простого герпеса, а из бактерий — выделить Salmonella, Shigella, Campylobacter spp.
Важно обратить внимание на хорошо дифференцированную нозологическую единицу — псевдомембранозный колит. Это острое воспалительное заболевание кишечника, ассоциированное с антибиотикотерапией. Его клиническая картина варьирует от кратковременной диареи до тяжелой формы с лихорадкой, дегидратацией и осложнениями. Описаны случаи этого заболевания при уремии, после цитостатической терапии.
При колоноскопии на слизистой оболочке обнаруживаются фибриноидные наложения, из-за которых заболевание и получило свое название. Несмотря на поверхностное сходство с кандидозом (начало заболевания провоцируется антибиотиками, на слизистой оболочке выявляются наложения белого цвета), псевдомембранозный колит не имеет никакого отношения к этой грибковой инфекции.
Возбудитель колита, ассоциированного с антибиотиками (синоним псевдомембранозного колита), установлен. Это Clostridium difficile — грамположительный анаэроб. Антибиотикотерапия, подавляя собственную микрофлору, создает условия для размножения С. difficile и проявления ее патогенных свойств.
Диагноз устанавливается на основании выявления возбудителя в кале или путем обнаружения токсина С. difficile. Это отступление, посвященное псевдомебранозному колиту, еще раз подчеркивает необходимость адекватной оценки клинической картины, данных инструментального обследования и лабораторных тестов. Диагноз грибковой инфекции, в том числе кандидоза, должен опираться на возможно более полную информацию.
Диагностика
Наиболее частые грибковые поражение желудочно-кишечного тракта — кандидоз ротовой полости и пищевода — имеют достаточно характерные признаки. Для правильного диагноза получение культуры возбудителя должно быть подтверждено характерными клиническими симптомами, исключением другой этиологии, а также гистологическими признаками тканевой инвазии.
В случае системного кандидоза диагноз помогает поставить посев гриба из крови, спинномозговой жидкости или из тканей, например, биоптата печени, что позволит прояснить клинические признаки — септицемию, менингит или поражение печени.
Гораздо меньшее значение в гастроэнтерологии имеют Cryptococcus и Histoplasma. Как правило, вовлечение в патологический процесс при этих грибковых инфекциях органов желудочно-кишечного тракта и печени наступает у больных с иммунодефицитом при диссеминированной форме заболевания.
Histoplasma capsulatum при гематогенном распространении из легких поражает печень и селезенку с явлениями гепато- и спленомегалии, а поражение желудочно-кишечного тракта сопровождается изъязвлением (особенно часто ротовой полости).
При СПИДе Cryptococcus neoformans и Histoplasma spp. при диссеминированных криптококкозе и гистоплазмозе поражают печень по типу гранулематозного гепатита. Клинически и биохимически при этом имеет место синдром холестаза. Для установления точного диагноза необходима биопсия печени, при которой будет доказана грибковая тканевая инвазия.
Лечение
Современные противогрибковые средства представляют собой весьма внушительный арсенал.
Флуконазол (водорастворимый триазол) высокоселективно ингибирует грибковый цитохром P450, блокирует синтез стеролов в клетках гриба. На сегодняшний день существует отечественный флуконазол — Флюкостат. Он почти полностью всасывается в желудочно-кишечном тракте, что позволяет быстро достичь адекватных концентраций в сыворотке. Его применяют при кандидозах и криптококкозе.
При СПИДе для лечения криптококкоза после предварительного курса амфотерицином В (без фторцитозина или в сочетании с ним, что предпочтительнее) флуконазол назначают по 200 мг в сутки.
Кетоконазол (производное имидазола) обладает широким спектром противогрибковой активности, однако в отличие от флуконазола может вызвать временную блокаду синтеза тестостерона и кортизола.
Фторцитозин включается в клетки гриба, где превращается в 5-фторурацил и ингибирует тимидилатсинтетазу. Обычно препарат используют для лечения кандидоза, криптококкоза, хромомикоза.
Амфотерицин В воздействует на стеролы грибковой мембраны, нарушает ее барьерные функции, что приводит к лизису грибов. Показанием к его назначению являются системные микозы — кандидамикоз, аспергиллез, гистоплазмоз и другие.
С учетом тяжести заболеваний, на фоне которых возможны оппортунистические инфекции, противогрибковая терапия часто требует комбинирования препаратов, повторных курсов или поддерживающего лечения. В качестве примера возможные варианты лечения кандидозного поражения желудочно-кишечного тракта у больных СПИДом представлены в таблице.
Источник
Микозы желудочно-кишечного тракта — патологические состояния, развившиеся вследствие поражения пищеварительных органов дрожжеподобными, плесневыми, диморфными грибами. Проявляются изменением вкуса, появлением налетов на видимых слизистых, диспепсией, жидким стулом, болевыми ощущениями разной локализации. Диагностируются с помощью эзофагогастродуоденоскопии, колоноскопии, электрогастрографии, микробиологического исследования биоптата, ИФА, РИФ, ПЦР. Для лечения используют антимикотики, пробиотики, иммуномодуляторы в сочетании с комплексной терапией основного заболевания, осложнившегося грибковой инфекций.
Общие сведения
Первые упоминания о специфическом поражении слизистой ротовой полости у ослабленных больных относятся к временам Гиппократа. Детальное описание орофарингеальной формы кандидозной инфекции было впервые подготовлено германским хирургом Бернгардом Лангенбеком в 1839 году. Микозы пищеварительного тракта выявляются у 8-10% пациентов, страдающих желудочно-кишечными болезнями. У 63% больных поражение ЖКТ протекает в виде кандидо-бактериальной, кандидо-герпетической, кандидо-протозойной микст-инфекции. Увеличение частоты микотических патологий связано с эпидемией ВИЧ, ростом распространенности миконосительства, заболеваний с вторичным иммунодефицитом, успехами фармакологии, предложившей эффективные иммуносупрессорные и антибактериальные средства для ранее труднокурабельных патологий.
Причины микозов желудочно-кишечного тракта
Возбудителями микотической инфекции органов ЖКТ становятся плесневые, дрожжеподобные, диморфные грибы, в большинстве случаев являющиеся естественными комменсалами человеческого организма. 9 из 10 микозов пищеварительного тракта провоцируется Candida albicans — условно-патогенным микроорганизмом, который высеивается у 65-70% населения. Микотический процесс также может развиться в результате размножения так называемых кандид non-albicans (С. guilliermondii, С. kefyr, С. krusei, С. tropicalis и др.). Некандидозные формы микотических желудочно-кишечных болезней, вызванные возбудителями бластомикоза, гистоплазмоза, кокцидиомикоза, криптококкоза, паракокцидиомикоза, споротрихоза, возникают при диссеминации грибов из очагов на коже, в респираторном тракте, других органах. Аспергиллез пищеварительных органов, интестинальный зигомикоз диагностируются редко, обычно – при наличии тяжелой сопутствующей патологии.
Манифестации микозов часто предшествуют другие патологические состояния, способствующие патологической активации условно-патогенной флоры за счет снижения местной защитной реакции слизистой ЖКТ, угнетения иммунных сил организма. Специалисты в сфере гастроэнтерологии и микологии выделяют следующие предпосылки к развитию желудочно-кишечного микотического заболевания:
- Физиологическая иммунная недостаточность. Естественное снижение иммунитета наблюдается у беременных, связано с необходимостью поддержания гестации. Незрелость иммунной системы характерна для новорожденных, риск инфицирования возрастает при недоношенности и наличии генитального кандидоза у матери. В пожилом возрасте отмечается инволютивное угасание защитных сил.
- Патологический иммунодефицит. Несостоятельность иммунной системы лежит в основе ВИЧ-инфекции и ее клинически выраженной формы — СПИД. Нарушения иммунитета отмечаются при дисплазии тимуса, других первичных иммунодефицитах, онкогематологических и лимфопролиферативных болезнях (лейкозах, лимфогранулематозе, неходжкинских лимфомах), сахарном диабете, голодании.
- Ятрогенные факторы. Иммунная функция угнетается при использовании кортикостероидов, цитостатиков, других химиопрепаратов у пациентов, перенесших трансплантацию органа, принимающих лечение по поводу онкопатологии, ревматоидного артрита, СКВ, гломерулонефрита, других системных болезней. Развитию микозов способствует антибактериальная терапия.
- Повреждения слизистой оболочки ЖКТ. Инвазии грибов более подвержены больные, страдающие атрофическим гастритом, ахалазией кардии, бульбитом, гастроэзофагеальной рефлюксной болезнью, дисбиозом, болезнью Крона, другой желудочно-кишечной патологией. Инфицирование облегчается при ожогах, травматизации эпителия зубными протезами, твердой пищей, интубационной трубкой.
Патогенез
Механизм развития микозов желудочно-кишечного тракта основан на нарушении баланса между реактивностью организма и факторами патогенности грибов — протеолитическими ферментами инвазии (коагулазой, каталазой, козеиназой, фосфолипазой), фибриллярными белковыми комплексами, эндотоксинами. При иммунодефиците уменьшается активность интраэпителиальных лимфоцитов, В-клеток кишечника, снижается цитотоксичность Т-клеточных элементов, нарушается секреция интерферона, фагоцитоз. В результате возбудители микозов быстро обсеменяют эпителий, легко проникают через собственную пластинку слизистой, агрегируются в пейеровых бляшках.
При травмах, химических ожогах, заболеваниях пищеварительных органов, изменениях кислотности и ферментативного состава желудочного, кишечного соков ситуация усугубляется наличием участков пораженной слизистой, замедленной регенерацией эпителиальных клеток, нарушением защитной функции естественных секретов. У пациентов, принимающих антибиотики, дополнительным патогенетическим фактором становится гибель облигатных микроорганизмов (кишечной палочки, аэробных лактобацилл, анаэробных бифидобактерий), которые являются естественными антагонистами грибов и сдерживают их неконтролируемое размножение.
Классификация
При систематизации форм микотической инфекции ЖКТ учитывают вид возбудителя, локализацию и распространенность патологического процесса. С учетом этиологии различают кандидоз, являющийся самым частым видом микозов, и редкие формы грибкового поражения (аспергиллез, криптококкоз, зигомицетоз и др.). При поражении одного отдела пищеварительного тракта говорят о фокальном микозе, при массивном распространении инфекции — об инвазивном диффузном, при отсутствии признаков инвазии — о микотическом дисбиозе. Наиболее часто используют классификацию микозов по локализации поражения, в соответствии с которой выделяют:
- Орофарингеальные поражения. В структуре микотических инфекций ЖКТ занимают первое место. Обычно встречаются у новорожденных и пациентов с иммунодефицитными состояниями (СПИД, гемобластозы).
- Микотический эзофагит. Диагностируется у 1-7% больных. Чаще развивается при сниженном иммунитете. Может протекать как в поверхностной, так и в эрозивной форме с повышенной кровоточивостью.
- Микотические поражения желудка. Составляют до 5,2% микозов ЖКТ. Выявляются при гастродуоденальных язвах, хронических гастритах. В ряде случаев определяются ассоциации грибов и хеликобактера.
- Микозы кишечника. Обычно возникают на фоне микотического поражения верхних отделов пищеварительного тракта. Как правило, диагностируются у больных, получающих массивную антибиотикотерапию.
- Микотическая инфекция гепатобилиарной системы. Осложняет дискинезию желчных путей, холестаз, холецистолитиаз, лямблиоз. Диагностируется редко, в том числе из-за низкой настороженности.
Симптомы микозов ЖКТ
Клиническая картина заболевания различна в зависимости от распространенности поражения. При орофарингеальной локализации микоза у пациента возникают боли во время приема пищи, неприятный привкус во рту, на слизистой оболочке щек и языка появляются белые налеты. Поражение пищевода и желудка характеризуется болью при глотании, дисфагией, изжогой, отрыжкой, тошнотой и рвотой, дискомфортом в эпигастральной области, снижением аппетита. При прогрессировании заболевания в процесс вовлекаются нижележащие отделы желудочно-кишечного тракта, что клинически проявляется диареей с примесями слизи и крови, болезненностью в левой подвздошной области. Возможны нарушения общего состояния: субфебрильная температура тела, слабость, снижение трудоспособности, резкое уменьшение веса.
Осложнения
Вследствие проникновения микроорганизмов из пищеварительного тракта в забрюшинную клетчатку могут возникать гнойно-воспалительные процессы — парапроктит, паранефрит, межкишечные или поддиафрагмальные абсцессы. У пациентов со сниженной реактивностью организма имеется склонность к генерализации микозов с развитием септицемии, приводящей к распространению грибков на другие органы. Наиболее опасно микотическое поражение гепатобилиарной системы, которое может вызывать желтуху и печеночную недостаточность. При тяжелом течении заболевания формируются некрозы стенки кишечника, иногда – с перфорацией. Возможны профузные желудочно-кишечные кровотечения, пенетрация язв в соседние органы.
Диагностика
Постановка диагноза микозов желудочно-кишечного тракта затруднена из-за полиморфности и неспецифичности клинической картины заболевания, которая сходна с проявлениями других патологий пищеварительной системы. Для диагностики грибкового поражения требуется комплексное обследование пациента. Наиболее информативными являются следующие методы:
- Эзофагогастродуоденоскопия. Характерные признаки микозов при эндоскопии — гиперемия, выраженная отечность и контактная ранимость слизистой оболочки, наличие белесоватого налета, язвенных дефектов. Во время исследования производится забор материала (налетов, биоптатов) для гистологического и цитологического анализа.
- Колоноскопия. Введение гибкого эндоскопа в толстую кишку позволяет оценить состояние кишечного эпителия, обнаружить эрозии или язвы слизистой, которые могут быть источником желудочно-интестинальных кровотечений, провести биопсию пораженных участков. Метод используется для дифференцировки микозов с другими патологиями толстой кишки.
- Электрогастрография. Регистрация биопотенциалов применяется для оценки моторно-эвакуаторной функции желудка, которая зачастую снижена при грибковых поражениях, что создает благоприятные условия для размножения микроорганизмов. Для изучения гастродуоденальной моторики также может назначаться сцинтиграфия.
- Микробиологическое исследование биоптата. Окраска материала по Граму, Романовскому-Гимзе позволяет определить грибки в материале, что подтверждает диагноз микоза. Выявление активной вегетации и формирования мицелия свидетельствует об остром процессе. Широко используется культурологическое исследование на среде Сабуро.
- Серологические реакции. Проведение реакций агглютинации, связывания комплемента, преципитации помогает обнаружить в крови пациента специфические противогрибковые антитела. ИФА повторяется через 10-15 дней для оценки количества антител в динамике – нарастание титра в 4 раза и более дает возможность верифицировать диагноз микоза.
В клиническом анализе крови наблюдаются неспецифические признаки воспалительного процесса: повышение СОЭ, незначительный лейкоцитоз, может выявляться снижение уровня эритроцитов и гемоглобина, что обусловлено кровотечениями. Для исследования структуры всех слоев стенки пищеварительного тракта выполняется эндоскопическая ультрасонография. Дифференциальная диагностика осуществляется с воспалительными заболеваниями кишечника (терминальным илеитом, неспецифическим язвенным колитом), злокачественными новообразованиями, псевдомембранозным энтероколитом, желудочно-кишечным туберкулезом. Помимо осмотра гастроэнтеролога пациенту могут потребоваться консультации инфекциониста, онколога, фтизиатра.
Лечение микозов ЖКТ
Основными задачами являются терапия расстройства, вызвавшего активацию микотической флоры, и этиопатогенетическое воздействие на возбудителя грибковой инфекции. Лечение болезней пищеварительного тракта, иммунодефицитных и других патологических состояний проводят по протоколам соответствующих заболеваний. Для подавления грибкового процесса используют:
- Антимикотики. По результатам наблюдений, наиболее эффективной является терапия триазолами. Средства этой группы угнетают систему цитохрома P-450 и синтез эргостерола клеточных мембран, нарушая рост и репликацию кандид и криптококков. В качестве альтернативы с учетом особенностей возбудителя могут применяться полиены, аллиламины, эхинокандины.
- Пробиотики. Препараты, в которых содержатся непатогенные и нетоксигенные микроорганизмы, позволяют восполнить естественную микрофлору кишечника, нормализовать ее состав после проведенной антибактериальной терапии. Апатогенные бактерии стимулируют кишечный иммунитет, оказывают антагонистический эффект по отношению к грибам, нарушают их адгезию к слизистым.
При отсутствии противопоказаний проводится неспецифическая иммунотерапия стимуляторами естественного иммунитета (высокополимерные полисахаридные комплексы, регенеранты, производные пиримидина), Т- и В-лимфоцитов (полипептидные экстракты вилочковой железы, культур клеток костного мозга, селезенки). Возможно дополнительное использование растительных иммуномодуляторов, витаминно-минеральных комплексов.
Прогноз и профилактика
Исход болезни зависит от степени повреждения пищеварительных органов, состояния иммунной системы пациента, своевременности диагностики и терапии. Прогноз сомнительный при генерализации процесса и наличии тяжелых сопутствующих заболеваний. Для предупреждения развития микозов необходимо не допускать неоправданного применения антибактериальных средств, назначать профилактические курсы противогрибковых препаратов при длительном лечении цитостатиками, кортикостероидами, другими медикаментами с иммунодепрессорным эффектом, осуществлять диспансерное наблюдение за пациентами с иммунодефицитом.
Источник